2. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室 青岛 266071;
3. 乳山市水产技术推广站 威海 261418;
4. 莱州明波水产有限公司 烟台 261418;
5. 大连天正实业有限公司 大连 116000
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071 ;
3. Rushan Fisheries Technical Extension Station 264500 ;
4. Laizhou Mingbo Aquatic Products Co. Ltd., Yantai 261418 ;
5. Dalian Tianzheng Industrial Co. Ltd., Dalian 116000
性别是脊椎动物的重要特征。哺乳类等高等脊椎动物,可以通过外部形态辨别出雌性和雄性。在鱼类中,一些种类具有明显的性征,如鲨鱼和花鳉(赵宁, 2006),另有一些鱼类的两性差异则不明显,很难根据外部形态区分出雌性和雄性。在鱼类的繁育和选育过程中,通过外部形态判别雌、雄差异是一种简单、实用的方法。随着计算机技术的发展,生物多元统计分析方法在自然科学、社会科学等方面得到广泛的应用(van Benthem et al, 2011; Singh et al, 2013)。近年来,在水产科学领域,生物多元统计分析方法对鱼类的形态差异也得到较为广泛的应用。林鼎等(1977)对珠江口下海鳗鲡进行雌、雄形态差异分析;郭弘艺等(2011)对长江口银色鳗的测量性状进行研究;倪海儿等(2003)对东海沿岸海域的鳓进行雌、雄形态差异分析,并且建立了雌、雄判别模型;吴波等(2014)对金钱鱼标准化的形态比例性状进行分析。目前,国内外有关应用生物多元统计分析方法对红鳍东方鲀(Takifugu rubripes)性别鉴别的研究尚未见有报道。
红鳍东方鲀隶属于鲀形目(Telraodontiformes)、鲀科(Tetradontidae)、东方鲀属(Takifugu),是暖温性底栖鱼类,一般栖息于沿岸海湾及近海,主要分布于日本和朝鲜半岛近海,在我国的渤海、黄海和东海也有分布(雷霁霖, 2005)。因其肉质细嫩、味道鲜美、蛋白质高、营养丰富,素有“鱼类之王”的美称(孙中之, 2002)。但是,鱼体的卵巢、肝脏、血液、肠等含有剧毒的河豚毒素,以卵巢和肝脏的毒性最强,而精巢微毒或无毒,口感嫩滑,雄性红鳍东方鲀的食用价值更高(黄枝梅等, 2009)。另外,在红鳍东方鲀选育的过程中,为了及早选育、精确评估选育进展、提高育种效率,也需要进行两性判别,从而制订合理、高效的育种规划。因此,红鳍东方鲀雌、雄的辨别对其繁育和选育均具有重要的理论和实际意义。红鳍东方鲀在各个生长阶段都没有性征,无法定性地鉴定雌鱼和雄鱼,而雌、雄两性形态判断是一种简单、实用的方法。本研究基于红鳍东方鲀的形态指标,采用生物多元统计分析方法对红鳍东方鲀的雌、雄差异进行分析,建立起鉴别雌、雄差异的数学模型,旨在为红鳍东方鲀繁育和选育过程中雌、雄性别的鉴定提供方法和理论依据。
1 材料与方法 1.1 材料与测量2010年11月-2011年5月在山东省烟台市莱州明波水产有限公司和辽宁省大连天正实业有限公司获取红鳍东方鲀的外部形态数据,数据来自两批不同规格红鳍东方鲀的不同生长阶段,实验前对实验用鱼进行电子标记。模型构建群体(GJ)包括雌鱼37尾、雄鱼35尾,共计72尾,3龄左右;验证群体(YZ)包括雌鱼22尾、雄鱼16尾,共计38尾,2.5龄左右。GJ群体和YZ群体的表型数据来自同一批鱼的不同生长阶段。模型普适性分析群体两个,群体1(FX1)包括雌鱼33尾、雄鱼21尾,共计54尾,6月龄左右;群体2包括雌鱼39尾、雄鱼22尾,共计61尾,1龄左右。FX1群体和FX2群体的表型数据来自另外同一批鱼的不同生长阶段。GJ群体、YZ群体、FX1群体和FX2群体中,群体内的样品处于相同的生长发育时期。
红鳍东方鲀的形态测量方法与王新安等(2012)一致,用直尺和卷尺测量全长(TL)、体长(BL)、躯干长(TR)、头长(HL)、眼后头长(EH)、口宽(MW)、吻长(SL)、眼间距(IS)、尾长(TA)、尾柄长(CPL)、尾柄高(CPW)、尾柄宽(CPB)、体高(BD)、体宽(BW)、体周长1(BG1)、体周长2(BG2),精确到0.1 cm。具体测量方法见图 1。用电子天平称量体重(BWH),精确到0.1 g。共得到17个形态性状,大体规格见表 1。解剖辨别雌、雄。

|
图 1 红鳍东方鲀形态测量示意 Figure 1 Schematic diagram of morphometrics of T. rubripes a.整体侧面观;b.整体背面观体周长1:沿胸鳍后环绕一周测量;体周长2:沿背鳍前环绕一周测量 a. Lateral view; b. Dorsal view Body circumference 1: Body circumference behind pectoral fin; Body circumference 2: Body circumference before dorsal fin |
|
|
表 1 样本的数量和规格 Table 1 Quantity and specifications of the samples |
为消除个体大小对形态数据的影响,将每尾红鳍东方鲀的形态测量数据除以体长作为形态度量分析的性状值(魏开建等, 2003),由体重/体长3×100%计算肥满度,共得到17个比例性状。对于鱼类的形态特征、度量性状采用比率标准化后,对不同阶段的比例性状比较,用比例性状进行主成分分析和判别分析。
2 结果 2.1 主成分分析对红鳍东方鲀雌、雄个体的17个比例性状进行主成分分析,共获得3个主成分。3个主成分的贡献率和各指标在这3个主成分的负荷量见表 2。
|
|
表 2 前3个主成分的贡献率和各指标的负荷量 Table 2 Contribution percentage of the first three principal components and loading capacity of indices |
主成分1的贡献率为46.776%,负荷量绝对值较大的有躯干长/体长、头长/体长、眼后头长/体长、尾长/体长、尾柄长/体长、尾柄高/体长、口宽/体长、眼间距/体长8个性状。主成分2的贡献率为27.668%,负荷量绝对值较大的有肥满度、体重/体长、体周长1/体长、体周长2/体长、尾柄宽/体长、体高/体长、体宽/体长7个性状。主成分3的贡献率为7.122%,负荷量绝对值较大的有全长/体长和吻长/体长。3个主成分的累积贡献率为81.566%,基本可以舍去其余的主成分。
由表 2求出72尾红鳍东方鲀的主成分坐标,绘制结果见图 2,大多数雌、雄鱼在3个主成分构成的三维空间上能分开。
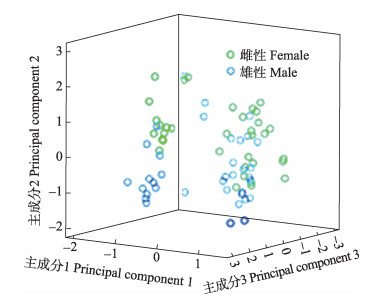
|
图 2 红鳍东方鲀雌性和雄性群体主成分1、主成分2和主成分3的散布 Figure 2 Scatter diagram for PC1, PC2 and PC3 of T. rubripesfemale and male populations |
对72尾红鳍东方鲀的17个比例性状进行逐步判别分析。逐步判别法采用Wilks’ λ方法,判据使用概率值,当P < 0.05时,变量进入判别函数;当P > 0.10时,变量从函数中删除(闫鑫甜等, 2012),根据各变量对判别函数的贡献大小,最终筛选出体周长2 /体长、体宽/体长这两个变量。所建立的判别模型方程为:
雌性F1=84.615 x1+307.287 x2-82.930
雄性F2=67.286 x1+403.543 x2-101.174
判别式中,x1为体周长2/体长,x2为体宽/体长。这两个指标反映红鳍东方鲀的体形特征。显著性检验表明,判别函数达到显著性水平(P < 0.01)。利用建立的判别函数对红鳍东方鲀个体的性别进行判别,将每个个体的体周长2/体长和体宽/体长分别代入方程F1和F2,可以算出F1和F2。如果F1 > F2,则判断为雌性,反之为雄性。对建立方程的72个个体进行回判,判别结果见表 3。37尾雌鱼中有33尾判别正确,准确率为89.2%;35尾雄鱼中有26尾判别正确,准确率为74.3%,72尾鱼的综合判别准确率为81.9%。
|
|
表 3 72尾样品的判别结果 Table 3 Discriminant results of 72 samples |
为了验证判别模型的效果,对2010年8月测量的38尾红鳍东方鲀个体进行性别判别,其中雌鱼的判别准确率为90.9%,雄性的判别准确率为75.0%,综合判别准确率为84.2%。具体的验证结果见表 4。
|
|
表 4 38尾样品的验证结果 Table 4 Results of verification for 38 samples |
对所建立的判别模型方程中的两个比例性状进行T检验,结果如表 5所示,体宽/体长在红鳍东方鲀两性群体间差异极显著(P < 0.01),体周长2/体长在红鳍东方鲀两性群体间差异显著(P < 0.05),表明红鳍东方鲀的雄性个体体形较宽,体周长2较长。
|
|
表 5 判别变量的方差分析和雌雄形态差异 Table 5 ANOVA analysis of discriminant variables and morphological differences between female and male |
在脊椎动物的系统进化中,鱼类处于过渡的关键地位(文爱韵等, 2008),鱼类性别鉴定是国际上的研究热点。对于两性异形的鱼类,可直接通过外部形态区分雌性和雄性,如鳑鲏的雌性特征是肚皮下有一产卵管(李润潼, 1993);鳚鱼的雄性特征为在臀鳍上有球状的腺体(Echeverria, 1986);岩鱼(Giacomello et al, 2005)和半滑舌鳎(李虎, 2012)1)雌性个体比雄性个体大;黄颡鱼则是雄性个体的体长显著大于雌性个体(林植华等, 2004)。然而,对于无性征或两性形态差异不明显的鱼类,则很难利用形态辨别进行雌、雄的鉴定。在鱼类的繁育过程中,亲本培育和催产环节需要辨别鱼类的性别(汤亚斌等, 2012),而在选育过程中,也需要鉴别雌、雄来制订合理的育种方案,显然,雌雄鉴别在繁育和选育过程中均有重要意义。本研究采用红鳍东方鲀性腺发育早期的外部形态数据,经过统计分析,阐明了用于鉴别雌、雄个体的外部形态特征。
1)李虎.半滑舌鳎(Cynoglossus semilaevis)性别决定机制、养殖群体性比及雌雄形态差异研究.上海海洋大学硕士研究生学位论文, 2012, 37
本研究通过测量72尾红鳍东方鲀的17个外部形态数据,采用主成分分析、逐步判别分析和T检验,最终筛选出体周长2/体长、体宽/体长两个比例性状,并建立了红鳍东方鲀的雌、雄判别模型。研究发现,当体长为26.6-33.0 cm、体重为837.0-1455.0 g时,雄性特征为体形较宽、体周长2较长。其原因可能是:(1)红鳍东方鲀雄鱼好动,抢食凶猛,身体健壮,体形较宽;(2)雄鱼2龄以上初次性成熟,而雌鱼3龄以上初次性成熟(雷霁霖, 2005)。实验用鱼均未进行繁殖,在2-3龄之间,由于雄性的性成熟早于雌性,雄鱼的性腺逐渐成熟,雌鱼的性腺尚未成熟,与雌鱼相比,雄鱼的体周长2较长。本研究结果与同为东方鲀属的暗纹东方鲀研究结论基本一致,华元渝等(2004)研究发现,在2.5龄之前,暗纹东方鲀雄鱼的腹围明显大于同一体长的雌鱼;与腹围不同,雌、雄间胸围大小无显著差异。本研究中,红鳍东方鲀的体周长1/体长在雌、雄两性间差异不显著,这与华元渝等(2004)的研究结果一致。
逐步判别分析是从大量已知因子中挑选数量不多、判别能力强的变量来建立判别函数,是判别分析中应用最多的一种方法(程启群等, 2004; 卢文喜等, 2009)。本研究应用逐步判别分析所构建的红鳍东方鲀雌、雄判别模型中含有体周长2/体长、体宽/体长两个变量,在生产实践中,只需测量体周长2、体宽和体长3个形态指标便可快速鉴别红鳍东方鲀的性别,准确率高达80%以上。对于无性征或两性异形的红鳍东方鲀,雌、雄判别模型提供了一种简单、实用的性别鉴定方法。
本研究建立的红鳍东方鲀雌、雄判别模型所采用的数据是在特定的体尺度范围之内,为了验证判别模型的普适性,又选取两个不同体尺度范围的红鳍东方鲀雌、雄群体进行分析。分析群体1(FX1)包括33尾雌鱼和21尾雄鱼,共计54尾,6月龄左右;分析群体2(FX2)包括39尾雌鱼和22尾雄鱼,共计61尾,1龄。FX1中雌、雄个体的体重在150-300 g之间,体长范围为15.5-20.5 cm;FX2中雌、雄个体的体重在450-650 g之间,体长范围为19.6-25.1 cm。结果发现,新采用的两个红鳍东方鲀雌、雄群体均未能建立雌、雄判别模型,这与安丽等(2011)对大鳞副泥鳅的研究结果相一致。研究表明,日本银色鳗鲡在繁殖期间由于卵巢和精巢的发育造成外部形态的改变(Han et al, 2003),因此,推断这可能是由于新采用的红鳍东方鲀两个群体的雌、雄个体处于非繁殖期,雌、雄之间尚不存在差异显著的外部形态特征。
红鳍东方鲀雌、雄判别模型的建立为繁育和选育过程中性别的鉴定提供了新的方法和理论依据。在繁殖前期对亲鱼的性别进行鉴别,使亲鱼保持合理的性比搭配范围,可以节约亲鱼培育的成本,并且可以提高红鳍东方鲀人工繁殖的效率。本研究建立的红鳍东方鲀雌、雄判别模型只适用于体重在837.0-1455.0 g之间、体长在26.6-33.0 cm之间的个体。对于体重和体长不在此范围内的红鳍东方鲀个体的雌、雄鉴别方法有待于进一步进行研究。而在选择育种过程中,为了准确地选留雌、雄亲鱼,完善育种规划,提高育种成效,也需要进行性别鉴定。目前,在鱼类遗传育种领域,主要采用分子遗传标记的方法对鱼类雌、雄差异进行鉴定(Cui et al, 2006; Chen et al, 2009; Wang et al, 2009; Fuji et al, 2010; Xia et al, 2011),尽管这种鉴定方法较为准确,但在选择育种过程中的实用性较差,且代价也较高。本研究从形态学方面对雌、雄差异进行判别,则是一种简单、实用的方法。
| 文爱韵, 尤峰, 徐永立, 等. 鱼类性别决定与分化相关基因研究进展. 海洋科学 , 2008, 32 (1) : 74-80 | |
| 王新安, 马爱军, 庄志猛, 等. 红鳍东方鲀体型性状选育指标的综合判定. 渔业科学进展 , 2012, 33 (6) : 10-15 | |
| 卢文喜, 李俊, 于福荣, 等. 逐步判别分析法在筛选水质评价因子中的应用. 吉林大学学报(地球科学版) , 2009, 39 (1) : 126-130 | |
| 孙中之. 红鳍东方鲀的生物学特性及人工育苗技术. 齐鲁渔业 , 2002, 19 (8) : 44-46 | |
| 华元渝, 李延友, 邹宏海. 养殖型暗纹东方鲀生长与发育特性. 水产学报 , 2004, 28 (1) : 8-14 | |
| 汤亚斌, 马达文, 易翀, 等. 大鲵亲本性别鉴定的几种方法. 中国水产 , 2012, 10 : 67 | |
| 安丽, 朱永安, 王玉新, 等. 大鳞副泥鳅雌雄个体的形态特征比较. 安徽农业科学 , 2011, 39 (1) : 289-290 | |
| 李润潼. 鱼类的性别. 生物学通报 , 1993, 28 (11) : 8-9 | |
| 闫鑫甜, 张弯弯, 徐小解, 等. 猕猴跖骨性别逐步判别分析. 解剖学杂志 , 2012, 35 (5) : 670-674 | |
| 吴波, 张敏智, 邓思平, 等. 金钱鱼雌雄个体的形态差异分析. 上海海洋大学学报 , 2014, 23 (1) : 64 | |
| 林植华, 雷焕宗. 黄颡鱼的两性异形和雌性繁殖特征. 动物学杂志 , 2004, 39 (6) : 13-17 | |
| 林鼎, 林浩然, 黄奕华, 等. 鳗鲡(Anguilla japonica Temminck & Schlegel)繁殖生物学研究Ⅰ.下海鳗鲡雌雄性状差异和鉴别. 水生生物学集刊 , 1977, 6 (2) : 177-190 | |
| 赵宁. 雌雄有别各显神通鱼的第二性征与繁殖. 水族世界 , 2006 (6) : 33-39 | |
| 郭弘艺, 魏凯, 谢正丽, 等. 长江口银色鳗的形态指标体系及其雌雄鉴别. 水产学报 , 2011, 35 (1) : 1-9 | |
| 倪海儿, 陈欣. 鳓形态指标体系分析及雌雄鉴别模型. 生物数学学报 , 2003, 18 (2) : 224-228 | |
| 黄枝梅, 陈绍军, 刘智禹. 河豚毒素及其分离纯化研究进展. 福建水产 , 2009, 4 : 80-83 | |
| 程启群, 李思发. 刀鲚和湖鲚种群的形态判别. 海洋科学 , 2004, 28 (11) : 39-43 | |
| 雷霁霖. 海水鱼类养殖理论与技术. 北京: 中国农业出版社, 2005 . | |
| 魏开建, 熊邦喜, 赵小红, 等. 五种蚌的形态变异与判别分析. 水产学报 , 2003, 27 (1) : 13-18 | |
| Chen J, Wang Y, Yue Y, et al. A novel male-specific DNA sequence in the common carp, Cyprinus carpio. Mol Cell Probes , 2009, 23 (5) : 235-239 DOI:10.1016/j.mcp.2009.04.004 | |
| Cui JZ, Shen XY, Gong QL, et al. Identification of sex markers by cDNA-AFLP in Takifugu rubripes. Aquaculture , 2006, 257 (1) : 30-36 | |
| Echeverria TW. Sexual dimorphism in four species of rockfish genus Sebastes (Scorpaenidae). Environ Biol Fish , 1986, 15 (3) : 181-190 DOI:10.1007/BF00002993 | |
| Fuji K, Yoshida K, Hattori K, et al. Identification of the sex-linked locus in yellowtail, Seriola quinqueradiata. Aquaculture , 2010, 308 (S1) : S51-S55 | |
| Giacomello E, Rasotto MB. Sexual dimorphism and male mating success in the tentacled blenny, Parablennius tentacularis (Teleostei_: Blenniidae). Mar Biol , 2005, 147 (5) : 1221-1228 DOI:10.1007/s00227-005-0023-4 | |
| Han YS, Liao IC, Huang YS, et al. Synchronous changes of morphology and gonadal development of silvering Japanese eel Anguilla japonica. Aquaculture , 2003, 219 (1) : 783-796 | |
| Singh EJK, Gupta A, Singh NR. Groundwater quality in Imphal West district, Manipur, India, with multivariate statistical analysis of data. Environ Sci Poll Res , 2013, 20 (4) : 2421-2434 DOI:10.1007/s11356-012-1127-2 | |
| van BM, Kotula P, Lu P. Multivariate statistical analysis strategies of EELS spectral images. Microsc Microanal , 2011, 17 (S2) : 784 DOI:10.1017/S143192761100479X | |
| Wang D, Mao H, Peng J, et al. Discovery of a male-biased mutant family and identification of a male-specific SCAR marker in gynogenetic gibel carp Carassius auratus gibelio. Prog Nat Sci , 2009, 19 (11) : 1537-1544 DOI:10.1016/j.pnsc.2009.04.008 | |
| Xia X, Zhao J, Du Q, et al. Cloning and identification of a female-specific DNA marker in Paramisgurnus dabryanus. Fish Physiol Biochem , 2011, 37 (1) : 53-59 DOI:10.1007/s10695-010-9415-6 |



