2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071
有关甲壳动物卵巢发育的调控研究,目前多集中在卵黄蛋白原(Vitellogenin, Vg)在甲壳动物体内的合成部位(梁俊平, 20131); Tom et al, 1987; Soroka et al, 2000; Han et al, 1994; 高祥刚等, 2006; 张成锋等, 2006)及在卵巢发育中的表达(程翔等, 2012; 李媛媛等, 2012),涉及到法尼酸甲基转移酶(Farnesoic acid O-methyltransferase, FAMeT)的研究较少。甲基法尼酯(Methylfarnesoate, MF)是化学结构与昆虫保幼激素(Juvenile hormone, JH)Ⅲ相似的一种倍半萜物质,是JH Ⅲ的非环氧化形式,被认为是甲壳动物的保幼激素(Nagaraju, 2007; 谢熙, 20132))。保幼激素是昆虫和其他节肢动物重要的一类内激素,对于调节生长发育、蜕皮、生殖等生命过程有重要作用(田铃等, 2007)。FAMeT是MF生物合成途径中最后一步的关键酶,它具有催化法尼酸(Farnesoic acid, FA)转变成MF的功能(Borst et al, 2001)。甲壳动物大颚器分泌的MF转运到性腺内后,通过促进性腺中卵黄蛋白原基因的表达(郭敏等, 2012)启动并加速卵黄发生,促进卵黄蛋白原的合成(黄辉洋等, 2003)。因此,FAMeT基因在甲壳动物繁殖过程中具有重要的调控作用。
1)梁俊平.脊尾白虾全人工繁育及繁殖相关基因的研究.中国海洋大学博士研究生学位论文, 2013
2)谢熙.三疣梭子蟹卵巢发育过程中FAMeT和MIH基因表达变化.宁波大学硕士研究生学位论文, 2013
脊尾白虾(Exopalaemon carinicauda)隶属于节肢动物门(Arthropoda)、甲壳纲(Curstacea)、十足目(Dec a poda)、长臂虾科(Palaemonidae)、白虾属(Exopalaemon),为重要中小型虾类。脊尾白虾具有繁殖周期短(3–4个月可繁殖1代)、生长速度快(1年内可多茬养殖)和环境适应性广(广温、广盐和广食)等优点(王兴强等, 2005)。随着沿海滩涂的开发,养殖面积迅速扩大,脊尾白虾已成为我国重要的养殖虾类,以黄渤海产量最大,其产量仅次于中国毛虾(Acetes chinesis)和中国对虾(Fenneropenaeus chinensis)(夏德庆, 1999)。根据王绪峨(1987)对脊尾白虾的研究,将脊尾白虾卵巢发育分为5个时期,当卵巢发育到Ⅳ期时到达成熟期,随后雌虾与雄虾交尾后受精抱卵。脊尾白虾的繁殖期较长,雌虾一年可多次抱卵繁殖。为探究FAMeT基因在脊尾白虾卵巢发育过程中的作用,本研究通过荧光定量PCR技术,对FAMeT基因在卵巢发育各阶段(Ⅰ−Ⅴ期)的表达进行了相对定量分析,以期为解释脊尾白虾多次繁殖特性提供支持。
1 材料与方法 1.1 材料 1.1.1 实验虾健康脊尾白虾成虾购自山东省日照开航水产有限公司,体长为(5.03±0.29) cm,体重为(1.26±0.19) g。购虾后暂养于200 L的桶中,每桶30尾。24 h充氧,并维持水温24℃、盐度30、pH=8.2。每天适当投喂高蛋白配合饲料,定期吸污换水。
参照王绪峨(1987)对脊尾白虾卵巢发育周期中卵巢不同发育阶段的界定,选取雌性脊尾白虾连续3次繁殖周期中卵巢发育不同时期(Ⅰ−Ⅴ期),挑取健康活泼的脊尾白虾个体,分别取卵巢、肝胰腺、大颚器3种组织用于提取RNA。实验期间,随机取5尾虾,取鳃、肝胰腺、卵巢、血细胞、大颚器、肌肉、眼柄、心脏、肠、胃等组织提取RNA。
1.1.2 试剂Trizol Reagent购自Invitrogen公司;Oligo(dT)18、M-MLV、DNaseⅠ、SYBR®Premix Ex TaqTMⅡ均购自TaKaRa公司;SMARTTM cDNA文库试剂盒购自Clontech公司;本实验所用引物均由生工生物工程(上海)股份有限公司合成;其他试剂均为国产分析纯。
1.2 方法 1.2.1 总RNA的提取及cDNA第一链的合成取脊尾白虾大颚器、肝胰腺、卵巢等组织各100 mg,液氮研磨后加入1 ml Trizol用于总RNA的提取。用消毒的5号针头和1 ml注射器从脊尾白虾心脏处抽取血淋巴,注射器中预先加入已灭菌的预冷抗凝剂(每升抗凝剂含柠檬酸钠7.94 g、NaCl 19.6 g、葡萄糖22.8 g、EDTA-2Na 3.3 g),使血液与抗凝剂最终体积比为1:1,将收集好的血淋巴于4℃、3000 r/min离心20 min,弃上清液,所得沉淀即为血细胞。RNA提取方法按照RNAiso Plus的操作步骤,研磨、组织裂解后,用传统的酚仿抽提法提取总RNA,并使用RNA-free DNase I纯化试剂盒用于各组织总RNA的纯化,紫外分光光度计测定RNA浓度及纯度,并通过琼脂糖凝胶电泳检测各组织总RNA的完整性。荧光定量PCR反应的cDNA按照BIO-RAD的iScript cDNA Synthesis Kit第一链合成试剂盒说明书进行反转,用于之后FAMeT基因在各组织分布的检测。cDNA反应体系:4 μl 5×iScript reaction mix,1 μl iScript reverse transcriptase,1 μg总RNA,加Nuclease-free water至总反应体积为20 μl。反应条件:25℃ 5 min;42℃ 30 min;85℃ 5 min;4℃ 5 min。合成的cDNA于–20℃保存备用。
1.2.2 引物的设计根据已提交到GenBank的基因序列(GenBank登录号:AHB23861)为模板,利用Primer 5.0软件设计1对特异性引物FAMeT HF/HR (表 1),对卵巢发育不同时期的脊尾白虾的卵巢、肝胰腺和大颚器中FAMeT基因的表达进行检测,并根据GenBank中脊尾白虾的Actin序列设计1对内参引物Actin F/R(表 1)。
|
|
表 1 实验中所用的引物序列 Table 1 Primer sequences used in this study |
利用荧光定量PCR对FAMeT基因在不同组织中的表达量进行检测。荧光定量PCR(ΔΔCт法)扩增体系为10 μl,包括SYBRRPremix Ex TaqTMⅡ(2×),5μl;PCR Forward Primer(10 μmol/L),0.4 μl;PCR Reverse Primer(10 μmol/L),0.4μl;ROX Reference Dye II(50X),0.2 μl;cDNA模板,1.0 μl;DEPC水,3.0 μl。反应程序:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。荧光定量结果导出后,2-DDCT法、SPSS 11.0软件进行分析。
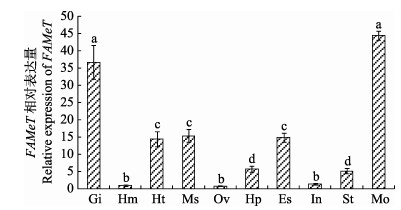
2 结果 2.1 脊尾白虾FAMeT基因的组织表达实时荧光定量PCR分析脊尾白虾FAMeT基因的组织表达(图 1),结果显示,FAMeT在脊尾白虾的各个组织中均有表达,其中,大颚器FAMeT基因相对表达量最高,鳃次之,肌肉、眼柄、心脏也有少量表达;其他组织FAMeT相对表达量较少,与大颚器、鳃中的相对表达量有显著差异(P < 0.05)。这说明FAMeT可参与调控脊尾白虾的多种生理功能。
|
图 1 FAMeT在脊尾白虾不同组织里的相对表达量 Figure 1 The relative expression of FAMeT in different tissues of E. carinicauda Gi:鳃;Hm:血细胞;Ht:心脏;Ms:肌肉;Ov:卵巢;Hp:肝胰腺;Es:眼柄;In:肠;St:胃;Mo:大颚器 Gi: Gill; Hm: Hemocytes; Ht: Heart; Ms: Muscle; Ov: Ovary; Hp: Hepatopancreas; Es: Eyestalk; In: Intestine; St: Stomach; Mo: Mandibular organ |
FAMeT是合成MF的关键酶,当脊尾白虾体内MF的浓度累积到一定值时,能促进卵黄蛋白原基因的表达。为检测脊尾白虾在连续3次卵巢发育的不同时期FAMeT基因的表达情况,以卵巢发育的5个时期为取样时间点,分别取大颚器、卵巢组织进行实时荧光定量PCR。
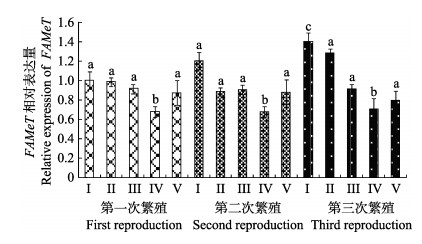
图 2的结果显示,在卵巢发育的不同时期,卵巢内FAMeT的相对表达量均在2以下,整体表达比较稳定,其中,Ⅳ期显著低于其他时期(P < 0.05),抱卵后的Ⅰ期表达量最高。在3次繁殖过程中,FAMeT基因的表达量变化趋势基本一致,都表现出了在Ⅰ−Ⅳ期逐渐下降、到Ⅴ期时上升的趋势。
|
图 2 卵巢FAMeT在脊尾白虾卵巢发育周期中的相对表达量 Figure 2 The expression of FAMeT in ovary of E. carinicauda during ovarian development cycle |
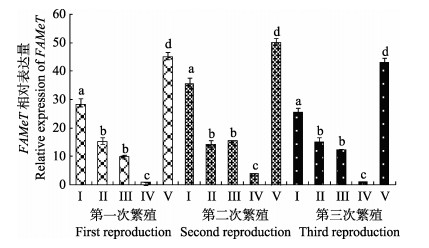
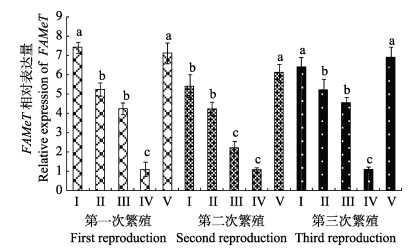
大颚器(图 3)和肝胰腺(图 4)中,FAMeT基因mRNA的表达量趋势基本一致,均表现为在前4个时期逐渐下降,在卵巢发育Ⅳ期(次级卵黄发生时期)时,FAMeT基因mRNA的表达量降到最低值。Ⅴ期(恢复期) FAMeT基因表达量急剧恢复到较高的状态,高于Ⅰ期时的表达量。
|
图 3 大颚器FAMeT在脊尾白虾卵巢发育周期中的相对表达量 Figure 3 The expression of FAMeT in mandibular organ of E. carinicauda during ovarian development cycle |
|
图 4 肝胰腺FAMeT在脊尾白虾卵巢发育周期中的相对表达量 Figure 4 The expression of FAMeT in hepatopancreas of E. carnicauda during ovarian development cycle |
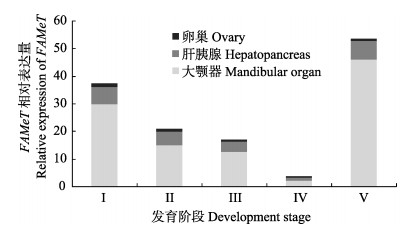
将卵巢发育Ⅰ期时卵巢内FAMeT基因mRNA的相对表达量作为1个单位,由此计算出卵巢发育各个时期FAMeT mRNA在卵巢、肝胰腺和大颚器中的相对表达量(图 5)。结果显示,在卵巢发育的各个时期,FAMeT基因在大颚器中的表达量最高,肝胰腺中次之,卵巢内表达量最低。FAMeT mRNA的总体相对表达量在卵巢恢复期最高,卵巢发育Ⅳ期时表达量最低。
|
图 5 不同发育阶段FAMeT mRNA在卵巢、肝胰腺及大颚器中的相对表达量 Figure 5 The relative expression of FAMeT mRNA in ovary, hepatopancreas and mandibular organ of E. carinicauda at different development stages |
甲壳动物的大颚器是其体内唯一合成甲基法尼酯的器官(Laufer et al, 2013),甲基法尼酯具有明显促进卵母细胞发育的作用(Reddy et al, 1998)。甲基法尼酯的生理功能及其作用机理已成为当前甲壳动物内分泌学的研究热点之一,研究表明,甲基法尼酯在蜘蛛蟹(Laufer et al, 1987)、克氏原螯虾(赵维信等, 2001)、南美白对虾(李文娟等, 2010; 夏西超等, 2013)、中华绒螯蟹(郭敏, 2012)1)、三疣梭子蟹(谢熙等, 2013)等甲壳动物的生殖、蜕皮、渗透压调节等方面,都起到了重要的调控作用(Yang et al, 2012)。FAMeT是合成甲基法尼酯过程中重要的限速酶,FAMeT基因的转录量在一定程度上决定了甲基法尼酯的合成量。
1)郭敏.中华绒螯蟹(Eriocheir sinensis)大颚器的生理功能及其对卵巢发育的内分泌调控.上海海洋大学硕士研究生学位论文, 2012
3.1 FAMeT基因在组织内的表达分析FAMeT基因组织表达分析结果显示,FAMeT基因在鳃、心脏、肌肉、肝胰腺、卵巢、大颚器等组织中均有稳定的表达,其中,在鳃和大颚器的表达量较高,显著高于其他组织。此结果与谢熙等(2013)、Gunawardene等(2002)在其他甲壳动物上的研究结果基本一致,表明FAMeT基因在鳃和大颚器中表达量显著高于其他组织。
FAMeT mRNA在脊尾白虾组织中广泛存在,FAMeT mRNA表达量的高低与甲壳动物的生长发育有着密不可分的关系。在FAMeT本体表达实验中,结果显示,FAMeT基因在鳃中的表达量也相对较高。但是,大颚器是MF合成的唯一器官,且已有研究表明,FAMeT不属于分泌蛋白,那么可以猜测FAMeT不仅仅能催化合成MF,也在其他组织中催化别的生化反应。已有文献对FAMeT的其他功能进行了研究,如刀额新对虾(Nagaraju et al, 2006)及南美白对虾(Hui et al, 2008)蜕皮过程中FAMeT的研究表明,FAMeT基因可参与蜕皮过程的调控。Ruddell等(2003)在食用黄道蟹的研究表明,动物体内大颚器组织中FAMeT基因的转录水平与卵黄发生和卵巢发育有相关性。本研究中也得到了FAMeT在鳃中表达量较高的结果,推测是因为FAMeT参与了渗透压调节的过程,还需进一步验证。
3.2 FAMeT基因在卵巢发育过程中在大颚器、卵巢、肝胰腺组织的表达分析脊尾白虾卵巢发育不同时期的卵巢、大颚器及肝胰腺FAMeT基因表达分析结果显示,卵巢发育的Ⅰ−Ⅳ期,大颚器中FAMeT的表达量呈下降趋势,Ⅳ期达到最低值,显著低于其他各期(P < 0.05),而抱卵后的Ⅰ期时表达量最高,显著高于其他时期(P < 0.05)。而在卵巢中的表达情况为:在Ⅳ期,FAMeT基因的表达量显著低于其他4个时期,其他各期相对表达量无显著差异,与李嘉尧(2008)2)在红螯光壳螯虾中的实验结果一致,FAMeT基因在卵巢发育周期内的表达变化趋势一致。考虑到脊尾白虾的繁殖特性,脊尾白虾在抱卵后为Ⅴ期,卵巢的状态与Ⅰ期相近,随后卵巢会继续发育,开始新一轮的繁殖过程。因此,可认为脊尾白虾的Ⅴ期为下一次卵巢发育周期的Ⅰ期,即FAMeT基因在脊尾白虾卵巢发育周期的Ⅰ期表达量最高,后期逐渐下降,到Ⅳ时表达量最低。在卵巢发育的各个时期,FAMeT基因的mRNA总表达量呈现Ⅰ−Ⅳ期时下降、Ⅴ期迅速恢复到最高值的规律。各个时期时,大颚器中的表达量为最高,约为肝胰腺内表达量的6倍,卵巢内表达量的20–30倍。此结果进一步证明了大颚器是合成FAMeT的主要组织,在卵巢发育过程中起到了重要的调控作用。
2)李嘉尧.红螯光壳螯虾(Cherax quadricarinatus)卵黄发生的研究.华东师范大学硕士研究生学位论文, 2008
对脊尾白虾卵巢发育过程中卵黄蛋白原基因的表达情况的研究(梁俊平, 2013)3)中发现:在卵巢发育的Ⅰ−Ⅳ期,脊尾白虾肝胰腺内卵黄蛋白原基因的相对表达量呈上升趋势,且在Ⅳ期时达到最高。抱卵后的Ⅴ期,卵黄蛋白原的相对表达量急速降低至Ⅰ期的表达量值。因此,根据FAMeT基因在卵巢发育过程中在卵巢和大颚器中的表达情况可以得出:在脊尾白虾卵巢发育过程中,大颚器中FAMeT基因的表达起到了前期调控的作用,即在卵巢发育初期大量表达,催化法尼酸转变成MF,当MF累积到一定浓度时,能促进卵黄蛋白原基因的表达,启动卵黄发生,促进卵黄蛋白原的生成。但是,当卵巢发育到卵黄细胞增殖期及次级卵黄细胞形成期时,FAMeT的表达量下调。因此,可推测FAMeT基因在卵巢发育初期大量表达,促进MF的合成进而促进卵黄蛋白原基因的表达,促进卵巢发育。
3)梁俊平.脊尾白虾全人工繁育及繁殖相关基因的研究.中国海洋大学博士研究生学位论文, 2013
| 王兴强, 阎斌伦, 马甡, 等. 脊尾白虾生物学及养殖生态学研究进展. 齐鲁渔业 , 2005, 22 (8) : 21-23 | |
| 王绪峨. 脊尾白虾繁殖生物学的初步观察. 动物学杂志 , 1987, 22 (1) : 7-10 | |
| 田铃, 嵇保中, 刘曙雯, 等. 甲基转移酶的功能与分类. 生命的化学 , 2007, 27 (5) : 425-427 | |
| 李文娟, 夏西超, 宁黔冀. KK-42对南美白对虾甲基转移酶基因转录的影响. 河南师范大学学报:自然科学版 , 2010, 38 (1) : 146-148 | |
| 李媛媛, 蔡生力, 刘红. 实时荧光定量PCR检测凡纳滨对虾和罗氏沼虾卵黄蛋白原mRNA在卵巢和肝胰腺中的表达. 水产学报 , 2012, 36 (11) : 1667-1674 | |
| 张成锋, 刘红, 高祥刚, 等. 中国对虾卵黄蛋白原合成部位的研究. 海洋水产研究 , 2006, 27 (6) : 7-13 | |
| 赵维信, 白桦. 克氏原螯虾大颚器合成甲基法尼酯的研究. 水产学报 , 2001, 25 (3) : 193-196 | |
| 夏西超, 杨洪, 宁黔冀, 等. KK-42对凡纳滨对虾物质储备相关酶类基因表达的影响. 水生生物学报 , 2013, 37 (2) : 388-392 | |
| 夏德庆. 脊尾白虾生物学特性及其养殖技术. 中国水产 , 1999, 3 : 42-43 | |
| 高祥刚, 刘红, 徐佳念, 等. 日本沼虾卵黄蛋白原合成部位的初步研究. 生物技术通报 , 2006 (S1) : 438-444 | |
| 郭敏, 魏华, 陶贤继, 等. 去眼柄后中华绒螯蟹法呢酸甲基转移酶表达和卵巢发育. 中国水产科学 , 2012, 19 (1) : 45-49 | |
| 黄辉洋, 叶海辉, 李少菁, 等. 锯缘青蟹大颚器对卵巢发育的调节作用:离体实验. 台湾海峡 , 2003, 22 (3) : 295-298 | |
| 程翔, 蔡生力, 刘红, 等. 中国明对虾卵黄蛋白原mRNA在卵巢和肝胰腺中表达量的实时光定量PCR检测. 上海海洋大学学报 , 2012 (1) : 1-6 | |
| 谢熙, 朱冬发, 崔晓雨, 等. 三疣梭子蟹FAMeT基因克隆及其在蜕皮周期中的表达水平. 水产学报 , 2013, 37 (7) : 994-1001 | |
| Borst DW, Ogan J, Tsukimura B, et al. Regulation of the crustacean mandibular organ. Amer Zool , 2001, 41 (3) : 430-441 | |
| Gunawardene YIN, Tobe SS, Bendena WG, et al. Function and cellular localization of farnesoic acid O-methyltransferase (FAMeT) in the shrimp, Metapenaeus ensis. Eur J Biochem , 2002, 269 (14) : 3587-3595 DOI:10.1046/j.1432-1033.2002.03048.x | |
| Han CH, Okumura T, Suzuki Y, et al. Immunocytochemical identification of the site of vitellogenin synthesis in the freshwater prawn Macrobrachium nipponense. Fisheries Sci , 1994, 60 : 149-154 | |
| Hui JHL, Tobe SS, Chan SM. Characterization of the putative farnesoic acid O-methyltransferase (LvFAMeT) cDNA from white shrimp, Litopenaeus vannamei: Evidence for its role in molting. Peptides , 2008, 29 (2) : 252-260 DOI:10.1016/j.peptides.2007.08.033 | |
| Laufer H, Borst D, Baker FC, et al. Identification of a juvenile hormone-like compound in a crustacean. Science , 2013, 235 (4785) : 202-205 | |
| Laufer H, Landau M, Homola E, et al. Methyl farnesoate: its site of synthesis and regulation of secretion in a juvenile crustacean. Insect Biochem , 1987, 17 (7) : 1129-1131 DOI:10.1016/0020-1790(87)90134-X | |
| Nagaraju GPC. Is methyl farnesoate a crustacean hormone?. Aquaculture , 2007, 272 (1-4) : 39-54 DOI:10.1016/j.aquaculture.2007.05.014 | |
| Nagaraju GPC, Reddy PR, Reddy PS. In vitro methyl farnesoate secretion by mandibular organs isolated from different molt and reproductive stages of the crab Oziotelphusa senex senex. Fisheries Sci , 2006, 72 (2) : 410-414 DOI:10.1111/fis.2006.72.issue-2 | |
| Reddy PS, Ramanurthi R. Methyl farnesoate stimulates ovarian maturation in the freshwater crab, . Ozitelphusa seex Fabricius.Curr Sci , 1998, 74 (1) : 68-70 | |
| Ruddell CJ, Wainwright G, Geffen A, et al. Cloning, character ization, and developmental expression of a putative farne soic acid O-methyl transferase in the female edible crab Cancer pagurus. Biol Bull , 2003, 205 (3) : 308-318 DOI:10.2307/1543294 | |
| Soroka Y, Milner Y, SAGI A. The hepatopancreas as a site of yolk protein synthesis in the prawn Macrobrachium rosenbergii. Invertebr Reprod Dev , 2000, 37 (1) : 61-68 DOI:10.1080/07924259.2000.9652400 | |
| Tom M, Goren M, Ovadia M. Localization of the vitellin and its possible precursors in various organs of Parapenaeus longirostris(Crustacea, Decapoda, Penaeidae). Int J Inver tebr Repr Dev , 1987, 12 (1) : 1-12 DOI:10.1080/01688170.1987.10510298 | |
| Yang YN, Ye HH, Huang HY, et al. Cloning, expression and functional analysis of farnesoic acid O-methyltransferase (FAMeT) in the mud crab, Scylla paramamosain. Mar Freshw Behav Phy , 2012, 45 (3) : 209-222 DOI:10.1080/10236244.2012.717372 |



