2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
作为我国养殖面积和产量最大的经济海藻,海带(Saccharina japonica)早期的生长发育一直广受关注,相关的研究也较多,主要涉及温度、光质、营养盐、植物激素等因素对海带胚孢子、配子体及孢子体的影响(朱明远等, 2004; 吴荣军等, 2006; Kai et al, 2006; 汪文俊等, 2009; 鞠青等, 2009; Liu et al, 2010;鲁志成等, 2012)。目前,关于环境因子对海带孢子囊影响的相关研究较少。Pang等(2004)和Lüning等(1988)分别研究假定的孢子形成抑制因子及光照周期对孢子囊形成的影响;Mizuta等(1999a)研究比较了孢子囊在海带中间和基部的形成情况,Mizuta等(1999b)同时发现,温度和营养盐对孢子囊的形成具有显著影响。这些研究为海带栽培业的发展奠定了重要理论基础。
直至2009年,我国的海带养殖面积已经达到了4.1万hm2(金振辉等, 2009)。在我国北方海区的海带育苗生产实践中,育苗场多采用海区中自然成熟的种海带进行孢子育苗。孢子采集后,通过循环制冷水来完成整个配子体发育和孢子体培养过程。然而,近3年以来,山东省荣成市海区的海带在种苗培育过程中,普遍出现了幼孢子体畸形率偏高的现象。畸形的幼孢子体往往因无法进行正常分裂而死亡,浪费了大量的人力和物力,制约了海带产业链的健康稳定发展。究竟是什么原因导致了海带幼孢子体畸形率偏高?可能的原因包括:首先是种海带本身存在问题。种海带孢子囊受到了不良条件的胁迫(如夏天高温等);其次是水质因素。海水中的兼性腐生菌和硫酸盐还原菌所产生的硫化氢常会危害海带幼孢子体的正常生长(吴超元等, 1979);同时,育苗基质(苗绳等)常含有可溶性的有机物质,如单宁酸,对海带幼苗具有慢性毒害作用(单志欣等, 1982);最后是物理因素,如光照和水温等。过高或过低的光照强度和温度,都可能对孢子体的正常生长产生影响。对山东省荣成市的多数育苗场来说,海带的育苗工艺基本没有发生大的变化。因此推测,海带育苗过程中出现的早期幼孢子体畸形率偏高的原因最可能是:种海带孢子囊受到了自然海区的高温胁迫。
近几年,随着全球气候变暖,海水的温度也在逐渐升高。生产实践上,育苗场为了节约制冷成本,倾向于推迟种海带的收割时间。然而,如果种海带收割过晚,逐渐升高的水温很可能对海带孢子囊产生胁迫,进而影响到游孢子的放散及其后期的正常发育。已有研究表明,经过一个罕见的高温夏天后(平均水温较正常提高了0.1-3.7℃),生长在德国赫尔戈兰岛(Helgoland)浅潮下带的绝大多数掌状海带受到了严重损害,在9月时,只观察到了部分腐烂的藻体(Bartsch et al, 2013)。由此可见,当海水温度接近物种的生理极限时,哪怕仅仅提高0.1℃,都可能对种群的持续发展产生质的影响。相对于孢子体,孢子囊作为繁殖器官,对温度或光辐射等物理因素可能更为敏感,因此,研究海带孢子囊受到的环境因素的影响是十分必要的。目前,关于海带孢子囊在相对高温条件下的孢子释放能力以及后续孢子萌发能力等方面的研究尚属空白。
本项研究系统的开展了不同温度和培养时间对种海带孢子囊放散游孢子以及后期孢子萌发和配子体发育、孢子体生长的影响,以期为海带种苗培育的生产实践提供数据。
1 材料与方法 1.1 材料种海带于2014年8月6日采自山东省荣成市桑沟湾荣成蜊江水产有限责任公司的海带养殖区,选取了两个品系作对比,分别是“205”和“C033”,它们都是用地理种群杂交结合定向选育而成。分别选择一棵孢子囊成熟度好,覆盖面积大的种海带,将具有孢子囊的海带随机分成大小相等的5份[长为(14.0±0.5) cm;宽为(11.0±0.5) cm],放入14℃的海水中培养24 h,去除海带分割过程产生的黏液,以消除在后期培养中可能带来的影响。
1.2 方法将等分割具有孢子囊的海带随机放入盛有2 L PES (Provasoli Enriched Seawater)的烧杯中(Pang et al, 2007),并置于不同温度的智能型光照培养箱(GXZ-260C, 宁波)中充气培养(20.0±0.3)、(21.0±0.3)、(22.0±0.3)、(23.0±0.3)、(24.0±0.3)℃,光强均控制在40 mmol photons/m2·s,光周期为12 h光照/12 h黑暗。每天更换与培养箱温度一致的PES。
当培养周期为4、8、12、16 d时,切割一块孢子囊[长为(4.5±0.5) cm;宽为(3.5±0.5) cm]进行游孢子的采集,具体操作:(1)用14℃的消毒海水对孢子囊进行阴干处理30 min;(2)快速将游孢子采集到直径为1.5 cm,且事先加入了14℃ PES的培养皿中,每组设置8个重复。(3)将不同处理组的培养皿置于温度为14℃,光强为18 mmol photons/m2·s,光周期为12 h/12 h (光照/黑暗)的条件下培养,每隔1 d换1次培养液。分别对孢子附着后第48小时的萌发率(20×物镜)、第7天的雌配子体大小(40×物镜)、第10天的受精率(10×物镜,孢子囊培养周期为16 d)和第18天的幼孢子体大小(20×物镜)进行统计。
孢子在培养皿中附着后第33天,将培养周期为4、16 d的幼孢子体轻轻刮下,放入盛有2 L PES的烧杯中充气培养,孢子体密度保持一致[(600±15)棵/2 L PES)],每隔1 d换1次PES,随着幼苗体积的增加,将数量减少至120棵/2 L PES,30 d后对其生长速率进行统计。海带幼孢子体的培养环境温度为14℃,光强为40 mmol photons/m2·s,光周期12 h/12 h(光照/黑暗)。
1.3 数据处理实验期间的胚孢子萌发率、雌配子体大小、受精率和生长速率计算如下:
胚孢子萌发率%=孢子萌发数×100/孢子总数
雌配子体大小=(Smax+Smin)/2
式中,Smax和Smin分别代表最大和最小直径。
受精率=成功受精的卵数×100/总卵数目×100%
生长速率=100×ln(lt/l0)/t×100%
式中,lt代表实验结束后孢子体的平均长度;l0代表孢子体由培养皿转移到烧杯中进行培养的起始平均长度;t代表培养天数。
用Excel和SPSS18软件对胚孢子萌发率、受精率、雌配子体和幼孢子体大小进行单因素方差分析(ANOVA);双因素方差分析用来比较温度和培养周期对雌配子体和幼孢子体大小的影响;同时对配子体、幼孢子体大小进行相关性分析。所有数据在分析前,进行方差齐性和正态分布检验,一旦有显著性差异,用Tukey’s HSD的方法对数据进行两两检验。P < 0.05为具有显著差异。
2 结果与分析 2.1 温度和培养周期对游孢子放散能力的影响当温度为24℃时,只有品系“205”的孢子囊在培养周期为4 d时,成功放散了游孢子;两个品系在相同的培养周期下,20–23℃的游孢子放散量差异不显著,都能成功地放散游孢子(表 1)。
|
|
表 1 温度处理组中两个品系海带孢子囊不同培养周期下的游孢子放散量比较 Table 1 Comparison of zoospore release between two strains of S. japonica under different culture periods in each temperature treatment |
品系“205”在相同培养周期下,培养周期为4 d时,20℃的萌发率显著高于21-24℃;培养周期为8 d时不同温度下的萌发率无显著差异;12、16 d培养周期下,20、21℃的孢子萌发率小于22、23℃。相同温度下:4 d培养周期的萌发率最小(除了20℃萌发率较大);8 d培养周期的萌发率小于12、16 d(图 1)。
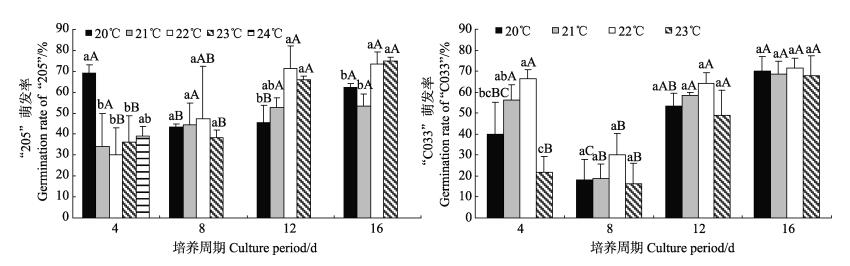
|
图 1 温度处理组中两个品系海带孢子囊不同培养周期下胚孢子附着48 h的萌发率比较 Figure 1 Comparison of embryo-spore germination rate after 48 h adhesion between two strains of S. japonica under different culture periods in each temperature treatment 图中所标注的不同字母的处理表示有显著差异(P < 0.05,N=8)。小写字母和大写字母分别表示培养温度和周期对胚孢子萌发率的统计学差异。黑线代表标准差 Different letters indicate significant difference (P < 0.05, N=8). Lower and upper case letters indicate statistical differences from temperature and culture period respectively. Black bars refer to standard deviations |
品系“C033”在相同培养周期下,4 d 23℃的萌发率显著小于20-22℃;其他培养周期下,温度对游孢子萌发率的影响不显著。相同温度下,8 d培养周期的萌发率显著小于其他周期;20、23℃时,4 d培养周期的萌发率小于12、16 d(图 1)。
无论是品系“205”还是“C033”,相同温度下,培养周期为12、16 d的胚孢子萌发率平均高于4、8 d的。
2.3 温度和培养周期对雌配子体大小的影响双因素方差分析显示,温度和培养周期对雌配子体大小都有显著影响(P < 0.05)。对品系“205”,温度效应F=59.270,时间效应F=235.351;对品系“C033”,温度效应F=42.178,时间效应F=111.194。对两个海带品系,时间效应都显著大于温度效应。
品系“205”在相同培养周期下(图 2):除了第16天在不同温度下的雌配子体无显著差异,其他培养周期下的雌配子体在20℃时最大,23℃(或24℃)时最小;相同温度下培养16 d的雌配子体显著小于其他培养周期的;培养到第8天,20℃、21℃的雌配子体显著小于4、12 d的。
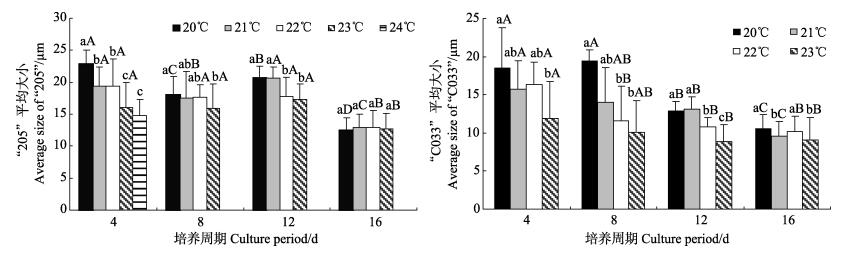
|
图 2 温度处理组中两个品系海带孢子囊不同培养周期下孢子附着后第7天雌配子体大小比较 Figure 2 Comparison of female gametophyte size 7 days after spore adhesion under different culture periods in each temperature treatment 图中所标注的不同字母的处理表示有显著差异(P < 0.05,N=50)。小写字母和大写字母分别表示培养温度和周期对雌配子体大小的统计学差异,黑线代表标准差 Different letters indicate significant difference (P < 0.05, N=50). Lower and upper case letters indicate statistical differences from temperature and culture period respectively. Black bars denote standard deviations |
品系“C033”在相同培养周期下(图 2):雌配子体在20℃具有最大值(除了12 d 20℃的雌配子体小于21℃),23℃具有最小值;8、12 d培养周期下,21℃的雌配子体大于22℃的;相同温度下:雌配子体随着培养时间的延长而变小(除了20℃在4 d培养周期的配子体小于8 d)。
无论是品系“205”还是“C033”,相同温度下,培养周期是16 d的雌配子体具有最小值;相同培养周期下,23℃(或24℃)的雌配子体最小。
2.4 温度和培养周期对受精率的影响培养8–10 d,雌、雄配子体分别形成卵囊和精子囊,并在24 h内完成受精作用。如图 3所示,对培养周期为16 d的孢子囊放散的孢子附着后第10天的雌配子体受精率进行统计。单因素方差分析发现,无论是品系“205”还是“C033”,不同温度下的受精率没有显著差异,但品系“C033”的受精率略高于“205”。
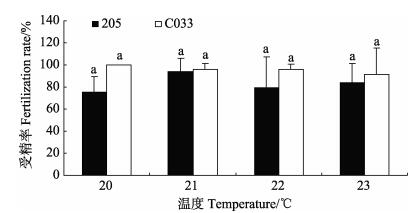
|
图 3 两个品系海带孢子囊在16 d培养周期下,孢子附着后第10天的雌配子体受精率比较 Figure 3 Comparison of fertilization rate 10 days after spore adhesion under 16 days culture periods in each temperature treatment 图中所标注的不同字母的处理表示有显著差异(P < 0.05,N=8)。黑线代表标准差 Different letters indicate significant difference (P < 0.05, N=8). Black bars denote standard deviations |
培养10–12d,受精卵逐渐发育向孢子体阶段转换。对孢子附着后第18天的幼孢子体进行统计分析见图 4。从图 4双因素方差分析显示,温度和培养周期对幼孢子体大小都有显著影响(P < 0.05)。对品系“205”,温度效应F=120.334,时间效应F=1224.159。对品系“C033”,温度效应F=78.898,时间效应F=594.154。对两个品系,时间效应显著大于温度效应。
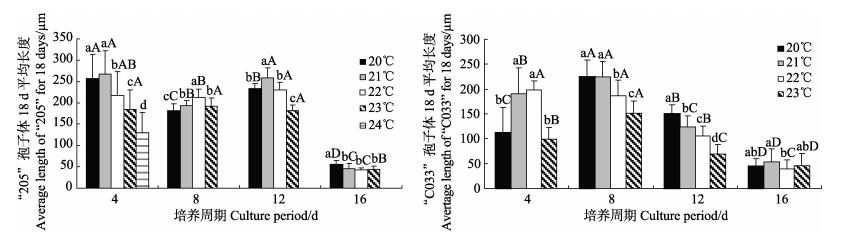
|
图 4 两个品系海带孢子囊不同培养周期下孢子附着后第18天获得的幼孢子体大小比较 Figure 4 Comparison of average juvenile sporophyte size 18 days after spore adhesion under different culture periods in each temperature treatment 图中所标注的不同字母的处理表示有显著差异(P < 0.05,N=50)。小写字母和大写字母分别表示培养温度和周期对孢子体大小的统计学差异,黑线代表标准差 Different letters indicate significant difference (P < 0.05, N=50). Lower and upper case letters indicate statistical differences from temperature and culture period respectively. Black bars denote standard deviations |
品系“205”在相同培养周期,4 d时,20、21℃的孢子体显著大于22–24℃的;8 d时,20、22℃的孢子体分别最小和最大;12 d时,23℃的孢子体显著小于其他温度的;16 d时,除了20℃的孢子体较大,其他温度无显著差异。相同温度下,16 d培养周期的孢子体显著小于其他周期的;8 d培养周期的孢子体小于4、12 d的(除了23℃孢子体较大);除了20℃ 4 d的孢子体显著大于12 d,4、12 d培养周期的孢子体差异不显著。
品系“C033”在相同培养周期,4 d时,20、23℃的孢子体显著小于21℃和22℃的;8、12 d时,20、21℃的孢子体显著大于22、23℃的,23℃的孢子体最小;16 d的孢子体21℃显著大于22℃的。相同温度下,16 d培养周期的孢子体最小,4、12 d的孢子体小于8 d的(除了4 d 22℃的孢子体较大)。
无论是品系“205”还是“C033”,相同温度下,当培养周期为16 d时,孢子体都最小;相同培养周期下,除了16 d培养周期中不同温度的孢子体差别不大,23℃(或24℃)条件下的孢子体都最小(除了“205” 8 d 23℃下孢子体较大)。
2.6 温度和培养周期对幼孢子体生长速率的影响对幼孢子体的生长速率进行统计见表 2。从表 2可以看出,培养周期为4 d时,品系“205”的幼孢子体在不同温度下的生长速率没有显著差异,22℃的生长速率最大;品系“C033”,在23℃的生长速率最小。培养周期为16 d时,品系“205”的幼孢子体在22、23℃的生长速率小于20℃和21℃的;品系“C033”在21–23℃的生长速率大于20℃的。
|
|
表 2 两个品系海带孢子囊不同培养周期下的幼孢子体生长速率比较 Table 2 Comparison of juvenile sporophyte growth rate under different culture periods in each temperature treatment |
对两个品系海带的幼孢子体生长速率进行比较发现,当培养周期为16 d时,品系“205”的生长速率显著小于“C033”。
2.7 雌配子体大小和幼孢子体大小的相关性分析对孢子附着后第7天和第18天的雌配子体与幼孢子体的大小进行相关性分析见图 5。从图 5可以看出,对品系“205”和“C033”,雌配子体与幼孢子体大小之间都具有很强的正相关性,相关系数r分别为0.928和0.689,P < 0.01。随着海带雌配子体变大,幼孢子体也变大。
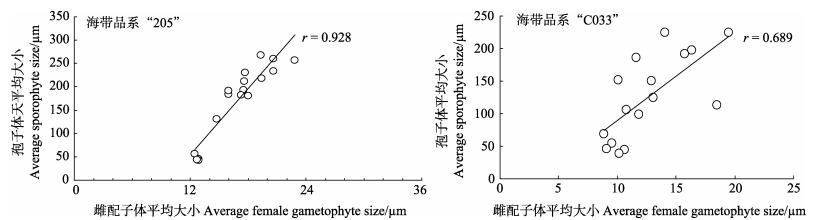
|
图 5 两个品系海带孢子囊不同培养周期下孢子附着后第7天和第18天的雌配子体和幼孢子体大小关系 Figure 5 Relationship between female gametophyte size and juvenile sporophyte size 7 days and 18 days after spore adhesion under different culture periods in each temperature treatment |
在海带养殖过程中,夏苗培育打破了季节对其生长的限制,大大提高了海带的产量。其中,采苗时间作为关键点受到人们的普遍重视。不同海区,由于平均水温的差异导致了采苗时间的不同。南方海区,如福建,常在5–6月将种海带移至室内进行保存并促进孢子囊的产生,9月底进行采苗。而北方海区,如山东,人工栽培的海带在5–8月产生孢子囊群,在8月初将种海带收割并移至室内进行人工采苗。此时,海上平均水温较高,海带的生理状态是否受到影响并不清楚。但已有研究表明,夏季高温会对海带目一些物种的繁殖力产生严重影响,糖海带(Saccharina latissima)放散的孢子数量明显降低(Lee et al, 1986);翅藻科的边翅藻(Alaria marginata)放散的孢子形态不正常,甚至无法存活(McConnico et al, 2005);边花昆布(Ecklonia radiata)的孢子囊能够成熟,但不能成功放散孢子(Novaczek et al, 1984);掌状海带(Laminaria digitata)的孢子萌发率明显降低(Bartsch et al, 2013)。由此可见,夏季高温对游孢子的数量和质量产生了严重胁迫,而游孢子的存活状态将会对整个物种生活史的顺利进行产生关键影响。
健康游孢子的获得,是海带育苗成功的前提。游孢子在“孢子发生”过程中形成,只有细胞膜包围,极易受到非生物因素的影响,如温度,光辐射等。然而,人们更加关注游孢子从孢子囊释放后受到的环境因素的影响(Roleda et al, 2005; Wiencke et al, 2006; Müller et al, 2008),而很少关注游孢子在孢子囊内部形成过程中受到的影响。已有研究发现,巨藻(Macrocystis pyrifera)在受到高温胁迫后,其“孢子发生”过程加快;Bartsch等(2013)首次研究了掌状海带的孢子囊在不同温度(10–22℃)的孢子放散量和萌发率,发现在17–20℃时,孢子放散量明显增加,显示较高的温度能促进“孢子发生”。同时发现,当对孢子囊进行不同时间的温度处理时,处理3 d的孢子萌发率大于处理7 d的。以上研究表明,游孢子在孢子囊内部发育过程中受到来自环境的影响,与其释放后受到的影响同等重要。因此,了解环境因素对海带孢子囊生理状态的影响,对预估游孢子在释放前的发育状态,在生产实践上更好地把握采苗时间,节约人力、物力和财力,提高生产效率是至关重要的。
本研究设置了5个较高的海水温度(20、21、22、23、24℃)和4个培养周期(4、8、12、16 d),选择了两个海带品系(“205”和“C033”)并选取同一棵海带同一部位的孢子囊群作为实验材料,对孢子放散力及后期萌发率等进行了观察和统计,选择两个品系作为相互对照,能更好的反应温度和时间对海带孢子囊的影响,以排除品种产生的误差。
3.1 游孢子的放散能力海带孢子囊放散游孢子能力的大小与海带产量密切相关。当放散的游孢子活力高且数量充足时,有利于采苗的顺利进行,为后期获得健康幼苗打下基础。研究表明,当海水温度达到24℃时,孢子囊几乎没有放散能力,只有品系“205”的孢子囊在培养4 d时,成功获得了游孢子。海水温度在20–23℃时,不同培养周期下的孢子囊游孢子放散能力没有显著差异。结果显示,当海水温度达到24℃时,海带孢子囊的生理状态受到了一定胁迫,无法保证孢子采苗的顺利进行。
3.2 胚孢子的萌发率海带胚孢子的萌发受到自身生理代谢机制和环境(如光质)的共同影响。Lüning等(1980)研究表明,当海带孢子囊放散的游孢子具备较高的生理成熟度时,它将不明显依赖于光照,表现为完全黑暗条件下培养48 h的胚孢子萌发率达到80%以上;黄鹤忠等(1998)通过对胚孢子在不同光照波长中培养36、48 h的孢子萌发率进行观察,发现不同光照波长对36 h的胚孢子萌发率没有显著影响,而在48 h的胚孢子萌发率与光质呈明显的负相关,这是由于在植物的光形态建成过程中,短波光较长,波光更容易激发光化学反应,从而改变胚孢子的生理代谢功能,促进萌发;Roleda等(2005)发现,随着光合有效辐射(PAR)处理时间的延长,3种海带属物种(掌状海带、糖海带和极北海带)的孢子萌发率显著降低;Müller等(2008)分析了温度(2–18℃)和光照辐射强度(光合有效辐射、紫外线A和B)对来自北极和温带海带目物种的交互作用,发现当温度达到18℃时,来自北极的糖海带、掌状海带和翅菜的孢子萌发率为0,同时,紫外线B能明显降低孢子萌发率。
在本研究中,胚孢子接受的光照和温度完全一样,以保证胚孢子的发育具备相同的环境。研究表明,各种温度处理下,当海带孢子囊的培养周期是12、16 d时,胚孢子的萌发率大于4、8 d的。可能的原因首先是种海带在由育苗场运回到实验室的过程中,位于孢子囊表层的孢子,受到了来自高温或者缺水环境的胁迫,所以在较短培养周期下进行孢子采集时,放散的游孢子质量受到了一定影响。其次是随着培养周期的延长,海带孢子囊的成熟度越来越高,因此,释放的孢子具备更加成熟的生理机能,更容易萌发。
对品系“205”,培养周期为4 d时,20℃的孢子萌发率显著较高,而培养周期为4 d的其他温度下的孢子萌发率则较低;对品系“C033”,8 d培养周期任何温度下的孢子萌发率都普遍较低。以上结果出现的原因,可能与孢子囊的生理状态有关。尽管用于研究的孢子囊来自同一棵海带,但并不能保证孢子囊不同部位的生理水平(如成熟度等)是完全一样的。
3.3 雌配子体与幼孢子体的生长发育在相同培养周期下,23℃(24℃)的雌配子体和幼孢子体远远小于20–22℃的,表明23℃(24℃)对海带孢子囊有一定的胁迫作用,进而影响到了游孢子的正常发育;在相同温度下,培养周期为16 d的雌配子体和幼孢子体显著小于其他培养周期的,表明无论海带孢子囊是处于20℃还是23℃,当在海水中连续培养16 d时,雌配子体的发育和幼孢子体的生长都会受到一定抑制作用。导致以上结果的原因包括:(1)高温通过破坏海带孢子囊的生存环境,对里面的孢子产生胁迫,进而影响到雌配子体和幼孢子体的生长发育。而且,这种作用较为直接和迅速。(2)培养周期对海带孢子囊的作用,可能是一种由温度引起的累积效应。20–24℃对于海带孢子囊是较高的温度,当它长期处于这种环境而又无法适应时,便累积了大量的胁迫力,从而导致孢子的后期发育受到一定影响。
雌配子体的细胞增值率与孢子体发生率常呈现异速生长的关系,当雌配子体的细胞数目随时间逐渐增多时,孢子体产生的概率逐渐下降(鲁志成等,2012)。雌配子体细胞数目的增殖常是其进行营养生长的标志,而光照和激素等因素常会对配子体进行营养生长起到促进或阻碍的作用。在正常的发育条件下,海带孢子囊释放的游孢子发育所形成雌配子体,将会维持在只有1个细胞的状态,随着细胞体积的增大,逐渐形成卵囊,完成受精作用并逐渐向孢子体阶段转化,而不会停留在配子体阶段甚至向营养生长状态转换。在本研究中,海带雌配子体大小与孢子体大小具有显著正相关性(P < 0.01),显示海带雌配子体的平均直径越大,它发育形成的孢子体生长速度越快。这是由于当雌配子体细胞越大时,积累的进行光合作用的色素和营养物质等越丰富,有利于卵囊的快速发育以及后期孢子体的生长。
3.4 配子体的受精率和幼孢子体的生长速率通常认为,海带配子体的受精作用发生在晚上(Lüning et al, 1981),但鲁志成等(2012)研究发现,在连续光照条件下,孢子体发生率也能达到40%以上。因此,本研究中的光照强度和周期等因素控制在一致的条件下。
本研究发现,在16 d培养周期下,不同温度处理组的配子体受精率之间无显著差异。表明配子体受精率的高低几乎不受前期孢子囊培养温度的影响。本研究只统计了孢子囊培养16 d的配子体受精率,所以,通过测定孢子囊不同培养周期下的配子体受精率,将能更好解释孢子囊培养温度和时间与受精率的关系。
在相同的培养条件下(温度、光照等)对幼孢子体生长速率进行比较,发现海带孢子囊的培养温度和时间对它的影响并不显著。当孢子囊的培养周期为16 d时,品系“205”的生长速率显著小于“C033”,表明幼孢子体生长速率会因品系而异。
3.5 海带孢子囊的生理状态与研究结果的关系海带孢子囊的发育是一个连续的过程,每个海带叶状体包含不同的孢子囊群,同一片孢子囊群的孢子囊成熟度也不尽相同,因此,孢子囊具有不断成熟、不断放散孢子的特点(曾呈奎等,1985)。Joska等(1987)对海带目巨藻科的Ecklonia maxima进行研究,发现看似健康成熟的藻体也可能无法成功地放散游孢子。Bartsch等(2013)发现,对掌状海带的孢子囊进行连续3 d的不同温度处理后,将其放在合适的温度(10℃)继续培养7 d,结果7 d后的孢子放散量显著小于3 d的。表明绝大多数的孢子都在第1次实验中进行了放散,而后期孢子囊的成熟度暂时无法满足孢子放散的要求。由此可见,孢子囊在实验前和实验中的发育状态将对实验结果产生一定的影响,但具体的影响目前尚不清楚。
因此,孢子囊的选取十分重要。参照Olischläger等(2013)对孢子囊成熟度的划分方式,将海带孢子囊的成熟度划分为以下4个阶段:叶状体(孢子囊全面发育,深褐色,表面向外凸起);半成熟孢子囊(藻体呈深褐色,孢子囊部分裂解,部分孢子放散);成熟孢子囊(孢子囊裂解,孢子完全放散)和衰老孢子囊(孢子放散结束,孢子囊完全裂解呈白色)。本研究中,选取了半成熟的孢子囊作为实验材料,该孢子囊来自同一孢子囊群,具备基本相同的生理成熟度,以减少实验误差。
不同成熟度的海带孢子囊对温度的敏感性可能存在差异,因此,本研究结果更适用于半成熟的海带孢子囊;在后期的研究中,将会进一步对不同成熟度的海带孢子囊进行温度和时间处理,得出更全面的结论。
4 结论综上所述,当温度达到23℃或培养时间达到16 d时,海带孢子囊受到了胁迫。因此,在海带育苗的生产实践中,如果海带孢子囊已经处于半成熟的生理状态,海水温度达到23℃之前,种海带需快速运到室内进行保种;当水温为20–23℃时,种海带在海上的暂养时间不要超过16 d,以免影响后期雌配子体的发育和幼孢子体的生长。
| 朱明远, 吴荣军, 李瑞香, 等. 温度对海带幼孢子体生长和光合作用的影响. 生态学报 , 2004, 24 (1) : 22-27 | |
| 吴荣军, 朱明远, 李瑞香, 等. 海带(Laminaria japonica)幼孢子体生长和光合作用的N需求. 海洋通报 , 2006, 25 (5) : 36-42 | |
| 吴超元, 高难生, 陈德成, 等. 海带幼体畸形病的研究. 海洋与湖沼 , 1979, 10 (3) : 238-247 | |
| 汪文俊, 孙修涛, 王飞久, 等. 光质对海带幼孢子体生长和假根发育的影响. 渔业科学进展 , 2009, 30 (5) : 113-118 | |
| 金振辉, 刘岩, 张静, 等. 中国海带养殖现状与发展趋势. 海洋湖沼通报 , 2009 (1) : 141-150 | |
| 单志欣, 王浦东. 海带夏苗培育中配子体死亡和小孢子体畸形的原因及其防治. 海洋渔业 , 1982, 4 (6) : 256-260 | |
| 黄鹤忠, 易剑国. 海带(Laminaria japonica Aresch)胚孢子萌发和配子体生长与光照波长间关系的研究. 水产科技情报 , 1998, 25 (6) : 265-269 | |
| 鲁志成, 唐永政, 张树宝, 等. 植物激素对海带孢子体发生的影响. 烟台大学学报(自然科学与工程版) , 2012, 25 (1) : 33-38 | |
| 鞠青, 王悠, 刘素, 等. 不同氮、磷配比人工海水对海带胚孢子早期发育的影响. 应用生态学报 , 2009, 20 (8) : 1947-1951 | |
| 曾呈奎, 王素娟, 刘思俭, 等. 海藻栽培学. 上海: 上海科学技术出版社, 1985 : 61 -62. | |
| Bartsch I, Vogt J, Pehlke C, et al. Prevailing sea surface temperatures inhibit summer reproduction of the kelp Laminaria digitata at Helgoland (North Sea). J Phycol , 2013, 49 (6) : 1061-1073 DOI:10.1111/jpy.12125 | |
| Joska MAP, Bolton JJ. In situ measurement of zoospore release and seasonality of reproduction in Ecklonia maxima (Alariaceae, Laminariales). Brit Phycol J , 1987, 22 (2) : 209-214 DOI:10.1080/00071618700650251 | |
| Kai T, Nimura K, Yasui H, et al. Regulation of sorus formation by auxin in Laminariales sporophyte. J Appl Phycol , 2006, 18 (1) : 95-101 DOI:10.1007/s10811-005-9020-8 | |
| Lee JA, Brinkhuis BH. Reproductive phenology of Laminaria saccharina (L.) Lamour. (Phaeophyta) at the southern limit of its distribution in the northwestern Atlantic Ocean. J Phycol , 1986, 22 (3) : 276-285 DOI:10.1111/j.1529-8817.1986.tb00024.x | |
| Liu F, Pang SJ. Performances of growth, photochemical effici-ency, and stress tolerance of young sporophytes from seven populations of Saccharina japonica (Phaeophyta) under short-term heat stress. J Appl Phycol , 2010, 22 (2) : 221-229 DOI:10.1007/s10811-009-9445-6 | |
| Lüning K. Photoperiodic control of sorus formation in the brown alga Laminaria saccharina. Mar Ecol Prog Ser , 1988, 45 (1-2) : 137-144 | |
| Lüning K. Critical levels of light and temperature regulating the gametogenesis of three Laminaria species (Phaeophyceae). J Phycol , 1980, 16 (1) : 1-15 DOI:10.1111/jpy.1980.16.issue-1 | |
| Lüning K. Egg release in gametophytes of Laminaria saccharina: Induction by darkness and inhibition by blue light and u.v.. Brit Phycol J , 1981, 16 (4) : 379-393 DOI:10.1080/00071618100650441 | |
| McConnico LA, Foster MS. Population biology of the intertidal kelp, Alaria marginata Postels and Ruprecht: a non-fugitive annual. J Exp Mar Biol Ecol , 2005, 324 (1) : 61-75 DOI:10.1016/j.jembe.2005.04.006 | |
| Mizuta H, Nimura K, Yamamoto H. Sorus development on median and marginal parts of the sporophyte of Laminaria japonica Areschoug (Phaeophyceae). J Appl Phycol , 1999a, 11 (6) : 585-591 DOI:10.1023/A:1008163412333 | |
| Mizuta H, Nimura K, Yamamoto H. Inducible conditions for sorus formation of the sporophyte discs of Laminaria japonica Areschoug (Phaeophyceae). Fish Sci , 1999b, 65 (1) : 104-108 | |
| Müller R, Wiencke C, Bischof K. Interactive effects of UV radiation and temperature on microstages of Laminariales (Phaeophyceae) from the Arctic and North Sea. Clim Res , 2008, 37 (2-3) : 203-213 DOI:10.3354/cr00762 | |
| Novaczek I. Development and phenology of Ecklonia radiata at two depths in Goat Island Bay, New Zealand. Mar Biol , 1984, 81 (2) : 189-197 DOI:10.1007/BF00393117 | |
| Olischläger M, Wiencke C. Seasonal fertility and combined effects of temperature and UV-radiation on Alaria esculenta and Laminaria digitata (Phaeophyceae) from Spitsbergen. Polar Biol , 2013, 36 (7) : 1019-1029 DOI:10.1007/s00300-013-1325-5 | |
| Pang SJ, Jin ZH, Sun JZ, et al. Temperature tolerance of young sporophytes from two populations of Laminaria japonica revealed by chlorophyll fluorescence measurements and short-term growth and survival performances in tank culture. Aquaculture , 2007, 262 (2-4) : 493-503 DOI:10.1016/j.aquaculture.2006.11.018 | |
| Pang SJ, Lüning K. Breaking seasonal limitation: year-round sporogenesis in the brown alga Laminaria saccharina by blocking the transport of putative sporulation inhibitors. Aquaculture , 2004, 240 (1-4) : 531-541 DOI:10.1016/j.aquaculture.2004.06.034 | |
| Roleda MY, Wiencke C, Hanelt D, et al. Sensitivity of Laminariales zoospores from Helgoland (North Sea) to ultraviolet and photosynthetically active radiation: implica-tions for depth distribution and seasonal reproduction. Plant Cell Environ , 2005, 28 (4) : 466-479 DOI:10.1111/pce.2005.28.issue-4 | |
| Wiencke C, Roleda MY, Gruber A, et al. Susceptibility of zoospores to UV radiation determines upper depth distribu-tion limit of arctic kelps: evidence through field experiments. J Ecol , 2006, 94 (2) : 455-463 DOI:10.1111/jec.2006.94.issue-2 |



