2. 上海海洋大学食品学院 上海 201306;
3. 青岛市食品药品检测中心 青岛 266071
2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306 ;
3. Qingdao Food and Drug Center for Control, Qingdao 266071
恩诺沙星(Enrofloxacin,ENR)化学名称为1-环丙基-6-氟-4-氧代-1, 4-二氢-7-(4-乙基-1-哌嗪基)-3-喹啉羧酸,分子式为C19H22FN3O3,分子量为359.1645,为第三代人工合成喹诺酮类广谱抗菌药物,具有抗菌谱广、抗菌活性强、给药方便以及与常用抗菌药物无交叉耐药性等特点,广泛应用于畜禽业和水产养殖业(杨先乐, 2006)。目前,对于恩诺沙星在真菌作用下(Wetzstein et al, 1997、2006; Parshikov et al, 2000)、在畜牧类(饶勇等, 20061); 方舟等, 2012)、家禽类(Morales et al, 2014)动物中代谢产物及代谢途径的研究较为详细。恩诺沙星在水产动物体内代谢动力学研究较多,通过乙烷基哌嗪环上脱去乙基生成的环丙沙星被普遍认为是恩诺沙星在大部分水产动物体内的主要代谢产物(Fang et al, 2007; Intorre et al, 2000; 徐维海等, 2004),但研究方向主要集中在恩诺沙星及其主要代谢产物环丙沙星的代谢动力学特征方面,对于恩诺沙星在水产动物体内其他代谢途径和代谢产物的研究较少,仅有房文红等(2009)、林峰等(2004)、周帅等(2012、2013)对恩诺沙星在锯缘青蟹(Scylla serrata)、烤鳗、异育银鲫(Carassius auratus Gibelio)和凡纳滨对虾(Litopenaeus vannamei)中代谢途径及代谢产物情况进行较深入的研究。
1) 饶勇, 曾振灵. QNs残留检测确证方法的建立和恩诺沙星代谢的比较研究.中国畜牧兽医学会兽医药理毒理学分会第九次学术讨论会论文与摘要集, 2006
本研究采用液相色谱-三重四级杆复合线性离子阱质谱(HPLC/Q-TRAP MS),对恩诺沙星在鲤鱼肝脏中的代谢产物进行系统分析,以期推测恩诺沙星在鲤鱼肝脏中的主要代谢途径和代谢产物。
1 材料与方法 1.1 试验动物实验动物采用生命体征健康的鲤鱼,购自青岛市平度双庙水库。鱼体重为730−950 g,试验喂药前于水族箱中暂养7 d,养殖用水为自来水,使用前连续充气24 h,养殖水温为(21±1)℃。
1.2 化学试剂甲酸(色谱纯,CNW公司),乙腈(色谱纯,Sigma公司),甲醇(色谱纯, Merck公司),正己烷(色谱纯,CNW公司),恩诺沙星和环丙沙星标准品(纯度≥98.0%,德国Dr. Ehrenstorfer公司),无水硫酸钠(分析纯,国药集团化学试剂公司),试验用水均为超纯水。
1.3 试验仪器LC-20A液相系统(日本Shimadzu公司);QTRAPTM5500三重四级杆复合线性离子阱质谱仪(美国AB Sciex公司),配有电喷雾电离源(ESI源);旋转蒸发仪(Heidolph Laborota 4000-efficient);旋涡混合仪(TALBOYS);离心机(Xiang Yi L-550);Gradient A10 Milli-Q超纯水器(Millipore);KQ-600DE超声波清洗器(昆山市超声仪器有限公司)。
1.4 体内给药和肝脏采集取鲤鱼6条,其中3条为空白对照,采集肝脏。将空白对照组鲤鱼肝脏混匀,置于生理盐水中反复冲洗,剔除脂肪和结缔组织后,用滤纸吸干表面水分,用研钵研磨后,于-20℃条件下保存待用。另外3条鲤鱼腹腔注射恩诺沙星,给药剂量为30 mg/kg鱼体重,给药后24 h采集肝脏,与空白对照组鲤鱼肝脏采用相同的处理方式,研磨后,于-20℃条件下保存待用。
1.5 样品提取净化准确称取(2.00±0.02) g肝脏研磨组织于50 ml具塞离心管中,加入10 g无水硫酸钠,涡旋混匀,再加入10 ml酸化乙腈(甲酸:乙腈=1:99,V/V),涡旋混合1 min,超声波提取10 min。4000 r/min离心5 min,取上清液于100 ml鸡心瓶中。残渣中加10 ml酸化乙腈,重复提取,合并两次提取液,于40℃水浴旋转蒸发至干。1 ml甲醇-0.1%甲酸溶液(10:90,V/V)涡旋溶解残留物,再加入3 ml正己烷,涡旋混合30 s,静置后弃上层液,取下层清液,过0.22 μm滤膜,供HPLC/Q-TRAP MS测定(样品提取净化过程参照农业部1077号公告-1-2008,略有修改)。
1.6 HPLC/Q-TRAP MS液相色谱条件HPLC/Q-TRAP MS液相色谱柱为C18 MG Ⅲ(150 mm×2.0 mm I.D.,5 μm粒径,日本资生堂公司),柱温为35℃,流速为0.2 ml/min,进样体积为10 μl,流动相A为甲醇,流动相B为0.1%(v/v)甲酸溶液,梯度洗脱程序为:0-3 min, 10%-35% A; 3-9 min, 35% A; 9-11 min, 35%-80% A; 11-15 min, 80% A; 15-16.5 min, 80%-10% A, 16.5-20 min, 10% A。
1.7 HPLC/Q-TRAP MS质谱条件采用电喷雾离子源(Electrospray ionization,ESI)正离子检测方式,气帘气30 psi,喷雾电压5000 V,雾化气60 psi,辅助气55 psi,离子化温度为550℃。扫描模式:多反应监测扫描引发增强型子离子扫描(MRM-IDA-EPI),二级质谱碰撞电压为35 eV,碰撞电压差为±15 eV,碰撞室射出电压为12 eV。
1.8 标准工作曲线绘制分别准确称取0.0100 g恩诺沙星、环丙沙星标准品于10 ml棕色容量瓶中,以色谱纯甲醇定容至10 ml,配制成浓度为1 mg/ml的恩诺沙星与环丙沙星标准储备液。再分别稀释成浓度为0.002、0.005、0.010、0.020、0.050、0.100、0.200、0.500、1.00 μg/ml的标准溶液。系列标准溶液用HPLC/Q-TRAP MS法进行检测,采用外标法对恩诺沙星和环丙沙星的标准曲线系列进行测定,以药物浓度(x)为横坐标,以峰面积(y)为纵坐标,作线性回归,并得回归方程和相关系数。
1.9 回收率与精密度取空白肝脏样品,添加一定量的标准工作液,分别按照2.0、10.0、20.0 μg/kg添加水平进行回收率实验,按照1.5进行样品前处理,按照1.6、1.7的液相色谱条件与质谱条件进行测定,每个浓度设置3个批次,每个批次3个平行。
1.10 数据处理方法采用AB Sciex Analyst Software 1.6和MultiQuant 2.1.1数据分析软件对鲤鱼肝脏中恩诺沙星及其代谢产物进行处理分析。
2 结果与分析 2.1 线性范围和最低检出限恩诺沙星和环丙沙星标准溶液在0.002-1.00 μg/ml浓度范围内,线性关系良好,相关系数均大于0.995,该方法最低检出限为1.0 μg/kg。
2.2 回收率与精密度在本实验条件下,以2.0、10.0、20.0 μg/kg 3个添加水平分别测试恩诺沙星和环丙沙星在肝脏中的回收率,每个浓度设置3个批次,每个批次3个平行。测得恩诺沙星和环丙沙星在肝脏中的平均回收率均大于70%。批内变异系数和批间变异系数均小于3.0%和5.0%。
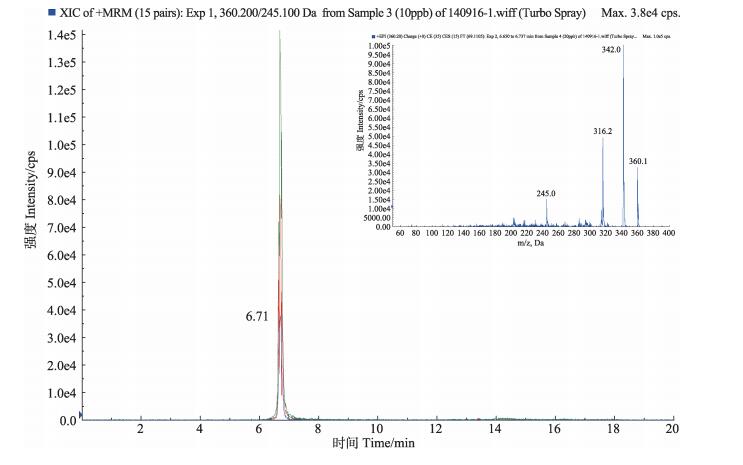
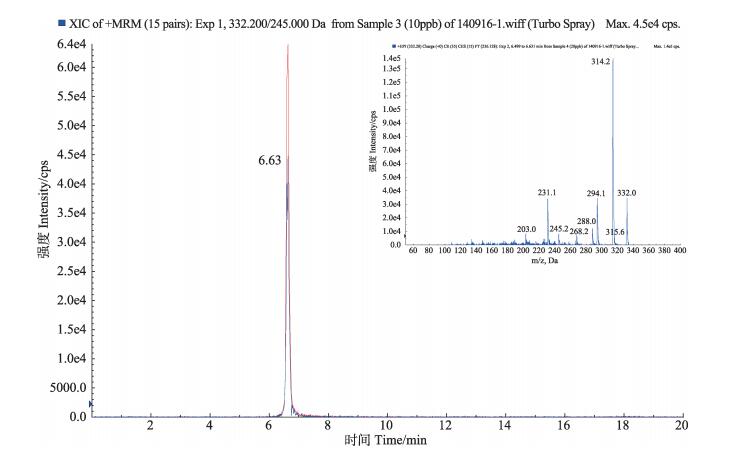
2.3 恩诺沙星和环丙沙星标准品的HPLC/Q-TRAP MS分析对恩诺沙星和环丙沙星的色谱质谱行为进行分析。分别取恩诺沙星和环丙沙星对照品溶液,按1.6、1.7色谱、质谱条件进行HPLC/Q-TRAP MS分析,见图 1和图 2。恩诺沙星和环丙沙星色谱保留时间tR分别为6.63、6.71 min,得到恩诺沙星的主要碎片离子有m/z 342.000 ([MH-H2O]+)、316.200 ([MH-CO2]+)、245.000 ([MH-CO2-C2H5NC2H4]+),质谱裂解特征是中性丢失-18 Da、-44 Da、-115 Da,环丙沙星的主要碎片离子有m/z 288.200 ([MH-CO2]+)、268.200 ([MH-H2O-CO2])、245.200 ([MH-CO2-HNC2H4]+),质谱裂解特征是中性丢失-44 Da、-62 Da、-87 Da。
|
图 1 恩诺沙星提取离子流色谱和二级质谱 Figure 1 Extracted ion chromatograms and MS2 spectra of enrofloxacin |
|
图 2 环丙沙星提取离子流色谱和二级质谱 Figure 2 Extracted ion chromatograms and MS2 spectra of ciprofloxacin |
在HPLC/Q-TRAP MS条件下,分别对空白鲤鱼和给药后24 h鲤鱼的肝脏提取物进行分析,首先对照其一级质谱的差异,分析可能存在的恩诺沙星代谢产物。然后对可能存在的恩诺沙星代谢产物进行二级质谱分析,结合恩诺沙星结构,并据各个代谢产物二级质谱图的碎片离子,推测代谢产物的化学结构。在一级质谱分析中共检测到5种相关物质,其保留时间tR分别为6.53、6.48、6.60、6.90、8.25 min,其质核比m/z分别为316.180 (M1)、332.180 (M2)、360.200 (M0)、376.210 (M3-1)和376.210 (M3-2)。
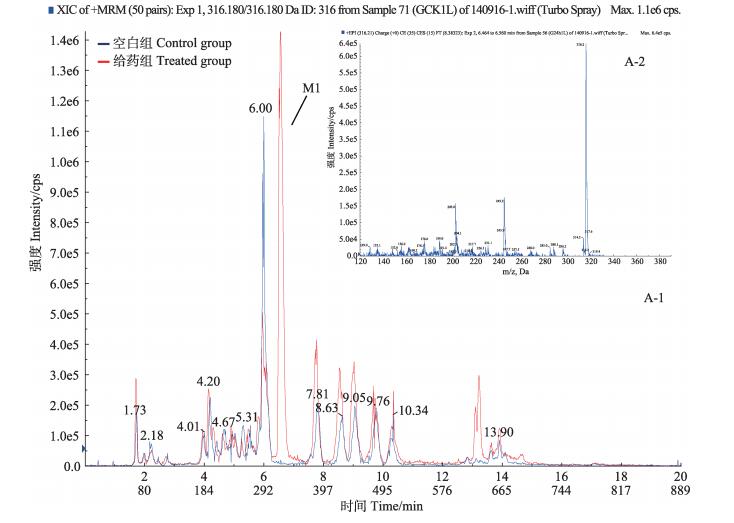
2.4.1 M1([M+H]+,m/z 316.210)在m/z为316.210的提取离子流色谱图中,检测到1个色谱峰M1,保留时间tR为6.53 min,主要碎片离子为m/z 245.200 ([MH-C2H5NC2H4]+)、203.000 ([MH- C2H5N2C4H8]+),质谱裂解特征是中性丢失-71 Da、-113 Da (图 3)。M1的准分子离子m/z 316.210,比恩诺沙星质荷比少44,推测M1是恩诺沙星母核六元环脱去-COOH得到,分子式为C18H21FN3O,判断M1为恩诺沙星脱羧代谢产物。
|
图 3 空白组与给药组鲤鱼肝脏中M1提取离子流色谱(A-1)和二级质谱(A-2) Figure 3 Extracted ion chromatogram(A-1) and MS2 spectra(A-2) for M1 in the liver of carp in control and treated groups |
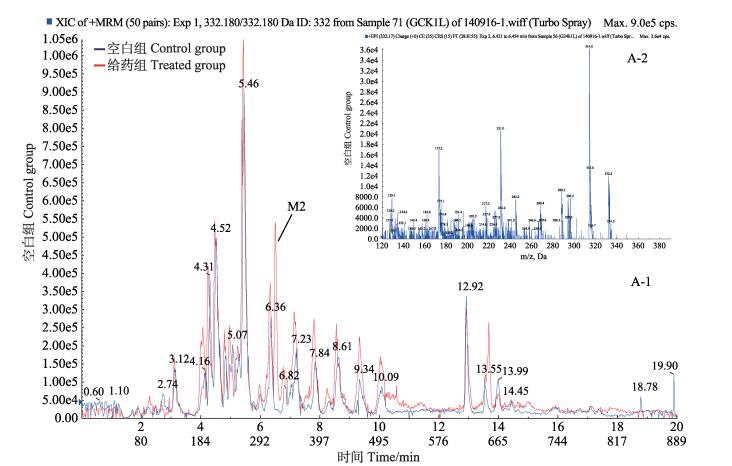
在m/z为332.180的提取离子流色谱图中,检测到1个色谱峰M2,保留时间tR为6.48 min,得到的主要碎片离子为m/z314.000 ([MH-H2O]+)、m/z 288.200 ([MH-CO2]+)、245.200 ([MH-C2H5NC2H4]+), 质谱裂解特征是中性丢失-18 Da、-44 Da、-87 Da (图 4)。M2的准分子离子m/z332.180,比恩诺沙星质荷比少28,推测M2是由恩诺沙星母核侧链上的哌嗪环脱去乙基得到,且M2与环丙沙星对照品色谱保留时间及质谱行为相同,因此,代谢产物M2被确认为环丙沙星。
|
图 4 空白组与给药组鲤鱼肝脏中M2提取离子流色谱(A-1)和二级质谱(A-2) Figure 4 Extracted ion chromatogram(A-1) and MS2 spectra(A-2) for M2 in the liver of carp in control and treated groups |
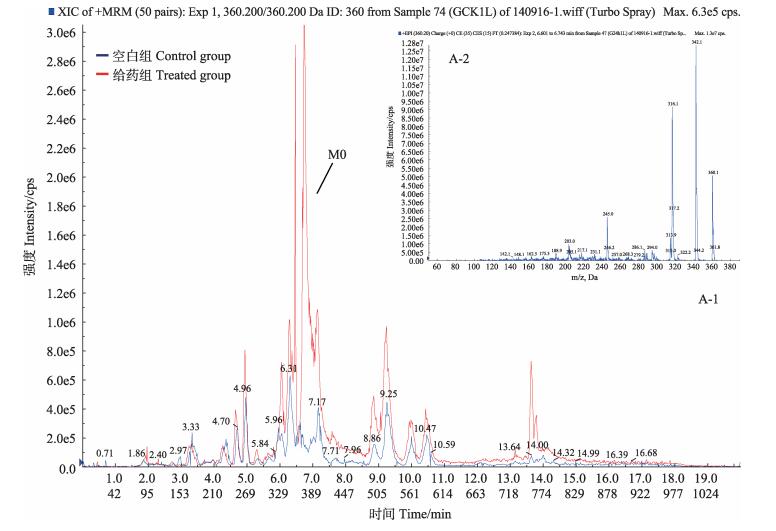
选择性检测m/z 360.200,色谱保留时间tR为6.60 min时出现一个色谱峰,命名为M0,进行二级质谱分析,得到的主要碎片离子为m/z 342.000 ([MH-H2O]+)、316.200 ([MH-CO2]+)、245.000 ([MH-CO2-C2H5NC2H4]+) (图 5),质谱裂解特征是中性丢失-18 Da、-44 Da、-115 Da。M0与恩诺沙星对照品的色谱保留时间以及质谱行为相同,确定M0是未被代谢的原形药物恩诺沙星。
|
图 5 空白组与给药组鲤鱼肝脏中M0提取离子流色谱(A-1)和二级质谱(A-2) Figure 5 Extracted ion chromatogram(A-1) and MS2 spectra(A-2) for M0 in the liver of carp in control and treated groups |
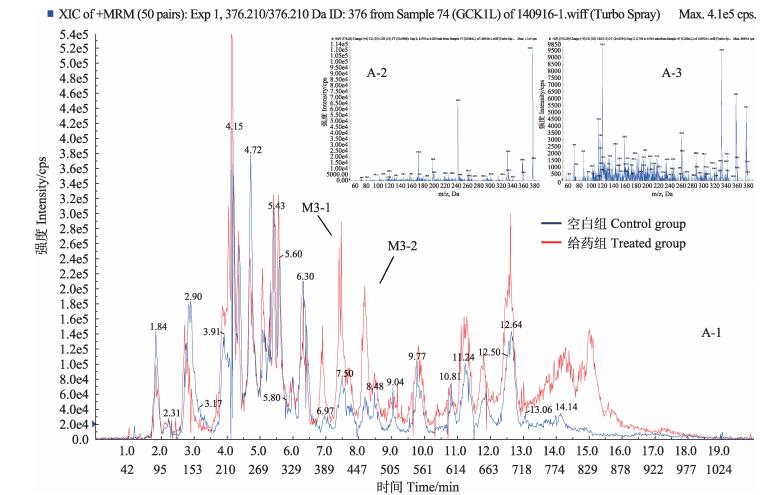
选择性检测m/z 376.210,色谱保留时间tR为6.90、6.82 min时,出现两个色谱峰M3-1和M3-2。对这两个峰分别进行二级质谱分析(图 6),M3-1得到的主要碎片离子为m/z 358.100 ([MH-H2O]+)、342.100、332.200 ([MH-CO2]+)、261.200 ([MH-CO2-C2H5NC2H4]+)。M3-2得到的主要碎片离子为m/z 358.000 ([MH-H2O]+)、332.000 ([MH-CO2]+)、261.000 ([MH-CO2-C2H5NC2H4]+)、243.000。M3-1和M3-2与原形药物相比,代谢产物的分子量均增加了16 Da,并且与原形药物具有相似的质谱裂解特征,即中性丢失-18 Da、-44 Da、-115 Da,因此,推测M3-1和M3-2是恩诺沙星羟基化代谢产物,二者是同分异构体。
|
图 6 空白组与给药组鲤鱼肝脏中M3-1、M3-2提取离子流色谱(A-1)和二级质谱(A-2、A-3) Figure 6 Extracted ion chromatogram(A-1) and MS2 spectra(A-2 and A-3) for M 3-1 and M3-2 in the liver of carp in control and treated groups |
表 1是30 mg/kg鱼体重恩诺沙星腹腔注射给药24 h后,鲤鱼肝脏中所测得的原形药物和代谢产物的峰面积。根据标准曲线,鲤鱼肝脏中存在恩诺沙星和代谢产物环丙沙星,浓度分别为0.2780 mg/kg、0.0064 mg/kg。对鲤鱼腹腔注射30 mg/kg鱼体重的恩诺沙星,给药24 h后,恩诺沙星在鲤鱼肝脏中大部分以原形物形式存在,环丙沙星为主要代谢产生物。环丙沙星与恩诺沙星浓度比约为2.3%。
|
|
表 1 鲤鱼肝脏中原形药物及主要代谢产物的峰面积及浓度 Table 1 The peak area and concentrations of enrofloxacin and its metabolites in carp liver |
房文红等(2009)对锯缘青蟹进行恩诺沙星30 mg/kg口灌给药,采用液相色谱-电喷雾离子阱质谱法(LC/MSn)分析了给药24 h后锯缘青蟹血淋巴中恩诺沙星的代谢产物,发现除恩诺沙星和主要代谢产物环丙沙星外,还存在恩诺沙星羟基化代谢产物及加氧恩诺沙星代谢产物,含量分别占总残留的98.56%、1.17%、0.18%和0.09%。推测恩诺沙星在锯缘青蟹体内的代谢反应主要是脱乙基反应、羟基化反应和氧化反应。林峰等(2004)采用液相色谱串联质谱法发现,恩诺沙星在烤鳗中发生脱羧、脱羧后哌嗪环断裂重排及脱羧、脱羰基后结构重排,但未详细解释其质谱裂解行为。周帅等(2012、2013)采用超高效液相色谱-四级杆-飞行时间质谱对恩诺沙星在异育银鲫、凡纳滨对虾体内和体外肝微粒体中代谢产物进行分析,结果显示,口灌给药24 h后,异育银鲫、凡纳滨对虾血浆中均以恩诺沙星原形药物为主(>99.80%),有少量N-去乙基代谢产物环丙沙星( < 0.30%),在异育银鲫血浆中还检测到少量葡萄糖醛酸结合物(0.21%),在凡纳滨对虾血浆中检测到少量通过加氢还原反应得到的环丙沙星哌嗪环开环代谢物(0.02%)及同分异构体(0.05%)。但恩诺沙星在异育银鲫和凡纳滨对虾肝微粒体中仅发生脱乙基反应生成环丙沙星(≤0.20%)。
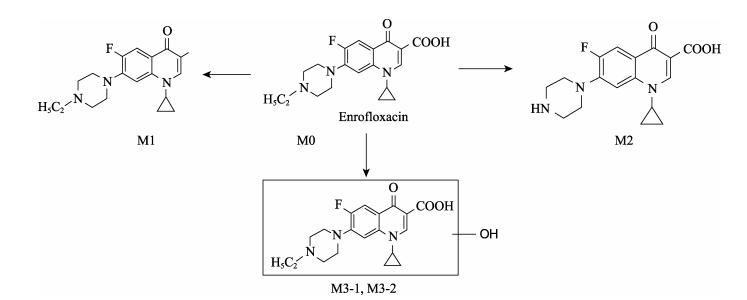
在本研究中,恩诺沙星在鲤鱼肝脏中除以原药形式以及主要代谢产物环丙沙星存在外,推测还有3种代谢产物,即恩诺沙星脱羧代谢产物(M1)和恩诺沙星羟基化代谢产物(M3-1和M3-2),从代谢产物的结构可以初步推断,恩诺沙星在鲤鱼肝脏中发生的代谢途径主要有母核六元环脱羧以及羟基化(图 7)。其中恩诺沙星脱乙基产生环丙沙星与大部分报道一致,恩诺沙星羟基化代谢产物与房文红等(2009)和方舟等(2012)研究一致。水产动物体内发现恩诺沙星脱羧代谢产物(M1)未见报道过,但饶勇等(2006)1)发现在大鼠体内存在恩诺沙星脱羧代谢产物。
|
图 7 推测的鲤鱼肝脏中恩诺沙星的代谢途径 Figure 7 Speculated metabolism pathway of enrofloxacin in carp liver |
1) 饶勇. QNs残留检测确证方法的建立和恩诺沙星代谢的比较研究.中国畜牧兽医学会兽医药理毒理学分会第九次学术讨论会论文与摘要集, 2006
恩诺沙星在不同动物体内代谢途径较为复杂,代谢产物种类与含量也存在差异。原因可能是动物种属、作用于药物代谢的酶种类以及检测分析的组织器官的不同而存在差别(赵冬梅等, 2000)。在后续的研究工作中,随着分析手段的提高,对恩诺沙星在水产动物体内代谢途径和代谢产物的状况,可以有更加深入的认识,进一步补充恩诺沙星的药物代谢动力学特征,为科学、合理地使用恩诺沙星提供理论依据。
| 方舟, 任恒鑫, 许鑫, 等. HPLC-DAD-MSn法分析恩诺沙星在兔血浆中的代谢产物. 中国兽药杂志 , 2012, 46 (2) : 19-22 | |
| 杨先乐. 新编渔药手册. 中国农业出版社, 2006 : 183 -184. | |
| 房文红, 胡琳琳, 陈玉露, 等. 采用LC/MSn法分析恩诺沙星在锯缘青蟹血浆中的代谢产物. 海洋渔业 , 2009, 30 (4) : 350-355 | |
| 林峰, 林海丹, 吴映璇, 等. LC-MS-MS测定烤鳗中4种氟喹诺酮药物残留量. 分析测试学报 , 2004, 23 (5) : 43-47 | |
| 周帅, 李国烈, 胡琳琳, 等. 恩诺沙星在异育银鲫体内和体外肝微粒体中代谢产物分析. 东北农业大学学报 , 2013, 44 (6) : 101-106 | |
| 周帅, 胡琳琳, 孙贝贝, 等. 恩诺沙星在凡纳滨对虾体内和体外肝微粒体中的代谢产物比较分析. 海洋渔业 , 2012, 34 (3) : 342-349 | |
| 赵冬梅, 李燕, 卢业竑. 药物代谢研究在新药开发中的作用. 药学学报 , 2000, 35 (2) : 156-160 | |
| 徐维海, 林黎明, 朱校斌, 等. 恩诺沙星及其代谢产物在吉富罗非鱼、中国对虾体内的残留规律研究. 水产科学 , 2004, 23 (7) : 5-8 | |
| Fang W, Zhou S, Yu H, et al. Pharmacokinetics and tissue distribution of enrofloxacin and its metabolite ciprofloxacin in Scylla serrata following oral gavage at two salinities. Aquaculture , 2007, 272 (1) : 180-187 | |
| Intorre L, Cecchini S, Bertini S, et al. Pharmacokinetics of enrofloxacin in the seabass (Dicentrarchus labrax). Aquaculture , 2000, 182 : 49-59 DOI:10.1016/S0044-8486(99)00253-7 | |
| Morales-Gutiérrez FJ, Hermo MP, Barbosa J, et al. High-resolution mass spectrometry applied to the identification of transformation products of quinolones from stability studies and new metabolites of enrofloxacin in chicken muscle tissues. J Pharmaceut Biomed , 2014, 92 : 165-176 DOI:10.1016/j.jpba.2014.01.014 | |
| Parshikov IA, Freeman JP, Lay JO, et al. Microbiological transformation of enrofloxacin by the fungus Mucor ramannianus. Appl Environ Microb , 2000, 66 (6) : 2664-2667 DOI:10.1128/AEM.66.6.2664-2667.2000 | |
| Wetzstein HG, Schmeer N, Karl W. Degradation of the fluoroquinolone enrofloxacin by the brown rot fungus Gloeophyllum striatum: identification of metabolites. Appl Environ Microb , 1997, 63 (11) : 4272-4281 | |
| Wetzstein HG, Schneider J, Karl W. Patterns of metabolites produced from the fluoroquinolone enrofloxacin by basidiomycetes indigenous to agricultural sites. Appl Microbiol Biot , 2006, 71 (1) : 90-100 DOI:10.1007/s00253-005-0178-4 |



