2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071
海带(Saccharina japonica)为冷水性褐藻,自然分布于北太平洋北部(曾呈奎等, 1962)。海带属约50多个种,自然生长在我国的海带只有1种,曾用拉丁文名为Laminaria japonica Aresch (曾呈奎等, 1984; 李晓捷等, 20031)),现更名为Saccharina japonica (Lane et al, 2006)。
1) 李晓捷.海带配子体克隆培养技术研究.中国海洋大学硕士研究生学位论文, 2003, 1-26
海带是我国最早实现全人工养殖和育苗的大型经济海藻,是我国海水养殖支柱产业之一,养殖规模与产量均居世界首位。海带具有重要的经济价值:食品上,可以加工成海带丝、海带结、海带卷等各种产品;医药上,可治疗甲状腺肿大、降压、降脂、抗凝血、抗肿瘤、抗辐射、增强免疫力等(李林等, 2001);工业上,可作为原料提取褐藻胶、碘和甘露醇,用于纺织印染业、橡胶工业、造纸业等;在生态学中,海带作为大型海藻,在海洋中形成“海洋森林”,不仅为其他生物提供栖息环境、丰富生物多样性、提高海洋初级生产力,还可以吸收海水中的氮、磷,固定二氧化碳,在解决近海水域富营养化、赤潮发生、海洋生态平衡、海洋环境污染等问题上起着不可替代的作用(杨宇峰等, 2003; 毛玉泽等, 2005; 葛长字, 2006)。
我国对海带的研究及应用现处于国际领先地位,是目前世界上唯一对海带育苗、育种、种质保存和栽培技术进行系统研究并形成完善技术体系的国家(曾呈奎等, 1962、1981; 方宗熙等, 1965; 王军等, 1999; 王宗诚等, 1980; 姚南瑜等, 1981; 岳国峰等, 2001; 张壮志等, 2010)。我国的海带多为人工养殖获得,养殖中面临品种退化、杂合、抗逆性差等诸多问题,但随着育种工作的不断进行,新的海带品种对环境的适应能力及其经济性状都有不同程度的改变,如对环境适应性增强、生长速度快、耐高温、抗强光;个体大、叶厚、边缘小,藻体韧性大等(丛义周, 20091); 张全胜等, 2001)。
1) 丛义周.东方3号杂交海带种质分析.中国农业科学院硕士研究生学位论文, 2009, 1-40
液相氧电极技术由于可以保持一定的测定环境条件和仪器简单等优点而被广泛应用于光合速率的测定。目前,国内外利用液相氧电极技术对微藻的光合及呼吸速率的测定研究较多(王铭, 20092); 张磊等, 2010; 张曼等, 2010),而使用液相氧电极技术对海带幼孢子体光合生理的研究较少。姚南瑜等(1981)利用液相氧电极进行了光照、温度、盐度对不同生长时期的海带及不同部位的光合活性测定的单因素实验,还有学者利用氧电极研究了温度及营养盐对海带幼孢子体生长和光合作用的影响(朱明远等, 2004; 吴荣军等, 2006)。
2) 王铭.雨生红球藻绿色细胞的光合特性及其无机碳利用机制.暨南大学硕士研究生学位论文, 2009
本研究以温度、光强及营养盐浓度设置单因素实验,研究环境因子对新品系“海天1号”海带生长、光合作用等影响。探究“海天1号”海带幼孢子体培育的适宜条件,为完善“海天1号”海带人工养殖技术提供理论依据。
1 材料与方法 1.1 材料实验所用的海带幼孢子体为2014年7月7日从山东省荣成市寻山集团青鱼滩养殖厂带回的种海带经室内采苗、培养所得。该海带是南方耐高温品种与北方高产品种杂交后并经过几代选育获得的海带新品系,具有产量高、耐高温、成熟稍早等特点(暂命名为“海天1号”海带)。培养液为灭菌的天然海水,氮、磷营养盐分别为NaNO3、KH2PO4溶液。
1.2 方法 1.2.1 采孢子种海带用灭菌海水清洗后,用纱布进行反复擦洗,除去表面杂藻,放于40 cm×60 cm的白色塑料箱中,低温阴干处理约2 h。然后放于灭菌的低温海水中,使其放散游孢子。用灭菌的低温海水稀释游孢子溶液至每视野10-15个游孢子水平(×100),将稀释液均匀喷洒在经消毒处理的带有棕绳的培养槽中。
培育条件:温度为13℃,光强为20-30 μmol photons/(m2·s),光周期为10 L:14 D,培养液为灭菌海水,氮营养盐浓度为4 mg/L,磷浓度为0.4 mg/L,静水培养,每隔3 d更换新水。在幼孢子体生长发育的不同阶段,对温度、光、营养盐等条件进行人工调节和控制。当海带幼孢子体生长至1-2 cm时,进行实验。
1.2.2 生长实验温度对幼孢子体生长及光合作用的影响实验:设置6℃、10℃、14℃、18℃、22℃ 5个处理组,每组设置3个重复。其他条件:光强为60 μmol photons/(m2·s),氮营养盐为4 mg/L,光周期为10 L:14 D(下同)。
光强对幼孢子体生长及光合作用的影响实验:设置20、40、60、80、100 μmol photons/(m2·s) 5个处理组,每组设置3个重复。其他条件:温度为14℃,氮营养盐为4 mg/L。
营养盐对幼孢子体生长及光合作用的影响实验:设置氮营养盐浓度为2、4、6、8、10 mg/L 5个处理组,每组设置3个重复。用PhotoLab多参数水质分析仪(德国WTW)标定实验用海水的氮、磷浓度。其他条件:光强为60 μmol photons/(m2·s),温度为14℃。
实验时,取10株长1-2 cm的幼孢子体,放在盛有1 L培养液的烧杯中,置于GXZ智能型光照培养箱中悬浮培养,培养周期为7 d,每3 d更换新水,2 d观察1次(下同)并记录。实验起始时,用吸水纸吸干藻体表面的水分,测量鲜重,培养7 d后再次称量,计算RGR,计算公式:
| $ RGR = \left[ {\ln \left({{W_t}/{W_\mathit0}} \right)/t} \right] \times 100\% $ |
式中,W0为初始藻体鲜重(g),Wt为实验结束时的藻体鲜重(g),t为实验持续的时间(d)(朱明远等, 2004)。
1.2.3 液相氧电极实验在不同环境条件下培养藻体,在相应条件下使用液相氧电极测定幼苗表观光合速率(Pn)和呼吸耗氧速率(R)。反应杯中的海水温度恒定,反应介质为灭菌的海水,以500 W碘钨灯作光源,通过移动光源距离调节光强。每个条件下稳定约5 min后再测量,每次测定在5 min之内完成,由氧电极自带软件得出Pn和R值。每个温度梯度设6次平行。
1.2.4 正交实验实验主要研究了温度、光强、营养盐浓度3个因子对幼孢子体RGR的影响,每个因子设置3个水平,每个水平重复3次。各因素设置见表 1。
|
|
表 1 正交实验因素水平设计 Table 1 Factors and levels of the orthogonal experiment |
用Origin整理数据及绘制图形,进行方差分析,以P < 0.05作为差异显著性水平,用正交设计助手Ⅱ V3.1对正交实验数据进行分析。实验数据用平均值±标准差(X±SD)的形式表示。
2 结果分析 2.1 环境因子对“海天1号”海带幼孢子体生长的影响温度从6℃升高到22℃时,幼孢子体的RGR呈先上升后下降的趋势。14℃时,RGR达到最大值,为14.00%;22℃时,RGR最低,为0.79%(图 1)。经单因素方差分析显示,14℃与22℃组存在显著性差异(P < 0.05),而其他实验组均无显著性差异(P>0.05)。在18℃与22℃培养条件下,幼孢子体出现“白化”现象,硅藻较多。

|
图 1 不同温度条件下培育7 d后幼孢子体的RGR Figure 1 Relative growth rate of sporophytes cultivated for 7 d at different temperature |
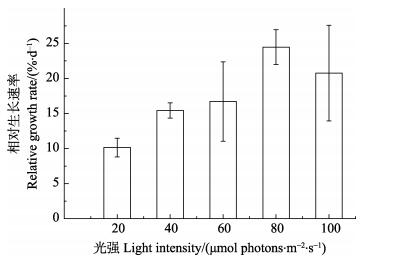
光强从20 μmol photons/(m2·s)升高到80 μmol photons/(m2·s)时,幼孢子体的RGR呈上升趋势,分别为10.15%、15.43%、16.70%和24.48%。在80 μmol photons/(m2·s)时,RGR达到最大;100 μmol photons/(m2·s)时,幼孢子体的RGR明显受到抑制(图 2)。单因素方差分析显示,20 μmol photons/(m2·s)组与80 μmol photons/(m2·s)组存在显著性差异,而其他组之间均无显著性差异(P>0.05)。
|
图 2 不同光强条件下培育7 d后幼孢子体的RGR Figure 2 Relative growth rate of sporophytes cultivated for 7 d under different illuminance |
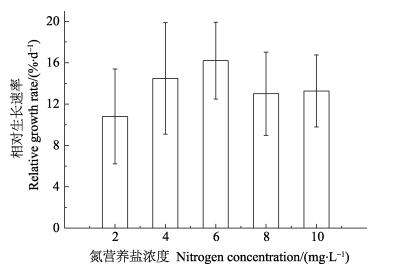
氮营养盐浓度从2 mg/L增加到10 mg/L时,幼孢子体的RGR呈先上升后下降的趋势。6 mg/L组的RGR最大,为16.20%;2 mg/L组的RGR最小,为10.80%。8 mg/L组和10 mg/L组的RGR均在13%左右(图 3)。单因素方差分析显示,5个处理组之间无显著性差异(P>0.05)。
|
图 3 不同氮营养盐浓度条件下培育7 d后幼孢子体的RGR Figure 3 Relative growth rate of sporophytes cultivated for 7 d at different nitrogen concentration |
由图 4可知,温度从6℃升高到22℃时,幼孢子体的Pn先上升后下降。14℃时,幼孢子体的Pn达到最大,显著高于其他处理组(P < 0.05);10℃时,幼孢子体Pn较大,显著高于22℃组(P < 0.05);幼孢子体的Pn在22℃时最小。22℃组幼孢子体的R最大;14℃时幼孢子体的R最低,显著低于18℃和22℃组(P < 0.05)。

|
图 4 不同温度条件下培育7 d后幼孢子体Pn与R的影响 Figure 4 Apparent photosynthetic rate and respiratory oxygen consumption rate of sporophytes cultivated for 7 d at different temperature |
由图 5可知,光强在20-80 μmol photons/(m2·s)范围内,随着光强的增强,幼孢子体的Pn呈上升趋势。20 μmol photons/(m2·s)时,幼孢子体的Pn最小;80 μmol photons/(m2·s)时,幼孢子体的Pn最大;100μmol photons/(m2·s)时,幼孢子体的Pn受到抑制。光强从20 μmol photons/(m2·s)增加到100 μmol photons/(m2·s)时,幼孢子体的Pn无显著性差异(P>0.05)。R在100μmol photons/(m2·s)时最大,显著高于40μmol photons/(m2·s)组(P < 0.05)。其他光强组之间无显著差异(P>0.05)。

|
图 5 不同光强条件下培育7 d后幼孢子体Pn与R的影响 Figure 5 Apparent photosynthetic rate and respiratory oxygen consumption rate of sporophytes cultivated for 7 d under different light intensity |
由图 6可知,随着氮营养盐浓度的增加,幼孢子体的Pn呈先上升后下降的趋势。4 mg/L组和6 mg/L组幼孢子体的Pn较大。4 mg/L组和6 mg/L组都与2 mg/L组、8 mg/L组及10 mg/L组幼孢子体的Pn变化差异显著(P < 0.05),2 mg/L组与8 mg/L组幼孢子体的Pn变化差异也显著(P < 0.05)。R随着氮营养盐浓度的增加先下降后上升。在6 mg/L时,R最小;10 mg/L时,R最大。方差分析结果显示,2 mg/L组与6 mg/L组、4 mg/L组与10 mg/L组、6 mg/L组与8 mg/L组、10 mg/L组幼孢子体的R变化有显著性差异(P < 0.05)。

|
图 6 不同氮营养盐浓度条件下培育7 d后幼孢子体Pn与R的影响 Figure 6 Apparent photosynthetic rate and respiratory oxygen consumption rate of sporophytes cultivated for 7 d at different nitrogen concentration |
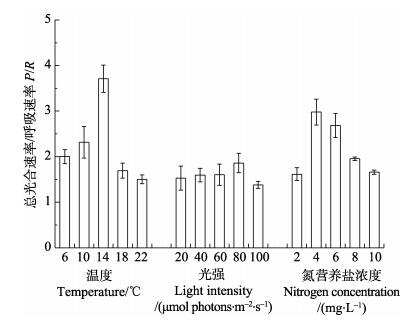
由图 7可知,温度、光强、氮营养盐浓度对“海天1号”海带幼孢子体的P/R (总光合速率/呼吸耗氧速率)的影响不同。光强对其影响较小,5个处理组之间无显著性差异(P>0.05)。温度和营养盐对其影响较大,14℃对幼孢子体的P/R的影响显著高于其他温度组(P < 0.05),10℃组与22℃组之间也存在显著性差异(P < 0.05),4 mg/L组、6 mg/L组与其他组均存在显著性差异(P < 0.05)。
|
图 7 不同培育条件对幼孢子体的总光合速率/呼吸耗氧速率的影响 Figure 7 The ratio of total photosynthetic rate and respiratory oxygen consumption rate of sporophytes under different conditions |
由表 2均值大小可以看出,生长效果较好的组合条件为:温度16℃、光强50 μmol photons/(m2·s)、氮营养盐浓度5 mg/L。由极差可以看出,在实验范围内,温度对海带幼孢子体生长影响较大,其次是营养盐,光强对其生长的影响较小,表明“海天1号”海带幼孢子体对光强反应不敏感。
|
|
表 2 海带幼孢子体室内生长条件优化正交设计和直观分析 Table 2 rthogonal design and intuitionistic analysis for optimization of sporophytes growth conditions in laboratory |
温度、光强、营养盐是海带幼孢子体的生长与发育的重要条件,其中,温度是影响生长的主要因子。海带生长耐受的最高温度是20℃,藻体干重增长的最适温度为13-20℃,幼孢子体生长的最适温度在10-15℃之间(曾呈奎等, 1957; 张泽宇等, 1999)。本研究结果显示,随着温度的升高,幼孢子体的RGR、光合作用均呈现先上升后下降的趋势,而呼吸作用与之相反。在14℃时,幼孢子体的RGR最大,光合作用最强,呼吸作用最弱,光合呼吸比值最大,说明此时幼孢子体生长状况最好。朱明远等(2004)在温度对海带幼孢子体生长和光合作用的影响研究中发现,幼孢子体在15℃下生长状况最好,Pn较大,本研究结果与此基本一致。低温6℃时,藻体生长、光合作用、呼吸作用水平比较低,可能是低温降低了CO2同化过程对激发能的利用,造成PSⅡ获得的过剩激发能增加,同时使光合作用的各个生化过程减慢。低温下电子传递速率低,因此,会出现生长缓慢、光合作用、呼吸作用水平较低的现象(韩博平, 2003)。当温度为22℃时,藻体容易受杂藻污染的影响,生长和光合作用受到了限制,主要是因为高温破坏叶绿体和细胞质的结构并使叶绿体的酶钝化,且在此温度时,藻体基部、叶尖部位出现不同程度的“白化”现象(刘佃林等, 2007)。
3.2 光强对“海天1号”海带幼孢子体生长及光合特性的影响光是控制藻类生长周期的重要因素,不同的生长阶段,对光的需求也大不相同。有研究表明,90 μmol photons/(m2·s)光强、充气悬浮培养配子体克隆具有较高的瞬时生长速率;巨藻雌、雄配子体在10 μmol photons/(m2·s)左右、温度15℃时,光合放氧非常低,适于巨藻配子体保种等(杨迎霞等, 2002; 李德茂等, 2005)。本研究结果表明,在20-80 μmol photons/(m2·s)范围内,幼孢子体的RGR随着光强的增加而升高。但在100 μmol photons/(m2·s)时,出现了光抑制现象,使其RGR降低,这可能是因为过剩的光能超过了可利用的光能,同时又超过了非辐射能量耗散的能力,使光系统受损,引起其光合能力下降(韩博平, 2003)。本实验中5个光强处理组,幼孢子体Pn无显著性差异(P>0.05)。R在100 μmol photons/(m2·s)最大,氧含量变化为415.47 nmol/(g·min),显著高于40 μmol photons/(m2·s)组,其他光强组之间无显著性差异(P>0.05)。这表明“海天1号”海带受光强变化的影响比较小,即在此范围内对光强变化不敏感。
3.3 营养盐浓度对“海天1号”海带幼孢子体生长及光合特性的影响营养盐对于植物的生长是不可或缺的,在自然界中,氮、磷营养盐常会成为植物生长的限制因素,氮和磷是组成蛋白质与核酸的元素,在细胞的代谢中发挥重要作用(王宗诚等, 1980)。有研究发现,海带雌雄配子体阶段,不含氮、磷营养盐的人工海水组约50%的配子体没有进行分化,并伴有裂解、死亡现象(Berges et al, 2001; Harrison et al, 2001; 鞠青等, 2009),进一步证实了氮、磷营养盐是海带配子体分化及继续生长的必需因素。营养条件不仅影响海带配子体的生长、健康状况,对其提高防病、抗病能力也有帮助(刘德厚等, 1997)。天然海水中添加氮磷营养盐可以促进海带配子体细胞分裂,在配子体发育过程中磷起的作用较多(Drew et al, 1910)。吴荣军等(2006)根据室内与围隔实验中海带幼孢子体在不同硝态氮浓度下的生长状况与光合速率分析指出,维持其生存的最低组织氮含量为其干重的1.68%,以最大生长速率生长所必需组织氮临界值为干重的2.04%。氮、磷含量过多或单独添加则会对藻体的生长和光合作用产生抑制,梁洲瑞等(2011)对鼠尾藻的研究表明,氮大于4 mg/L或磷大于1.2 mg/L培养30 h后,幼苗的FV/Fm(PSⅡ的最大量子产量)和rETRmax(最大潜在相对电子传递速率)均有明显下降。本研究结果表明,氮营养盐浓度从2 mg/L升高到6 mg/L时,其RGR、Pn、R均随之上升。氮营养盐浓度为2 mg/L时,因营养盐供应少,降低了其对无机营养盐的吸收,并减少了藻体的各种营养库,进而其RGR、Pn、R较低。有研究表明,氮可以通过叶绿体发育、叶绿素生物合成、光合作用酶活性等调节光合作用,缺氮会影响PSII反应中心蛋白合成(Berges et al, 1996; Kolber et al, 1988)。磷不足会使藻体中的ATP(三磷酸腺苷)和NADPH(还原型辅酶Ⅱ)明显下降,影响碳、氮代谢及电子传递(Fredeen et al, 1990; Rao et al, 1989)。氮营养盐浓度为6 mg/L时,幼孢子体的RGR、Pn、R达到最大,说明此时藻体有了充足的营养盐供应。当浓度变为8、10 mg/L时,幼孢子体的RGR、Pn、R受到限制,这与以上研究者提到的当营养盐含量过多时藻体生长会受到限制结果一致。
正交实验结果表明,“海天1号”海带幼孢子体对温度、营养盐、光强的敏感度依次降低,所以,在育苗过程中,应更加注重温度与营养盐浓度的人工控制,以保证育苗的产量与质量。
| 王军, 张泽宇, 张晓东. 温度与照度对利尻海带配子体及幼孢子体的影响. 中国水产 , 1999 (2) : 39-42 | |
| 王宗诚, 方宗熙. 无机氮和磷对海带配子体生长发育的影响. 山东海洋学院学报 , 1980, 10 (4) : 74-77 | |
| 毛玉泽, 杨红生, 王如才. 大型藻类在综合海水养殖系统中的生物修复作用. 中国水产科学 , 2005, 12 (2) : 225-231 | |
| 方宗熙, 李家俊. 温度和遗传对海带雌配子体细胞数目和成熟速度的影响. 海洋与湖沼 , 1965, 7 (4) : 385-395 | |
| 朱明远, 吴荣军, 李瑞香, 等. 温度对海带幼孢子体生长和光合作用的影响. 生态学报 , 2004, 24 (1) : 22-27 | |
| 刘佃林, 代彦满, 陈玉琴, 等. 植物生理学. 北京: 北京大学出版社, 2007 : 64 -65. | |
| 刘德厚, 于波. 不同营养元素对海带幼体发病及育苗效果的影响. 齐鲁渔业 , 1997, 14 (4) : 12-14 | |
| 李林, 罗琼, 张声华. 海带中褐藻糖胶的组成分析. 中国食品学报 , 2001, 1 (1) : 46-49 | |
| 李德茂, 王广策, 李兆生, 等. 光照强度和温度对营养生长的巨藻雌、雄配子体光合放氧的影响. 海洋科学 , 2005, 29 (12) : 51-55 | |
| 吴荣军, 朱明远, 李瑞香, 等. 海带(Laminaria japonica)幼孢子体生长和光合作用的N需求. 海洋通报 , 2006, 25 (5) : 36-43 | |
| 杨宇峰, 费修绠. 大型海藻对富营养化海水养殖区生物修复的研究与展望. 青岛海洋大学学报(自然科学版) , 2003, 33 (1) : 53-57 | |
| 杨迎霞, 罗世菊, 解建祖, 等. 光照强度对海带配子体克隆生长的影响. 水产科技情报 , 2002, 29 (3) : 114-116 | |
| 张全胜, 刘升平, 曲薯村, 等. "901"海带新品种培育的研究. 海洋湖沼通报 , 2001 (2) : 46-53 | |
| 张壮志, 李晓捷, 曲善村, 等. 海带配子体克隆二次附苗技术. 福建水产 , 2010, 26 (2) : 9-13 | |
| 张泽宇, 范春江. 海带属种间杂交育种的研究. 大连水产学院学报 , 1999, 14 (4) : 13-17 | |
| 张曼, 曾波, 张怡, 等. 温度变化对藻类光合电子传递与光合放氧关系的影响. 生态学报 , 2010, 30 (24) : 7087-7091 | |
| 张磊, 桑敏, 李爱芬, 等. 氮、锰、硫缺乏对蛋白核小球藻(Chlorella pyrenoidosa)光合产氢及其生长的影响. 生物工程学报 , 2010, 26 (4) : 489-494 | |
| 岳国峰, 王金霞, 王建飞, 等. 海带幼孢子体的光合碳利用. 海洋与湖沼 , 2001, 32 (6) : 647-652 | |
| 姚南瑜, 李建之. 海带光合特性研究. 植物生理学报 , 1981 (4) : 18-20 | |
| 梁洲瑞, 王飞久, 孙修涛, 等. 利用叶绿素荧光技术揭示光照、温度和盐度对鼠尾藻嫩芽的影响. 海洋科学 , 2011, 35 (12) : 21-27 | |
| 葛长字. 大型海藻在海水养殖系统中的生物净化作用. 渔业现代化 , 2006 (4) : 11-13 | |
| 韩博平. 藻类光合作用机理及模型. 北京: 科学出版社, 2003 : 79 -80. | |
| 曾呈奎, 王素娟, 刘思俭, 等. 海藻栽培学. 上海: 上海科学技术出版社, 1984 : 1 -5. | |
| 曾呈奎, 吴超元, 任国忠. 温度对海带配子体的生长发育的影响. 海洋与湖沼 , 1962, 4 (1-2) : 103-130 | |
| 曾呈奎, 吴超元, 孙国王. 温度对海带孢子体的生长和发育的影响. 植物学报 , 1957, 6 (2) : 103-130 | |
| 曾呈奎, 潘忠正, 周百成. 底栖海藻比较光合作用研究Ⅱ.潮间带褐藻的光合作用与光强的关系. 海洋与湖沼 , 1981, 12 (3) : 254-258 | |
| 鞠青, 王悠, 刘素, 等. 不同氮、磷配比人工海水对海带胚孢子早期发育的影响. 应用生态学报 , 2009, 20 (8) : 1947-1951 | |
| Berges JA, Charlebois DO, Mauzerall DC, et al. Differential effects of nitrogen limitation on photosynthetic efficiency of photosystemsⅠand Ⅱ in microalgae. Plant Physiol , 1996, 110 (2) : 689-696 DOI:10.1104/pp.110.2.689 | |
| Berges JA, Franklin DJ, Harrison PJ. Evolution of an artificial seawater medium: Improvements in enriched seawater artificial water over the last two decades. J Phycol , 2001, 37 (6) : 1138-1145 DOI:10.1111/jpy.2001.37.issue-6 | |
| Drew GH. The reproduction and early development of Laminaria digitata and Laminaria saccharina. Ann Bot , 1910, 24 (93-96) : 177-189 | |
| Harrison PJ, Hurd CL. Nutrient physiology of seaweeds: application of concepts to aquaculture. Cah Biol Mar , 2001, 42 (1-2) : 71-82 | |
| Kolber Z, Zehr J, Falkowski PG. Effects of growth irradiance and nitrogen limitation on photosynthesis energy conversion in photosystem Ⅱ. Plant Physiol , 1988, 88 (3) : 923-929 DOI:10.1104/pp.88.3.923 | |
| Fredeen AL, Raab TK, Rao IM, et al. Effects of phosphorus, nutririon on photosynthesis in Glycine max (L.). Meer. Planta , 1990, 181 (3) : 399-405 | |
| Lane CE, Mayes C, Druehl LD, et al. A multi-gene molecular investigation of the kelp (Laminariales, phaeophyceae) supports substantial taxonomic re-organization. J Phycol , 2006, 42 (4) : 493-512 | |
| Rao IM, Arulanantham AR, Terry N. Leaf phosphate status, photosynthesis and carbon partilioning in sugar beel: Ⅱ. Diurnal changes in sugar phosphates, adenylates, and nicotinamide nucleotides. Plant Physiol , 1989, 90 (1) : 29-36 DOI:10.1104/pp.90.1.29 |



