石油是一种化学组成极其复杂的混合物,主要组成部分是烃类,约占总组分的95%-99%,人类活动过程是其进入海洋水体的主要途径(Zakaria et al, 2000)。石油进入海洋环境后,在外界环境物理、化学和生物活动等因素的影响下,其化学组成和物理性质以及含量都会随时间的延长而不断改变,但大部分最终以水溶性成分(Water accommodated fraction, WAF)的形式存在于海洋中,其中对海洋生物毒性最大的部分为低分子量烷烃以及芳香烃组分(Mackay et al, 1980)。石油污染物能干扰海-气界面间正常的气体、能量和水分交换(Lee et al, 1997),对各类海洋生物产生毒害(Gilde et al, 2012; Bejarano et al, 2006; Rodrigues et al, 2010)。浮游植物属于海洋生态环境中的初级生产者,可以为食物链上高营养级别的海洋生物提供基础饵料,其生物量的变动会引起食物链高级环节上生物量的变动(Wang et al, 1998)。石油污染物对海洋浮游植物生长的影响是多方面的,目前国内外针对石油污染的水溶性成分对不同种类海洋浮游植物的毒性效应研究已经见诸报道,评价石油污染的指标包括叶绿素含量、细胞粒度(王修林等, 2004)、抑制率EC50值、酶活性、脂质过氧化损伤、DNA损伤等(Parab et al, 2008; Chao et al, 2012; Desai et al, 2010)。但由于各个地区的油品存在差异,特别是原油,不同产地的性质差异明显。因此,针对不同种类石油污染对海洋浮游植物生长影响的差异研究依然需要进一步补充。
本研究以小球藻(Chlorella vulgaris)为研究对象,通过不同暴露浓度下0#柴油、原油WAF小球藻的生长情况,探讨分析两种石油污染物WAF对小球藻生长的影响差异,为进一步研究和评价海洋水环境中石油污染对海洋浮游植物的潜在生态风险评价提供理论基础。
1 材料与方法 1.1 小球藻培养小球藻属于世界范围内的普生性种属,生长条件相对简单,环境耐受性较强,适宜在实验室中开展毒理实验,因此,本研究选择其作为受试藻类。小球藻购自中国海洋大学藻种室,采用f/2培养液(Guillard et al, 1962)在光照培养箱里培养至指数生长期,培养温度为(21±1)℃,光照度为2500 lx,光暗周期12 h:12 h,每天定时摇动两次。海水取自江苏省启东海域(盐度为21,pH为8.1),经0.45 μm醋酯纤维滤膜抽滤、高压蒸汽灭菌,冷却后配制培养液。
1.2 实验母液的制备将0#柴油、原油分别与过滤海水按1:10(V:V)配制,置于磁力搅拌机上,连续高速搅拌24 h后,静置3 h分离出水相,注入玻璃瓶中作为母液储备(贾晓平等, 1998)。使用752N型紫外分光光度计(上海三科仪器有限公司)测定石油烃的含量(国家质量监督检验检疫总局,2008)。0#柴油为市售,原油为东海平湖原油。
1.3 0#柴油、原油WAF组分分析分别取2 L的0#柴油、原油WAF,用60 ml正己烷(色谱级,Thermo Fisher Scientific,USA)分4次萃取,每次用振荡器(KS-2,江苏省金坛市恒丰仪器制造有限公司)振荡2 min后静置分层,共获得约60 ml正己烷萃取液,用氮吹仪(3 L/min)浓缩至1 ml后吸取上层正己烷,上机进样进行GC-MS(5977E,Agilent Technologies,USA)分析。进样方式:自动、不分流;载气:氦气(1 ml/min);进样量:0.l2 μl;进样口温度为290℃;传输线温度为280℃;柱温程序:初始50℃,恒温1 min后以6℃/min的速率升温至280℃,恒温保持10 min;离子源:EI;离子源温度:70 eV,离子化电流:300 Pa;离子源温度:200℃;扫描范围:50-550 amu自动调谐;质谱检索:采用NIST98谱库检索。
1.4 实验设计移取200 ml处于指数增长期(36.23×105个/ml)的藻液转移到250 ml的锥形瓶中并封口。根据预实验的结果,按照等对数比例间距将0#柴油WAF的实验浓度设为0.10、0.30、0.90,2.70、8.10 mg/L;原油WAF浓度分别设为0.58、1.17、2.34,4.68、9.36 mg/L。摇匀后置于光照培养箱中培养,以不加入0#柴油、原油WAF的藻液做作为对照,每个浓度设置3个重复。实验共进行96 h,分别于第0、24、48、96小时取样。取样量为1 ml,先用Lugol碘液固定,再用血球计数板计数,根据计数结果计算藻细胞密度。
1.5 数据分析 1.5.1 96 h-EC50计算采用概率单位-浓度对数法(熊丽等, 2002)计算出96 h-EC50,以生物量为实验终点计算的50%抑制浓度记为EC50。相对增长率(K)按以下公式计算:
| $ K = \frac{{\ln {N_t} - \ln {N_0}}}{T} $ | (1) |
式中,Nt为培养t时刻的藻细胞密度;N0为起始藻细胞密度;T为培养时间(h)。
相对抑制率计算公式如下:
| $ I = \frac{{{K_c} - {K_i}}}{K_c} $ | (2) |
式中,Kc为对照组相对增长率;Ki为处理组相对增长率。
根据抑制率的几率单位和相应的浓度对数,用直线回归法得到浓度效应方程,计算出96 h-EC50。
1.5.2 NOEC、LOEC计算为了确认0#柴油和原油WAF对小球藻生长影响的效应节点,分别计算NOEC和LOEC值。NOEC(No observed effect concentration)是指毒性效应与对照组无显著差异的最大处理浓度,LOEC(Lowest observed effect concentration)是指毒性效应与对照组有显著差异的最小浓度。采用方差分析(One-Way ANOVA)中的Dunnett多重比较检验确定0#柴油和原油WAF对小球藻产生效应的NOEC和LOEC值。
1.6 数据统计与分析采用SPSS 19.0进行数据分析与处理,采用t检验法统计分析实验组与同期对照组间的差异。P < 0.05时为显著差异,同时对剂量反应方程进行χ2检验,以验证其可靠性。
2 结果与分析 2.1 0#柴油和原油WAF的组分分析分别对0#柴油和原油WAF中的芳香烃及其取代物、烷烃的峰面积进行计算,得到其各自所占比例(表 1)。从表 1可以看出,相同处理方式下,0#柴油WAF中芳香烃及其取代物、烷烃比例均高于原油WAF。
|
|
表 1 0#柴油和原油WAF组分比例 Table 1 Proportion of components of WAFs of No.0 fuel oil and the crude oil |
实验过程中,对照组的小球藻均处于指数生长期,细胞密度在实验周期内快速增长,而0#柴油和原油WAF对小球藻的细胞密度变化则产生了不同程度的影响(图 1)。与对照组相比较,在0#柴油WAF影响下,小球藻的细胞密度表现为3种不同的变化趋势(图 1-a)。8.10 mg/L实验组小球藻细胞密度在整个实验过程中表现为持续下降;2.70、0.90 mg/L实验组小球藻细胞密度则分别在第24、48小时达到峰值后持续下降,与8.10 mg/L实验组变化趋势相反;0.30、0.10 mg/L实验组小球藻细胞密度在整个实验过程中表现为持续上升,且96 h时0.10 mg/L实验组小球藻细胞密度显著高于同期对照组(P < 0.05);0.30 mg/L实验组小球藻细胞密度则略高于同期对照组(P>0.05)。与对照组相比较可见,在原油WAF影响下,小球藻的细胞密度也表现为3种不同的变化趋势(图 1b)。9.36 mg/L实验组小球藻细胞密度表现为持续下降;4.68 mg/L实验组小球藻细胞密度在第48小时达到峰值后持续下降。2.34、1.17、0.58 mg/L实验组小球藻细胞密度均表现为持续上升,但2.34 mg/L实验组小球藻细胞密度增长缓慢,且细胞密度在第96小时显著低于同期对照组(P < 0.05)。1.17、0.58 mg/L实验组小球藻细胞密度在整个实验过程中表现为持续上升,且96 h时,0.58 mg/L实验组小球藻细胞密度显著高于同期对照组(P < 0.05),1.17 mg/L实验组小球藻细胞密度则略高于同期对照组(P>0.05)。
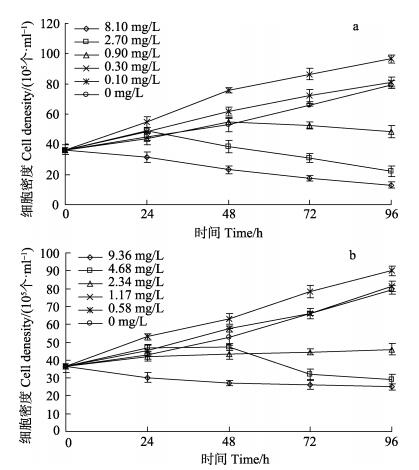
|
图 1 0#柴油(a)和原油(b)WAF作用下小球藻的生长曲线 Figure 1 Growth curves of C. vulgaris treated with WAFs of No.0 fuel oil (a) and crude oil (b) WAF |
根据公式(1)、(2)计算得到0#柴油和原油WAF对小球藻的剂量反应关系及96 h-EC50 (表 2),结果表明,0#柴油WAF对小球藻的96 h-EC50值为3.34 mg/L,NOEC值为0.30 mg/L,LOEC值为0.90 mg/L;原油WAF对小球藻的96 h-EC50值为6.54 mg/L,NOEC值为1.71 mg/L,LOEC值为2.34 mg/L,小球藻对0#柴油WAF胁迫的敏感性高于原油WAF。为了验证计算96 h-EC50的可靠性,对0#柴油、原油WAF的剂量反应方程进行χ2检验,查χ2表得χ0.052=23.685,本研究结果显示,0#柴油、原油WAF的χ2均小于χ0.052(表 2),说明剂量反应方程符合精度要求。
|
|
表 2 0#柴油和原油WAF对小球藻的96 h-EC50值、回归方程及NOECs、LOECs Table 2 EC50values, NOECs, LOECs and regression equations for C.vulgaris treated with WAFs of No.0 fuel oil and the crude oil |
石油烃对海洋浮游植物生长的影响既可以表现为促进作用,也可以表现为抑制作用,促进或者抑制作用与石油烃的浓度有关(Pereira et al, 2012)。本研究中,在石油烃胁迫下小球藻表现出了较为明显的浓度效应相关性,当石油烃暴露浓度较低时,0#柴油(0.30、0.10 mg/L实验组)和原油(1.17、0.58 mg/L实验组)WAF均能促进小球藻的生长。两个实验组小球藻的密度在96 h内持续上升,在96 h时均显著高于同期对照组(P < 0.05)(图 1),这与其他研究中低浓度石油条件对浮游植物的生长具有促进作用的结果一致(Nayar et al, 2005; El-Sheekh et al, 2000)。其原因是有毒物质在较低浓度下出现的增益现象(Stimulatory effects),即“毒物的兴奋效应”(Hormesis)所引起的(Stebbing, 1982)。在“毒物的兴奋效应”作用下,即在低浓度石油烃暴露条件下,小球藻细胞内活性氧自由基(ROS)会有一定程度的升高;而ROS的适当上升能够刺激藻体的细胞生长、密度升高;同时也能增强藻体内某些酶的活性,或者促进藻体细胞中的DNA、RNA和蛋白质的合成量增加(El-Sheekh et al, 2000; Cerutti et al, 1989),从而促进藻体的生长。此外,由于石油烃是由大量的碳氢化合物组成,这些碳氢化合物在藻体自身或者生活水体环境中微生物的降解作用下,可以转化为其生长所需的有机碳源和氮源等营养物质(Nayar et al, 2005; Semple et al, 1999),从而间接促进藻体的生长。但“毒物的兴奋效应”对浮游植物的生长促进作用,具有一定的浓度范围限制。由图 1可以看出,石油烃对小球藻生长的促进作用随着石油烃浓度的增加而减弱,甚至对小球藻的生长产生抑制作用。0#柴油WAF 2.70、0.90 mg/L实验组能够在24 h、48 h之前促进小球藻的生长;原油WAF 4.68 mg/L实验组能够在48 h之前促进小球藻的生长,但这个促进生长的过程维持时间不长。0#柴油WAF 2.70、0.90 mg/L实验组小球藻的生长分别在24 h、48 h后受到抑制,细胞密度由增长变为下降;原油WAF 4.68 mg/L实验组小球藻的生长也在48 h后受到抑制,细胞密度也由增长变为下降。而在高浓度石油烃暴露时,0#柴油8.10 mg/L实验组和原油9.36 mg/L实验组WAF的小球藻生长直接受到抑制,实验一开始小球藻的细胞密度即开始下降(图 1)。这是因为在高浓度石油烃暴露条件下,石油烃对小球藻生长的抑制作用占主导地位,过高浓度的石油烃首先会干扰小球藻的光合作用过程,降低小球藻对CO2的吸收、阻止细胞分裂、降低光合作用和呼吸作用速率(Singh et al, 1990),同时使藻体细胞中的叶绿素a、类脂色素、糖脂、甘油三酸酯等含量降低(Morales-Loo et al, 1990),并且能够干扰抗氧化防御系统的正常运转(Aksmann et al, 2008),从而对藻体产生毒性作用,抑制藻体的生长(Pereira et al, 2012)。同时,表 2的结果显示,0#柴油WAF对小球藻的96 h-EC50值低于原油WAF,即0#柴油WAF对小球藻的毒性效应高于原油WAF。这是因为石油烃的毒性主要来源于芳香烃组分及其衍生物(如苯、萘、菲)以及低分子量烷烃及烷基衍生物,且毒性与其含量呈正比关系(Pulich et al, 1974)。而在本研究所用的两种石油污染物中,0#柴油WAF中芳香烃含量以及烷烃占总成分的比例均高于原油WAF,因而0#柴油WAF的毒性更高,对小球藻的生长抑制效应也比原油WAF更强。
4 结论(1) 0#柴油WAF中芳香烃及其取代物、烷烃比例均高于原油WAF。
(2) 0.30、0.10 mg/L的0#柴油WAF和1.17、0.58 mg/L的原油WAF能够促进小球藻的生长,8.10、2.70、0.90 mg/L的0#柴油WAF、9.36、4.68、2.34 mg/L的原油WAF会抑制小球藻的生长。
(3) 0#柴油WAF对小球藻的96 h-EC50值为3.34 mg/L,NOEC为0.30mg/L,LOEC为0.90mg/L;原油WAF对小球藻的96 h-EC50值为6.54 mg/L,NOEC为1.71 mg/L,LOEC为2.34 mg/L。
| 王修林, 杨茹君, 祝陈坚. 石油烃污染物存在下旋链角毛藻生长的粒度效应初步研究. 中国海洋大学学报(自然科学版) , 2004, 34 (5) : 849-853 | |
| 国家质量监督检验检疫总局. GB 17378-2007海洋监测规范.北京:中国标准出版社, 2008 http://www.oalib.com/references/17864844 | |
| 贾晓平, 林钦. 南海原油和燃料油对仔虾和仔鱼的急性毒性试验. 热带海洋 , 1998, 17 (1) : 93-98 | |
| 熊丽, 吴振斌, 况琪军, 等. 氯氰菊酯对斜生栅藻的毒性研究. 水生生物学报 , 2002, 26 (1) : 66-73 | |
| Aksmann A, Tukaj Z. Intact anthracene inhibits photosynthesis in algal cells: a fluorescence induction study on Chlamydomonas reinhardtii cw92 strain. Chemosphere , 2008, 74 (1) : 26-32 DOI:10.1016/j.chemosphere.2008.09.064 | |
| Bejarano AC, Chandler GT, He L, et al. Individual to population level effects of South Louisiana crude oil water accommodated hydrocarbon fraction (WAF) on a marine meiobenthic copepod. J Exp Mar Biol Eco , 2006, 332 (1) : 49-59 DOI:10.1016/j.jembe.2005.11.006 | |
| Cerutti P. Larsson R, Krupitza G, et al. Pathophysiological mechanismsa of active oxygen. Mutat Res , 1989, 214 (1) : 81-88 DOI:10.1016/0027-5107(89)90200-5 | |
| Chao M, Shen X, Lun F, et al. Toxicity of fuel oil water accommodated fractions on two marine microalgae, Skeletonema costatum and Chlorela spp. Bull Environ Contam Toxicol , 2012, 88 (5) : 712-716 DOI:10.1007/s00128-012-0525-y | |
| Desai SR, Verlecar XN, Ansari ZA, et al. Evaluation of genotoxic responses of Chaetoceros tenuissimus and Skeletonema costatum to water accommodated fraction of petroleum hydrocarbons as biomarker of exposure. Water Res , 2010, 44 (7) : 2235-2244 DOI:10.1016/j.watres.2009.12.048 | |
| EI-Sheekh MM, El Naggar AH, Osman MEH, et al. Comparative studies on the green algae Chlorella homosphaera and Chlorella vulgaris with respect to oil pollution in the river Nile. Water Air Soil Poll , 2000, 124 (1-2) : 187-204 | |
| Gilde K, Pinckney JL. Sublethal effects of crude oil on the community structure of estuarine phytoplankton. Estuar Coast , 2012, 35 (3) : 853-861 DOI:10.1007/s12237-011-9473-8 | |
| Guillard RR, Ryther JH. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt, and Detonula confervacea (Cleve) Gran. Can J Microbiol , 1962, 8 : 229-39 DOI:10.1139/m62-029 | |
| Lee RF, Page DS. Petroleum hydrocarbons and their effects in subtidal regions after major oil spills. Mar Pollut Bull , 1997, 34 (11) : 928-940 DOI:10.1016/S0025-326X(97)00078-7 | |
| Mackay D, Buistt IA, Mascarenhas R, et al. Oil spill processes and models. Ottawa: Environment Canada , 1980 | |
| Morales-Loo MR, Goutx M. Effects of water-soluble fraction of the Mexican crude oil "Isthmus Cactus" on growth, cellular content of chlorophylla, and lipid composition of planktonic microalgae. Mar Biol , 1990, 104 (3) : 503-509 DOI:10.1007/BF01314357 | |
| Nayar S, Goh BP, Chou LM. Environmental impacts of diesel fuel on bacteria and phytoplankton in a tropical estuary assessed using in situ mesocosms. Ecotoxicology , 2005, 14 (3) : 397-412 DOI:10.1007/s10646-004-6373-8 | |
| Parab SR, Pandit RA, Kadam AN. Effect of Bombay high crude oil and its water-soluble fraction on growth and metabolism of diatom Thalassiosira sp. Indian J Mar Sci , 2008, 37 (3) : 251-255 | |
| Pereira SA, Araújo VQ, Reboucas MV, et al. Toxicity of biodiesel, diesel and biodiesel/diesel blends: comparative sub-lethal effects of water-soluble fractions to microalgae species. Bull Environ Contam Toxicol , 2012, 88 (2) : 234-238 DOI:10.1007/s00128-011-0430-9 | |
| Pulich Jr WM, Winters K, Van Baalen C. The effects of a No. 2 fuel oil and two crude oils on the growth and photosynthesis of microalgae. Mar Biol , 1974, 28 (2) : 87-94 DOI:10.1007/BF00396299 | |
| Rodrigues RV, Miranda-Filho KC, Gusmão EP, et al. Deleterious effects of water-soluble fraction of petroleum, diesel and gasoline on marine pejerrey Odontesthes argentinensis larvae. Sci Total Environ , 2010, 408 (9) : 2054-2059 DOI:10.1016/j.scitotenv.2010.01.063 | |
| Semple KT, Cain RB, Schmidt S. Biodegradation of aromatic compounds by microalgae. Fems Microbiol Lett , 1999, 170 (2) : 291-300 DOI:10.1111/fml.1999.170.issue-2 | |
| Singh AK, Gaur JP. Effects of petroleum oils and their paraffinic, asphaltic, and aromatic fractions on photosynthesis and respiration of microalgae. Ecotoxicol Environ Saf , 1990, 19 (1) : 8-16 DOI:10.1016/0147-6513(90)90073-E | |
| Stebbing AR. Hormesis-the stimulation of growth by low levels of inhibitors. Sci Total Environ , 1982, 22 (3) : 213-234 DOI:10.1016/0048-9697(82)90066-3 | |
| Wang JS, Chou HN, Fan JJ, et al. Uptake and transfer of high PCB concentrations from phytoplankton to aquatic biota. Chemosphere , 1998, 36 (6) : 1201-1210 DOI:10.1016/S0045-6535(97)83101-3 | |
| Zakaria MP, Horinouchi AI, Tsutsumi S, et al. Oil pollution in the Straits of Malacca, Malaysia: Application of molecular markers for source identification. Environ Sci Technol , 2000, 34 (7) : 1189-1196 DOI:10.1021/es990950o |



