2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Laboratory for Marine Fisheries and Aquaculture, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266235
三疣梭子蟹(Portunus trituberculatus)是我国重要的海洋经济蟹类之一,主要分布于中国、朝鲜、日本等海域(李健等, 2013; 于金红等, 2013),也是我国重要的海洋捕捞和水产养殖对象(王冲等, 2010)。但随着三疣梭子蟹养殖规模的不断增大,种质退化和疾病问题愈发突出(王国良等, 2006; 荣晔婧等, 2014),由中国水产科学研究院黄海水产研究所采取群体选育与家系选育方法选育出的三疣梭子蟹“黄选1号”具有成活率高、生长速度快等特点(李健等, 2013),已推广至山东、河北以及浙江等地,取得较显著的经济和社会效益。
水生甲壳动物生存环境中的盐度经常发生变化,无论是广盐性还是狭盐性的水生甲壳动物,随着生存水环境盐度的改变,在神经内分泌系统的调控下,渗透调节器官的结构、血淋巴渗透压和离子转运等都会发生一系列变化以适应外界环境中盐度的变化,维持机体正常的生理代谢活动(潘鲁青等, 2005)。而水生甲壳动物具有适应盐度等水生环境因子的能力,主要是通过血淋巴渗透压调控来实现。水生甲壳动物血淋巴渗透压的调节主要依赖于血淋巴中水分和渗透压效应物含量的变化以及对无机离子通透性的变化,血淋巴中渗透压效应物主要包括无机离子和自由氨基酸,这两种效应物对甲壳动物渗透压水平起决定作用(Chen et al, 1997; Lima et al, 1997; Spaargaren, 1971; DallaVia, 1989),其中,无机离子起最主要的作用。此外,血淋巴组成(如蛋白质、糖类、脂类和氨等)物质代谢水平对渗透压也会产生影响(王悦如等, 2011)。
目前,关于盐度对甲壳动物血淋巴渗透压影响的研究已有开展,包括罗氏沼虾(Macrobrachium rosenbergii) (Wilder et al, 1998)、中华绒螯蟹(Eriocheir sinensis) (贾小燕等, 2012)和天津厚蟹(Helice tientsinensis) (徐敬明, 2013)等。但是,关于三疣梭子蟹血淋巴渗透压及离子含量的研究目前未见文献报道。本研究系统分析了不同盐度急性胁迫对三疣梭子蟹“黄选1号”血清渗透压及离子含量的影响,旨在为三疣梭子蟹“黄选1号”的养殖推广提供一定的理论资料,也为三疣梭子蟹的渗透压调节机理以及海洋甲壳类动物的盐度适应性研究提供一定的理论参考。
1 材料与方法 1.1 实验材料实验所用80日龄的三疣梭子蟹,体重为(30.00±2.25) g,为中国水产科学研究院黄海水产研究所选育出的三疣梭子蟹“黄选1号”品种,实验于2014年8月9日在山东省昌邑市海丰水产养殖有限责任公司进行,实验前,于养殖车间自然海水盐度下(盐度为30)暂养7 d,暂养期间连续充气,每天定时投喂蓝蛤,换水清污,整个暂养期间淘汰活力不强的个体。
1.2 实验方法 1.2.1 急性盐度胁迫实验设计实验设置4个实验组(盐度分别为5、10、20和50)和1个对照组(自然海水,盐度为30),每个盐度组均设3个平行。盐度50的实验水体由自然海水加深层地下卤水混匀配制,低盐实验水体由自然海水与自来水混匀配制,实验前水体均充分曝气。实验于400 cm×400 cm×150 cm的水泥池、水深40 cm的水体中进行,水体温度为22-25℃。每个实验盐度组99只三疣梭子蟹,设3个平行,实验期间的投喂和饲养管理与暂养期相同。
1.2.2 实验样品及环境介质取样与保存对照组取0、3、6、9、12、24、48、72 h样品,各盐度实验组分别在实验第3、6、9、12、24、48、72 h时取样。取样时,从每个平行组中随机取1只三疣梭子蟹,抽取心脏处血淋巴1 ml于1.5 ml离心管内,室温下放置1 h (不加抗凝剂),4℃冰箱过夜处理后,离心10 min (4℃,12000 r/min),用移液器吸取血清于新的1.5 ml离心管中,标记编号后置于液氮中保存,待测。
取盐度胁迫实验用海水1 ml于1.5 ml离心管中,每个盐度组取3个平行样品,标记编号后置于液氮保存,待测。
1.2.3 实验样品及介质渗透压和离子含量测定使用Fiske Micro-Osmometer Model 210冰点渗透压计测定血清及环境介质渗透压,按照仪器说明书要求进行操作。血清及介质Na+、K+、Cl−的含量均采用江苏省南京建成生物工程研究所生产的试剂盒测定,操作按试剂盒说明书进行。
1.2.4 统计分析实验数据均以平均值±标准差表示,采用SPSS 19.0软件进行单因素方差分析和Duncan检验,用单因素方差分析(ANOVA)及Duncan检验对不同盐度组的测定指标进行差异比较,数据统计的显著性水平定为P<0.05。
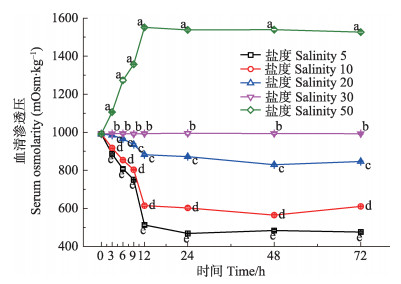
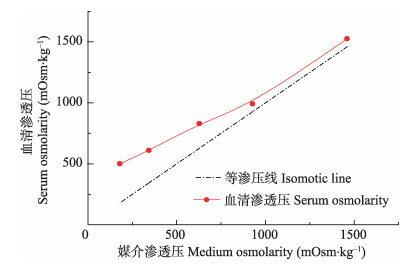
2 结果 2.1 急性盐度胁迫下三疣梭子蟹“黄选1号”血清渗透压的变化不同盐度下,三疣梭子蟹血清渗透压发生明显变化(图 1)。在0-12 h胁迫过程中,盐度为5、10、20实验组的血清渗透压均随时间的延长而下降,其中,盐度为5、10实验组血清渗透压在9-12 h分别由(750±4) mOsm/kg和(800±5) mOsm/kg急剧下降到(512±3) mOsm/kg和(614±4) mOsm/kg,盐度20实验组血清渗透压变化较慢,盐度50实验组血清渗透压在0-12 h随时间明显升高;各实验组血清渗透压在12-72 h胁迫中均维持基本稳定,并与对照组血清渗透压有显著差异(P < 0.05)。结果显示(图 2),随着媒介渗透压的升高,三疣梭子蟹血清渗透压也随之升高并始终高于环境介质的渗透压。当环境介质渗透压在100-990 mOsm/kg范围内时,血清渗透压与环境介质渗透压的差值从(310±10) mOsm/kg减小到(65±5) mOsm/kg;环境介质渗透压在990-1500 mOsm/kg范围内时,差值基本维持在(65±5) mOsm/kg下,在实验盐度5-50内未出现血清渗透压与环境介质渗透压相等,即等渗现象。
|
图 1 急性盐度胁迫对血清渗透压的影响 Figure 1 Effects of acute salinity stress on serum osmolarity 不同字母表示同一时间不同盐度的血清渗透压差异显著(P<0.05) Different letters show significant difference in different salinity at same time (P < 0.05) |
|
图 2 不同盐度水平下血清渗透压与媒介渗透压之间的关系 Figure 2 Relationship between serum osmolarity and medium osmolarity in different salinity 血清渗透压取自48 h数据 Serum osmolarity data at 48 h were used in Fig.2 |
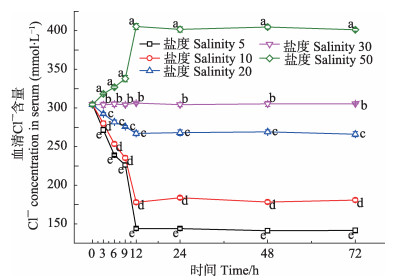
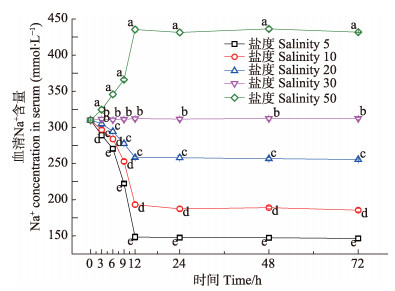
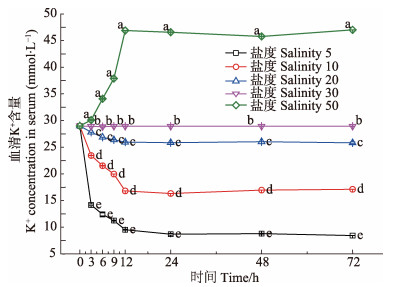
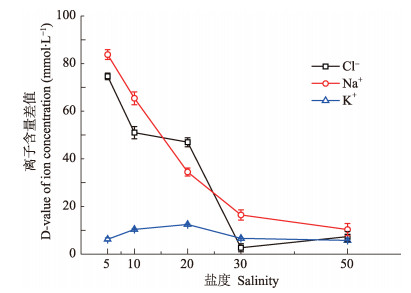
三疣梭子蟹血清中Cl−、Na+、K+含量在急性盐度胁迫下呈现相似的变化规律,各盐度实验组中血清Cl−、Na+、K+含量均在0-12 h内发生明显变化,盐度5、10、20实验组的血清Cl−、Na+、K+含量在0-12 h内呈下降趋势,盐度50实验组的血清Cl−、Na+、K+含量在0-12 h内呈上升趋势。其中,盐度5实验组K+含量在0-3 h快速下降,下降幅度达14.8 mmol/L,3-12 h缓慢下降;盐度5、10实验组的Cl−、Na+含量在9-12 h快速下降。各盐度实验组的血清Cl−、Na+、K+含量在12-72 h均维持基本稳定,血清Cl−、Na+在各盐度组中含量较多且水平相当,K+含量较少(图 3-图 5)。随着盐度的升高,血清内各离子含量与媒介海水离子含量之间的差值均发生变化,其中,Cl−、Na+含量的差值,在5-30盐度范围内随着盐度的升高而降低,在30-50盐度范围内比较稳定,而K+含量的差值则在5-30盐度范围内先升高后降低,在30-50盐度范围内趋于稳定(图 6)。
|
图 3 急性盐度胁迫对血清Cl−含量的影响 Figure 3 Effects of acute salinity stress on the Cl−concentration in serum 不同字母表示同一时间不同盐度的血清离子含量差异显著(P<0.05) Different letters show significant difference in different salinity at same time (P < 0.05) |
|
图 4 急性盐度胁迫对血清Na+含量的影响 Figure 4 Effects of acute salinity stress on the Na+ concentration in serum 不同字母表示同一时间不同盐度的血清离子含量差异显著(P<0.05) Different letters show significant difference in different salinity at same time (P < 0.05) |
|
图 5 急性盐度胁迫对血清K+含量的影响 Figure 5 Effects of acute salinity stress on the K+concentration in serum 不同字母表示同一时间不同盐度的血清离子含量差异显著(P<0.05) Different letters show significant difference in different salinity at same time (P < 0.05) |
|
图 6 不同盐度下血清与媒介离子浓度差值的变化 Figure 6 Variation of ion concentration D-value between serum and medium at different salinity 血清离子含量取自48 h数据 Serum ion concentration data at 48 h were used in Fig.6 |
甲壳动物对盐度变化的适应,主要是靠调控血淋巴渗透压和离子含量来维持机体正常的生命活动实现的,大多数甲壳动物血淋巴的主要阳离子和阴离子的含量相近,研究发现,Cl−、Na+是形成血淋巴渗透压的两种主要离子,所占比例高达76%-90% (Henry et al, 2002、Henry et al, 2003; Chen et al, 1997)。本研究结果表明,在不同盐度胁迫下,三疣梭子蟹的血清渗透压和Cl−、Na+、K+含量变化趋势相似,说明Cl−、Na+、K+均与血清渗透压调节相关。三疣梭子蟹的渗透压调节起主要作用的离子是Cl−和Na+,而K+对血清渗透压的影响较弱。
Péqueux(1995)研究发现,甲壳动物对外界渗透压的适应分为渗透压调节型和渗透压随变型,前者具有很强的自身渗透压调节能力,当外界渗透压发生变化时,能主动调节并维持体内渗透压在一定水平内变动,以保证正常生命活动(吕富, 2002)1),属于广盐性甲壳动物;后者缺乏自身调节能力,体内渗透压随外界渗透压的变化而变化,与外界环境呈现等渗状态,为狭盐性甲壳动物。而渗透压调节型又分为高渗调节型和低渗调节型,高渗调节型能维持体内渗透压高于外界渗透压,而低渗调节型能维持体内渗透压低于外界渗透压,当外界渗透压变化时,渗透压调节型也会发生变化并呈现一定的规律。本研究表明,三疣梭子蟹“黄选1号”能在5-50盐度下生存,渗透压的变化均在12 h内完成,12 h后渗透压稳定并维持在一定水平,说明三疣梭子蟹“黄选1号”具有很强的盐度适应性,这与隋延鸣等(2012)的研究一致。随着外界盐度的升高,血清渗透压与外界渗透压差值越来越小,但始终高于外界渗透压,未出现等渗现象,说明三疣梭子蟹属于渗透压调节型中的高渗调节型。本研究表明,在高盐度范围内,三疣梭子蟹的血清渗透压与外界环境渗透压的差值明显低于低盐度范围内的差值,且差值稳定在(65±5) mOsm/kg左右,推测三疣梭子蟹的渗透压调节耗能在30-50的高盐度范围要比5-10的低盐度范围低。此外,潘鲁青等(2005)认为,血淋巴中的非离子成分,如渗透压调节效应物之一的游离氨基酸、糖类、脂类等也对甲壳动物的渗透压调节起作用。三疣梭子蟹的这些方面都有待于进一步的研究。
| 于金红, 潘鲁青. 三疣梭子蟹C-型凝集素的原核表达和活性检测. 渔业科学进展 , 2013, 34 (5) : 58-63 | |
| 王冲, 姜令绪, 王仁杰, 等. 盐度骤变和渐变对三疣梭子蟹幼蟹发育和摄食的影响. 水产科学 , 2010, 29 (9) : 510-514 | |
| 王国良, 金珊, 李政, 等. 三疣梭子蟹(Portunus trituberculatus)乳化病的组织病理和超微病理研究. 海洋与湖沼 , 2006, 37 (4) : 297-303 | |
| 王悦如, 李二超, 龙丽娜, 等. 中华绒螯蟹对盐度变化的适应及其渗透压调节的研究进展. 海洋渔业 , 2011, 33 (3) : 352-360 | |
| 李健, 刘萍, 高保全. 三疣梭子蟹新品种"黄选1号"的选育. 渔业科学进展 , 2013, 34 (5) : 51-57 | |
| 荣晔婧, 陈强, 史雨红, 等. 基于DArT标记的三疣梭子蟹地理种群遗传多样性分析. 生物学杂志 , 2014, 31 (2) : 19-21 | |
| 贾小燕, 庄平, 冯广朋, 等. 中华绒螯蟹雌性亲蟹血淋巴生化指标与盐度的关系. 水产学报 , 2012, 36 (1) : 91-96 | |
| 徐敬明. 天津厚蟹渗透压调节对盐度的响应. 水产科学 , 2013, 32 (10) : 613-615 | |
| 隋延鸣, 高保全, 刘萍, 等. 三疣梭子蟹"黄选1号"盐度耐受性分析. 渔业科学进展 , 2012, 33 (2) : 63-68 | |
| 潘鲁青, 刘泓宇. 甲壳动物渗透压调节生理学研究进展. 水产学报 , 2005, 29 (1) : 109-114 | |
| Chen JC, Chia PG. Osmotic and ionic concentrations of Scylla serata (Forskal) subjected to different salinity levels. Comp Biochem Physiol A Comp Physiol , 1997, 117 (2) : 239-244 DOI:10.1016/S0300-9629(96)00237-X | |
| Dalla Via GJ. The effect of salinity on free amino acids in the prawn Palaemon elegans (Rathke). Arch Hydrobiol , 1989, 115 (1) : 125-135 | |
| Henry RP, Garrelts EE, McCarty MM. Differential induction of branchial carbonic anhydrase and Na+/K+-ATPase activity in the euryhaline crab, Carcinus maenas, in response to low salinity exposure. J Exp Zool , 2002, 292 (7) : 595-603 DOI:10.1002/(ISSN)1097-010X | |
| Henry RP, Gehnrich S, Weihrauch D, et al. Salinity-mediated carbonic anhydrase induction in the gills of the euryhaline green crab, Carcinus maenas. Comp Biochem Physiol A Comp Physiol , 2003, 136 (2) : 243-258 DOI:10.1016/S1095-6433(03)00113-2 | |
| Lima AG, McNamara JC, Terra WR. Regulation of hemolymph osmolytes and gill Na+/K+-ATPase activities during accli mation to saline in the freshwater shrimp Macrobrachium olfersii (Wiegmann, 1836) (Decapoda, Palaemonidae). J Exp Mar Biol Ecol , 1997, 215 (1) : 81-91 DOI:10.1016/S0022-0981(97)00016-6 | |
| Péqueux A. Osmotic regulation in crustaceans. J Crust Biol , 1995, 15 (1) : 1-60 DOI:10.1163/193724095X00578 | |
| Spaargaren DH. Aspects of osmotic regulation in the shrimp Crangon crangon and Crangon allmnni. Neth J Sea Res , 1971, 5 (3) : 275-333 DOI:10.1016/0077-7579(71)90015-9 | |
| Wilder MN, Ikuta K, Atmomarsono M, et al. Changes in osmotic and ionic concentrations in the hemolymph of Macrobrachium rosenbergii exposed to varying salinities and correlation to ionic and crystalline composition of the cuticle. Comp Biochem Physiol A Comp Physiol , 1998, 119 (4) : 941-950 DOI:10.1016/S1095-6433(98)00008-7 |



