2. 潍坊市产品质量检验所 潍坊 261061
2. Weifang Product Quality Inspection Institute, Weifang 261061
牡蛎是海洋养殖年产量最大的类群,2012年我国牡蛎产量达394余万t (农业部渔业局, 2013),是我国重要的养殖经济贝类。牡蛎大多生活在近海海域或河流入海口,其生长环境因人类活动的影响而受到不同程度的污染,牡蛎在滤食海水中饵料的同时,也将水体中的食源性病毒-诺如病毒(Norovirus, NoV)特异性地富集于体内,污染牡蛎常引起食品安全事件(Langlet et al, 2015; Moore et al, 2015)。牡蛎特异性富集NoV的分子机理近几年成为国际上的研究热点,目前已确定其消化组织内存在一种类似于人A型组织血型抗原(A Like Histo-Blood Group Antigens,A Like HBGAs)的物质,其作为受体介导了牡蛎特异性富集NoV的生物学过程(LeGuyader et al, 2006; Tian et al, 2006),这个发现是该领域的重要理论突破,揭示了牡蛎特异性富集NoV的分子机理。
在人A型HBGAs的合成过程中,FUT2(Fucosyl transferase 2, α-1, 2-岩藻糖基转移酶,即Se酶)将岩藻糖基转移到I型链(β-1, 3糖苷键连接的前体物质)半乳糖残基末端形成H抗原,随后A酶(α-1, 3-N-乙酰半乳糖胺基转移酶)将GalNAc转移到H抗原Gal残基末端,形成A型抗原(Shirato et al, 2012),因此Se酶是人类A型HBGA合成的关键酶。本研究在前期首次成功克隆太平洋牡蛎(Crassostrea gigas)类FUT2基因cDNA全长的基础上,根据大肠杆菌密码子偏爱性对基因进行了优化,构建了类FUT2基因原核表达重组质粒,并在大肠杆菌中进行表达与鉴定,为进一步研究牡蛎类FUT2基因功能奠定基础。
1 材料与方法 1.1 质粒与菌株含有太平洋牡蛎类FUT2基因完整编码框的质粒pMD-OF2由姜薇等(2014)构建(GenBank登录号:KJ184342);原核表达载体pRSET-A为Invitrogen公司产品;大肠杆菌Top10和BL21(DE3)感受态细胞为天根生化科技(北京)有限公司产品。
1.2 工具酶与主要试剂限制性内切酶、T4 DNA连接酶、Taq酶、预染及非预染蛋白质分子量Marker购自Fermentas公司,DNA快速回收试剂盒、抗6×His标签单克隆抗体、HRP标记的羊抗鼠IgG、HRP-DAB底物显色试剂盒购自天根生化科技(北京)有限公司,抗人FUT2单克隆抗体购自Abcam公司,His Gravei Trap Ni亲和层析柱购自美国GE公司,超滤离心管(10 kDa)购自美国Millipore公司,IPTG、氨苄青霉素钠等试剂购自北京索莱宝科技有限公司,其他试剂均为分析纯。
1.3 太平洋牡蛎类FUT2基因稀有密码子分析及基因合成利用Codon Usage Database (http://www.kazusa. or.jp/coden)对太平洋牡蛎类FUT2基因进行稀有密码子分析。按照大肠杆菌密码子偏爱性对类FUT2基因进行优化,由上海生工生物工程有限公司进行全基因合成并克隆到pMD-18T载体上,命名为pMD-mof。
1.4 引物设计与PCR扩增根据太平洋牡蛎类FUT2基因的序列信息,设计扩增完整开放阅读框的引物FofPm/RofH,上下游引物两端分别设计Pst Ⅰ和Hind Ⅲ的酶切位点,引物序列:FofPm 5 -TTTCTGCAGATGGTGAAACGTA-TGTTTTCATCTGG-3;RofH 5-TTTAAGCTTCATT-GGGATCCATTGAGGAAAATAATAATC-3;。类FUT2的扩增以质粒pMD-mof为模板,反应条件为:95℃预变性5 min;94℃ 1 min,52℃ 40 s,72℃ 2.5 min,30个循环后72℃延伸7 min。通过1.0%(W/V)的琼脂糖凝胶电泳鉴定PCR产物。
1.5 原核表达重组质粒的构建与鉴定将上述PCR扩增产物经DNA凝胶回收试剂盒纯化后,用Pst I和Hind Ⅲ双酶切,再次回收纯化,插入同样用Pst I和Hind Ⅲ双酶切的pRSET-A载体中,将连接产物转化Top10感受态细胞,挑取单菌落小量提取质粒并通过酶切及PCR鉴定,将阳性克隆送至上海生工生物公司进行测序。
1.6 原核表达将构建成功的重组质粒转化大肠杆菌感受态细胞BL21,挑取阳性重组细菌接种到LB培养液(含50 μg/ml氨苄青霉素),37℃振荡过夜培养,取菌液,按1:100的比例再次接种至新鲜LB培养液中,37℃振荡培养至OD600 nm值约0.4−0.6时,加入终浓度为0.4、0.6、0.8、1.0 mmol/L的IPTG,37℃诱导表达。在加入IPTG后,分别于2、3、4、5、6 h各收集菌液1.5 ml,经12000 r/min离心5 min,弃上清液,用80 μl pH=7.4的PBS重悬菌体沉淀物,加入20 μl的5×Loading Buffer,水浴煮沸10 min后立即置于冰上,通过SDS-PAGE电泳分离,考马斯亮蓝R-250染色检测表达情况,同时设置转入pRSET-A空载体的BL21与BL21作为对照。
1.7 重组蛋白纯化使用His标签镍离子亲和层析柱进行蛋白质纯化。先用10 ml结合缓冲液(20 mmol/L Na3PO4,500 mmol/L NaCl,20 mmol/L咪唑,pH=7.4)平衡层析柱,加入经超声波破碎的含目的蛋白的菌体裂解液10 ml,用10 ml结合缓冲液洗涤,最后加3 ml洗脱缓冲液(20 mmol/L Na3PO4,500 mmol/L NaCl,500 mmol/L咪唑,pH=7.4)洗脱,收集洗脱液。取4 ml上述洗脱液,加入Amicon Ultra的过滤装置内管中并套入外管,14000 r/min离心20 min后,将内管倒置套在另一洁净离心管内,3500 r/min离心10 min,得到的样品即为纯化后的目的蛋白,用SDS-PAGE检测纯化效果。
1.8 表达产物的Western blot分析收集重组细菌,进行SDS-PAGE电泳,将PAGE胶上的蛋白电转印至硝酸纤维素膜后,用含10%脱脂奶粉的TBST封闭过夜,TBST洗涤3次,与抗6×His标签单克隆抗体(用TBST 1:2000倍稀释)或抗人FUT2单克隆抗体(用TBST 1:1000倍稀释)作用1 h,TBST洗涤3次,与辣根过氧化物酶标记的羊抗鼠IgG (用TBST 1:1000倍稀释)作用40 min后,TBST洗涤5次,用HRP-DAB底物显色试剂盒显色观察。
2 结果 2.1 类FUT2基因的稀有密码子分析及优化太平洋牡蛎野生型类FUT2基因中的稀有密码子分析结果显示,类FUT2基因中含有6种稀有密码子,共31个,比例为11.6%,比例较高(表 1),其中,包含11个精氨酸密码子、9个甘氨酸密码子、4个亮氨酸密码子、4个脯氨酸密码子、2个异亮氨酸密码子和1个苏氨酸密码子,并且存在1个二联体稀有密码子(亮氨酸-精氨酸)和1个三联体稀有密码子(精氨酸-精氨酸-甘氨酸)。针对上述稀有密码子,按照大肠杆菌密码子偏爱性重新优化合成了类FUT2基因,用大肠杆菌中使用频率高的CGU来表达精氨酸,用GGU表达甘氨酸,用AUU表达异亮氨酸,用CUG表达亮氨酸,用CCG表达脯氨酸,用ACC表达苏氨酸,将突变型FUT2基因命名为mof。测序结果表明,优化的基因不存在大肠杆菌稀有密码子,并且未改变氨基酸序列。
|
|
表 1 太平洋牡蛎野生型类FUT2基因稀有密码子分析 Table 1 The analysis of rare codons of FUT2 like gene in wild-type C. gigas |
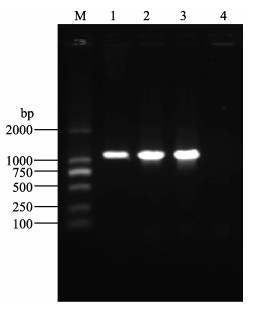
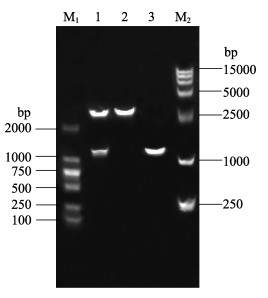
以质粒pMD-mof为模板,使用引物FofPm/RofH对目的片段进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳,可见大小约为1.1 kb的特异性条带,与目的基因的大小一致(图 1)。将纯化后的PCR产物经PstI和HindⅢ双酶切后,插入同样用PstI和HindⅢ双酶切的pRSET-A载体中,转化大肠杆菌感受态细胞Top10后,小量提取质粒,酶切鉴定可见大小约为2.9 kb的载体条带与1.1 kb左右的插入片段,证实构建正确(图 2),测序结果表明PCR过程中没有误配,将该原核表达重组载体命名为pRSET-mof。
|
图 1 优化后的类FUT2基因PCR扩增产物电泳
Figure 1 Agarose gel analysis of codon-optimized FUT2-like gene PCR amplification product
M. DNA分子量DL2000; 1−3.类FUT2扩增产物; 4.阴性对照 M. DNA marker DL2000; Lane 1−3. FUT2-like gene PCR product; Lane 4. Negative control |
|
图 2 重组质粒pRSET-mof的双酶切鉴定与PCR鉴定
Figure 2 Digestion and PCR identification of the recombinant plasmid pRSET-mof
M1. DNA分子量DL2000; M2. DNA分子量DL15000; 1. Pst I和Hind Ⅲ双酶切pRSET-mof; 2. Pst I和Hind Ⅲ双酶切pRSET A; 3. pRSET-mof的PCR扩增 M1. DNA marker DL2000; M2. DNA marker DL15000; Lane 1. pRSET-mof digested with Pst I and Hind Ⅲ; Lane 2. pRSET-A digested with Pst I and Hind Ⅲ; Lane 3. PCR identification of pRSET-mof |
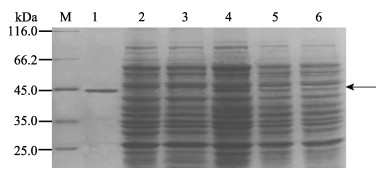
重组质粒pRSET-mof转化大肠杆菌感受态细胞BL21后,分别加入终浓度为0.4、0.6、0.8、1.0 mmol/L的IPTG以确定最佳诱导浓度;分别在诱导2、3、4、5、6 h后收集菌液,经超声波破碎,分离上清液和沉淀,进行SDS-PAGE分析。结果显示,在IPTG终浓度为1.0 mmol/L、诱导4 h的样本中,出现大小约为46 kDa的蛋白条带,大小与预计结果相符合,两个对照组均未见目的条带。重组蛋白经His Gravei Trap Ni亲和层析柱纯化,SDS-PAGE结果显示,纯化产物仅有1条大小约为46 kDa的特异性条带,未见其他大小的杂质蛋白条带(图 3),表明获得较高纯度的重组类FUT2蛋白。
|
图 3 重组FUT2蛋白在大肠杆菌中的诱导表达和亲和层析柱纯化
Figure 3 Expression and Ni2+ affinity column purification of the recombinant FUT2 protein
M.蛋白质分子量; 1.纯化后的重组FUT2蛋白; 2. pRSET A空载菌体蛋白; 3.大肠杆菌BL21(DE3)菌体蛋白; 4−6.诱导后的重组FUT2蛋白, 箭头指向目的蛋白 M. Protein relative molecular mass marker; Lane 1. Purified recombinant FUT2; Lane 2. Negative control of BL21(DE3) transformed by pRSET A; Lane 3. Negative control of BL21(DE3); Lane 4−6. Recombinant FUT2 protein induced by IPTG, arrow indicates the target protein |
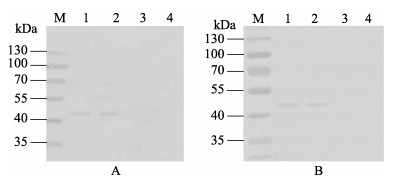
重组细菌经SDS-PAGE电泳后,通过电转印将蛋白转移到硝酸纤维素膜上,分别用抗6×His标签单抗、抗人FUT2单抗作为一抗,进行Western blot分析。结果显示,在约46 kDa处有明显的蛋白条带(图 4),两个对照组均未见条带,表明重组蛋白不仅能被抗6×His标签单抗识别,也能与人FUT2单抗发生特异性反应,说明太平洋牡蛎类FUT2重组蛋白成功获得表达。
|
图 4 重组FUT2蛋白的Western blot分析
Figure 4 Western blot analysis of the recombinant FUT2 protein
A:以抗6×His-Tag单克隆抗体为一抗的Western blot结果. M.蛋白质分子量; 1−2.重组FUT2蛋白; 3. pRSET A空载菌体对照; 4.大肠杆菌BL21(DE3)对照 B:以抗人FUT2单克隆抗体为一抗的Western blot结果. M.蛋白质分子量; 1−2.重组FUT2蛋白; 3. pRSET A空载菌体对照; 4.大肠杆菌BL21(DE3)对照 A: Western blot results using monoclonal antibody of 6×His-Tag as the first antibody. M. Protein relative molecular mass marker; Lane 1−2. Recombinant FUT2 protein; Lane 3. Negative control of BL21(DE3) transformed by pRSET A; Lane 4. Negative control of BL21(DE3) B: Western blot results using monoclonal antibody of human FUT2 as the first antibody. M. Protein relative molecular mass marker; Lane 1−2. Recombinant FUT2 protein; Lane 3. Negative control of BL21(DE3) transformed by pRSET A; Lane 4. Negative control of BL21(DE3) |
NoV是导致人类急性非细菌性腹泻的最主要病原(Atmar et al, 2006),已有多项研究表明,NoV可识别人HBGAs,即NoV将HBGAs作为连接的配体或受体感染人体(Hennessy et al, 2003; Rockx et al, 2005; Shirato, 2012),而FUT2是人HBGAs合成的关键酶之一。生活在受污染水域的牡蛎,作为NoV传播的重要载体,具有特异性富集NoV的特性。现已证实牡蛎中存在类A型HBGA(LeGuyader et al, 2006; Tian et al, 2006),牡蛎是否也存在与人相似的HBGAs合成途径,是否也利用类似FUT2的酶合成自身类A型HBGAs,这些问题的研究不仅有利于深入揭示牡蛎特异性富集诺如病毒的分子机理,也有助于进一步解读牡蛎基因组信息。
本研究在前期获得太平洋牡蛎类FUT2基因cDNA全长的基础上,开展原核表达研究,最初使用野生型类FUT2基因进行原核表达,但利用多种原核表达载体及菌株,经过培养温度、IPTG浓度、诱导时间等多种条件的优化后,仍未见目的条带出现,推测可能是野生型类FUT2基因中含有限制大肠杆菌表达的稀有密码子,即大肠杆菌中tRNA的数量制约了某些外源基因的表达;当外源基因的mRNA在大肠杆菌中翻译时,由于1种或多种tRNA的稀有或缺少,导致了翻译延迟、成熟前翻译终止、翻译移码和氨基酸错配;特别是基因中含有成串或多个大肠杆菌稀有密码子,外源蛋白的表达量将非常低甚至不表达(Lavner et al, 2005)。经分析,牡蛎类FUT2基因cDNA序列中含有高达11.6%的稀有密码子,并且有两个连续稀有密码子串联的现象,这些稀有密码子及串联稀有密码子的存在,可能是导致目的基因在大肠杆菌中不表达的最主要原因。随后,利用密码子优化后的基因,实现了太平洋牡蛎类FUT2基因在大肠杆菌中的表达,该结果也证实了前期的推测。
经过多次试验优化,类FUT2基因的表达量无明显提高,推测可能是其mRNA中存在不稳定序列或复杂结构,限制了目的基因的大量表达。一是今后可通过生物信息学预测mRNA的构象及其稳定性,在不影响蛋白质功能的前提下,将不稳定序列缺失,通过条件优化,将缺失突变体利用原核表达系统实现高表达;二是利用真核表达系统表达,真核表达系统与原核表达系统相比,具有不受稀有密码子限制的优点,表达蛋白的活性高,更适合真核生物基因的表达和功能研究。通过上述两种方式,突破类FUT2基因在原核生物中表达量低的问题,为今后太平洋牡蛎类FUT2基因的功能研究提供基础。
由于目前没有商业化的太平洋牡蛎类FUT2基因表达产物的抗体,本研究使用两种抗体对大肠杆菌原核表达产物进行Western blot鉴定,一种是抗6×His-Tag单体,可准确标记6×His-Tag融合表达蛋白,结果显示,抗6×His-Tag单抗能与约48 kDa大小的特异性蛋白条带反应,证明了太平洋牡蛎类FUT2基因在大肠杆菌中实现了表达。经过生物信息学软件分析,太平洋牡蛎类FUT2基因的翻译蛋白质序列与人FUT2的蛋白质序列有一定同源性,理论上推测抗人FUT2的单抗也可以识别太平洋牡蛎类FUT2基因的表达产物,因此,本研究又利用抗人FUT2的单抗(针对的抗原表位位于保守结构域内)作为一抗,对太平洋牡蛎类FUT2基因的原核表达产物进行Western blot鉴定,结果在硝酸纤维素膜上同样出现大小约为48 kDa的特异性条带,空白对照未见条带出现。该结果表明,太平洋牡蛎类FUT2基因的原核表达产物能与抗人FUT2单抗结合,从另一个角度证实了该基因在大肠杆菌中获得成功表达。此外,由于抗人FUT2单克隆抗体的高度特异性,能与太平洋牡蛎类FUT2基因的原核表达产物发生特异性反应,说明二者之间具有高度相似的免疫原性,甚至可以大胆推测,太平洋牡蛎类FUT2的结构域与人FUT2相似,具有相似的催化功能。该推测还需后续实验证实。
Kelly的研究团队在首次克隆了人FUT2基因后,对不同人群的FUT2基因进行了大量分析后指出,该基因蛋白编码区内单碱基的突变(如G428A、A385T、C571T、C628T、G849A、C658T)产生的无功能等位基因导致Se酶活性的丧失,而这些等位基因的分布具有一定的地域特异性、种族特异性,同时兼具个体差异性(Kelly et al, 1995; Rouquier et al, 1995)。研究表明,Se酶活性缺失的人群更不易受到诺如病毒的感染(Marionneau et al, 2002; Harrington et al, 2004; Huang et al, 2005)。牡蛎作为全世界广泛分布的贝类,品种繁多,个体数量庞大,其中是否存在不具备Se酶活性的个体或地域性群体,从而使得其类A型HBGAs即诺如病毒受体不表达,继而缺失特异性富集诺如病毒的能力?如果这种推测被后续研究证实,那么随着牡蛎全基因组测序结果的不断解析(Zhang et al, 2012),结合贝类育种技术,培育不富集诺如病毒的、食用安全性更高的牡蛎新品种的研究思路将得到更为广泛的关注。
| 姜薇, 姚琳, 江艳华, 等. 太平洋牡蛎(Crassostrea gigas)类FUT2基因的克隆与组织表达. 渔业科学进展 , 2014, 35 (5) : 70-75 | |
| 中国渔业统计年鉴. 农业部渔业局编制. 北京: 中国农业出版社, 2013 . | |
| Atmar RL, Estes MK. The epidemiologic and clinical importance of norovirus infection. Gastroenterol Clin North Am , 2006, 35 (2) : 275-290 DOI:10.1016/j.gtc.2006.03.001 | |
| Harrington PR, Vinjé J, Moe CL, et al. Norovirus capture with histo-blood group antigens reveals novel virus-ligand interactions. J Virol , 2004, 78 (6) : 3035-3045 DOI:10.1128/JVI.78.6.3035-3045.2004 | |
| Hennessy EP, Green AD, Connor MP, et al. Norwalk virus infection and disease is associated with ABO histo-blood group type. J Infect Dis , 2003, 188 (1) : 176-177 DOI:10.1086/jid.2003.188.issue-1 | |
| Huang P, Farkas T, Zhong W, et al. Norovirus and histo-blood group antigens: demonstration of a wide spectrum of strain specificities and classification of two major binding groups among multiple binding patterns. J Virol , 2005, 79 (11) : 6714-6722 DOI:10.1128/JVI.79.11.6714-6722.2005 | |
| Kelly RJ, Rouquier S, Giorgi D, et al. Sequence and expression of a candidate for the human secretor blood group alpha(1, 2)-fucosyltransferase gene (FUT2). Homozygosity for for an enzyme-inactivating nonsense mutation commonly correl ates with the non-secretor phenotype.. J Biol Chem , 1995, 270 (9) : 4640-4649 DOI:10.1074/jbc.270.9.4640 | |
| Langlet J, Kaas L, Greening G. Binding-based RT-qPCR assay to assess binding patterns of noroviruses to shellfish. Food Environ Virol , 2015 DOI:10.1007/s12560-015-9180-x | |
| Lavner Y, Kotlar D. Codon bias as a factor in regulating expression via translation rate in the human genome. Gene , 2005, 345 (1) : 127-138 DOI:10.1016/j.gene.2004.11.035 | |
| Le Guyader F, Loisy F, Atmar RL, et al. Norwalk virus-specific binding to oyster digestive tissues. Emerg Infect Dis , 2006, 12 (6) : 931-936 DOI:10.3201/eid1206.051519 | |
| Marionneau S, Ruvo n N, Le Moullac-Vaidye B, et al. Norwalk virus binds to histo-blood group antigens present on gast roduodenal epithelial cells of secretor individuals. Gastroen terology , 2002, 122 (7) : 1967-1977 DOI:10.1053/gast.2002.33661 | |
| Moore MD, Goulter RM, Jaykus LA. Human norovirus as a foodborne pathogen: challenges and developments. Annu Rev Food Sci Technol , 2015, 6 : 411-433 DOI:10.1146/annurev-food-022814-015643 | |
| Rockx BH, Vennema H, Hoebe CJ, et al. Association of histo-blood group antigens and susceptibility to norovirus infections. J Infect Dis , 2005, 191 (5) : 749-754 DOI:10.1086/jid.2005.191.issue-5 | |
| Rouquier S, Lowe JB, Kelly RJ, et al. Molecular cloning of a human genomic region containing the H blood group alpha (1, 2)-fucosyltransferase gene and two H locus-related DNA restriction fragments. J Biol Chem , 1995, 270 (9) : 4632-4639 DOI:10.1074/jbc.270.9.4632 | |
| Shirato H. Norovirus recognition sites on histo-blood group antigens. Front Microbiol , 2012, 177 (3) : 1-3 | |
| Tian P, Bates AH, Jensen HM, et al. Norovirus binds to blood group A-like antigens in oyster gastrointestinal cells. Lett Appl Microbiol , 2006, 43 (6) : 645-651 DOI:10.1111/lam.2006.43.issue-6 | |
| Zhang G, Fang X, Guo X, et al. The oyster genome reveals stress adaptation and complexity of shell formation. Nature , 2012, 490 (7418) : 49-54 DOI:10.1038/nature11413 |



