2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产物过程功能实验室 青岛 266071
2. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
甲虫螺(Cantharus cecillei)隶属于软体动物门(Mollusca)、腹足纲(Gastropoda)、狭舌目(Strenoglossa)、蛾螺科(Buccinidae),主要分布于日本、韩国以及我国沿海地区。其生活范围较广,遍布于潮间带至海底水深60 m左右的岩石和粗沙,其中,大多生活在水深20−30 m的海底(李凤兰等, 2000)。目前国内外有关甲虫螺的研究报道较少,主要集中在甲虫螺的形态学、性畸变以及分类学等方面(李凤兰等, 2000; 李海涛等, 2010; 汤丽等, 2009),对其生理生态学的研究较少。近年来,甲虫螺作为污损生物的防治生物被应用于鲍螺混养模式中,并在福建、山东沿海等地的贝螺混养技术中进行推广应用,取得了显著的效果(王进可等, 2013)。因此,开展甲虫螺的生理生态学研究,有助于人们掌握其生理生态学特征以及对生态环境的影响。海洋贝类自身的生长和繁殖与温度和盐度密不可分,温度对海洋贝类生殖的影响贯穿整个繁殖周期(Dridi et al, 2007),盐度则通过引起贝类渗透压的变化,从而影响其生理代谢活动。呼吸代谢可反映环境因素对贝类生理活动的影响程度及其生理状态。本文研究了不同温度和盐度对两种规格甲虫螺呼吸代谢的影响,可为甲虫螺的人工繁殖以及贝螺混养技术提供科学的依据。
1 材料与方法 1.1 材料来源及暂养实验开始于2014年4月,甲虫螺取自山东荣成寻山集团海上养殖笼。实验用的甲虫螺要求外壳完整,无附着物,活力良好。按壳高分为大(A)、小(B)两组,并置于循环水中暂养,暂养期间投喂配合颗粒饲料。配合饲料的主要成分为50%−52%的粗蛋白,12%−16%的粗脂肪。实验海水需经脱脂棉过滤,暂养期间每天换水2次,暂养14 d后,开始温度和盐度驯化。
1.2 温度和盐度梯度的设定 1.2.1 温度梯度的设定实验设置温度为12、16、20、24和28℃ 5个梯度,温度控制在光照培养箱中进行,以每天升温或降温1℃的方式进行温控实验,达到预定温度后再适应2 d,开始实验。实验前24 h停止投喂。实验在1 L聚乙烯塑料瓶中进行,每瓶中放置甲虫螺个数分别为A组5个,B组5个,对照组0个。每组每个温度设3个重复。实验期间,海水盐度为(30.0±0.3)。放入甲虫螺后立即用保鲜膜封口,实验持续时间为2 h,测定实验前后呼吸瓶中溶解氧(DO)和氨氮浓度(NR)。实验结束后,测量甲虫螺的生物学参数。
1.2.2 盐度梯度的设定实验设置盐度为20、25、30、35、和40五个梯度,通过添加蒸馏水和海水晶来升高或降低海水盐度,盐度升降范围不超过2。达到预定盐度后适应2 d开始实验,实验方法同1.2.1。实验期间,水温为(24.0±0.5)℃。测定实验前后(实验持续时间为2 h)呼吸瓶中溶解氧(DO)浓度和氨氮浓度(NR)。实验结束后,测量甲虫螺的生物学参数。
|
|
表 1 甲虫螺生物学数据 Table 1 Biological characteristics of C. cecillei |
分别采用Winkler法及次溴酸钠氧化法测定不同温度或盐度下实验海水中溶解氧含量(DO)及氨氮(NR)浓度。甲虫螺的单位干重量耗氧率(OR:mg/g·h)及排氨率(NR:μg/g·h)通过以下公式计算:
| $ \begin{array}{l} OR = \left[ {\left({D{O_1} - D{O_2}} \right) \times V} \right]/\left({W \times t} \right)\\ NR = \left[ {\left({{N_1} - {N_2}} \right) \times V} \right]/\left({W \times t} \right) \end{array} $ |
式中,DO1和DO2分别为实验组和空白组水中溶氧的变化浓度DO(mg/L),N1和N2为实验组和空白组水中氨氮的变化浓度N(μg/L),V为呼吸瓶中水的体积(L),W为实验贝软组织干重量(g),t为实验持续时间(h)。
1.4 数据处理实验数据采用Microsoft Excel 2010和SPSS17.0统计分析软件进行统计学分析,实验结果以平均值±标准差(Mean±SD)来表示。采用ANOVA方法进行双因子方差分析,组间差异采用Tukey HSD法分析。
2 实验结果 2.1 温度和规格对甲虫螺耗氧率和排氨率的影响温度、规格均对甲虫螺的耗氧率和排氨率有显著影响(P < 0.05),但其二者的交互作用对甲虫螺的耗氧率和排氨率没有显著影响。温度对耗氧率和排氨率的影响趋势相近,都是当温度为12−24℃时,两种规格甲虫螺的耗氧率和排氨率随温度的升高而逐渐增加,温度为24℃时达到最高值。之后随着温度的继续升高,各组耗氧率和排氨率均有明显的下降(图 1)。当温度在12−28℃时,大规格组(A组)甲虫螺的单位体重耗氧率和排氨率均小于小规格组(B组)。表 2为不同温度下两种规格甲虫螺的O/N比值。从表 2中可以看出,甲虫螺的O/N比值范围在8.17−17.31之间。温度为20℃和24℃时,各实验组均有最大的氧氮比值,温度升至28℃时,氧氮比值明显下降。
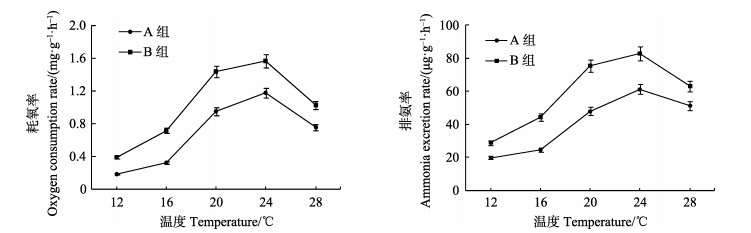
|
图 1 温度对不同规格甲虫螺耗氧率和排氨率的影响 Figure 1 Effects of different temperatures on OR and NR of C. cecillei |
|
|
表 2 两种规格甲虫螺在不同温度下的O/N比值 Table 2 O/N ratios of C. cecillei with two sizes at different temperatures |
盐度、规格均对甲虫螺的耗氧率、排氨率有显著影响(P < 0.05),但其二者的交互作用对甲虫螺的耗氧率和排氨率没有显著影响。盐度对耗氧率和排氨率的影响趋势相近,都是当盐度为20−30时,两种规格甲虫螺的耗氧率和排氨率随盐度的升高而逐渐增加,盐度为30时达到最高值。之后随着盐度的继续升高,各组耗氧率和排氨率均有明显的下降(图 2)。当盐度为20−40时,大规格组(A组)甲虫螺的单位体重耗氧率和排氨率均小于小规格组(B组)。表 3为不同盐度下两种规格甲虫螺的O/N比值。从表 3中可以看出,甲虫螺的O/N比值范围在10.80−22.71之间。在盐度为30时,各实验组均有最大的氧氮比值,盐度升至35和40时,氧氮比值明显下降。
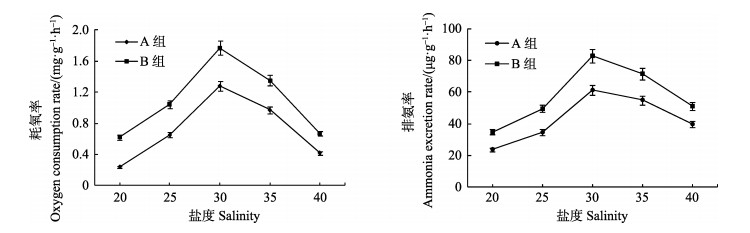
|
图 2 盐度对不同规格甲虫螺耗氧率和排氨率的影响 Figure 2 Effects of different salinities on OR and NR of C. cecillei |
|
|
表 3 两种规格甲虫螺在不同盐度下的O/N比值 Table 3 O/N ratios of C. cecillei with two sizes at different salinities |
温度是影响贝类呼吸排泄的重要环境因子(常亚青等, 1996),温度的波动通常会引起贝类生理活动的变化(王资生等, 2003)。本研究表明,在温度为18−28℃范围下,甲虫螺的耗氧率和排氨率先随温度的升高而逐渐增加,达到最高值后随着温度的继续升高各组耗氧率和排氨率均有明显的下降。以往研究结果显示,
在一定温度范围内,贝类的代谢率随温度的升高而增加,超出这个范围,贝类的代谢就会出现异常(王俊等, 2002; Bougrier et al, 1995)。本研究结果与扁玉螺(Neverita didyma)、脉红螺(Rapana venosa)和香螺(Naptunea cumingii)等有相类似的现象(王资生等, 2003; 叶安发等, 2008; 张旭峰等, 2014)。有研究表明,之所以出现这种现象是因为随着温度的升高, 动物体内酶的活性逐渐增强, 体内物质的生化反应速率得到加强,导致生物的呼吸速率和排谢速率加快。但超过一定的温度, 酶的活性将会受到抑制, 从而导致生物体内的生理功能发生紊乱, 造成耗氧率和排氨率的急速下降(Nils et al, 1987; 林小涛等, 2002; 杨红生等, 1998)。甲虫螺主要分布于中国的东南沿海,属于暖水种贝类(李凤兰等, 2000),从本研究结果来看, 甲虫螺代谢强度最高时,对应的温度值为24℃, 表明其最适生长温度为24℃左右, 确定合理的温度范围有利于甲虫螺在人工繁育和贝螺混养技术方面的研究。
O/N比值表示生物体内蛋白质与脂肪、碳水化合物分解代谢的比率, 可以作为生物适应环境压力的指标之一(Widdow, 1978)。当O/N比值处于较低(7−9.3)水平时,生物机体以蛋白质代谢为主;当O/N比值大于24时,以脂肪和碳水化合物代谢为主(Mayzaud, 1973)。本研究表明,在温度范围为12−28℃时,甲虫螺的O/N比值范围在8.17−17.31之间。大规格组在温度为12℃时有最低值,最低值为8.17。在温度为20℃和24℃时,各实验组均有最大的氧氮比值。温度升至28℃时,氧氮比值明显下降,但都低于24。这说明在较适宜的温度范围内,甲虫螺的代谢为蛋白质与脂肪和碳水化合物的混合代谢,而在低温时,甲虫螺的代谢底物以蛋白质为主。
3.2 盐度对甲虫螺耗氧率和排氨率的影响盐度是决定海洋贝类分布并影响其生理代谢的重要环境因子之一(Cheung et al, 1995)。本研究表明,在盐度为20−40范围下,两种规格甲虫螺的耗氧率和排氨率随盐度的升高而逐渐增加,达到最高值后随着盐度的继续升高,各组耗氧率和排氨率均有明显的下降。本研究结果与香螺、方斑东风螺(Babylonia areolata)、泥螺(Bullacta exarata)和皱肋文蛤(Neptunea cumingii)等有类似的现象(张旭峰等, 2014; 刘建勇等, 2005; 吴文广等, 2013; 栗志民等, 2011),即在一定盐度范围内,贝类的代谢率随盐度的升高而增加,超出这个范围,呈现下降趋势。已有研究表明,香螺、方斑东风螺和皱肋文蛤达到最大耗氧率和排氨率时的盐度分别为34、28和23(张旭峰等, 2014; 刘建勇等, 2005; 栗志民等, 2011),本研究中,当盐度为30时,甲虫螺有最大的耗氧率和排氨率。出现这种情况的原因,作者认为一是不同种类对盐度的适应范围有关,二是因为实验盐度的梯度设置不同,在实验过程中会对实验结果造成一定的影响。
本研究表明,在盐度范围为20−40下,甲虫螺的O/N比值范围在10.80−22.71之间。当盐度为20−30时,甲虫螺的O/N比值随着盐度的增加而增大,在盐度为30时,各实验组均有最大的氧氮比值,盐度升至35−40时,氧氮比值明显下降,但都低于24。这说明在较适宜的盐度范围内,甲虫螺的代谢为蛋白质、脂肪、碳水化合物的混合代谢。从本研究结果来看, 甲虫螺的O/N比值在盐度为30时,出现最大值,其蛋白质的代谢水平在该盐度时也最低, 从侧面证明其最适生长盐度为30左右。
| 王进可, 钟幼平, 黄良敏, 等. 养殖海域鲍螺混养技术的初步研究. 集美大学学报(自然科学版) , 2013, 18 (5) : 329-336 | |
| 王俊, 姜祖辉, 唐启升. 栉孔扇贝耗氧率和排氨率的研究. 应用生态学报 , 2002, 13 (9) : 1157-1160 | |
| 王资生, 彭斌. 温度和规格对扁玉螺耗氧率和排氨率的影响. 盐城工学院学报(自然科学版) , 2003, 16 (4) : 50-54 | |
| 叶安发, 周一兵, 代智能, 等. 温度和体重对脉红螺呼吸和排泄的影响. 大连水产学院学报 , 2008, 23 (5) : 364-369 | |
| 刘建勇, 绍杰, 卓健辉. 盐度对方斑东风螺耗氧率和排氨率的影响. 热带海洋学报 , 2005, 24 (4) : 35-40 | |
| 汤丽, 刘青坡, 施华宏, 等. 厦门海域岩相海岸带疣荔枝螺(Thais clavigera)与甲虫螺(Cantharus cecillei)性畸变. 生态学报 , 2009, 29 (9) : 4640-4648 | |
| 李凤兰, 林民玉. 中国近海蛾螺科的初步研究Ⅰ.唇齿螺属及甲虫螺属. 海洋科学集刊 , 2000, 42 : 108-115 | |
| 李海涛, 朱艾嘉, 方宏达, 等. 蛾螺科、织纹螺科和细带螺科腹足类齿舌的形态学研究. 海洋与湖沼 , 2010, 41 (4) : 495-499 | |
| 杨红生, 张涛, 王萍, 等. 温度对墨西哥湾扇贝耗氧率及排泄率的影响. 海洋学报 , 1998, 20 (4) : 91-96 | |
| 吴文广, 张继红, 方建光, 等. 盐度对不同规格泥螺耗氧率和排氨率的影响. 生态学杂志 , 2013, 32 (9) : 2457-2461 | |
| 张旭峰, 杨大佐, 周一兵, 等. 温度、盐度对香螺幼螺耗氧率和排氨率的影响. 大连海洋大学学报 , 2014, 29 (3) : 251-255 | |
| 林小涛, 钟金香, 颉晓勇, 等. 温度对翡翠贻贝能量收支的影响. 海洋科学 , 2002, 26 (4) : 13-16 | |
| 栗志民, 刘志刚, 徐法军, 等. 体重、温度和盐度对皱肋文蛤耗氧率和排氨率的影响. 海洋科学进展 , 2011, 29 (4) : 512-520 | |
| 常亚青, 王子臣. 贝类生物能量学研究进展. 海洋科学 , 1996, 6 (5) : 25-30 | |
| Bougrier S, Geairon P, Deslous-Paoli JM, et al. Allometric relation ships and effects of temperature on clearance and oxygen consumption rates of Crassostrea gigas (Thunberg). Aqua culture , 1995, 134 (1-2) : 143-154 DOI:10.1016/0044-8486(95)00036-2 | |
| Cheung SG, Lam SW. Effect of salinity, temperature and acclimation on oxygen consumption rate of Nassarius festivus (Powys, 1835) (Gastropoda: Nassariidae). Comp Biochem Physiol IIIA , 1995, 111 (4) : 625-631 | |
| Dridi S, Romdhane MS, Elcafsi MH. Seasonal variation in weight and biochemical composition of the Pacific oyster, Crassostrea gigas in relation to the gametogenic cycle and environmental conditions of the Bizert lagoon, Tunisia. Aquaculture , 2007, 263 (1) : 238-248 | |
| Mayzaud P. Respiration and nitrogen excretion of zooplankton. II. Studies of the metabolic characteristics of starved animals. Mar Biol , 1973, 21 (1) : 19-28 DOI:10.1007/BF00351188 | |
| Kautsky N, Evans S. Role of biodeposition by Mytilus edulis in the circulation of matter and nutrients in a Baltic coastal ecosystem. Mar Ecol Prog Ser , 1987, 38 (3) : 201-212 | |
| Widdow J. Combined effect of body size, food concentration and season on the physiology of Mytilus edulis. J Mar Biol Assoc UK , 1978, 58 (1) : 109-124 DOI:10.1017/S0025315400024449 |



