2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266200
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306 ;
3. Qingdao National Laboratory for Marine Science and Technology, Functional Laboratory of Marine Fisheries Science and Food Production Processes, Qingdao 266200
丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)信号通路在细胞应对细胞外刺激过程中起着重要作用(Rouse et al, 1994),是一类丝氨酸/苏氨酸蛋白激酶,通过磷酸化级联反应将细胞外信号传递到细胞内。MAPK超家族包含细胞外调节激酶(Extracellular signal-regulated kinase, ERK)、大丝裂素活化蛋白激酶1(Big MAP kinase 1, BMK1)、C-Jun氨基末端激酶(C-Jun N-terminal kinase, JNK)/应激活化蛋白激酶(Stress-activated protein kinase, SPAK)和p38 MAPK通路4个亚族,其中,p38 MAPK信号通路可被多种细胞外刺激所激活,包括炎症性细胞因子、环境胁迫、紫外线和病原体感染等(Raingeaud et al, 1995; Regan et al, 2009; Huang et al, 2011)。
p38 MAPK基因自从第一次克隆(Brewster et al, 1993)以来,其分子功能及机制等得到较为深入的研究。p38同系物在脊椎动物(Fujii et al, 2000; Hashimoto et al, 2000)以及无脊椎动物(Han et al, 1998)、酵母菌(Brewster et al, 1993)中均被发现,分为p38α、β、γ、δ共4个亚型,且都含有典型保守的Thr-Gly-Tyr(TGY)双磷酸化位点和紧密相连的底物结合位点Ala-Thr-Arg-Trp(ATRW)(Hanks et al, 1995)。p38在多种调节过程中起着重要作用,如蛋白质降解及定位、mRNA稳定性、内吞作用、细胞凋亡等(Cuadrado et al, 2010);p38在斑马鱼早期胚胎发育过程中起着重要作用(Krens et al, 2006);p38是小鼠胚胎正常发育所必需的,并被认为是哺乳动物肌肉发育的关键调节因子(Natale et al, 2004; Keren et al, 2006);p38能被胁迫激活,与Ⅱ型糖尿病、正常免疫和炎症反应等多种病理学现象相关(Ozcan et al, 2004; Roux et al, 2004; Lee et al, 2011);近年的研究表明,p38可通过toll样受体(TLRs)参与免疫调节反应(Li et al, 2013; Yee et al, 2013);点带石斑鱼感染虹彩病毒时,p38 MAPKs在调节细胞凋亡和病毒复制过程中起着至关重要的作用(Cai et al, 2011)。由此可见,p38在生物生长发育及胁迫刺激、免疫等过程中发挥着极其重要的作用。
中国对虾(Fenneropenaeus chinensis)在我国经济养殖虾类中占据重要地位(邓景耀等, 1990)。近年来,随着沿海地区经济社会的发展和陆源污染物的增加,中国对虾养殖环境急剧变化,降低了对虾的适应性(Capy et al, 2000),其中,残饵、虾体排泄物等有机物在海水中经微生物分解后产生大量的氨氮等物质,而氨氮在高浓度时对虾体有致死作用(Wickens, 1976),并且随着氨氮浓度的不断升高,虾体免疫力越低,越容易感染病原体(哈承旭等, 2009)。由此可见,氨氮对中国对虾的生长和免疫有着极其重要的影响。对虾中关于p38报告仅见于凡纳滨对虾(He et al, 2013; Yan et al, 2013),中国对虾中尚未见报道。本研究克隆获得中国对虾p38基因,对其组织表达分布及氨氮胁迫后在各组织中表达变化情况进行初步分析,以期为中国对虾p38基因的生物学功能及其应对胁迫刺激机理提供依据。
1 材料与方法 1.1 材料健康中国对虾取自山东省昌邑市海丰水产养殖有限责任公司培养的“黄海3号”,体长为(74.97±7.54) mm,体重为(5.34±1.67) g,于150 L的整理箱中暂养,每箱30尾,养殖水温约为25℃,盐度为31,pH=8.4,持续充氧,每天换水1/3,暂养10 d,正常投喂配合饲料。
TRIzol Reagent提取液为Invitrogen生产;SMARTTM RACE Amplification试剂盒为Clontech生产;LA Taq、DEPC水、SYBR® Premix Ex TaqTM11、pMD18-T载体和Top 10感受态细胞购自TaKaRa公司;实验所用引物及胶回收试剂盒均由生工生物工程(上海)股份有限公司(下文简称上海生工)提供;其余实验试剂均为国产分析纯。
1.2 总RNA提取和cDNA第一链的合成取健康中国对虾肝胰腺于液氮中进行研磨,按TRIzol试剂说明书提取总RNA,总RNA完整性及质量用2.0%琼脂糖凝胶电泳与紫外分光光度计进行检测。利用普通反转录试剂盒反转录合成cDNA(韩俊英等, 2011),利用SMARTTM RACE Amplification Kit分别反转录合成3' RACE和5' RACE cDNA第一条链。
1.3 中国对虾p38基因全长cDNA克隆及测序在NCBI中搜寻日本囊对虾(Marsupenaeus japonicus, BAK78916.1)、凡纳滨对虾(Litopenaeus vannamei, AGG82488/AFL70597.1)和果蝇(Drosophila melanogaster, NP 477361.1)的p38基因,经ClustalX同源比对确定保守区域,根据保守序列设计简并引物p38-F1和p38-R1,引物由上海生工合成。以中国对虾肝胰腺cDNA为模板,以p38-F1和p38-R1为引物,进行中国对虾p38基因中间片段扩增(表 1)。PCR反应体积为50 μl,反应程序:94℃预变性5 min;94℃变性30 s,55.0℃退火30 s,72℃延伸1.0 min,35个循环;70℃延伸10 min。扩增的PCR产物经2%琼脂糖凝胶电泳检测后,直接送往上海生工进行测序。测序结果经NCBI(http://www.ncbi.nlm.nih.gov)比对,获得中国对虾p38基因中间片段序列。根据测序获得的中国对虾p38基因序列,应用引物设计软件Primer Premier5.0进行3' RACE和5' RACE特异性引物设计,然后交予上海生工进行合成。
|
|
表 1 实验所用引物 Table 1 The primers used in this study |
3' RACE:以RACE反转录试剂盒合成的3' RACE第一链为模板,用引物p38-F2和通用引物UPM配对,进行3' RACE第1次扩增;接着使用p38-F3和通用引物NUP配对,以第1次扩增产物为模板进行3' RACE第2次扩增。反应程序同中间片段扩增程序,但将第2次扩增条件改为62.0℃ 30 s。
5' RACE:以RACE反转录试剂盒合成的5' RACE第一链为模板,用引物p38-R2和通用引物UPM,进行5' RACE第1次扩增;然后使用引物p38-R3和通用引物NUP,以第1次扩增产物为模板进行5' RACE第2次扩增。反应程序同中间片段扩增程序,但将第1次退火条件改为58.0℃ 30 s,第2次退火条件改为54.0℃ 30 s。
RACE所得产物经2.0%琼脂糖凝胶电泳检测后,使用胶回收试剂盒进行纯化,然后连接到pMD18-T载体,重组好的载体转入Top 10感受态细胞,产生的阳性克隆经菌落PCR鉴定后(所用引物为M13-F和M13-R,程序同普通PCR)送测序。
1.4 中国对虾p38基因序列分析使用DNAStar软件中的SeqMan程序去除测序所得结果中的载体序列并进行拼接,然后用EditSeq程序进行开放阅读框(ORF)的预测及氨基酸翻译。使用NCBI BLAST对p38 MAPK基因的核苷酸序列及推导的氨基酸序列进行相似性比对。蛋白质理化性质预测使用ProtParam (http://web.expasy.org/protparam/)在软件,信号肽预测使用SignalP4.1 (http://www.cbs.dtu. dk/services/SignalP)在线软件,使用NCBI网站保守结构域(CDD)数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行氨基酸序列的保守结构域预测。使用ClustalX软件,将中国对虾p38基因预测编码氨基酸与其他物种的p38基因所翻译的氨基酸序列进行多重序列比对及同源性分析,在此基础上,采用MEGA 4.1软件,以邻接法(NJ)进行系统进化树构建。
1.5 氨氮胁迫实验实验用64 mg/L的NH4Cl海水溶液进行氨氮胁迫实验(此浓度为中国对虾“黄海3号”新品种选育时所用氨氮浓度,其最终存活率为10%)。实验前随机挑选暂养7 d的健康中国对虾180尾,平均分为两组(氨氮胁迫组和空白对照组),每组3个平行,实验期间正常投喂饵料,且每天(24 h)换取新配制的NH4Cl海水溶液。各组分别在实验开始后的0、3、6、12、24、48、72和96 h,取血细胞、鳃、心脏、肝胰腺、胃、肠、肌肉,每个时间点各取6尾,保存于液氮,用于RNA的提取。此外,为检测中国对虾p38基因在不同组织中的分布情况,另选6尾健康的中国对虾,取其血细胞、心脏、淋巴、鳃、肝胰腺、肠、胃和肌肉组织,保存于液氮,用于各组织总RNA的提取。
1.6 p38基因RT-PCR定量检测按TRIzol试剂说明书对不同实验组中国对虾所取组织进行总RNA提取,检测后进行cDNA合成,方法参照韩俊英等(2011)。
根据测序获得的中国对虾p38基因和已获得的内参基因β-actin全长序列,分别设计1对正反引物(p38-F4和p38-R4;β-actin-F和β-actin-R),对健康中国对虾各组织及不同时间点氨氮胁迫的中国对虾各组织中的p38基因的表达量进行检测。RT-PCR扩增体系为20 μl,试剂添加按照SYBR® Premix Ex TaqTM 11说明书进行。反应程序为:95℃ 30 s;95℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s,60℃ 1.0 min,95℃ 15 s。采用2-DDCt方法对荧光定量PCR检测结果进行分析,显著性用SPSS 17.0软件进行分析。
2 结果与分析 2.1 Fcp38基因全长cDNA克隆及序列分析利用TRIzol试剂提取获得的中国对虾肝胰腺总RNA,紫外分光光度计检测结果OD260 nm/OD280 nm为1.98,表明RNA质量较好;RNA完整性经2.0%琼脂糖凝胶电泳检测,其中,18S和28S rRNA条带清晰且完整,符合实验所需。用特异性引物p38-F2和p38-R2通用引物UPM以及p38-F3和p38-R3与通用引物NUP分别配对,进行3' RACE和5' RACE扩增,所得产物经测序拼接后,获得中国对虾p38 MAPK基因全长cDNA序列,命名为Fcp38 MAPK,GenBank登录号为KF991368。该基因总长为1563 bp,其中,5'端非编码区(5' UTR)长122 bp,3'端非编码区(3' UTR)长343 bp,开放阅读框(ORF)长1098 bp。3'端含有PolyA尾,但不含多聚腺苷酸AATAA加尾信号(图 1)。

|
图 1 中国对虾p38基因核苷酸序列及其推导的氨基酸序列 Figure 1 Nucleotide sequence of F. chinensis p38 gene and its deduced amino acid sequence 起始密码子ATG由细线方框标出;终止密码子TGA由*标出;画线部分为S-TKs保守结构域 Start codon(ATG) is marked with filament box. Asterisk indicates stop codon(TGA). The conserved domain S-TKs is underlined |
氨基酸序列分析可知,Fcp38基因编码的蛋白质由365个氨基酸残基组成,包括42个碱性氨基酸(K和R)、52个酸性氨基酸(D和E)、121个疏水性氨基酸(A、I、L、F、W和V)、89个亲水性氨基酸(N、C、Q、S、T和Y)、94个带电荷氨基酸(D、E、R和K),其推导分子量为41.77 kDa,理论等电点为5.68,脂溶指数为85.51,为脂溶性蛋白质,总平均疏水性为–0.420,为亲水性蛋白,但亲水性不强。信号肽预测分析显示,Fcp38预测蛋白不含信号肽;保守结构域分析显示,Fcp38预测蛋白存在S-TKc(丝氨酸/苏氨酸蛋白激酶催化区)保守结构域,且该蛋白属于PKc(蛋白激酶c)超家族。
2.2 Fcp38基因同源性分析利用NCBI BLASTP软件对中国对虾Fcp38基因编码的氨基酸序列进行同源比对,发现该序列与凡纳滨对虾(L. vannamei)和日本囊对虾(M. japonicus)的相似性最高,为98%;与其他无脊椎动物如拟穴青蟹(Scylla paramamosain)、中华蜜蜂(Apis cerana cerana)、大红斑蝶(Danaus plexippus)、埃及伊蚊(Aedes aegypti)、丽蝇蛹集金小蜂(Nasonia vitripennis)、家蚕(Bombyx mori)和烟粉虱(Bemisia tabaci)的p38基因的同源性分别为88%、82%、80%、80%、80%、78%和78%;与其他脊椎动物如非洲爪蟾蜍(Xenopus tropicalis)、智人(Homo sapiens)、鸡(Gallus gallus)、鲈鱼(Dicentrarchus labrax)、斑马鱼(Danio rerio)、小家鼠(Mus musculus)和半滑舌鳎(Cynoglossus semilaevis)的p38基因的相似性分别为76%、76%、75%、74%、73%、73%和73%。
利用MEGA 4.1软件进行系统进化分析显示,中国对虾p38和凡纳滨对虾和日本囊对虾p38聚为一支,与其他无脊椎动物p38聚为一类(图 2)。将中国对虾p38基因编码的氨基酸序列与凡纳滨对虾、日本囊对虾、埃及伊蚊、拟穴青蟹、斑马鱼、智人和小家鼠等动物的p38基因所编码的氨基酸序列进行同源分析,结果表明,Fcp38包含p38家族特有的标志性Thr-Gly-Tyr(TGY)双磷酸化位点和底物结合位点Ala-Thr-Arg-Trp(ATRW),还具有p38家族关键功能位点ED(ERK docking)(图 3)。

|
图 2 利用MEGA 4.1软件构建的基于p38基因所编码氨基酸序列的NJ系统进化树 Figure 2 NJ phylogenetic tree based on p38 amino acid sequences by MEGA 4.1 |

|
图 3 中国对虾p38氨基酸序列与其他物种p38氨基酸序列比对 Figure 3 Amino acid sequences alignment of F.chinensis p38 with other species'p38 双磷酸化位点TGY和底物结合位点ATRW用方框标出; ED位点用箭头标出 The predicted phosphorylation motif TGY and substrate-binding site ATRW are indicated by boxes. The conserved ED motif, which is important for docking, is indicated by arrows. |
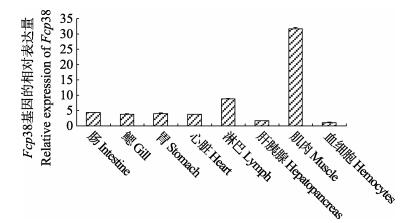
用RT-PCR对中国对虾不同组织中p38基因的相对表达水平进行分析,结果显示,Fcp38基因在肠、鳃、胃、心脏、淋巴、肝胰腺、肌肉、血细胞中均有表达,在肌肉中的相对表达量最高(为血细胞中相对表达量的31.64倍),其次为淋巴、肠、胃(分别为血细胞中相对表达量的8.73、4.35、4.01倍),在血细胞中的相对表达量最少(图 4)。
|
图 4 p38基因在中国对虾不同组织中的表达分布 Figure 4 Distribution of p38 gene relative expression in different tissues of F. chinensis |
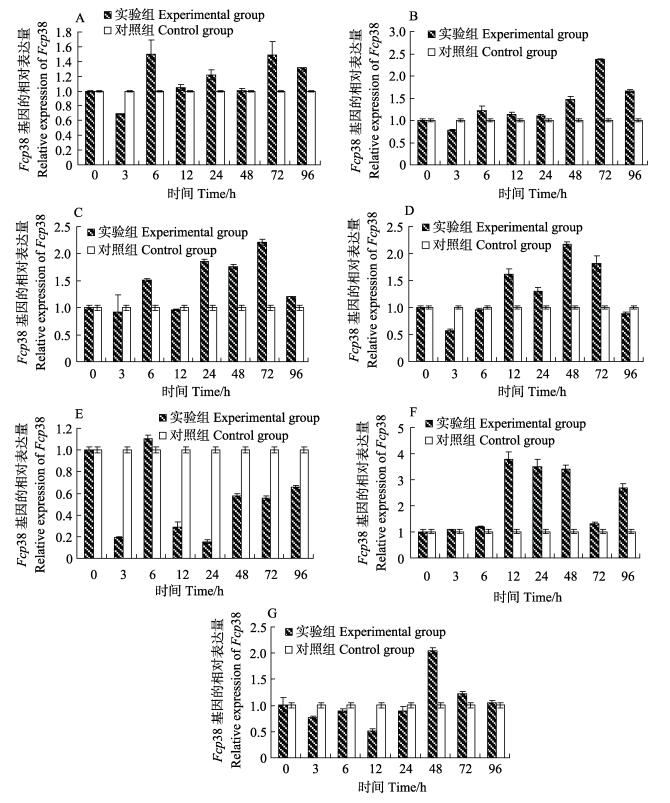
中国对虾氨氮胁迫后,p38基因在肠、鳃、胃、心脏、肝胰腺、肌肉和血细胞中的相对表达量变化情况显示(图 5),与对照组相比,Fcp38基因相对表达量在肠、鳃、胃、心脏、肝胰腺和血细胞中首先表现为下调趋势,其中,在肠、鳃、胃、心脏和肝胰腺中的相对表达量在3 h最低,分别为对照组的0.69倍(P < 0.01)、0.78倍(P < 0.01)、0.92倍(P > 0.05)、0.56倍(P < 0.01)和0.19倍(P < 0.01);在血细胞中的相对表达量在12 h最低,为对照组的0.51倍(P < 0.01);随后,Fcp38基因的相对表达量出现上调,各组织表达量分别在72 h、72 h、72 h、48 h、6 h和48 h达到最大值,相对表达量分别为对照组的1.48倍(P < 0.01)、2.37倍(P < 0.01)、2.20倍(P < 0.01)、2.16倍(P < 0.01)、1.11倍(P < 0.01)和2.04倍(P < 0.01),且Fcp38的相对表达量总体呈现先下降后上升再下降的变化趋势。
|
图 5 氨氮胁迫后中国对虾p38基因在不同时间的表达变化 Figure 5 Expression of p38 gene in F.chinensis after ammonia-N stress A:肠; B:鳃; C:胃; D:心脏; E:肝胰腺; F:肌肉; G:血细胞 A: Intestine; B: Gill; C. Stomach; D. Heart; E. Hepatopancreas; F. Muscle; G. Hemocytes |
与上述情况相反,氨氮胁迫后,中国对虾Fcp38基因在肌肉中的相对表达量呈现先上调后下调再上调的变化趋势,且分别在12 h和96 h达到最大值,相对表达量分别为对照组的3.78倍(P < 0.01)和2.69倍(P < 0.01),且在各时间点,氨氮胁迫组Fcp38基因的相对表达量均高于对照组。
3 讨论p38 MAPK信号转导通路从酵母菌到哺乳动物高度保守(Roux et al, 2004; Cargnello et al, 2011),能被环境胁迫和细胞因子激活。p38基因自从第一次克隆(Brewster et al, 1993)以来,其分子功能及机制等得到较为深入的研究。p38在蛋白质降解及定位、mRNA稳定性、内吞作用、细胞凋亡(Cuadrado et al, 2010)等过程中起重要的调节作用。对斑马鱼的研究表明,p38在早期胚胎发育过程中起着重要作用(Krens et al, 2006)。点带石斑鱼的研究结果表明(Cai et al, 2011),在虹彩病毒感染过程中,p38 MAPKs在调节细胞凋亡和病毒复制过程中起着至关重要的作用。由于p38 MAPKs在生物中的重要作用,已在许多物种中得到广泛研究,但在甲壳动物中的研究比较滞后。本研究克隆获得中国对虾p38基因全长,并命名为Fcp38,该基因全长1563 bp,其开放阅读框1098 bp,编码1个由365个氨基酸组成的多肽。Fcp38基因编码的蛋白质经BLASTP在线比对,结果显示,该蛋白属于p38 MAPK家族,且与其他无脊椎动物和脊椎动物的相似性都较高(98%–73%)。系统进化分析显示,中国对虾p38与凡纳滨对虾、日本囊对虾p38聚为一支,与无脊椎动物p38聚为一类。p38是一个高度保守的基因,同源性分析表明,Fcp38基因编码的氨基酸与其他物种的p38基因编码的氨基酸一样高度保守,具有p38家族保守的TGY双磷酸化位点和底物结合位点ATRW(Hanks et al, 1995),还具有p38家族关键功能位点ED(ERK docking)(图 3)。综上所述,可以确定该序列为中国对虾p38基因序列。
p38 MAPK在生物体各组织中广泛表达,且存在明显的组织差异性。凡纳滨对虾研究表明(He et al, 2013),凡纳滨对虾p38基因在眼柄、肠、鳃、肌肉、肝胰腺和心脏中都有所表达,且在肌肉和肝胰腺中的相对表达量较高,且存在显著的组织差异性。RT-PCR结果显示,中国对虾p38基因在肠、鳃、胃、心脏、淋巴、肝胰腺、肌肉和血细胞中均有表达(图 4),其中,在肌肉中的相对表达量最高,其次为淋巴、肠、胃,在血细胞中的表达量最少,且存在明显的组织差异性,其可能与组织生理功能有关。
近年来,由于p38 MAPK基因在生物生理及病理过程中的重要作用,在许多物种中进行了研究。在小鼠中的研究表明(Natale et al, 2004; Keren et al, 2006),p38是小鼠胚胎正常发育所必需的,并在肌肉发育过程中起着关键性调节因子的作用;胁迫能激活p38,并参与Ⅱ型糖尿病、正常免疫和炎症反应等多种病理学过程(Ozcan et al, 2004; Roux et al, 2004; Lee et al, 2011);研究表明,p38可通过toll样受体(TLRs)参与免疫调节反应(Li et al, 2013; Yee et al, 2013)。为研究中国对虾p38基因在应对环境胁迫中的作用,本研究采用64 mg/L的NH4Cl海水溶液对中国对虾进行氨氮胁迫实验,结果显示,中国对虾肠、鳃、胃、心脏、肝胰腺、血细胞和肌肉中p38基因的相对表达量均有明显的时间差异。氨氮胁迫后Fcp38基因的相对表达量在肠、鳃、胃、心脏、肝胰腺和血细胞中先下调后上调,在肌肉中的相对表达量则先上调后下调,且各组织中各时间点Fcp38基因相对表达量变化不尽相同,其原因可能是组织器官功能差异性所致(李美玉等, 2012)。中国对虾p38基因在各组织中的相对表达量无论是先下调后上调(如肠、鳃等),还是先上调后下调(肌肉),其总体变化趋势呈现出上调和下调波动性往复变化的趋势,由此可推测,中国对虾p38基因在应对持续性氨氮胁迫过程中通过反复调节基因表达,以维持机体正常的生理功能。关于p38 MAPKs在对虾中的作用机制方面的研究仅见于凡纳滨对虾(He et al, 2013; Yan et al, 2013),在凡纳滨对虾蜕皮及先天性免疫过程中起着重要作用,但研究比较滞后,虾类p38 MAPKs是否与其他物种p38 MAPKs具有相似性功能,还需进一步的研究。
4 结论本研究成功克隆获得了中国对虾p38基因的全长cDNA序列,并通过分析氨氮胁迫后中国对虾p38基因在肠、鳃、胃、心脏、肝胰腺、肌肉、血细胞中的相对表达量特征,推断其可能在中国对虾应对环境胁迫过程中起着重要的作用,为深入研究中国对虾p38蛋白特性及应对环境胁迫的途径和机理奠定了理论基础。
| 邓景耀, 叶昌臣, 刘永昌. 渤黄海的对虾及其资源管理. 北京: 海洋出版社, 1990 : 36 -164. | |
| 李美玉, 李健, 刘萍, 等. 脊尾白虾(Exopalaemon carinicauda) ferritin基因克隆及表达分析. 海洋与湖沼 , 2012, 43 (2) : 306-312 | |
| 哈承旭, 刘萍, 何玉英, 等. 氯化铵对"黄海1号"中国对虾免疫相关酶类的影响. 渔业科学进展 , 2009, 30 (1) : 34-40 | |
| 韩俊英, 李健, 李吉涛, 等. 脊尾白虾热休克蛋白HSP70基因的克隆及其表达分析. 水产学报 , 2011, 35 (8) : 1130-1138 | |
| Brewster JL, Dwyer ND, Winter E, et al. An osmosensing signal transduction pathway in yeast. Science , 1993, 259 (5102) : 1760-1763 DOI:10.1126/science.7681220 | |
| Cai J, Huang YH, Wei SN, et al. Characterization of p38 MAPKs from orange-spotted grouper, Epinephelus coioides involved in SGIV infection. Fish Shellfish Immunol , 2011, 31 (6) : 1129-1136 DOI:10.1016/j.fsi.2011.10.004 | |
| Capy P, Gasperi G, Biemont C, et al. Stress and transposable elements: co-evolution or useful parasites?. Heredity , 2000, 85 (2) : 101-106 DOI:10.1046/j.1365-2540.2000.00751.x | |
| Cargnello M, Roux PP. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases. Microbiol Mol Biol Rev , 2011, 75 (1) : 50-83 DOI:10.1128/MMBR.00031-10 | |
| Cuadrado A, Nebreda AR. Mechanisms and functions of p38 MAPK signaling. Biochemical J , 2010, 429 (3) : 403-417 DOI:10.1042/BJ20100323 | |
| Fujii R, Yamashita S, Hibi M, et al. Asymmetric p38 activation in zebrafish. J Cell Biol , 2000, 150 (6) : 1335-1348 DOI:10.1083/jcb.150.6.1335 | |
| Han ZS, Enslen H, Hu X, et al. A conserved p38 mitogen-activated protein kinase pathway regulates Drosophila imm unity gene expression. Mol Cell Biol , 1998, 18 (6) : 3527-3539 DOI:10.1128/MCB.18.6.3527 | |
| Hanks SK, Hunter T. Protein kinases 6. The eukaryotic protein kinase superfamily: kinase (catalytic) domain structure and classification. FASEB J , 1995, 9 (8) : 596 | |
| Hashimoto H, Fukuda M, Matsuo Y, et al. Identification of a nuclear export signal in MKK6, an activator of the carp p38 mitogen-activated protein kinases. FEBS J , 2000, 267 (14) : 4362-4371 | |
| He S, Qian Z, Yang J, et al. Molecular characterization of a p38 MAPK from Litopenaeus vannamei and its expression during the molt cycle and following pathogen infection. Dev Comp Immunol , 2013, 41 (2) : 217-221 DOI:10.1016/j.dci.2013.05.010 | |
| Huang X, Huang Y, Cai J, et al. Roles of stress-activated protein kinases in the replication of Singapore grouper iridovirus and regulation of the inflammatory responses in grouper cells. J Gen Virol , 2011, 92 : 1292-1301 DOI:10.1099/vir.0.029173-0 | |
| Keren A, Tamir Y, Bengal E. The p38 MAPK signaling pathway: a major regulator of skeletal muscle development. Mol Cell Endocrinol , 2006, 252 (1-2) : 224-230 DOI:10.1016/j.mce.2006.03.017 | |
| Krens SFG, He S, Spaink HP, et al. Characterization and exp ression patterns of the MAPK family in zebrafish. Gene Expression Patterns , 2006, 6 (8) : 1019-1026 DOI:10.1016/j.modgep.2006.04.008 | |
| Lee J, Sun C, Zhou YJ, et al. p38 MAPK-mediated regulation of Xbp1s is crucial for glucose homeostasis. Nat Med , 2011, 17 (10) : 1251-1283 DOI:10.1038/nm.2449 | |
| Li DQ, Lei H, Li ZH, et al. A novel lipopeptide from skin commensal activates TLR2/CD36-p38 MAPK signaling to increase antibacterial defense against bacterial infection. PLoS ONE , 2013, 8 (3) : 1-9 | |
| Natale DR, Paliga AJM, Beier F, et al. p38 MAPK signaling during murine preimplantation development. Dev Biol , 2004, 268 (1) : 76-88 DOI:10.1016/j.ydbio.2003.12.011 | |
| Ozcan U, Cao Q, Yilmaz E, et al. Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes. Science , 2004, 306 (5695) : 457-461 DOI:10.1126/science.1103160 | |
| Raingeaud J, Gupta S, Rogers JS, et al. Pro-inflammatory cytokines and environmental stress cause p38 mitogen-act ivated protein kinase activation by dual phosphorylation on tyrosine and threonine. J Biol Chem , 1995, 270 (13) : 7420-7426 DOI:10.1074/jbc.270.13.7420 | |
| Regan AD, Cohen RD, Whittaker GR. Activation of p38 MAPK by feline infectious peritonitis virus regulates pro-inflamm atory cytokine production in primary blood-derived feline mononuclear cells. Virology , 2009, 384 (1) : 135-143 DOI:10.1016/j.virol.2008.11.006 | |
| Rouse J, Cohen P, Trigon S, et al. A novel kinase cascade triggered by stress and heat shock that stimulates MAPKAP kinase-2 and phosphorylation of the small heat shock protein. Cell , 1994, 78 (6) : 1027-1037 DOI:10.1016/0092-8674(94)90277-1 | |
| Roux PP, Blenis J. ERK and p38 MAPK-activated protein kinases: a family of protein kinases with diverse biological functions. Microbiol Mol Biol Rev , 2004, 68 (2) : 320-344 DOI:10.1128/MMBR.68.2.320-344.2004 | |
| Wickens JF. The tolerance of warm water prawn to recirculated water. Aquaculture , 1976, 9 (11) : 19-37 | |
| Yan H, Zhang S, Li CZ, et al. Molecular characterization and function of a p38 MAPK gene from Litopenaeus vannamei. Fish Shellfish Immunol , 2013, 34 (6) : 1421-1431 DOI:10.1016/j.fsi.2013.02.030 | |
| Yee NK, Hamerman JA. β2 integrins inhibit TLR responses by regulating NF-KB pathway and p38 MAPK activation. Eur J Immunol , 2013, 43 (3) : 779-792 DOI:10.1002/eji.201242550 |



