天津市海岸线全长153.67 km,传统海域面积约3000 km2。天津沿海地势平坦,属冲积海积低的平原,海岸为典型的粉砂淤泥质海岸;气候四季分明、多风少雨、日照充足、蒸发量大,属暖温带半湿润大陆与海洋过渡型季风气候区;是海河水系和蓟运河水系的入海口,自北向南汇集9个河口和渠口;附近海域的潮汐为不规则半日潮,潮流通常为回转流,海浪以风浪为主,海水交换能力较弱。
天津市海洋资源丰富,优质资源包括港口资源、油气资源、盐业资源、旅游资源和生物资源。拥有我国最大的人工港天津港,目前拥有万吨级以上泊位124个,综合经济效益居全国沿海港口前列。附近海域石油天然气资源丰富,已探明石油储量超过1.9亿t,天然气储量638亿m2,其中大港油田和渤海油田是我国重要的沿海平原潮间带和海上油气开发区。盐田面积为338 km2,海盐年产量240多万t,是我国最大的海盐产区之一。滨海旅游资源丰富,拥有滨海旅游景点26处,是距北京最近的海滨景区。海域蓄水和光照条件好,不仅是海洋基础饵料的生产场所,也是鱼、虾、蟹和贝的洄游、索饵和产卵的良好场所。海区水产资源主要种类为中国明对虾(Fenneropenaeus chinensis)、斑鰶(Clupanodon punctatus)、青鳞(Harengula zunasi)、赤鼻棱鯷(Thrissa kammalensis)、毛虾(Acetes sp.)、糠虾(Mysidae sp.)、毛蚶(Scapharca subcrenata)等。
但是,近些年来,为缓解土地供求的矛盾,扩大社会生存和发展空间,保障经济发展,天津兴起了大规模的围填海工程。围填海工程使海岸失去了补充氧气的天然资源,改变了现存的生物结构,给海岸生态和资源带来严重的影响。围填海工程使用挖泥、吹填等方式,改变了沉积物环境,并造成大量悬浮物的扩散,引起海底泥沙再悬浮,使海洋中悬浮物含量增加。沉积物环境的改变、悬浮物以及其中有害物质的释放造成的二次污染如重金属等,直接对海洋生物资源造成了危害。为了探讨围填海工程对海洋生物资源的影响,我们开展了研究,通过结合室内模拟实验和渤海湾渔业资源发展动态,对围填海工程对海洋生物资源的影响进行了综述。
1 开发利用建设现状目前,天津市已形成海洋交通运输业、滨海旅游业、海洋油气业、海洋化工业等十大海洋产业,2010年天津市海洋生产总值为3088.4亿元,占天津市生产总值的33.9%,形成了传统产业和海洋生物、海水综合利用等与新兴产业结合的海洋工业基地。随着海洋开发活动的不断深入,天津围填海工程正在进一步加大。其中,以2007年和2009年围填海面积增长最为迅速(胡聪等, 2014)。据《天津市海洋功能区划2011-2020年》,从北至南就有汉沽工业与城镇用海区、滨海旅游休闲娱乐区、天津港港口航运区、临港经济区工业与城镇用海区、高沙岭工业与城镇用海区、南港工业与城镇用海区等围填海地区。
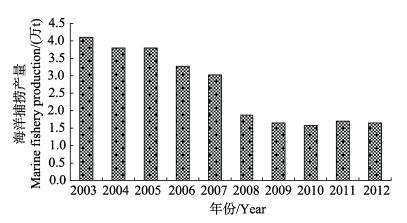
大规模的围填海工程,对环境造成负面的影响。由于释放了高浓度的固体物质,水体中悬浮物浓度升高,固体物质快速沉降,改变了沉积物的物理和化学特性(Neff, 2005; Patin, 1999; Smit et al, 2008)。在改变海洋水质环境的同时,破坏了海洋生物原有的栖息环境,影响了鱼类等的洄游规律和其他海洋生物的生存环境,渔获量减少(魏婷, 2014)。近些年来,天津市海洋捕捞量大幅下降。据《中国渔业统计年鉴》记载(农业部渔业局,2002-2012),2003-2012年天津市海洋捕捞产量呈逐年下降的趋势(图 1),其中以2008年下降最为迅猛,这也与2007年天津市进行的大规模的围填海活动相吻合。从2003-2012年,经济鱼类资源量下降了40%,甲壳类资源量下降了57%,底栖贝类资源量下降了63%,头足类下降了91%(表 1),前景令人担忧。
|
图 1 2003-2012年天津市海洋捕捞产量 Figure 1 Marine fishery production from 2003 to 2012 in Tianjin |
|
|
表 1 天津市渔业资源捕捞种类 Table 1 Species of Tianjin fishery resources |
围填海工程对底栖生物产生的负面影响最为直接。工程时产生的高浓度悬浮物影响滤食性贝类等底栖生物的摄食率和生理结构(Barillél et al, 1997)。工程作业后用海范围内的底质环境被破坏,海洋沉积物组分和分布特征发生变化,抑制海洋动物聚集(Bolam, 2011、2014, Bolam et al, 2003)、生物生境缩小,导致生物群落改变和渔业资源受损。围填海工程对底栖生物的破坏是不可逆转的,尤其是在沉积物中迁移能力弱的生物,如一些经济贝类,则更加敏感。
2.1.1 材料与方法本研究采用渤海湾吹填淤泥进行毛蚶和四角蛤蜊(Mactra veneriformis)的掩埋模拟实验,观测不同掩埋深度下两种经济贝类的致死情况。毛蚶和四角蛤蜊采自渤海湾天津海域滩涂。实验分别以4种不同规格A、B、C、D组(体长分别为1.0-2.0、3.0、4.0、5.0 cm)的毛蚶和两种不同规格E、F组(体长分别为2.0、4.0 cm)的四角蛤蜊为实验对象,将实验生物在水族箱中暂养3 d,挑选健康、活泼个体进行实验。
实验前,将25 cm×25 cm×25 cm的玻璃容器经高锰酸钾溶液消毒后用自然海水浸泡3 d,实验开始时将实验生物置于容器底部,并加入掩埋淤泥使其达到所设定深度。实验设定掩埋深度分别为0、2.0、4.0、6.0、8.0、10.0、12.0 cm。除A实验组每个容器中受试生物为40只外,其余均为24只。每组实验设两个平行,加新鲜海水至20 cm高度,其中对照组容器底部设置约为0.5 cm的薄层掩埋淤泥。每隔1 d观察1次实验生物存活数和死亡数,实验共持续8 d。期间定时定量投放饵料,并在投放饵料前用虹吸法更换新鲜海水,模拟潮汐变化。每天记录受试生物的死亡数量,将死亡生物取出。
实验期间,海水水温平均为(20.0±0.5)℃,海水pH值平均为8.0±0.3,盐度平均为23.6±0.5。实验吹填土铜、锌、铅、镉4种重金属含量均符合《海洋沉积物质量(GB18668-2002)》一类标准要求。
利用SPSS 19.0软件求出各梯度规格生物8 d的半致死浓度LC50及95%置信限,并对各组掩埋深度和样品死亡率进行线性回归分析。
2.1.2 结果与讨论毛蚶和四角蛤蜊在不同深度掩埋条件下的死亡率结果见表 2。掩埋淤泥对实验生物的致死深度及95%置信限深度见表 3。结果显示,毛蚶和四角蛤蜊被掩埋后均表现出垂直迁移行为,有些个体虽未迁移至沉积物表面,但会在其垂直位置的疏浚淤泥表面陷出气孔或伸出气管,这与Hale (1972)和Oliver等(1973)分别对北极蛤(Arctaca islandica)和大型双壳贝类(Tresus nuttallii)的研究结果一致。总的来说,毛蚶比四角蛤蜊的垂直迁移能力弱。随着体长的增加,生物迁移能力增强。在8 d的观察实验中,吹填土掩埋深度与各梯度贝类死亡率之间均有正相关关系(R2=0.850-0.969),说明随着掩埋深度的增加,死亡率逐渐增加。吹填土掩埋深度直接影响底栖生物种群存亡,其垂直迁移能力也可影响存活及种群重建几率。晁敏等(2007)通过使用长江口深水航道工程疏浚土模拟掩埋尖紫蛤(Sanguinolaria acuta)、文蛤(Meretrix meretrix),观测两种贝类对不同埋深的反应及其存活情况,其掩埋效果对生物体的影响结果与本研究结果相近。
|
|
表 2 实验生物在不同深度掩埋条件下的死亡率 Table 2 Average motality rates of experimental animals with different burial depth (%) |
|
|
表 3 预测掩埋淤泥对实验生物的致死深度及95%置信限深度 Table 3 Predictied of burial depth and the eorresponding 95% CI |
国外一些学者研究了悬浮物对底栖生物的影响。有研究表明,暴露在悬浮沉积物中,东部牡蛎(Crassostrea virginica)在卵粒阶段只能存活几个小时(Kirby, 1994),而北部圆蛤类(Mercenaria mercenaria)能存活12 h (Pratt et al, 1956)。高浓度悬浮物对双壳贝类的作用包括降低了净滤水率、以假粪的形式排出多余的物质。当悬浮物浓度超过了能被双壳贝类有效过滤的阈值,可用的食物得到稀释。在高泥沙地带,北部圆蛤类和东部牡蛎分别表现出了生长率降低和成活率减少,悬浮物对致死率的影响是非常高的。Leverone等(1995)的研究也表明,水体中高浓度的悬浮泥沙会造成一些贝类腮丝受到损伤、摄食率降低以及抗病性下降。
许多学者还研究了沉积物掩埋对底栖生物的影响。底栖生物的掩埋特性和效果由掩埋深度、掩埋速度、沉积物粒径、季节和种类耐受性比如生活习性、逃脱能力、低氧耐受性等等的不同而有差异。Maurer等(1980)研究了疏浚物掩埋对软体动物迁移和致死率的影响,其研究表明,随着沉积物深度、掩埋时间以及掩埋的沉积物与自然沉积物粒径差异大小的增加,死亡率是增加的。Maurer等(1978)的研究还表明,沉积物间隙水的化学性质在掩埋后的14 d内会有变化,期间溶解氧降低非常快。降低的原因归于无机氧化反应和呼吸作用。硫化物和氨氮含量在试验的1-7 d迅速增加,在8-14 d期间保持恒定。解释硫化物和氨氮的增加原因为沉积物中有机物质被细菌分解矿化。以细菌为媒介的降解能够向间隙水中释放各种新陈代谢产物包括氨氮、硫化物。Colby等(1967)研究表明,0.27 mg/L硫化氢对片脚类动物(Gammarus pseudolimnaeus)毒性非常大。Glude(1954)研究还表明,10℃时,在氧气不足、硫化氢存在条件下,双壳贝类耐受性最强,其次是腹足类、多毛类和甲壳类动物。通过对砂海螂(Mya arenaria)进行22 cm各种材质的沉积物掩埋实验结果显示,其存活率在淤泥中最低,在泥砂土中最高。存活率冬季高于夏季。在实验室试验中,Pfitzenmeyer等(1967)研究表明,砂海螂的挖掘率被温度直接影响,但只限于一定温度范围内和特定种类的双壳贝类。
不少学者研究了软体动物的形态学(比如壳长、厚度、形状、装饰和内部容积)与掩埋的关系。Stanley (1970)研究了大多数挖掘速度快者大致为盘状、叶片状、或者圆柱形,而不是球状。延长或削尖的贝壳常与其快速挖掘习性相一致。较大的装饰和厚的瓣膜以深度浅、速度慢的习性为特征。与Kranz (1972)形成对比,Stanley (1970)研究发现,深穴底内动物对于掩埋最不敏感。浅穴底内动物介于深穴和底上动物之间;Krenz (1972)和Stanley (1970)都表示双壳类足部形态与其逃脱能力高度相关。足部较短的双壳类或者利用足丝附着的双壳类一般没有挖掘能力。具有较大圆柱形肌肉发达的足部、往往占据了壳内大部分体积的双壳类,一般具有较强的挖掘能力;Pettibone (1963)对软体动物有过研究,多毛目环节动物具有明显不同的头部和高度发达的针刺、疣足和刺毛,一般认为是出色的挖掘手。停留在沉积物表面的多毛目环节动物与底内动物形成了鲜明对比,一般认为挖掘能力弱。
Kranz (1972)对30种瓣鰓纲动物受到掩埋后的挖掘行为进行了研究。生活习性在决定其逃离掩埋能力方面是非常重要的。底上食悬浮物动物,蛀虫和成年深度挖掘虹吸悬浮物动物一般不能逃离1 cm的掩埋深度,底内非虹吸食悬浮物动物能够逃离5 cm载荷,但一般不超过10 cm。浅穴居虹吸食悬浮物动物和幼年深穴虹吸食悬浮物动物能逃脱10-50 cm自然沉积物的掩埋。具有毒性的沉积物经常能使生物致死或者引起机体挖掘能力的降低。其研究还表明,每个种类的大个体双壳类动物在相同深度下显示出比小个体更高的迁移能力,与本研究结果相一致。
2.2 围填海工程对浮游生物的影响围填海工程引起的高浓度悬浮物使水体浑浊,限制了太阳辐射的垂直进入,光线衰减降低了能见度,缩短了光区深度,创造了大的无光区,并且能改变水柱中温度的垂直成层。白天只有最上面的几米水体能够被加热(Bruton, 1985)。由于透光层区域非常浅,浮游植物要在黑暗中度过较长的时间,光合作用减少(Lewis et al, 2001),在这段时间呼吸作用超过了光合作用,这些因素造成了低水平的初级生产力。同时,水体中的有机物和硫化物等有害物质含量升高,其降解过程消耗大量溶解氧。最终影响浮游植物的细胞分裂和生长,使浮游植物数量减少。
浮游动物和悬浮物浓度直接相关。悬浮物中的一些碎屑和无机固体物质可以妨碍浮游动物对食物的摄取,或者稀释肠中的内容物,从而减少对食物的吸收(宋伦等, 2012)。高浓度悬浮物导致的浮游植物生物量的减少,也将使以此为饵料的浮游动物的生长受到限制,并直接决定着食物链顶端大型游泳生物的数量分布,进而影响工程区域海洋生物的丰度、群落结构、生物多样性等,进而影响整个食物链。
2.2.1 材料与方法样品采自渤海湾天津海区吹填土样品,以卤虫(Artemia parthenogenetica)无节幼体为实验对象,用不同浓度的悬浮物进行急性毒性实验,测定悬浮物对卤虫无节幼体的96 h半致死浓度LC50。
卤虫无节幼体为丰年虫卵在适宜温度、盐度、光照条件下孵化24 h的个体,挑选出活泼、健康、大小一致的个体进行实验。
试验液配制:首先测定淤泥的干重/湿重比,然后根据所需配制的试验悬浮相的含量来计算并称取所需淤泥的重量,将定量淤泥溶于定量海水中,激烈搅拌30 min,过200目筛绢,静置不离心,取上层悬浊液用于实验。同时,取样测定悬浮物实际含量。每个实验浓度设1个平行组,每组设2个空白对照。实验重复1次。
实验期间,海水水温上下波动不超过1.0℃,海水pH值平均为7.96±0.05,盐度平均为27.8±0.7。实验所用沉积物铜、锌、铅、镉4种重金属含量均符合《海洋沉积物质量(GB18668-2002)》一类标准要求。
利用SPSS 19.0软件对试验结果进行直线回归处理,求得死亡率与悬浮物的浓度对数之间的关系表达式,并计算出悬浮物浓度对卤虫无节幼体和梭鱼幼鱼的24、48、72、96 h的半致死浓度LC50。安全浓度SC的计算公式如下:SC=0.1×96 h LC50。
2.2.2 结果与讨论悬浮物溶液对卤虫无节幼体的急性毒性试验结果见表 4。从表 4中可以看出,悬浮物溶液对卤虫无节幼体的24、48、72和96 h半致死浓度LC50分别为2281、1642、974和271 mg/L;安全浓度为27.1 mg/L。随着实验生物暴露于悬浮物中时间的延长,LC50在逐步下降。即悬浮物对于生物的危害性随着时间延长在不断增加。
|
|
表 4 悬浮物溶液对卤虫无节幼体的急性毒性试验结果 Table 4 The acute toxicity of the suspended solution on Artemia nauplii |
徐兆礼等(1999a)的研究表明,长江口疏浚弃土悬沙对微绿球藻和牟氏角毛藻生长有一定的抑制作用;徐兆礼等(1999b)还用长江口疏浚泥浸出液和悬浮液对小球藻和大型溞进行生长试验,结果显示,浓度分别为90%和100%疏浚泥的浸出液及100%的悬浮液对小球藻生长也有较强的抑制作用。Brett等(1998)研究表明,悬浮物可以降低多个溞属和其他一些枝角类的摄食率、生长率及竞争能力。
2.3 围填海工程对仔鱼和鱼卵的影响有研究表明,仔鱼比成年阶段对各种污染物更为敏感(曲克明等, 2002; Mckia, 1977)。悬浮物对鱼卵的伤害主要是对鱼卵进行的擦损(Wilbe et al, 2001)引起的胚胎发育异常和黏附在鱼卵周身导致的窒息死亡(高文斌等, 2009)。郑志华等(2008)的研究也表明,悬浮物对水生生物影响最大的主要是卵、稚仔和幼体)。
2.3.1 材料与方法本课题组在渤海湾天津海域采吹填土样品进行实验(陈永平等, 2015),实验鲈鱼(Lateolabrax japonicus)和梭鱼(Mugil soiuy)幼鱼采自天津市水产研究所养殖基地,幼鱼平均体长3.20 cm,平均体重为0.025 g。暂养10 d,然后挑选体型健壮、规格整齐的个体进行实验。实验开始前1 d停止投喂饵料。实验在50 cm×30 cm×22 cm水族箱中进行,实验前箱体用高锰酸钾溶液消毒,并用实验海水浸泡3 d。
在实验水族箱中加入10 L配置好的悬浮液,其浓度分别为0、10、40、160、640、1280和2560 mg/L。每个水族箱中分别放置20尾鲈鱼、梭鱼幼鱼,实验水温分别为(21.0±1.0)℃和(24.0±1.0)℃。实验开始后的12 h每隔1 h进行观察和记录,之后每隔12 h进行观察和记录1次。死亡标准为用细玻璃棒触动其腹部,5 s内没有任何反应,则视其为死亡。每组设置一组平行,每组两个空白对照。实验重复1次。
实验期间,海水水温上下波动不超过1.0℃,海水pH值平均为7.96±0.05,盐度平均为27.8±0.7。实验所用沉积物铜、锌、铅、镉4种重金属含量均符合《海洋沉积物质量(GB18668-2002)》一类标准要求。
以Lichfied-WiLCoxon法,计算悬浮物对鲈鱼、梭鱼幼鱼的半致死浓度LC50及95%置信区间,安全浓度SC的计算公式如下:SC=0.1×96 h LC50。
2.3.2 结果与讨论不同水温条件下悬浮物对鲈鱼、梭鱼幼鱼的急性毒性试验结果分别见表 5、表 6。结果显示,在相同水温条件下,随着在悬浮物中暴露时间的延长,幼鱼对悬浮物的敏感性逐渐增强;水温可影响幼鱼对悬浮物的耐受能力,随着水温的升高,鲈鱼、梭鱼幼鱼的LC50逐渐降低。这与李纯厚等(1997)、周勇等(2009)研究的悬浮物对鳞鲻鱼、半滑舌鳎胚胎及初孵仔鱼的毒性效应结果一致。两种生物的48 h LC50和96 h LC50与半滑舌鳎幼苗有较大差异,这可能是由于生物品种不同的原因,也可能是水体中有害物质的不同而导致的差异。与梭鱼幼鱼相比,鲈鱼幼鱼的48h LC50和96 h LC50均较大,这可能由于鲈鱼生物体对悬浮物毒性比梭鱼具有更强的耐受性,这个结果与金彩杏等(2002)研究的三唑磷农药对鲈鱼等鱼类的急性毒性试验结果相一致。
|
|
表 5 不同水温条件下悬浮物溶液对鲈鱼幼鱼的急性毒性试验(n=20) Table 5 The acute toxicity of the suspended solution to the L. japonicus larvae at different water temperatures |
|
|
表 6 不同水温条件下悬浮物溶液对梭鱼幼鱼的急性毒性试验(n=20) Table 6 The acute toxicity of the suspended solution to the M. soiuy larvae at different water temperatures |
王云龙等(1999a、b)通过研究长江口疏浚土悬沙对中华绒鳌蟹幼体发育和变态的试验研究表明,不同悬沙浓度会使蚤Ⅰ蜕皮变态推迟;其对疏浚作业后长江口悬浮物和溶出Zn2+对中华绒螯蟹产卵率和早期发育影响的研究表明,当悬浮物浓度低于8 g/L时,不会对中华绒螯蟹的交配、产卵和胚胎发育造成影响;当水中溶出Zn2+浓度超过197.8 μg/L时,则会对蚤状幼体的发育产生影响。
工程作业时机械设备本身也会对生物体造成负面影响。Wilbe等(2001)研究了5种鲑鱼、鱼卵、幼鱼在悬浮物浓度低于200 mg/L时的1-117 d的耐受反应,最大的致死率(超过75%)是由于工程作业时挖掘机水压刀盘引起的。
2.4 围填海工程对游泳动物的影响围填海工程也会对游泳动物造成一定影响。高浓度的悬浮物短期破坏了鱼类等游泳动物的进食行为,降低了其滤食率,阻止了它们得到远海和近海的食物资源,最终使其生长率以及成熟时个体大小和最大个体大小降低,并破坏了这些游泳动物生活的地方,迫使其重新部署下游没有受到干扰的地方。
高浓度悬浮物条件下,细颗粒悬浮物覆盖在鱼类的呼吸道上皮细胞上,由此阻断了与水中的气体交换。大颗粒的悬浮物质则随着鱼类的呼吸被腮部截留,沉积在鳃片、鳃丝及鳃小片上,封锁了水的通道,影响了其滤水和呼吸功能,最后导致窒息。在悬浮物中生活的鱼类缺氧反应主要表现为红细胞数量、血球容积和外围血的血色素浓度增加(Wilbe et al, 2001)。
当然,悬浮物并不是对所有游泳动物的影响都是有害的。通常认为,成鱼的游泳能力较强,施工作业造成的高浓度悬浮物质对成鱼的影响更多的表现为驱散效应(高文斌等, 2009)。在混浊的水体环境下有些游泳动物却大量繁殖,大概是降低了被侵袭的危险几率。在实验室环境下,与干净的水体相比,许多游泳动物更喜欢混浊的环境(Gradall et al, 1982, Cyrus et al, 1987),大概是混浊环境在某种情形下促进了其进食,同时避免了被攻击的危险。
3 结论吹填土对毛蚶和四角蛤蜊的掩埋实验结果显示,两种经济贝类被掩埋后均表现出垂直迁移行为。总的来说,毛蚶比四角蛤蜊的垂直迁移能力弱。随体长增加,生物迁移能力增强。随掩埋深度的增加,死亡率逐渐增加。
悬浮物对卤虫无节幼体的急性毒性实验表明,悬浮物溶液对卤虫无节幼体的96 h半致死浓度LC50为271 mg/L;安全浓度为27.1 mg/L。悬浮物对于生物的危害性随着时间延长不断增加。
悬浮物对两种经济鱼类的急性毒性实验表明,随着在悬浮物中暴露时间的延长,幼鱼对悬浮物的敏感性逐渐增强;水温可影响幼鱼对悬浮物的耐受能力,随着水温的升高,其耐受能力逐渐降低;生物品种不同,其对悬浮物的耐受能力也有较大差异。
近10年天津市海洋捕捞产量表明,海洋捕捞产量连续下降。其中,以2008年下降最为迅猛,与2007年进行的大规模围填海活动相吻合。生物品种以头足类资源量下降最迅速,其次是底栖贝类资源量,经济鱼类资源量下降最小。
4 建议(1) 开展舆论宣传,加强海洋环境和生物资源保护意识。海洋环境和生物资源的保护需要整个社会的广泛参与。这需要官方机构做大量的研究,并对海洋环境和资源的保护进行实施宣传和推广。民间也需要公益机构等组织的共同参与,增强公众参与海洋保护的自觉性和积极性。
(2) 切实加强围填海管理,合理安排围填海用海。健全完善海域管理相关措施,增强海洋功能区划的控制工作。严格执行围填海用海预审制度,凡是未通过用海预审的围填海项目,各级投资主管部门不能予以审批、核准。继续完善和推进围填海工程用海规模控制标准,加强对海岸线的使用进行监管,促进节约集约使用海域资源。
(3) 改变围填方式并避开产卵期施工。在围填海施工过程中,一次性大量投入沉积物往往比定期多次投放对底质的结构组成造成更剧烈影响。因此施工过程应考虑改变围填方式,合理安排施工,适度进行填埋。每年的5、6月正是渤海湾鱼虾贝产卵盛期,而工程施工对鱼虾贝卵粒及幼体伤害最大。因此,施工应考虑避开产卵期。最好在秋冬季施工。
(4) 加强围填海动态监测。对围填海区域进行动态监测,对围填海项目的环境和资源影响进行评价,分析围填海工程对海洋环境和生物资源产生的长远影响。对围填海工程带来的负面影响提出相应的保护措施。
(5) 进行增殖放流和投放人工鱼礁。引导和督促相关部门加大增殖放流力度。同时,为加速恢复海洋生态环境和渔业资源,充分发挥人工鱼礁区功能,加大趋礁性品种如鱼类、头足类、底栖贝类等的增殖放流。
| 王云龙, 成永旭, 徐兆礼, 等. 长江口疏浚土悬沙对中华绒鳌蟹幼体发育和变态的影响. 中国水产科学 , 1999a, 6 (5) : 20-23 | |
| 王云龙, 成永旭, 徐兆礼, 等. 长江口疏浚土悬浮物及其溶出Zn2+对中华绒螯蟹产卵率和早期发育的影响. 中国水产科学 , 1999b, 6 (5) : 24-28 | |
| 农业部渔业局. 《中国渔业统计年鉴》. 北京: 中国农业出版社, : 2002 -2012. | |
| 曲克明, 陈民山, 马绍赛, 等. 几种工业废水对牙鲆仔稚鱼的急性毒性及联合毒性作用. 海洋水产研究 , 2002, 23 (4) : 40-45 | |
| 陈永平, 王娟娟, 李兆千, 等. 天津港口疏浚淤泥悬浮物对海洋动物的急性毒性效应. 河北渔业 , 2015, 1 : 8-12 | |
| 李纯厚, 林燕棠, 杨美兰, 等. 南海海港疏浚淤泥悬浮物对海洋动物的急性毒性效应. 中国环境科学 , 1997, 17 (6) : 550-553 | |
| 宋伦, 杨国军, 王年斌, 等. 悬浮物对海洋生物生态的影响. 水产科学 , 2012, 31 (7) : 444-448 | |
| 金彩杏, 丁跃平, 刘士忠, 等. 三唑磷农药对鲈鱼等鱼类的急性毒性试验. 水产科技情报 , 2002, 29 (4) : 156-158 | |
| 周勇, 马绍赛, 曲克明, 等. 悬浮物对半滑舌鳎胚胎和初孵仔鱼的毒性效应. 渔业科学进展 , 2009, 30 (3) : 33-37 | |
| 周勇, 马绍赛, 曲克明, 等. 悬浮物对半滑舌鳎稚鱼的急性毒性效应. 海洋环境科学 , 2010, 29 (2) : 229-230 | |
| 胡聪, 于定勇, 赵博博. 天津滨海新区围填海工程对海洋资源影响评价. 海洋环境科学 , 2014, 33 (2) : 214-219 | |
| 郑志华, 徐碧华. 航道疏浚中悬浮泥沙对海水水质和海洋生物影响的数值研究. 上海船舶运输科学研究所学报 , 2008, 31 (2) : 105-110 | |
| 高文斌, 刘修泽, 段有洋, 等. 围填海工程对辽宁省近海渔业资源的影响及对策. 大连水产学院学报 , 2009, 24 (S1) : 163-166 | |
| 徐兆礼, 易翠萍, 沈新强, 等. 长江口疏浚弃土悬沙对2种浮游植物生长的影响. 中国水产科学 , 1999a, 6 (5) : 33-36 | |
| 徐兆礼, 许加武, 袁骐, 等. 长江口疏浚泥浸出液、悬浮液对浮游生物的影响. 中国水产科学 , 1999b, 6 (5) : 29-32 | |
| 晁敏, 沈新强, 陈亚瞿. 长江口疏浚土掩埋对两种贝类存活的影响. 应用与环境生物学报 , 2007, 13 (5) : 674-677 | |
| 魏婷. 连云港围填海工程对海洋生态环境的影响及防治对策研究. 国土资源情报 , 2014, 6 : 22-27 | |
| Barillél prou J, Héral M, et al. Effects of high natural seston concentration on the feeding, selection, and absorption of oyster Crassostrea gigas (Thunberg). J Exp Mar Biol Ecol , 1997, 212 (2) : 149-172 DOI:10.1016/S0022-0981(96)02756-6 | |
| Bolam SG. Macrofaunal recovery following the intertidal recharge of dredged material: A comparison of structural and fun-ctional approaches. Mar Environ Res , 2014, 97 : 15-29 DOI:10.1016/j.marenvres.2014.01.008 | |
| Bolam SG., Whomersley P. Invertebrate recolonization of fine-grained beneficial use schemes: an example from the south-east coast of England. J Coast Conser , 2003, 9 (2) : 159-169 DOI:10.1652/1400-0350(2003)009[0159:IROFBU]2.0.CO;2 | |
| Bolam SG. Burial survival of benthic macrofauna following deposition of simulated dredged material. Environ Monit Assess , 2011, 181 (1) : 13-27 | |
| Bruton MN. The effects of suspensoids on fish. Hydrobiologia , 1985, 125 (1) : 221-241 DOI:10.1007/BF00045937 | |
| Colby PJ, Smith LL. Survival of wall eye eggs and fry on paper fiber sludge deposits in Rainy River, Minnesota. Trans Am Fish Soc , 1967, 96 (3) : 278-296 DOI:10.1577/1548-8659(1967)96[278:SOWEAF]2.0.CO;2 | |
| Cyrus DP, Blaber SJM. The influence of turbidity on juvenile marine fishes in estuaries.Part 2. Laboratory studies, comparisons with field data, and conclusions. J Exp Mar Biol Ecol , 1987, 109 (1) : 71-91 DOI:10.1016/0022-0981(87)90186-9 | |
| Glude JB. Survival of soft-shell clams, Mya arenaria, buried at various depths. Bull Dept Sea Shore Fish Res Bull , 1954, 22 : 1-6 | |
| Gradall KS, Swenson WA. Responses of brook trout and creek chubs to turbidity. Trans Am Fish Soc , 1982, 111 (3) : 392-395 DOI:10.1577/1548-8659(1982)111<392:ROBTAC>2.0.CO;2 | |
| Hale SS. Some reactions of the ocean quahog Arctica islandica upon burial. Graduate School of Oceanography, URI, Kingston, RI. Mimeo Report, 1972 | |
| Kirby R. Sediments 2-oysters 0: the case histories of two legal disputes involving fine sediment and oysters. J Coastal Res , 1994, 10 (2) : 466-487 | |
| Kranz PM. The anastrophic burial of bivalves and its paleoecological significance. Jgeov , 1974, 82 (2) : 237-265 | |
| Leverone JR, et al. Growth and survival of caged adult bay scallopa (Argopecten irradians concentricus) in Tampa Bay with respect to levels of turbidity, suspended solids and chlorophyll a. Florida Science , 1995, 58 (2) : 216-227 | |
| Lewis MA, Weber DE, Stanley RS, et al. Dredging impact on an urbanized Florida bayou: effects on benthos and algal-periphyton. Environ Pollut , 2001, 115 (2) : 161-171 DOI:10.1016/S0269-7491(01)00118-X | |
| Maurer DL, Keck RT, Tinsman JC, et al. Vertical migration of benthos in simulated dredged material overburdens Vol 1: marine benthos. Technical Report , 1978 : 1-97 | |
| Maurer DL, Keck RT, Tinsman JC, et al. Vertical migration and mortality of benthos in dredged material-part I: mollusca. Mar Environ Res , 1981, 4 (4) : 299-319 DOI:10.1016/0141-1136(81)90043-X | |
| Neff JM. Composition, environmental fates, and biological effect of water based drilling muds and cuttings discharged to the marine environment: A synthesis and annotated bibliography. Technical Report. Battelle, Duxbury, MA, USA, 2005 | |
| Oliver JS, Slattery PN. Dredging, dredge spoil disposal and benthic invertebrates in Monterey Bay. Moss Landing Mar Lab Rept , 1973, 130 | |
| Patin S. Environmental impact of the offshore oil and gas industry. New York: S. Patin. Ecomonitor Publishing, 1999 . | |
| Pettibone MH. Marine polychaetes worms of the New England region. I. Aphroditidae through Trochochaetidae. Bull U. S. Nat Mus , 1963, 277 (1) : 1-356 | |
| Pftizenmeyer HT, Drobeck KG. Some factors influencing reburrowing activity of soft-shell clam, Mya arenaria. Ches Sci , 1967, 8 (3) : 193-199 DOI:10.2307/1351384 | |
| Pratt DM, Campbell DA. Environmental factors affecting growth in Venus mercenaria. Limnol Oceanogr , 1956, 1 (1) : 2-17 DOI:10.4319/lo.1956.1.1.0002 | |
| Smit MGD, Holthaus KIE, Trannum HC, et al. Species sensi-tivity distributions for suspended clays, sediment burial, and grain size change in the marine environment. Env-iron-Toxicol Chem , 2008, 27 (4) : 1006-1012 DOI:10.1897/07-339.1 | |
| Stanley SM. Relation of shell form to life habits in the Bivalvia (Mollusca). Geol Soc Amer Mem , 1970, 125 : 296 | |
| Wilbe DH, Clarke DG. Biological effects of suspended sediments: A review of suspended sediment impacts on fish and shellfish with relation to dredging activities in estuaries. Nor Am J Fish Manage , 2001, 21 (4) : 855-875 DOI:10.1577/1548-8675(2001)021<0855:BEOSSA>2.0.CO;2 |



