2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所碳汇渔业实验室 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Dalian Ocean University 116023 ;
3. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture; Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
4. College of Fisheries and Life Science, Shanghai Ocean University 201306
我国是世界第一养殖大国,据统计,2013年藻类养殖面积约为119.23×103 hm2,年产量达163.65万t。其中海带(Sacharina japonica)的产量稳居所有藻类的首位(2012渔业统计年鉴)。养殖的大型藻类因生长速度快,生物量大的特点(毛玉泽等, 2005),通常成为浅海养殖生态系统的优势种,在浅海营养物质循环中发挥重要作用(Naldi et al, 2002)。大型藻类被称为是最具潜力的生物净化器,其在光合作用过程中,不仅能够利用二氧化碳,释放氧气,同时也利用水体中的溶解性无机氮和磷,起到净化水质的作用(沈淑芬等, 2013)。而通过收获,可使海域中的C、N、P等被有效地移除(Mcvey et al, 2002)。然而,在养殖过程中大型藻类会部分脱落,并且在进入衰亡期后,藻体的梢部会逐渐腐烂分解。脱落后死亡及衰亡期的大型藻类发生腐烂,不仅改变水体的物理化学性质、消耗氧气,同时向水体中释放出大量的营养盐(C、N、P、Si等),这一过程会引起水环境产生较大变动,进而会对海洋生态系统的稳定性产生影响。目前,关于海带养殖、生长、光合作用等方面的研究较多(Delille et al, 2009; Kregting et al, 2013),对于其腐烂降解速率及影响因素的研究鲜有报道。本研究在实验室可控条件下,选择桑沟湾主要养殖大型藻类——海带作为研究对象,测定了海带的腐烂降解速率以及底质、溶解氧对海带的降解速率的影响,以期为了解养殖藻类在养殖生态系统物质循环中的作用提供基础数据。
1 材料与方法 1.1 样品采集2014年7月31日于桑沟湾海带养殖区取生长良好的海带,尽快运回实验室。用干净海水清洗,去除衰老死亡植株及其他附着藻类后,每10 cm剪取一段并从中带部剪开备用。用抓斗式采泥器采集桑沟湾藻类养殖区表层沉积物(0-10 cm),去除动植物残体和砾石后,混匀冷藏备用(4℃)。同时,用采水器采集表层海水备用。
1.2 实验方法 1.2.1 实验分组情况Ⅰ为海水对照组;Ⅱ为海带+海水;Ⅲ为底泥+海带+海水;Ⅳ为底泥+海带+厌氧条件+海水;Ⅴ为底泥+海水。实验组中海带湿重均为50 g。
1.2.2 实验分两个部分1.底质(加底泥,无底泥)对海带降解过程的影响(实验组Ⅱ以Ⅰ为对照组,实验组Ⅲ以Ⅴ为对照组);2.水中溶解氧含量(正常海水、厌氧条件)对海带降解过程的影响(实验组Ⅲ、Ⅳ,以Ⅴ为对照组)。每组设置3个重复。
1.2.3 具体操作实验采用5.5 L塑料桶,塑料桶外壁覆黑纸以避免光照产生的影响。按照分组设置,加入底泥的实验组操作为:准确称取0.30 kg沉积物均匀平铺于塑料桶底部,然后放入50 g海带,并向所有塑料桶中缓慢注入5 L的过滤海水。除厌氧处理组外,每个塑料桶放置1个气石,分别悬挂于塑料桶中间部位适量充气防止底泥上浮,确保各气石位置相同,充气量一致。实验过程中,监测离水体表面3 cm处的pH、溶解氧(DO)、盐度等指标变化情况。根据藻类降解变化情况定期在距水泥界面3 cm处虹吸法取150 ml水样,分析上覆水中各类营养盐成分变化情况。实验监测共27 d,从2014年8月1日开始,期间第3、9、15、21、27天取得实验水样。
1.3 样品分析按GB17378-2007《海洋监测规范》规定的方法进行样品的采集、处理和保存。DO、水温和盐度等指标使用YSI水质分析仪Pro 10(美国)测定。实验水样经0.45 μm醋酸纤维滤膜过滤后,分别采用碱性过硫酸钾氧化法、过硫酸钾氧化法、次溴酸钠氧化法、锌-镉还原法及重氮-偶氮法测定TN、TP、铵盐(NH4+-N)、硝酸盐(NO3-N)及亚硝酸盐(NO2-N);采用磷钼蓝法测定DIP。DIN=NH4+-N+NO3-N+NO2-N;DON=TN-DIN;DOP=TP-DIP
1.4 数据分析与计算方法海带降解过程营养盐的释放速率根据以下公式计算:
| $ R = \frac{{{W_n} - {C_0}{V_0}}}{{{A_0} \cdot t}} $ |
| $ {W_n} = {C_n}\left[ {{V_0} - \left({n - 1} \right){V_{取}}} \right] + \sum\limits_{i = 1}^{n - 1} {{C_{i - 1}}{V_{取}}} $ |
式中, R为上覆水营养盐的释放速率(μmol/g·d);Wn为第n次取样时上覆水营养盐含量(μmol);C0、V0分别为初始营养盐浓度和水样体积;A0为实验海带初始质量(g);t为实验天数(d);Cn为第n次采样测得营养盐浓度(μmol/L);V取为每次取样水体体积(L);Ci-1为i-1次取样时水体营养盐浓度(μmol/L)。
测定实验组各营养盐浓度需减掉其对照组浓度以比较底质、DO在不同条件下个营养盐的变化规律。
采用SPSS16.0统计软件进行统计学分析,单因子方差分析(One-way ANOVA)检验组内差异,P<0.05视为差异显著,P<0.01视为差异极显著。
2 结果与分析实验过程中海水的温度、DO、pH、盐度等水质参数见表 1。
|
|
表 1 实验过程中水温、溶解氧、盐度、pH的变化 Table 1 Variations of temperature, dissolved oxygen, salinity and pH in the experiment |
总体来看,海带降解的速率加底泥组(Ⅲ组)大于未加底泥组(Ⅱ组),并且,降解过程中,不同元素(N、P)释放速率不同(图 1)。在第9天时,Ⅲ组的DIN显著高于Ⅱ组(P < 0.01)。但是,Ⅱ组、Ⅲ组上覆水中的DIP、TP浓度没有显著的变化;在第15天时,Ⅲ组的TN、TP、DIN、DIP都显著高于Ⅱ组(P < 0.01)。在实验结束时,加底泥组的水体中,TP、DIN、DIP的含量都显著高于未加底泥组(P < 0.01),但是TN没有显著性差异(P > 0.05)。
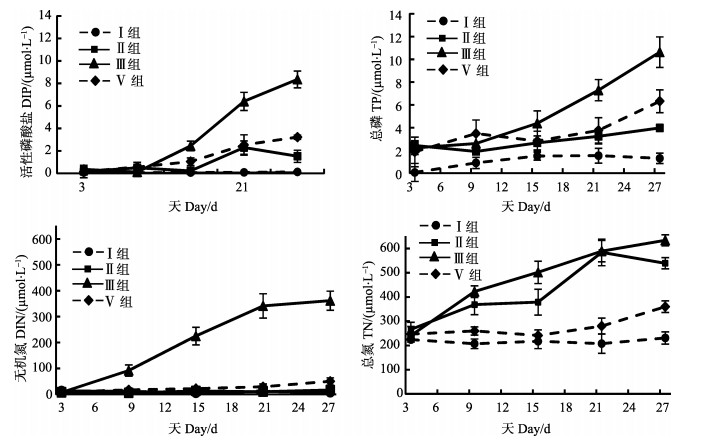
|
图 1 底泥对水体中DIP、TP、DIN、TN浓度的影响 Figure 1 The effects of sediment on the concentrations of DIP, TP, DIN and TN in water |
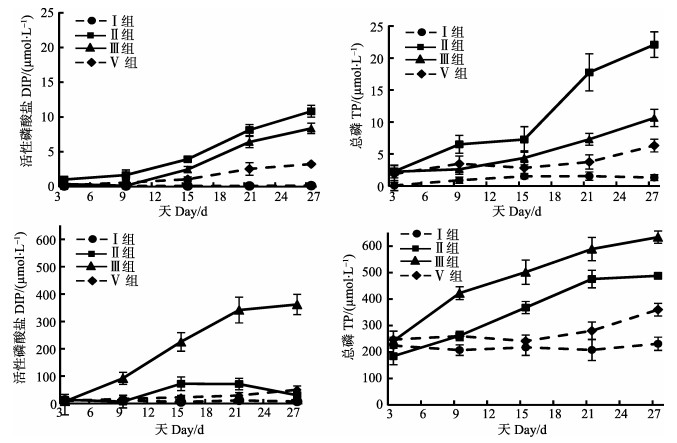
|
图 2 DO对水体中DIP、TP、DIN、TN浓度的影响 Figure 2 The effects of dissolved oxygen on the concentrations of DIP, TP, DIN and TN in water |
Ⅱ组、Ⅲ组中,海带的降解程度不同。对于N来讲,Ⅲ组中,DIN占TN的比例由开始的3%增至实验结束时的57%;而Ⅱ组没有明显的增加。对于P,Ⅲ组的DIP与TP的比值由初始的16%增至78%;Ⅱ组增至38%。
底泥的加入,影响海带降解产生的DIN组成。总体来讲,DIN的组成以硝酸盐为主,其次为氨氮。氨氮在溶解无机氮中的比例,Ⅱ组由初始的25%降至结束时的17%,Ⅲ组降至14%,最终的比例差异不大。但是,第9天时,出现了相反的现象,Ⅱ组的比例急剧上升至44%,Ⅲ组则降至5%。
由TN的变化趋势图(图 1)可以看到,两组处理TN曲线变化规律与DIN、DIP及TP的变化趋势不同,Ⅱ组、Ⅲ组上覆水中TN的含量都显著增加。虽然在实验结束时,Ⅲ组的TN略高于Ⅱ组,但是差异不显著(P > 0.05)。
海带的降解极大地改变了水体营养盐结构,Ⅱ组、Ⅲ组处理N:P比范围分别为(4.44±0.04)-(52.14±9.47);(20.39±2.92)-(736.47±121.54)(表 2),远远偏离经典Redfield值(N:P=16:1)。Ⅲ组N:P呈现先增加到最大值为736.47±121.54后,逐渐降低到39.75±3.97的趋势。底泥的加入使的N:P变化更明显,Ⅲ组N:P平均值为207.83±301.37,明显高于Ⅱ组的27.14±25.14。
|
|
表 2 水体中氮磷比随时间的变化 Table 2 The time course of the N:P ratio |
溶解氧对上覆水中TN、TP、DIN浓度有显著的影响(P < 0.05),然而,其对N、P的作用趋势刚好相反。对于P,不论是DIP,还是TP,都是厌氧组(Ⅳ组)高于正常组(Ⅲ组);对于N,却是Ⅲ组高于Ⅳ组。
对于Ⅳ组,上覆水中TP在第21天迅速增大,在实验结束时,TP达22.10 μmol/L,是Ⅲ组的2.1倍;但是,DIP在TP中的比例没有显著变化,仅由初始的44%增至48%;而Ⅲ组,DIP在TP中的比例增至78%。表明Ⅳ组中,有机磷的含量较高,降解不充分。
虽然两组处理中,TN的变化趋势相近,但是,因Ⅲ组中DIN的迅速增加,使得Ⅲ组与Ⅳ组中DIN占TN的比例显著不同。实验结束时,Ⅳ组中DIN/TN为6%,而Ⅲ组的比例高达57%。
分析Ⅲ、Ⅳ组N:P的结果显示(表 3),其对水体N:P的影响正好相反,Ⅲ组中海带的降解显著提高了水体的N:P。而厌氧状态下,水体N:P逐渐降低,到27 d时仅为2.36±0.54。实验周期内平均值为9.38±6.55。水体营养盐结构同样发生明显改变。
|
|
表 3 水体中氮磷比随时间的变化 Table 3 The time course of the N:P ratio |
分析整个实验过程中上覆水N、P的释放速率(表 4),对于Ⅲ组,TN、TP、DIN、DIP 27d内释放速率分别为1.802、0.033、1.234、0.028 μmol/(g·d)均高于Ⅱ组的1.476、0.010、0.039、0.005 μmol/(g·d)。而对于DON,Ⅱ组的1.437 μmol/(g·d)却显著高于Ⅲ组的0.568 μmol/(g·d)。TN浓度低的情况下具有更高的DON浓度,表明底泥的加入大大增加了DON转化为DIN的速率。Ⅱ、Ⅲ组之间DOP的降解速率同为0.005 μmol/(g·d)。由于海带组织本身N、P含量的不同,因而海带N、P降解速率存在较大差别。
|
|
表 4 不同处理条件下上覆水各营养盐释放速率 Table 4 Nutrient release rates under different conditions [μmol/(g·d)] |
Ⅳ组P的释放(TP、DIP、DOP)要显著高于Ⅲ组,厌氧状态促进了P的释放。对于TN、DIN却与之相反,特别指出的是Ⅳ组DIN释放通量为0.097 μmol/(g·d),仅为Ⅲ组DIN的8%,而此过程TN为Ⅲ组的71%。即厌氧状态下抑制了DIN的释放,从而使得水体DON上升明显。Ⅳ组DON释放速率为1.178 μmol/(g·d),显著高于Ⅲ组的0.568 μmol/(g·d)。
分析不同时间段内释放速率可知,各营养盐因子释放速率总体呈现前半段快于后半段的规律,降解速率随时间增长逐渐放缓,只有在Ⅳ组厌氧状态下的P呈现不同的态势,其降解速率随时间而逐渐增大。
3 讨论 3.1 海带降解过程的影响因素大型藻类的降解分为两个阶段,第一阶段是低分子物质的渗出,第二阶段是结构物质的降解(Taylor et al, 1999);并且,通常第一阶段的降解速率较高(Lillebø et al, 1999)。本研究的结果与此相一致。在降解的前3 d,营养盐释放通量较高,尤其是DON、DOP的释放通量远远高于DIN、DIP的释放,可能是大量低分子物质从细胞中渗出的缘故。
藻体的降解受多种因素的影响,如底质、沉积物中微生物的分布、DO状况及周边环境的温度等(周俊丽等, 2006; 张菊等, 2011)。
微生物是影响大型藻类等有机物降解的主要因素之一。通常,底泥因含有丰富的营养物质,成为微生物生长繁殖的场所(张沛东等, 2014)。底泥中由于微生物的存在而参与海洋生态系统的物质循环和能量流动,通过微生物的同化作用和异化作用分解藻类残体而形成海底生态系统的C循环、S循环、N循环(赵兴青等, 2008),进而影响海洋生态系统中的营养盐及分布、转化(Cromey et al, 2002)。本研究发现,Ⅴ组仅添加底泥的海水DIP、TP、DIN、TN浓度相对应对照组Ⅰ组有明显的升高,即底泥自身的营养盐成分通过微生物的化学作用下释放出来。添加底泥的实验Ⅲ组,海带的降解速度显著高于未加底泥的实验Ⅱ组,可能与添加底泥带入大量的微生物有关。
溶解氧影响有机物的降解速率及过程。通常,在有氧条件下,通过好氧细菌的作用,有机物可以彻底氧化分解,发生化学反应为:(CH2O)106(NH3)16H3PO4+ 138O2 → 106CO2 + 16HNO3 + 122H2O + H3PO4 (Redfield et al, 1963)。同时Fe3+与P结合,以FePO4形成沉积。从而抑制磷的释放(Span et al, 1990)。而在厌氧状态下,厌氧细菌的作用下,发生化学反应:(CH2O)106(NH3)16H3PO4+84.8HNO3→106CO2+42.4N2+ 148.4H2O+16NH3+H3PO4并继续发生脱氮作用,5NH3+ 3HNO3→ 4N2 + 9H2O(Jahnke et al, 1982),从而降低水体中N含量,同时不溶性的Fe(OH)3变成可溶性的Fe(OH)2,使与Fe结合的P大量释放进入水体(Beltrami et al, 1999)。本研究中,厌氧处理Ⅳ组在P的释放速率方面要超过充气处理Ⅲ组,而在N的释放速率方面要显著低于正常充气Ⅲ组。实验结果与实验条件(好氧、厌氧)显著相关。
3.2 海带降解过程对水质的影响温度波动范围为19.6-22.7℃。正常充气组处理DO波动范围为4.53-6.36 mg/L。厌氧组处理DO迅速下降至0.25 mg/L以下。除厌氧组外,各组pH均处于正常水体pH范围内。厌氧组的pH出现了下降趋势,平均值为6.93±0.39,可能原因为厌氧状态下,海带碎屑等分解不充分时,就会产生和积累各种有机酸,主要是腐殖酸,从而使水体的pH降低。
在6-7月,大量海带碎屑的腐烂降解,营养盐短时间的集中释放,可能会影响水质(唐金艳等,2013),刺激浮游植物的生长,有诱发赤潮的潜在危险。本研究中在不同底质、DO条件下,上覆水中C、N相较于对照组在27 d内浓度都迅速提高。TN、TP分别较开始阶段扩大了2.01-2.65、1.61-9.77倍。实验Ⅲ组中,DIN、TN、DIP、TP浓度变化都极为显著。实验Ⅳ组除DIN外,其余营养盐浓度同样迅速提高。
海带碎屑的降解,不仅对营养盐浓度有影响,而且由于海带降解过程中氮磷释放的速率不同,会使氮磷比发生较大改变。实验中Ⅱ、Ⅲ、Ⅳ组N:P比对照组发生明显变化,远远偏离经典Redfield值。而营养盐结构的改变,会对浮游生物的组成、数量、种类、优势种等产生深远影响。孙晓霞等(2011)研究发现,10余年来胶州湾营养盐结构发生巨大变化,浮游植物种类随之减少,数量迅速降低。谢琳萍等(2012)证实黄渤海营养盐结构变化,N/P、Si/N和Si/P比值均偏离Redfield比值,浮游生物的生长受到影响。营养盐结构的变化将引起营养盐同时或交替限制浮游生物生长的现象(张辉等, 2009)。
海带碎屑的降解是复杂的过程,不仅与外界环境因子,诸如温度、盐度、摄食生物等有关,而且,还受海带自身的元素组成等因素的影响。海带在养殖生态系统中的生态功能还有待进一步研究。
4 结论(1) 底质对海带降解过程DIN、TN、DIP、TP的释放速率具有显著影响,添加底泥实验组营养盐浓度显著高于未加底泥实验组。
(2) DO条件不同,营养盐的释放存在较大差异。好氧条件,促进氮的释放(DIN、TN),厌氧条件,促进海带组织磷(DIP、TP)的释放。
(3) 海带碎屑的降解过程显著改变了水体营养盐的浓度和结构,特别是有底泥参与条件下,水体营养盐浓度迅速提高,N/P变化更为显著。
(3) 海带碎屑的降解过程显著改变了水体营养盐的浓度和结构,特别是有底泥参与条件下,水体营养盐浓度迅速提高,N/P变化更为显著。
| 毛玉泽, 杨红生, 王如才. 大型藻类在综合海水养殖系统中的生物修复作用. 中国水产科学 , 2005, 12 (2) : 225-231 | |
| 孙晓霞, 孙松, 赵增霞, 等. 胶州湾营养盐浓度与结构的长期变化. 海洋与湖沼 , 2011, 42 (5) : 662-669 | |
| 沈淑芬, 魏婷, 孙琼花, 等. 海带对罗源湾养殖区海水的生物修复研究. 福建师范大学学报(自然科学版) , 2013, 29 (4) : 103-108 | |
| 张辉, 石晓勇, 张传松, 等. 北黄海营养盐结构及限制作用时空分布特征分析. 中国海洋大学学报 , 2009, 39 (4) : 773-780 | |
| 张菊, 邓焕广, 王东启, 等. 不同温度条件下徒骇河沉水植物腐烂对上覆水体中营养盐浓度的影响. 水资源保护 , 2011, 27 (4) : 22-26 | |
| 张沛东, 张倩, 张秀梅, 等. 底质类型对中国明对虾存活、生长及行为特征的影响. 中国水产科学 , 2014, 05 : 1079-1086 | |
| 国家海洋标准计量中心, 国家海洋局第一海洋研究所, 国家海洋局第二海洋研究所. GB 17378–2007海洋监测规范.北京:中国标准出版社, 2008 | |
| 周俊丽, 吴莹, 张经, 等. 长江口潮滩先锋植物草腐烂分解过程研究. 海洋科学进展 , 2006, 24 (1) : 44-50 | |
| 赵兴青, 杨柳燕, 尹大强, 等. 不同空间位点沉积物理化性质与微生物多样性垂向分布规律. 环境科学 , 2008, 12 : 3537-3545 | |
| 唐金艳, 曹培培, 徐驰, 等. 水生植物腐烂分解对水质的影响. 应用生态学报 , 2013, 24 (1) : 83-89 | |
| 谢琳萍, 孙霞, 王保栋, 等. 渤黄海营养盐结构及其潜在限制作用的时空分布. 海洋科学 , 2012, 09 : 45-53 | |
| Beltrami M, Rossi D, Baudo R. Phytotoxicity assessment of Lake Orta sediments. Aquat Ecosyst Health , 1999, 2 (4) : 391-401 DOI:10.1080/14634989908656977 | |
| Cromey CJ, Nickell TD, Black KD. DEPOMOD—modelling the deposition and biological effects of waste solids from marine cage farms. Aquaculture , 2002, 214 (1-4) : 211-239 DOI:10.1016/S0044-8486(02)00368-X | |
| Delille B, Borges AV, Delille D. Influence of giant kelp beds (Macrocystis pyrifera) on diel cycles of pCO2 and DIC in the Sub-Antarctic coastal area. Estuarine, Estuar Coast Shelf Sci , 2009, 81 (1) : 114-122 DOI:10.1016/j.ecss.2008.10.004 | |
| Jahnke RA, Emerson SR, Murray JW. A model of oxygen reduction, denitrification, and organic matter mineralization in marine sediment. Limnol Oceanogr , 1982, 27 (4) : 610-623 DOI:10.4319/lo.1982.27.4.0610 | |
| Kregting L, Blight A, Els er B, et al. The influence of water motion on the growth rate of the kelp Laminaria hyper borea. J Exp Mar Biol Eol , 2013, 448 (4) : 337-345 | |
| Lilleb AI, Flindt MR, Pardal MA, et al. The effect of macrofauna, meiofauna and microfauna on the degradation of Spartina maritima detritus from a salt marsh area. Acta Oecol , 1999, 20 (4) : 249-258 DOI:10.1016/S1146-609X(99)00141-1 | |
| Mcvey JP, Stickney RR, Yaris C, et al. Aquatic poly culture and balanced ecosystem management: new paradigms in seafood production. In: Stickney RR, McVey JP(eds), Responsible Marine Aquaculture. Oxon: CABI Publishing, 2002: 91–104 http://www.marineagronomy.org/node/165 | |
| Naldi M, Viaroli P. Nitrate uptake and storage in the seaweed Ulva rigida C. Agardh in relation to nitrate availability and thallus nitrate content in a eutrophic coastal lagoon (Sacca di Goro, Po River Delta, Italy). J Exp Mar Biol Ecol , 2002, 269 (1) : 65-83 DOI:10.1016/S0022-0981(01)00387-2 | |
| Redfield AC, Ketchup BH, Richards FA. The influence of organisms on the composition of seawater. In: Hill, MN(ed), The Sea. London: Wiley-Interscience, 1963: 26–77 http://citeseerx.ist.psu.edu/showciting?cid=4537093 | |
| Span D, Dominik J, Loizeau JL, et al. Phosphorus trapping by turbidites in deep-lake sediments. Chem Geol , 1992, 102 (1-4) : 73-82 DOI:10.1016/0009-2541(92)90147-W | |
| Taylor MR, Harrison PTC. Ecological effects of endocrine disrup tion: Current evidence and research priorities. Chemosphere , 1999, 39 (8) : 1237-1248 DOI:10.1016/S0045-6535(99)00191-5 |



