2. 南京农业大学无锡渔业学院 无锡 214081
2. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214081
生物絮团技术(Bio-floc technology)是一种新兴的改善养殖水质的生态养殖技术。生物絮团作为微生物的集合体,在生态系统的微生物循环、生物地球化学过程以及生态调控中起着重要作用(包卫洋等, 2009)1)。李卓佳等(2008)把生物絮团作为对虾养殖系统各种物质循环中非常重要的一环,其在养殖池塘中不仅可以降低氨氮和亚硝酸盐氮等有害物质,净化水体;而且能够作为生物饵料,从而降低饲料系数。生物絮团的形成和维持既解决了养殖水体有害物质积累问题,又提高了蛋白质的利用效率,降低了养殖生物对饲料的需要量,增加了收益(Avnimelech, 1999、2007)。生物絮团技术已经成功应用在斑节对虾(Penaeus monodon)、凡纳滨对虾(Litopenaeus vannamei)等高密度养殖对虾的养殖中(Anand et al, 2013、2014; Burford et al, 2004; Xu et al, 2012; 邓应能等, 2012; 张许光等, 2013),近年来在我国罗非鱼(Oreochromis niloticus × Oreochromis aureus)、草鱼(Ctenopharyngodon idellus)、鳙鱼(Aristichthys nobilis)养殖中也有陆续报道(李朝兵, 20122);卢炳国等, 2013; 谭洪新等, 2014)。但是关于零换水条件下团头鲂(Megalobrama amblycephala)养殖水体中合适的C/N值及其对鱼体免疫机能的影响未见报道。
1) 包卫洋, 马甡, 单洪伟, 等. 生物絮团在海水养殖中的应用及其前景. 2009 全国海水养殖研讨会. 2009
2) 李朝兵. 生物絮团作为鳙饵料的研究与应用. 上海海洋大学硕士研究生学位论文, 2012, 15–24
团头鲂具有肉质鲜美、生长快、经济价值高等特点,已经成为我国重要的淡水养殖鱼类之一(王为民, 2009)。在团头鲂集约化养殖过程中,大量残饵粪便排放到养殖水体中,氨氮等有毒物质迅速累积,导致养殖水质恶化,影响了团头鲂的生长并易引发细菌类疾病。作者研究了不同碳氮比形成的生物絮团对团头鲂生长、消化酶活性和免疫机能的影响,以期为生物絮团的作用机理及最佳碳氮比参数的确定提供理论依据。
1 材料与方法 1.1 实验碳源与添加方法实验饲料为团头鲂专用配合饲料(粗蛋白含量为30%)。实验用葡萄糖为无水葡萄糖,有效成分为99.9%。对照组投喂基础饲料,实验组在饲料中分别添加葡萄糖,控制投入的C/N分别为12:1 (实验组1)、16:1 (实验组2)、20:1 (实验组3),共4个处理组,每个处理组设置3个重复。本研究的碳源添加量参考了相关的碳氮比计算方法(Avnimelech, 1999),根据饲料投喂量调整葡萄糖的添加量以保持各组的C/N。实验中的C/N指添加物质(饲料和葡萄糖)所含的碳元素与氮元素的质量比。碳源的添加时间为每次投喂饲料后1–2 h,把投喂的碳源与少量养殖水体混合搅拌,全池均匀泼洒。
1.2 实验鱼种与饲养管理养殖实验在中国水产科学研究院淡水渔业研究中心大浦实验基地进行。实验所用团头鲂鱼种由中国水产科学研究院淡水渔业研究中心南泉实验基地提供,驯化14 d后,将240条健康、规格一致的团头鲂鱼种[(36.74±0.82) g/尾]随机分入12个平均水深为0.4 m的室内水泥池(1 m × 4 m × 0.6 m),共5组,每组设置3个平行,放养密度为20尾/池。每个水泥池中设置微孔增氧管,置于水泥池的底部,微孔增氧管通过PPR管与池边一个5 kW的鼓风机相连接,保持连续充气。
养殖期间每天定时投喂3次饲料(8:00、12:00和16:00),日投饵量为团头鲂体重的5%,每7 d根据摄食和生长情况做适当调整,实验周期为56 d。实验期间不换水,只补充因渗漏、蒸发及采样而丢失的水量。实验期间水温为18–24℃,pH为7.7–8.5,溶解氧大于5 mg/L。养殖用水为经过沉淀、过滤后的池塘水,每日观察鱼的摄食及死亡情况,发现死鱼及时捞出并称重计数、检查死亡原因。实验结束后禁食24 h,测量鱼体长和体重,并采集鱼的肠道和肝脏样品。
1.3 样品收集和测定方法 1.3.1 生长与形态学指标测定增重率(Weight gain rate, WGR, %)=(Wt-W0)/W0×100 %;
特定生长率(Specific growth rate, SGR, %/d)=(lnWt-lnW0)/t×100 %;
饵料系数(Feed conversion ratio, FCR)=FI/(Wt-W0);
成活率(Survival rate, SR, %)=Nt/N×100 %;
式中,W0(g)为鱼初体均重;Wt(g)为鱼末体均重;t(d)为饲喂天数;FI(g)为每尾鱼平均摄食饲料总量;Nt为收获尾数,N为放养尾数。
1.3.2 全鱼体成分测定饲养实验结束后,每箱随机选取2尾鱼,每个处理组取6尾鱼,用于测定鱼体的粗蛋白、粗脂肪、灰分和水分等常规组成成分含量。通过常压干燥法在105℃的烘箱中烘至恒重来计算干物质含量;通过凯氏定氮法(GB/T6432-1994)来检测样品的粗蛋白含量(Horwitz et al, 1995);使用索氏抽提法(GB/T6432-1994)即利用乙醚抽脂来检测粗脂肪含量;采用560℃灼烧法(GB/T6438-1992)在马氟炉焚烧5 h后计算灰分含量。
1.3.3 消化酶活性和非特异性免疫指标测定使用浓度为100 mg/L的MS-222快速深度麻醉团头鲂后,取出其肠道和肝脏,按各组织重量分别加入适量生理盐水,使用电动匀浆机在冰浴下制成20%的组织匀浆液,50000 r/min 4℃离心15 min,取上清液待测定。肠道蛋白酶、淀粉酶、脂肪酶分别采用福林-酚试剂法、淀粉-碘比色法和比色法进行测定(谭洪新等,2014)。
蛋白酶活性定义为每毫克组织蛋白在37℃、每分钟酶液蛋白生成1 μg氨基酸相当于1个酶活力单位。淀粉酶活性定义为组织中每毫克酶液蛋白在37℃与底物作用30 min、水解10 mg淀粉为1个酶活力单位。脂肪酶活性定义为组织中每毫克酶液蛋白在37℃,每分钟催化产生1 μg分子脂肪酸的酶量为1个脂肪酶活力单位(U)。
|
|
表 1 不同实验组葡萄糖的添加量及C/N Table 1 The amounts of glucose and C/N ratio in different treatments |
肝脏碱性磷酸酶(Alkaline phosphatase, AKP)、超氧化物歧化酶(Superoxide dismutase, SOD)和溶菌酶(Lysozyme,LZM)活性分别采用金氏法(磷酸苯二钠为底物)、连苯三酚自氧化法和比浊法进行测定,酶液蛋白浓度的测定采用考马斯亮蓝法进行测定。上述指标均使用专业试剂盒进行检测。
碱性磷酸酶活性定义为每毫克酶液蛋白在37℃与基质作用15 min、产生1 mg酚为1个酶活力单位。超氧化物歧化酶活性定义为每毫克酶液蛋白在1 ml反应液中SOD抑制率达50%时所对应的量为1个酶活力单位。溶菌酶活性定义为在28℃,pH为6.26条件下,每克组织每分钟使A450下降0.001为1个酶活力单位。
1.4 数据统计与分析实验数据采用SPSS 16.0统计软件中的单因素方差分析(One-way ANOVA),若差异显著时,再进行多重比较(Duncan’s procedure)。P < 0.05表示差异显著,所有的结果均以平均值±标准误(Mean±SE)表示。
2 结果与分析 2.1 不同碳氮比条件下形成的生物絮团的形态结构及对团头鲂生长性能的影响通过观察生物絮团形成的结构组成(图版Ⅰ),发现由不同碳氮比形成的生物絮团结构组成类似,且生物絮团具有不规则的形状,主要由丝状菌、藻类及浮

|
图版Ⅰ 生物絮团的形态显微镜观察 PlateⅠ Microscopic observation of the morphology of bioflocs A.藻类;B.浮游动物;C.丝状细菌 A. Algae; B. Zooplankter; C. Filamentous bacteria |
游动物等组成。实验发现,不同碳氮比条件下形成不同含量的生物絮团,对团头鲂生长性能具有不同的影响(表 2)。与对照组(C/N=8)相比,处理组(C/N=16和C/N=20)的终末体重、增重率以及特定生长率均显著提高(P < 0.05),但与处理组(C/N=12)相比并无显著性差异(P > 0.05);处理组(C/N=16和C/N=20)的饲料系数显著低于对照组(P < 0.05),但与处理组(C/N=12)相比并无显著性差异(P > 0.05);各实验组间存活率并无显著性差异(P > 0.05)。
|
|
表 2 生物絮团对团头鲂生长性能的影响 Table 2 Effects of biofloc on growth performance of juvenile M. amblycephala |
利用生物化学方法测定鱼体的粗蛋白、粗脂肪、灰分和水分等常规组成成分含量。实验发现,不同碳氮比条件下形成不同含量的生物絮团对团头鲂体成分没有显著性影响(表 3)。与对照组相比,处理组(C/N=16、C/N=20和C/N=24)的团头鲂粗蛋白含量具有增加趋势,但差异不显著(P > 0.05)。
|
|
表 3 生物絮团对团头鲂体成分的影响 Table 3 Effects of biofloc on the body composition of juvenile M. amblycephala(Dry matter, %) |
利用试剂盒检测团头鲂肠道蛋白酶、淀粉酶和脂肪酶活性(图 1)。从实验结果可以看出,处理组(C/N=16和C/N=20)团头鲂肠道的蛋白酶活性和淀粉酶活性均显著高于对照组和处理组(C/N=12)(P < 0.05),相对于对照组,处理组(C/N=20)蛋白酶活性和淀粉酶活性分别提高了1.92倍和0.69倍,而处理组(C/N=16和C/N=20)间团头鲂肠道的蛋白酶活性和淀粉酶活性随碳氮比提高呈逐步升高的趋势,但二者差异不显著(P > 0.05),不同碳氮比条件下形成的生物絮团对团头鲂肠道脂肪酶活性没有显著影响(P > 0.05)。
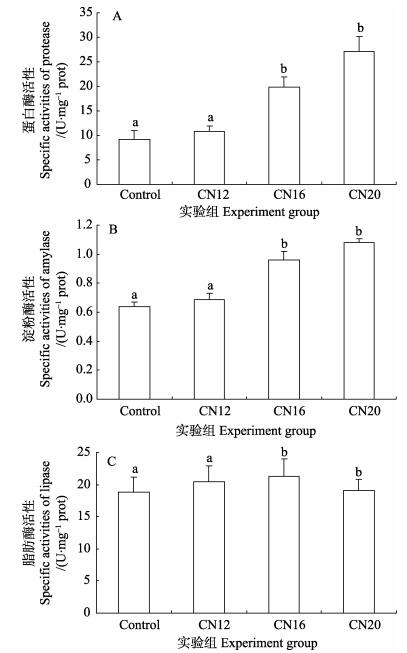
|
图 1 生物絮团对团头鲂肠道消化酶活力的影响 Figure 1 Effects of biofloc on activities of intestinal protease, amylase and lipase of juvenile M. amblycephala 不同字母表示差异显著(P < 0.05) Different letters denoted significant difference (P < 0.05) |
实验发现,不同碳氮比条件下形成不同含量的生物絮团对团头鲂免疫酶活力具有不同的影响(图 2)。处理组(C/N=16和C/N=20)团头鲂肝脏的超氧化物歧化酶和碱性磷酸酶活性均显著高于对照组和处理组(C/N=12)(P < 0.05),而处理组(C/N=16和C/N=20)团头鲂肝脏的超氧化物歧化酶和碱性磷酸酶活性的影响较为一致,均呈降低的趋势,但处理组间没有显著性差异(P > 0.05)。处理组(C/N=16和C/N=20)团头鲂肝脏的溶菌酶活性显著高于对照组和处理组(C/N=12) (P < 0.05),而处理组(C/N=16和C/N=20)团头鲂肝脏的溶菌酶活性均呈逐渐升高的趋势,但处理组间没有显著性差异(P > 0.05)。
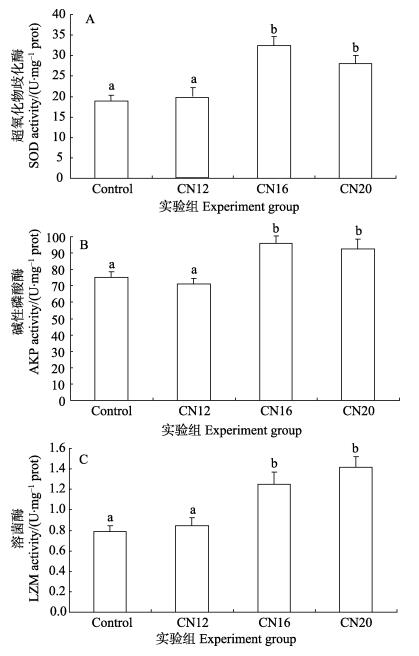
|
图 2 生物絮团对团头鲂肝脏免疫相关酶活性的影响 Figure 2 Effects of biofloc on activities of SOD, AKP and in LZM the liver of juvenile M. amblycephala 不同字母表示差异显著(P < 0.05) Different letters denoted significant difference (P < 0.05) |
传统的团头鲂养殖方式片面追求产量,往往忽略
了分解者和生产者的地位和作用,常常强化水体中外能量的投入——过度投喂饲料,导致养殖水体中有机代谢物的大量沉积,使分解环节受抑制,硝化反应难以顺畅进行,产生多种有机酸及氨氮、亚硝酸盐等中间有毒、有害产物,而团头鲂恰恰是一种氨氮应激性较强的淡水鱼类(张武肖等, 2015)。生物絮团作为微生物的集合体,絮团的粗蛋白含量为30% (干重),能够满足部分水产养殖动物的基本营养需求(夏耘等, 2014; 孙振等, 2013)。Kuhn等(2010)已经证实,滤食性虾类能够较好的吸收生物絮团中的营养物质,从而促进养殖动物生长,降低饲料成本。运用生物絮凝技术养殖杂食性鱼类罗非鱼也可以降低饲料系数,增强饲料蛋白质的利用率(Azim et al, 2008; Crab et al, 2009)。本研究发现,碳氮比为16–20实验组鱼的终末体重和增重率显著高于对照组,其饲料系数显著低于对照组,再次证明生物絮凝养殖技术可以将絮凝物作为团头鲂的饵料,节约养殖成本。孙盛明等(2015)研究表明,团头鲂养殖水体的适宜碳氮比能够有效促进生物絮团的形成并降低水体中的氨氮和亚硝酸盐含量。故此,在养殖系统中的碳氮比为16–20的前提下,生物絮凝技术可将残饵、粪便和水体中的无机氮转化为可被鱼类摄食的有机氮,实现了饲料氮的再次利用。
3.2 不同碳氮比条件下形成的生物絮团对团头鲂肠道消化酶活性的影响江晓浚等(2014)研究发现,团头鲂幼鱼肠道内存在大量生物絮团,表明草食性鱼类团头鲂能够摄食生物絮团。本研究表明,碳氮比为16–20的实验组鱼体肠道中蛋白酶和淀粉酶活性显著高于对照组,而其肠道中脂肪酶活性无显著性差异,这与在斑节对虾中的研究结果相似(Anand et al, 2014)。因此,在生物絮凝原位养殖系统中,团头鲂摄食不同碳氮比条件下形成的絮体对其肠道蛋白酶活性有显著提高。一方面,这是因为不同碳氮比条件下形成的生物絮团被团头鲂摄食进入肠道后会干扰肠道中菌群结构(孙盛明等, 2015),在一定程度上改变已经平衡的、产生或诱导产生消化酶的微生物菌群。另一方面,生物絮团包含单胞藻、浮游生物、细菌和颗粒有机体等(图版Ⅰ),其内部微生物群落结构较为复杂且含多种有益微生物(夏耘等, 2012)。
3.3 不同碳氮比形成的生物絮团对团头鲂肝脏非特异性免疫的影响鱼类是兼具特异性免疫和非特异性免疫的低等脊椎动物,而非特异性免疫在抵御外源微生物中发挥重要作用(Jones, 2001)。鱼类血液或黏液中的具有非特异性抵抗作用的酶类包括溶菌酶、碱性磷酸酶和抗氧化酶等。碱性磷酸酶是动物体内参与免疫的重要水解酶,能增强血细胞识别异物的功能,在机体免疫中起重要作用;超氧化物歧化酶是机体特异性清除活性氧自由基的重要抗氧化酶;溶菌酶是一种细胞非特异性免疫蛋白,在免疫防御过程中发挥重要作用。上述免疫酶活性是评价水产养殖动物非特异性免疫力的主要指标(马元庆等, 2013; 张秀珍等, 2014)。本研究表明,碳氮比为16–20的实验组鱼体肝脏中超氧化物歧化酶、碱性磷酸酶和溶菌酶活性显著高于对照组。研究结果显示,在生物絮团养殖技术中,适宜的碳氮比对团头鲂幼鱼的免疫活性具有一定的促进作用,这可能是因为鱼体摄食或存在于养殖环境中可以通过促进鱼体生长和诱导消化道微生物菌群变化来增加养殖动物免疫力,提高抵御环境胁迫的能力(Defoiedt et al, 2007; Zhou et al, 2010),孙盛明等(2015)研究表明养殖水体中适宜的碳氮比能够促进团头鲂幼鱼肠道中芽孢杆菌含量的增加。李卫芬等(2012)发现,饲料中添加芽孢杆菌可以改善养殖水质和草鱼肠粘膜抗氧化功能。沈斌乾等(2013)发现,芽孢杆菌作为饲料添加剂使用时能促进青鱼生长,提高机体免疫及抗病能力。华雪铭等(2001)发现,饲料中添加芽孢杆菌能显著增强异育银鲫(Carassius auratus gibelio)对嗜水气单胞菌(Aeromonas hydrophila)的抗感染能力。鉴于生物絮团应用于淡水养殖系统时细菌的组成和多样性极其丰富,不同碳氮比条件下形成的生物絮团对鱼类摄食效率及免疫机能的作用机制还需要更深入的研究。
| 马元庆, 李斌, 张秀珍, 等. 生物絮团对仿刺参幼参消化与免疫酶活性的影响. 水生态学杂志 , 2013, 34 (6) : 91-95 | |
| 王为民. 团头鲂养殖产业现状. 科学养鱼 , 2009 (4) : 44-45 | |
| 邓应能, 赵培, 孙运忠, 等. 生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果. 渔业科学进展 , 2012, 33 (2) : 69-75 | |
| 卢炳国, 王海英, 谢骏, 等. 不同C/N水平对草鱼池生物絮团的形成及其水质的影响. 水产学报 , 2013, 37 (8) : 1220-1228 | |
| 华雪铭, 周洪琪, 邱小琮, 等. 饲料中添加芽孢杆菌和硒酵母对异育银鲫的生长及抗病力的影响. 水产学报 , 2001, 25 (5) : 448-453 | |
| 江晓浚, 孙盛明, 戈贤平, 等. 添加不同碳源对零换水养殖系统中团头鲂鱼种生长、肠道生化指标和水质的影响. 水产学报 , 2014, 38 (8) : 1113-1122 | |
| 孙振, 王秀华, 黄倢. 一种微生物絮团的生化分析及其对凡纳滨对虾免疫力的影响. 水产学报 , 2013, 37 (3) : 473-480 | |
| 孙盛明, 朱健, 戈贤平, 等. 零换水条件下养殖水体中碳氮比对生物絮团形成及团头鲂肠道菌群结构的影响. 动物营养学报 , 2015, 27 (3) : 948-955 | |
| 李卫芬, 邓斌, 陈南南, 等. 芽孢杆菌对草鱼生长和肠粘膜抗氧化功能及养殖水质的影响. 水生态学杂志 , 2012, 33 (1) : 65-70 | |
| 李卓佳, 陈永青, 杨莺莺, 等. 对虾养殖水环境无公害高效调控技术(上). 海洋与渔业 , 2008 (4) : 28-29 | |
| 沈斌乾, 陈建明, 郭建林, 等. 饲料中添加枯草芽孢杆菌对青鱼生长、消化酶活性和鱼体组成的影响. 水生生物学报 , 2013, 37 (1) : 48-53 | |
| 张许光, 赵培, 王国成, 等. 不同放苗密度凡纳滨对虾生物絮团养殖的环境和产出效应. 渔业科学进展 , 2013, 34 (3) : 111-119 | |
| 张秀珍, 李斌, 白艳艳, 等. 生物絮团对仿刺参幼参生长与酶活性的影响. 中国水产科学 , 2014, 21 (4) : 793-799 | |
| 张武肖, 孙盛明, 戈贤平, 等. 急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃肝和肾组织结构的影响. 水产学报 , 2015, 39 (2) : 233-244 | |
| 夏耘, 邱立疆, 郁二蒙, 等. 生物絮团培养过程中养殖水体水质因子及原核与真核微生物的动态变化. 中国水产科学 , 2014, 21 (1) : 75-83 | |
| 夏耘, 郁二蒙, 谢骏, 等. 基于PCR-DGGE技术分析生物絮团的细菌群落结构. 水产学报 , 2012, 36 (10) : 1563-1571 | |
| 谭洪新, 刘文畅, 高启, 等. 生物絮凝养殖条件下吉富罗非鱼的消化能力和非特异性免疫能力研究. 水产学报 , 2014, 38 (8) : 1123-1130 | |
| Anand PSS, Kohli MPS, Kumar S, et al. Effect of dietary supplementation of biofloc on growth performance and digestive enzyme activities in Penaeus monodon. Aquaculture , 2014, 418-419 : 108-115 | |
| Anand PSS, Kohli MPS, Roy SD, et al. Effect of dietary supplementation of periphyton on growth performance and digestive enzyme activities in Penaeus monodon. Aquaculture , 2013, 392-395 : 59-68 | |
| Avnimelech Y. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture , 1999, 176 (3-4) : 227-235 DOI:10.1016/S0044-8486(99)00085-X | |
| Avnimelech Y. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds. Aquaculture , 2007, 264 (1-4) : 140-147 DOI:10.1016/j.aquaculture.2006.11.025 | |
| Azim ME, Little DC. The biofloc technology (BFT) in indoor tanks: Water quality, biofloc composition, and growth and welfare of Nile tilapia (Oreochromis niloticus). Aquaculture , 2008, 283 (1-4) : 29-35 DOI:10.1016/j.aquaculture.2008.06.036 | |
| Burford MA, Thompson PJ, McIntosh PR, et al. The contribution of flocculated material to shrimp (Litopenaeus vannamei) nutrition in high-intensity, zero-exchange system. Aquaculture , 2004, 232 (1-4) : 525-537 DOI:10.1016/S0044-8486(03)00541-6 | |
| Crab R, Kochva M, Verstraete W, et al. Bio-flocs technology application in over-wintering of tilapia. Aquacult Eng , 2009, 40 (3) : 105-112 DOI:10.1016/j.aquaeng.2008.12.004 | |
| Defoiedt T, Boon N, Soegeloos P, et al. Alternatives to antibiotics to control bacterial infections: luminescent vibriosis in aquaculture as an example. Trends Biotechnol , 2007, 25 (10) : 472-479 DOI:10.1016/j.tibtech.2007.08.001 | |
| Horwitz W, Senzel A, Reynolds H, et al. Official methods of analysis of the association of official analytical chemists international, 16th Ed. Arlington: AOAC, 1995 . | |
| Jones SRM. The occurrence and mechanisms of innate immunity against parasites in fish. Dev Comp Immunol , 2001, 25 (8-9) : 841-852 DOI:10.1016/S0145-305X(01)00039-8 | |
| Kuhn DD, Lawrence AL, Boardman GD, et al. Evaluation of two types of bioflocs derived from biological treatment of fish effluent as feed ingredients for Pacific white shrimp, Litopenaeus vannamei. Aquaculture , 2010, 303 (1-4) : 28-33 DOI:10.1016/j.aquaculture.2010.03.001 | |
| Xu WJ, Pan LQ, Zhao DH, et al. Preliminary investigation into the contribution of bioflocs on protein nutrition of Litopenaeus vannamei fed with different dietary protein levels in zero-water exchange culture tanks. Aquaculture , 2012, 350-353 : 147-153 | |
| Zhou X, Tian Z, Wang Y, et al. Effect of treatment with probiotics as water additives on tiapia (Oreochomis niloticus) growth performance and immune response. Fish Physiol Biochem , 2010, 36 (3) : 501-509 DOI:10.1007/s10695-009-9320-z |



