2. 中国海洋大学海洋生命学院 青岛 266003;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266237
2. College of Marine Life Sciences, Ocean University of China, Qingdao 266003 ;
3. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266200
对虾是重要的水产养殖品种,近年来受病毒性及细菌性病原感染导致的偷死病及早期死亡症发生频繁(Zhang et al, 2014; Joshi et al, 2014)。有研究表明,在养殖水体中添加有益菌,可以有效控制病原微生物,优化养殖生态环境,减少虾病发生(Gatesoupe, 1999; Ziaei-Nejad et al, 2006)。将有益菌加入饵料中投喂对虾,能够显著增强对虾的消化吸收和抗逆水平,促进对虾的生长(Wang, 2007; Verschuere et al, 2000)。地衣芽孢杆菌(Baclicus lincheniformis)作为水产养殖有益菌用于水产养殖,可提高养殖动物生长速度与成活率(刘波等, 2005),还能有效降解水体中残余饵料中的蛋白和淀粉(谢航等, 2008)。
对虾疾病发生与养殖环境存在密切关系,优良的水质理化条件及健康的微生物群落有助于对虾的生长,减少疾病发生(Gatesoupe, 1999; Samocha et al, 2004),但随着集约化对虾养殖业的发展,由大量残饵、粪便导致的养殖水体富营养化及有害氮源积累问题日渐突出,降低了对虾的免疫力(Crab et al, 2012)。生物絮团技术在对虾工厂化养殖中有良好的应用效果,该技术通过调节养殖水体中的碳氮比,促进脱氮微生物繁殖,具有降低水体中氮源浓度、提高饲料利用率及减少换水量的效果。生物絮团对虾养殖中,微生物的组成存在多样性(Zhao et al, 2012),但目前尚没有通过向生物絮团养殖系统中添加有益微生物来实现定向培养有益微生物的研究报道。
本研究在实验室规模条件下,利用从对虾养殖池中分离出的芽孢杆菌作为有益菌,添加到生物絮团对虾养殖系统中,研究了芽孢杆菌联合生物絮团对虾养殖技术对凡纳滨对虾(Litopenaeus vannamei)养殖水质指标(pH、氨氮、亚硝酸氮)、对虾生长、存活及微生物群落的影响,以期为生物絮团对虾养殖技术升级提供理论支撑。
1 材料与方法 1.1 实验材料凡纳滨对虾购自山东日照市某对虾育苗场,平均体长为(1.52±0.36) cm,平均体重为(0.049±0.003) g。
1.2 实验方法 1.2.1 菌株采集与分离纯化从山东省潍坊市某对虾养殖场的工厂化对虾养殖池中,用无菌采样瓶采集水样,低温保存带回实验室。在无菌条件下,于2216E平板上划线分离纯化,对不同菌株编号并进行鉴定。
1.2.2 菌株鉴定16S rDNA序列比对法参照范文辉等(2005)。扩增产物由上海桑尼生物工程有限公司测序,所得序列在GenBank数据库中利用BLAST进行同源性比对;细菌全细胞脂肪酸分析鉴定法参照MIDI公司(美国)提供的标准方法进行,气相色谱系统应用美国Agilent6850型气相色谱仪,分析软件应用MIDI公司开发的细菌全细胞脂肪酸鉴定及分析系统(MIS)。
1.2.3 菌株02发酵将菌株02接种于2216E液体培养基,于28℃摇床振荡培养24 h,发酵产物经离心后,PBS重悬沉淀备用,细菌浓度采用涂布平板计数法确定。
1.2.4 实验分组及养殖管理随机取暂养的实验对虾360尾,分别置于12个有效水体为7 L的实验水桶内,每个水桶30尾。实验设加菌加糖组(菌株02联合生物絮团组)、加菌组、加糖组(生物絮团组)和空白对照组,各组设3个平行。菌株02的量在养殖水体中达到2.0×104CFU/ml,仅在实验开始时一次性接种,加糖量(蔗糖)为每次饵料投喂量的70% (邓应能等, 2012),投饵30 min后添加。实验对虾每天投喂4次(08:00、12:00、16:00和20:00),投喂量为对虾体重的3%。养殖实验为期51 d,实验用水为砂滤海水,整个养殖过程不换水,连续充气,每天早、中、晚检查对虾摄食及存活情况,对死亡对虾及时取出,记录体长、体重。
1.2.5 水质指标测定使用YSI556便携式水质测定仪每日09:00对养殖水体的温度、盐度、溶氧和pH值进行测量。同时,取各组水样用0.45 μm微孔滤膜过滤后,分别采用次溴酸盐氧化法和盐酸萘乙二胺分光光度法测定养殖水体的氨氮和亚硝酸氮浓度(GB 17378.4-2007, 2007)。养殖结束时,使用Nalgene沉淀漏斗测定养殖水体内生物絮团的沉积量,取样静置20 min后读数。每次实验均设置3个平行,取平均值进行分析。
1.2.6 对虾生长及存活率测定实验进行到22 d、44 d、51 d时,统计各组对虾的存活率;实验结束时,统计各组对虾的生物学体长,计算对虾体长增长率。
存活率(%)=终末尾数/初始尾数×100;
体长增长率(%)=(终末平均体长−初始平均体长)/初始平均体长×100
1.2.7 养殖水体中主要可培养菌群组成分析实验结束时,采用2216E平板划线分离法,对养殖水体中的细菌进行分离,采用细菌16S rDNA序列分析比对法对所分离的细菌进行初步分类鉴定。根据菌落形态、颜色等特征,统计不同处理组主要可培养细菌的种类及所占比例。
1.3 数据统计分析水体pH、氨氮及亚硝酸氮的组间差异性,采用SPSS 18.0软件的两因素方差分析法进行分析;絮团沉积量、对虾存活率、体长增长率的组间差异采用单因素方差分析,设显著水平α=0.05(P < 0.05为差异显著)。实验结果用平均数±标准方差(X±SD,n=3)表示。
2 结果 2.1 菌株的分离与鉴定从对虾养殖水体中分离得到可培养细菌7株,编号分别为2013042401–2013042407,将各菌株16S rDNA的序列进行比对,结果显示,7株菌分别与海洋屈挠杆菌(Tenacibaculum maritimum)、地衣芽孢杆菌(B. licheniformis)、假交替单胞菌(Pseudoalteromonas sp.)、微小杆菌(Exiguobacterium sp.)、鲁杰氏菌(Ruegeria conchae)、中国黄海菌(Gilvimarinus chinensis)和溶藻弧菌(Vibrio alginolyticus)相似度最高,相似度分别为95.5%、99.9%、96.9%、99.8%、97.9%、97.0%和99.8%。选取芽孢杆菌2013042402 (简称菌株02)作为目标菌株,用于后续实验。
对菌株02全细胞脂肪酸进行气相色谱分析,结果见图 1,与MIDI细菌脂肪酸数据库TSBA6 (6.10)比对,结果见表 1。该菌与浸麻芽孢杆菌(B. macerans)和萎缩芽孢杆菌(B. atrophaeus)的相似度分别为0.542和0.533,均大于0.5,表明该菌为芽孢杆菌属。结合16S rDNA分子鉴定结果,综合判定菌株02为芽孢杆菌(Bacillus sp.)。
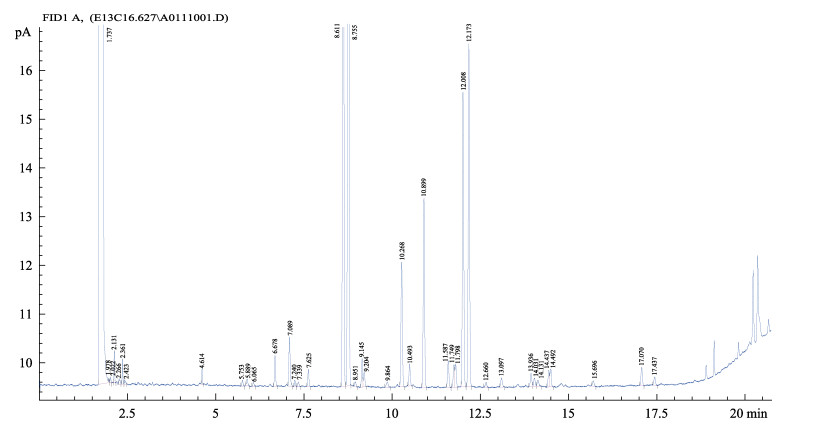
|
图 1 菌株02全细胞脂肪酸气相色谱 Figure 1 Gas chromatographic chart of whole cell fatty acid of Strain 02 |
|
|
表 1 菌株脂肪酸鉴定结果 Table 1 Analysis of whole cell fatty acid of the strain 02 using gas chromatography |
对虾养殖过程中,各组水体中溶解氧均 > 5.5 mg/L,各组间温度、盐度变化均趋于一致,变化曲线分别见图 2和图 3。各组水体pH变化曲线见图 4,随着养殖时间延长,各组水体pH均呈现下降趋势,统计分析显示,相同检测时间点各组pH差异不显著(P > 0.05)。
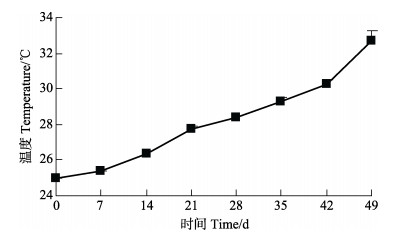
|
图 2 养殖水体的温度变化 Figure 2 Variation of water temperature |
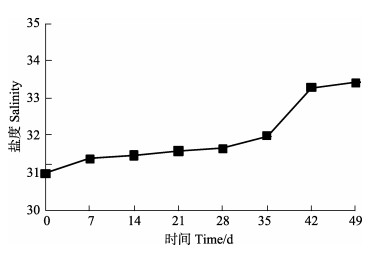
|
图 3 养殖水体的盐度变化 Figure 3 Variation of water salinity |
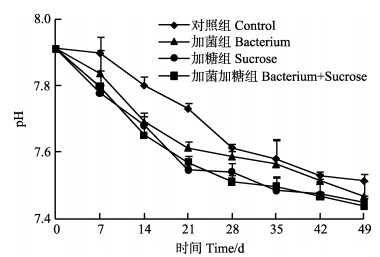
|
图 4 各组养殖水体的pH变化 Figure 4 Variation of water pH in each group |
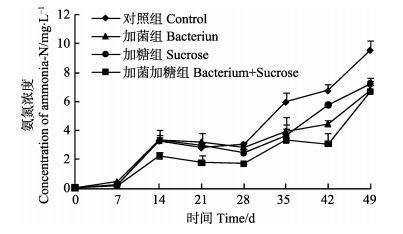
水体中氨氮变化趋势如图 5所示,在养殖1–7 d内,各组水体中的氨氮浓度呈缓慢上升趋势,至7 d时各组中的氨氮浓度差异不显著(P > 0.05),7–14 d各组水体中的氨氮浓度均呈快速上升趋势,至14 d时加菌加糖组中的氨氮水平显著低于加菌组与对照组(P < 0.05);在养殖至14–28 d,各组氨氮含量均呈逐渐降低趋势,且加菌加糖组与其他组相比仍保持较低水平(P < 0.05);28 d之后,各组开始呈现上升态势,仅有加菌加糖组的氨氮浓度在42 d时又出现一定程度下降,而其他3组随着养殖时间的延长,氨氮浓度持续升高。至第49天时,对照组氨氮达到9.6 mg/L,显著高于加糖加菌组、加菌组及加糖组。在49 d的检测时间内,各组氨氮浓度的变化趋势呈现升高、降低、升高的变化趋势。结果显示,加菌加糖组氨氮显著低于其他各组(P < 0.05),而对照组氨氮显著高于其他各组(P < 0.05)。
|
图 5 各组养殖水体中氨氮的变化 Figure 5 Variation of ammonia-N in each group |
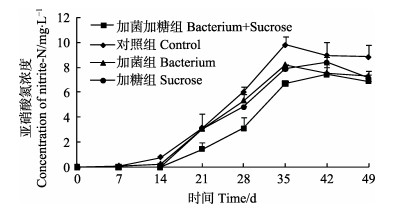
水体中亚硝酸氮变化情况见图 6,在养殖实验的前14 d,各组的亚硝酸氮含量均处于较低水平,相同检测时间点各组间的差异不显著(P > 0.05),14–35 d各组的亚硝酸氮含量开始快速上升,该时间段内相同检测时间点,加菌加糖组亚硝酸氮浓度显著低于其他组(P < 0.05);之后加菌加糖组与加糖组缓慢上升,至42 d达到高峰,而其他两组在35 d之后已开始呈现下降。对整个检测时段的变化进行统计分析,加菌加糖组、加菌组和加糖组水体亚硝酸氮含量总体显著低于对照组(P < 0.05)。
|
图 6 各组养殖水体中亚硝酸氮的变化 Figure 6 Variation of nitrite-N in each group |
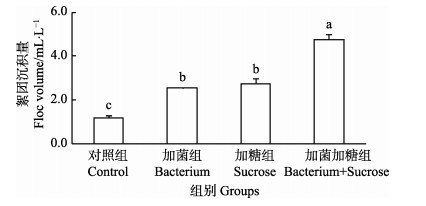
养殖结束时,对各组水体中絮团量进行测定,结果见图 7。统计结果显示,加菌加糖组絮团量显著高于其他各组(P < 0.05),对照组中絮团量显著低于其他各组(P < 0.05),加菌组与加糖组差异不显著(P > 0.05)。
|
图 7 不同处理组的絮团沉积量 Figure 7 Floc volume in different group |
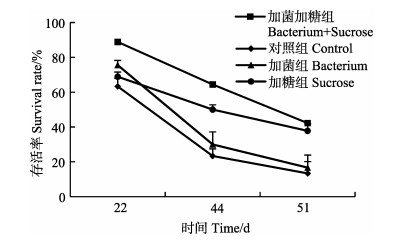
在养殖22 d、44 d、51 d时,统计各时间段对虾的存活率,结果见图 8。在养殖22 d时,加菌加糖组对虾存活率为89.00%±1.57%,显著高于其他组(P < 0.05),加菌组与加糖组的存活率差异不显著(P > 0.05);养殖至44 d时,加菌加糖组存活率为64.00%±6.29%,显著高于其他各组(P < 0.05),且加糖组存活率显著高于加菌组(P < 0.05),加菌组与对照组差异不显著(P > 0.05);养殖至51 d时,加菌加糖组存活率降低至42.00%±5.67%,与加糖组存活率(38.00%±4.16%)差异不显著(P > 0.05)。而加菌组与对照组存活率仅为17.00%±2.72%和13.00%±2.72%,二者无显著差异(P > 0.05),但显著低于加菌加糖组与加糖组(P < 0.05)。
|
图 8 各组对虾存活率 Figure 8 Survival rate of shrimp in different group |
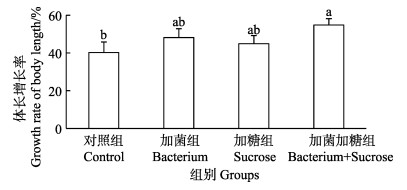
实验结束时,统计各组对虾的生物学体长,计算体长增长率,结果见图 9。加菌加糖组、加菌组、加糖组及对照组的对虾体长增长率分别为55.00%±3.34%、48.00%±4.67%、45.00%±4.35%及40.00%±5.63%。统计分析显示,加菌加糖组、加菌组及加糖组间的体长增长率差异不显著(P > 0.05),但加菌加糖组高于对照组(P < 0.05)。
|
图 9 各实验组对虾体长增长率 Figure 9 Growth rate of shrimp body length in different group |
对实验水体中的可培养细菌进行分类及初步鉴定,结果见表 2。不同实验组中主要菌群组成存在差异,对照组中主要细菌有4种,其中,色盐杆菌属(Chromohalobacter sp.)为优势菌,占49%±1%;加菌组中主要细菌有3种,其中,弧菌属(Vibrio sp.)为优势菌,占63%±3%;加糖组中主要有4种细菌,其中,鲁杰氏菌属(Ruegeria sp.)为优势菌,占66%±2%;加菌加糖组中主要有3种细菌,其中,芽孢杆菌属(Bacillus sp.)为优势菌,占49%±1%,没有检出弧菌。
|
|
表 2 各实验组中主要菌群组成 Table 2 The composition of dominant bacterial communities in different groups |
地衣芽孢杆菌作为益生菌已被用于家畜及水产养殖动物疾病防治及饲料添加剂等领域(吴莹雯等, 2014; Larsen et al, 2014; 刘文斌等, 2007)。在水产养殖中,地衣芽孢杆菌可用于抑制养殖环境中有害藻类的生长(李卓佳等, 2009),降解对虾粪便中的有机物(曹煜成等, 2010),鱼类口服地衣芽孢菌后可增强其吞噬细胞活力,提高对细菌的抵抗力(Cha et al, 2013)。地衣芽孢杆菌产生的抗菌肽对革兰氏阳性、阴性细菌及真菌均有较好的抗菌效果(樊陈等, 2013)。本研究将从对虾养殖池中分离出的1株芽孢杆菌应用于生物絮团对虾养殖中,在零换水条件下,通过分析不同实验组对虾的生长、存活参数、养殖水环境的理化及微生物因子差异,证实在生物絮团对虾养殖系统中添加芽孢杆菌,可改善养殖水质,提高对虾存活率及生长速度,且养殖环境中微生物组成结构良好,未检出病原菌,研究结果为在生物絮团对虾养殖系统中联合应用有益菌奠定了理论基础。
在零换水生物絮团对虾养殖系统中,随着养殖时间增长,残饵及粪便积累增多,分解后导致氨氮浓度快速上升。本研究结果表明,零换水生物絮团养殖系统中氨氮及亚硝酸氮浓度存在一定的变化规律(图 5、图 6),在养殖前14 d水体中的有害氮化合物以氨氮为主,亚硝酸盐浓度较低。在养殖至14–28 d,系统内发生亚硝化反应,亚硝酸氮浓度快速升高,氨氮浓度出现一定降低,35 d后亚硝酸盐浓度出现下降,表明系统发生硝化作用。本研究发现,在加菌加糖组中,氨氮及亚硝酸氮浓度低于其他组,但仍然保持较高浓度,表明菌株02及所分离其他菌均不具有高效脱氮能力。有研究发现,不同地衣芽孢杆菌的脱氮效果存在差异,聂欢欢等(2013)从南美白对虾养殖池中分离得到1株高效去除亚硝酸氮的地衣芽孢杆菌FP6,对硝酸氮和氨氮都有较强的去除能力。而曹煜成等(2010)报道的1株地衣芽孢杆菌脱氮效果较差。研究结果提示,在生物絮团养殖系统中,有必要分析菌群功能,如脱氮菌群缺少需及时添加。
采用生物絮团技术养殖对虾,可以提高对虾的养殖存活率及生长速度(Zhao et al, 2012),本研究结果也显示,在对虾养殖系统中添加一定浓度的碳源,可显著提高养殖中、后期对虾的存活率(图 8),而在生物絮团养殖系统中添加芽孢杆菌后养殖效果比单一絮团养殖技术更具优越性。实验也发现,在养殖后期,各组对虾的养殖存活率均较低,作者认为该结果与实验养殖密度过高(每立方水体4285尾)及养殖中、后期水体中氨氮及亚硝酸氮浓度过高有关,尽管统计结果分析显示加菌加糖组中的氨氮及亚硝酸氮在养殖42 d前均显著低于其他各组,但其浓度仍然分别达到6.7 mg/L与7.4 mg/L。Barbieri(2010)研究表明,对虾在盐度为35、pH为8时,氨(离子与非离子氨总和)的96h LC50为38.88 mg/L,对幼虾的相对安全浓度仅为3.95 mg/L (Lin et al, 2001)。
生物絮团除了能够改善养殖水质、提高饲料利用率外,还可降低水体弧菌群体感应,对病原体具有生物控制活性(Crab et al, 2010)。在生物絮团养殖水体中添加碳水化合物,不仅可以促进絮团的形成,还可促进絮团菌群中益生菌繁殖,而益生菌对病原菌也具有一定的抑制作用(Defoirdt et al, 2007)。本研究结果也表明,在养殖水体中添加碳源对芽孢杆菌生长繁殖具有促进效果,对弧菌具有良好抑菌效果。Vinoj等(2013)研究发现,地衣芽孢杆菌提取物对副溶血弧菌具有显著的抑制效果,且该菌产生的N酰化丝氨酸内酯酶,能抑制副溶血弧菌的生物膜形成,降低养殖动物因感染副溶血弧菌导致的死亡(Vinoj et al, 2014)。本研究结果表明,在生物絮团对虾养殖中,添加芽孢杆菌或其他有益菌是提升生物絮团技术的方法之一。
| GB 17378.4-2007海洋监测规范(中华人民共和国国家标准).北京:海洋出版社, 2007, 111-115 | |
| 邓应能, 赵培, 孙运忠, 等. 生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果. 渔业科学进展 , 2012, 33 (2) : 69-75 | |
| 刘文斌, 尹君, 方星星, 等. 3种益生素配伍对异育银鲫(Carassius auratus gibelio)生长、消化及肠道菌群组成的影响. 海洋与湖沼 , 2007, 38 (1) : 29-35 | |
| 刘波, 刘文斌, 王恬. 地衣芽孢杆菌在异育银鲫日粮中的应用. 湛江海洋大学学报 , 2005, 25 (6) : 31-35 | |
| 李卓佳, 王少沛, 曹煜成, 等. 地衣芽孢杆菌与3种微藻生长的相互影响. 农业环境科学学报 , 2009, 28 (4) : 839-844 | |
| 吴莹雯, 姜宏伟. 地衣芽孢杆菌活菌胶囊对肝炎后肝硬化患者血清内毒素、超敏C反应蛋白及前降钙素水平的影响. 中国微生态学杂志 , 2014, 26 (9) : 1046-1048 | |
| 范文辉, 黄倢, 王秀华, 等. 养殖大菱鲆溃疡症病原菌的分离鉴定及系统发育分析. 微生物学报 , 2005, 45 (5) : 665-670 | |
| 聂欢欢, 赵群芬, 李长红, 等. 一株高效去除亚硝酸氮细菌的分离鉴定及其脱氮特性研究. 微生物学通报 , 2013, 40 (11) : 2146-2155 | |
| 曹煜成, 李卓佳, 林小涛, 等. 地衣芽孢杆菌De株对凡纳滨对虾粪便的降解效果. 热带海洋学报 , 2010, 29 (4) : 125-131 | |
| 谢航, 邱宏端, 王秀彬, 等. 地衣芽孢杆菌降解水产养殖中残余饵料的特性研究. 福建水产 , 2008, 26 (3) : 31-35 | |
| 樊陈, 高兆建, 张桂英, 等. 地衣芽孢杆菌抗菌肽的纯化及抗菌特性分析. 中国农学通报 , 2013, 29 (33) : 313-318 | |
| Barbieri E. Acute toxicity of ammonia in white shrimp (Litopenaeus schmitti) (Burkenroad, 1936, Crustacea) at different salinity levels. Aquaculture , 2010, 306 (1-4) : 329-333 DOI:10.1016/j.aquaculture.2010.06.009 | |
| Cha JH, Rahimnejad S, Yang SY, et al. Evaluations of Bacillus spp. as dietary additives on growth performance, innate immunity and disease resistance of olive flounder (Paralichthys olivaceus) against Streptococcus iniae and as water additives. Aquaculture , 2013, 402-403 : 50-57 DOI:10.1016/j.aquaculture.2013.03.030 | |
| Crab R, Defoirdt T, Bossier P, et al. Biofloc technology in aquaculture: Beneficial effects and future challenges. Aquaculture , 2012, 356 (4) : 351-356 | |
| Crab R, Lambert A, Defoirdt T, et al. The application of bioflocs technology to protect brine shrimp (Artemia franciscana) from pathogenic Vibrio harveyi. J Appl Microbiol , 2010, 109 (5) : 1643-1649 | |
| Defoirdt T, Boon N, Sorgeloos P, et al. Alternatives to antibiotics to control bacterial infections: luminescent vibriosis in aquaculture as an example. Trends Biotechnol , 2007, 25 (10) : 472-479 DOI:10.1016/j.tibtech.2007.08.001 | |
| Gatesoupe FJ. The use of probiotics in aquaculture. Aquaculture , 1999, 180 (1-2) : 147-165 DOI:10.1016/S0044-8486(99)00187-8 | |
| Joshi J, Srisala J, Truong VH, et al. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND). Aquaculture , 2014, 428-429 : 297-302 DOI:10.1016/j.aquaculture.2014.03.030 | |
| Larsen N, Thorsen L, Kpikpi EN, et al. haracterization of Bacillus spp. strains for use as probiotic additives in pig feed. Appl Microbiol Biotechnol , 2014, 98 (3) : 1105-1108 DOI:10.1007/s00253-013-5343-6 | |
| Lin YC, Chen JC. Acute toxicity of ammonia on Litopenaeus vannamei Boone juveniles at different salinity levels. J Exp Mar Biol Ecol , 2001, 259 (1) : 109-119 DOI:10.1016/S0022-0981(01)00227-1 | |
| Samocha TM, Lawrence AL, Collins CA, et al. Production of the Pacific white shrimp, Litopenaeus vannamei, in high-density greenhouse-enclosed raceways using low salinity groundwater. J Appl Aquacult , 2004, 15 (3-4) : 1-19 DOI:10.1300/J028v15n03_01 | |
| Verschuere L, Rombaut G, Sorgeloos P, et al. Probiotic bacteria as biological control agents in aquaculture. Microbiol Mol Biol Rev , 2000, 64 (4) : 655-671 DOI:10.1128/MMBR.64.4.655-671.2000 | |
| Vinoj G, Vaseeharan B, Jayaseelan DB, et al. Inhibitory effects of Bacillus licheniformis(DAB1) and Pseudomonas aeruginosa (DAP1) against Vibrio parahaemolyticus isolated from Fenneropenaeus indicus. Aquacult Int , 2013, 21 (5) : 1121-1135 DOI:10.1007/s10499-012-9617-2 | |
| Vinoj G, Vaseeharan B, Thomas S, et al. Quorum-quenching activity of the AHL-lactonase from Bacillus licheniformis DAHB1 inhibits vibrio biofilm formation in vitro and reduces shrimp intestinal colonisation and mortality. Mar Biotechnol , 2014, 16 (6) : 707-715 DOI:10.1007/s10126-014-9585-9 | |
| Wang YB. Effect of probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei. Aquaculture , 2007, 269 (1-4) : 259-264 DOI:10.1016/j.aquaculture.2007.05.035 | |
| Zhang QL, Liu Q, Liu S, et al. A new nodavirus is associated with covert mortality disease of shrimp. J Gen Virol , 2014, 95 (12) : 2700-2709 | |
| Zhao P, Huang J, Wang XH, et al. The application of bioflocs technology in high-intensive, zero exchange farming systems of Marsupenaeus japonicus. Aquaculture , 2012, 354-355 (2) : 97-106 | |
| Ziaei-Nejad S, Rezaei MH, Takami GA, et al. The effect of Bacillus spp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus. Aquaculture , 2006, 252 (2-4) : 516-524 DOI:10.1016/j.aquaculture.2005.07.021 |



