2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266237;
4. 广西水产科学研究院 南宁 530021;
5. 浙江省海洋水产养殖研究所 温州 324005;
6. 江苏省海洋水产研究所 南通 226007
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306 ;
3. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266200 ;
4. Guangxi Academy of Fishery Science, Nanning 530021 ;
5. Zhejiang Mariculture Research Institute, Wenzhou 324005 ;
6. Jiangsu Institute of Oceanology and Marine Fisheries, Nantong 226007
急性肝胰腺坏死病(Acute Hepatopancreatic Necrosis Disease, AHPND),又称早期死亡综合征(Early Mortality Syndrome, EMS),是一种严重危害养殖对虾的疫病(Lightner et al, 2012)。该病最早于2010年发生于中国南方和越南,随后在马来西亚和泰国相继暴发,感染该病的对虾幼苗,在放苗10–30 d内高达100%的死亡率(FAO, 2013; Lightner et al, 2012),给亚洲各国对虾养殖业造成巨大经济损失。因此,对AHPND病原的探究引起了国内外学者的广泛关注。本实验室最早在2010年从广西北海大规模死亡的凡纳滨对虾中分离到了一株高抗生素抗性和高致病力的副溶血弧菌(Vibrio parahaemolyticus)(张宝存等, 2012)。Tran等(2013)通过病原学分析确定了引起AHPND的病原为副溶血弧菌。副溶血弧菌是一种常见的革兰氏阴性致病菌,对凡纳滨对虾(Litopenaeus vannamei)危害严重,近年来多次引起凡纳滨对虾大规模死亡(张晓君等, 2010; 张宝存等, 2012; Tran et al, 2013; Schryver et al, 2014)。
在探究AHPND病原的过程中,Lightner等从引起AHPND的副溶血弧菌(VPAHPND)中诱导并分离到了一株溶源性噬菌体,并推测该噬菌体是副溶血弧菌的毒力因子(FAO, 2013),但Lightner等的上述观点并没有相关研究论文的正式报道,随后Lightner等又自我否定了溶源噬菌体是导致副溶血弧菌引发AHPND的毒力因子的观点。
本研究旨在分析从AHPND样品中分离得到的副溶血弧菌携带溶源噬菌体的情况,并分析溶源噬菌体是否是副溶血弧菌导致AHPND的主要原因,从而为探究溶源噬菌体、副溶血弧菌与AHPND的关系提供直接依据。
1 材料与方法 1.1 菌株实验所用菌株为本实验室从2013年来自我国广西、浙江和江苏以及2014年来自越南的感染急性肝胰腺坏死病(AHPND)的凡纳滨对虾或养殖水体中分离得到的5株副溶血弧菌(表 1)。所用菌株均由本实验室分离、鉴定并保藏。
|
|
表 1 实验所用副溶血弧菌菌株 Table 1 Vibrio parahaemolyticus strains used in this study |
细菌总DNA的提取采用天根细菌基因组DNA提取试剂盒(TIANGEN, 北京)。1%琼脂糖凝胶电泳检测DNA质量。
1.3 AHPND相关副溶血弧菌质粒的PCR检测为确定所用副溶血弧菌是否为导致AHPND的致病菌株,采用Flegel等(2014)公布的针对致AHPND的副溶血弧菌(VPAHPND)的质粒的检测方法,引物为AP2 (AP2-F: 5′-TCA CCC GAA TGC TCG CTT GTG G-3′和AP2-R: 5′-CGT CGC TAC TGT CTA GCT GAA G-3′),委托上海生工生物进行合成。以100 ng/μl细菌总DNA为模板,采用Ex Taq DNA聚合酶(TaKaRa, 大连)进行扩增。扩增产物采用1%琼脂糖凝胶电泳分析。
1.4 丝裂霉素C有效浓度的确定和噬菌体溶源性感染菌株的筛选借鉴梅运军等(2011)的方法,采用丝裂霉素C释放细菌中的溶源性噬菌体。为确定丝裂霉素C诱导溶源噬菌体的有效浓度,将5株副溶血弧菌接种于25 ml 2216E培养液中,于28℃ 160 r/min振荡培养至OD660 nm为0.2左右。取5 ml于25 ml灭菌锥形瓶中,加入0.5 mg/ml丝裂霉素C至终浓度分别为0、0.1、0.5、1 μg/ml。于28℃继续振荡培养,每小时取200 μl菌液在96孔酶标板中测定OD660 nm,连续监测10 h。绘制每种丝裂霉素C浓度下5种细菌生长的均值曲线,选择有效的丝裂霉素C浓度。在该浓度下,对5株副溶血弧菌进行噬菌体溶源性感染与否的筛选。
1.5 噬菌体的分离噬菌体的分离基本采用Lan等(2009)的方法,根据本实验的需要进行了修改。挑取疑似感染有溶源噬菌体的菌株的单菌落,分别接种于5 ml 2216E培养液中,28℃振荡培养过夜,制备种子液。取1 ml种子液接种于150 ml 2216E培养液中,于28℃ 160 r/min振荡培养至OD660 nm为0.2左右,加入丝裂霉素C至有效浓度,继续振荡培养约4 h。将菌液于4℃、6000 × g离心15 min,上清液用0.22 μm滤膜过滤。向滤液中逐步加入NaCl固体(国药, 北京),使其完全溶解,至终浓度为1 mol/L。冰上静置30 min后,于4℃、6000 × g再次离心15 min。在上清液中逐步加入PEG 6000,轻轻颠倒混匀,使PEG 6000 (Sigma, 美国)完全溶解,至终浓度为10%。在4℃竖直静置24 h。然后,4℃、6000 × g离心20 min,弃上清液,沉淀溶于500 μl TE缓冲液(pH2.5)中,于4℃暂存。
1.6 噬菌体电镜观察取20 μl噬菌体提取液,滴于疏水载玻片上,覆盖铜网于其上,静置10 min。取铜网,用滤纸吸去多余液体,再将铜网覆于1滴2%的磷钨酸(pH=6.5)液滴上,静置10 min。用滤纸从侧面吸去多余的液体,干燥后进行电镜观察并拍照。
1.7 副溶血弧菌菌株对卤虫无节幼体的感染实验 1.7.1 菌液的制备分别接种各株副溶血弧菌于30 ml TSB培养液中,28℃摇床过夜培养,制备种子液。次日,分别取300 µl种子液加入30 ml新鲜的TSB培养液中,28℃、160 r/min振荡培养6 h,至菌浓度约为2×109 CFU/ml。
1.7.2 卤虫卵的孵化称取1 g卤虫卵(Great Salt Lake, Utah, 美国)于100 ml纯水中,连续充气1 h后,用100目筛过滤,将卤虫卵转移至50 ml离心管。加入脱壳液(NaClO 10 ml,NaOH 0.5 g,纯水4 ml),充气2 min,立即依次用1 L无菌水、2 L无菌10% Na2S2O3,1 L无菌水冲洗。将冲洗后的卤虫卵放入1 L盐度约30的无菌海水中,28℃充气照明培养24 h。
1.7.3 卤虫无节幼体的感染实验5株副溶血弧菌分别进行卤虫无节幼体攻毒,每组设置4个平行。每个平行实验在9 cm无菌培养皿中进行。加入30 ml无菌海水(盐度约30),放入30只卤虫无节幼体,加入300 μl菌液至终浓度为107 CFU/ml。对照组加入300 μl无菌TSB培养液。培养48 h后,对存活卤虫进行计数统计。取100 μl对照组培养液于30 ml TSB中,在28℃培养箱中放置5 d,确定无污染。
1.7.4 数据分析与处理实验数据用SPSS 18.0进行处理,使用0.05为显著性水平。
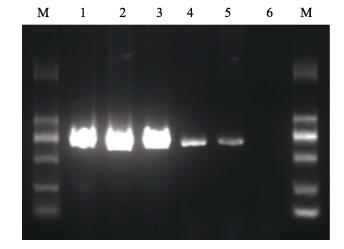
2 结果 2.1 5株副溶血弧菌的AHPND相关质粒的PCR检测利用AP2引物对5株副溶血弧菌进行AHPND相关质粒的PCR检测(图 1),目的产物约为700 bp,表明5株菌均为含AHPND相关质粒的细菌。其中20130629002S01,20130726001S01及20130721001 S 023株菌的PCR产物很亮,另外2株菌编号为2014 VN 01S01G和20130722DXES05的产物亮度较弱,可能代表AHPND相关质粒的拷贝数的差异。
|
图 1 5株副溶血弧菌的AHPND相关质粒的PCR检测 Figure 1 PCR detection of plasmid associated with AHPND in the five isolates of V. parahaemolyticus 1. 20130629002S01(A); 2. 20130726001S01(D); 3. 20130721001S02(B); 4. 2014VN01S01G(E); 5. 20130722DXES05(C); 6.空白对照Blank control; M. DL2000 marker (TaKaRa) |
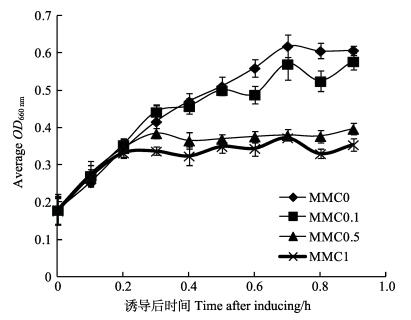
5株副溶血弧菌分别接种于2216E培养液中28℃至OD660 nm值约为0.2,加入丝裂霉素C,使其终浓度分别为0、0.1、0.5和1 μg/ml,每小时测定各菌OD660 nm。监测10 h后绘制5株副溶血弧菌在不同丝裂霉素C浓度下的平均生长曲线(图 2)。结果显示,丝裂霉素C浓度为0时,所有菌株在10 h内的生长总体呈上升趋势;丝裂霉素C浓度为0.1 μg/ml时,多数副溶血弧菌菌株的生长受抑制,但作用不明显;而丝裂霉素C浓度为0.5 μg/ml和1 μg/ml时,在2 h后细菌生长表现出了抑制作用。因此,本实验最终选取丝裂霉素C的有效浓度为0.5 μg/ml,用于诱导溶源噬菌体。
|
图 2 不同浓度丝裂霉素C对5种副溶血弧菌的生长影响 Figure 2 The average effects of mitomycin C at different concentrations on the growth of V. parahaemolyticus |
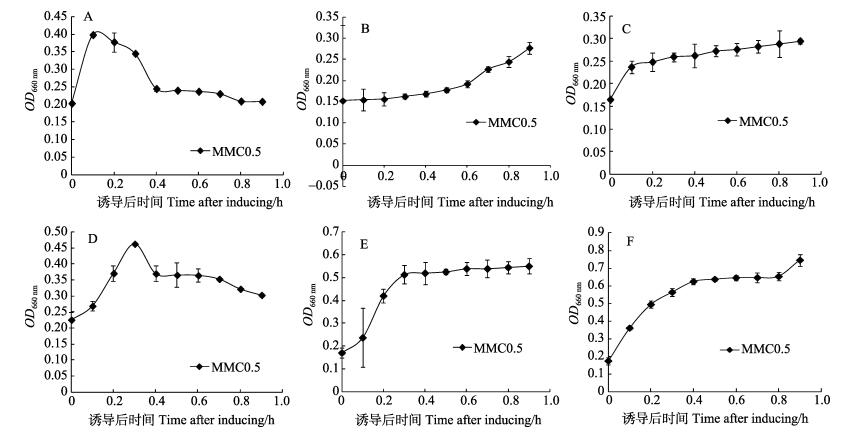
在丝裂霉素C浓度为0.5 μg/ml时,对5株副溶血弧菌的生长曲线进行分析(图 3)。结果显示,20130629002S01 (A)和20130726001S01 (D)两株菌的生长曲线都呈现先上升后下降的生长趋势,初步判定这两株菌为溶源性细菌。其中,20130629002S01 (A)在添加丝裂霉素C后1 h达到最高值,之后缓慢下降,8 h后基本趋于稳定,裂解周期较长,约为7 h。而20130726001S01 (D)在添加丝裂霉素C 3 h后生长达到最高值,随后OD660 nm下降,4 h后基本趋于恒定,裂解周期较短,约为1 h。为进一步确定是否携带溶源性噬菌体,对5株副溶血菌在丝裂霉素C为0.5 μg/ml下进行诱导过夜培养,次日,只有A和D两菌株的培养液变澄清,而其他3株菌的培养液并没有变澄清。结果表明A和D两株菌携带溶源性噬菌体。
|
图 3 0.5 μg/ml丝裂霉素C浓度对副溶血弧菌生长的影响 Figure 3 Effects of 0.5 μg/ml mitomycin C on the growth of V. parahaemolyticus strains A. 20130629002S01; B. 20130721001S02; C. 20130722DXES05; D. 20130726001S01; E. 2014VN01S01G |
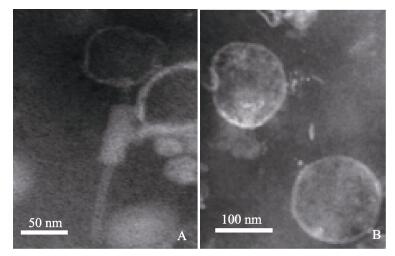
为验证A和D两株菌(20130629002S01和20130 726001S01)内有溶源噬菌体,并验证丝裂霉素C诱导溶源噬菌体的方法的可行性,分别分离5株菌的噬菌体,并进行透射电镜观察。电镜观察结果(图 4)显示,自20130629002S01 (A)分离得到噬菌体Phage1(图 4A)分为头尾两部分,头部为球形,直径约50 nm,有一丝状尾,长约为150 nm,其上有50 nm × 16 nm左右的圆柱形鞘;自20130726001S01 (D)分离得到的噬菌体Phage2 (图 4B),为球形,直径约为120 nm,没有观察到尾部。噬菌体分离和电镜观察结果表明两株菌释放的噬菌体种类不相同。而其余3株副溶血弧菌未分离和观察到噬菌体,表明它们并非溶源性细菌。
|
图 4 噬菌体电镜照片 Figure 4 Transmission electron microscopy of phages A.噬菌体Phage1; B.噬菌体Phage2 |
采用无菌培养的卤虫无节幼体测试5株副溶血弧菌的致病力。各组卤虫无节幼体的存活率用SPSS 18.0进行统计分析(图 5)。结果显示,各组中卤虫无节幼体的存活率都存在显著差异(P < 0.05)。其中,B组(20130721001S02)卤虫存活率最低,该菌株毒力最强。两株含有溶源噬菌体的菌株A (20130629002S01)和D (20130726001S01)的毒力介于B、E (2014VN01S 01G)之间,显著低于菌株B。中卤虫存活率可看出,菌株A和菌株D对卤虫无节幼体的致病性分别为菌株B的60.8%和53.2%。
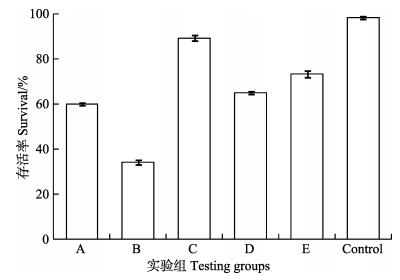
|
图 5 副溶血弧菌对卤虫无节幼体的致病力测试 Figure 5 Virulence testing of 5 isolates of V. parahaemolyticus on Artimia nauplii A. 20130629002S01, B. 20130721001S02, C. 20130722DXES05, D. 20130726001S01, E. 2014VN01S01G, Control, Control group without V. parahaemolyticus |
导致AHPND的副溶血弧菌(VPAHPND)对对虾的致病原因曾引起国际上的广泛关注,Lightner等2012从部分VPAHPND菌株中分离到了溶源性噬菌体,因此怀疑溶源性噬菌体可能与VPAHPND的致病性有关(FAO,2013)。随后的研究表明,VPAHPND对对虾的致病性应该与副溶血弧菌携带了特定的质粒有关(Gomez-Gil et al, 2014; Kondo et al, 2014; Yang et al, 2014),在此之后Lightner等也否定了其原来的观点,但这一过程并没有正式的研究报告。
本研究采用Flegel等(2014)公开的VPAHPND相关的质粒的检测方法,对5株副溶血弧菌进行了PCR检测,表明该5株副溶血弧菌均含有与AHPND相关质粒,说明这5株副溶血弧菌均为AHPND的病原菌,经卤虫无节幼体的感染实验,证明了这5株副溶血弧菌具有不同的致病力,而且PCR所得到较强条带的目标产物的3株菌对卤虫无节幼体的致病力也较强。
丝裂霉素C可用于分离细菌的溶源性噬菌体,不同细菌所采用的丝裂霉素C的浓度有所不同(Oakey et al, 2000; Lan et al, 2009)。本研究用5株副溶血弧菌测试对丝裂霉素C的敏感性,确认0.5 μg/ml为适宜的使用浓度,在此浓度下,有两株副溶血弧菌(2013 0629002S01和20130726001S01)的生长曲线表现出溶源性噬菌体进入烈性周期的趋势,表明只有一部分副溶血弧菌菌株中可能含有溶源性噬菌体,这一结果不支持VPAHPND的致病力是溶血性噬菌体赋予的观点。
超离心收集诱导释放的溶源性噬菌体,经透射电镜下观察,证明上述两株副溶血弧菌的噬菌体提取物中的确存在噬菌体,但这两株副溶血弧菌中的噬菌体形态和大小完全不同,属于两种不同的噬菌体,形态上来看,phage1类似Wang等(2010)的描述,可能属于肌尾病毒科,而phage2可能属于盖病毒科盖噬菌体属(冯书章等, 2007),具体种属有待进一步验证。该结果表明所分离的噬菌体可能与VPAHPND的AHPND致病性无关。
卤虫无节幼体可以作为副溶血弧菌致病力测试的动物模型,其测试结果与副溶血弧菌对对虾的致病力具有相关性。采用卤虫无节幼体对5株副溶血弧菌的致病力测试结果进一步表明,虽然两株含有溶源性噬菌体的副溶血弧菌对卤虫具有致病力,但最高致病力的副溶血弧菌并不含溶源性噬菌体,卤虫致病力的强弱与AHPND相关的质粒有关联,而与溶源性噬菌体的有无无关,噬菌体的存在也没有表现为副溶血弧菌致病力的提升。2014年初,本实验室从副溶血弧菌毒力株中鉴定了毒力相关蛋白VPP19 (GenBank Accession KM035408),这5株副溶血弧菌也含有VPP19基因。Sirikharin等(2014)也从VPAHPND鉴定了可能的毒力蛋白基因,并建立了VPAHPND的PCR检测方法。目前,基因组学比较表明,VPAHPND的毒力是由于染色体外的一个新发现的约70 kb的质粒所赋(Gomez-Gil et al, 2014; Kondo et al; 2014; Yang et al, 2014)。本研究结果进一步表明,部分副溶血弧菌毒力株可能携带溶源性噬菌体,但是溶源性噬菌体与副溶血弧菌的毒力无关。副溶血弧菌毒力株也存在致病力差异,但是,该差异产生的原因与溶源性噬菌体也没有必然联系。
| 冯书章, 刘军, 孙洋. 细菌的病毒—噬菌体最新分类与命名. 中国兽医学报 , 2007, 27 (4) : 604-606 | |
| 张宝存, 刘飞, 边慧慧, 等. 一株凡纳滨对虾病原菌的分离、鉴定及其致病力分析. 渔业科学进展 , 2012, 33 (2) : 56-62 | |
| 张晓君, 梁利国, 阎斌伦, 等. 水产动物致病性副溶血弧菌双重PCR检测方法的研究. 海洋科学 , 2010, 34 (10) : 7-12 | |
| 梅运军, 陈锦, 沈萍. 诱导溶源性嗜盐古生菌产生噬菌体的方法. 生物技术 , 2011, 21 (6) : 58-59 | |
| FAO. Report of the FAO/MARD Technical Workshop on Early Mortality Syndrome (EMS) or Acute Hepatopancreatic Necrosis Syndrome (AHPNS) of Cultured Shrimp (under TCP/VIE/3304) Hanoi, Vietnam, 25-27 June, 2013, FAO Fisheries and Aquaculture Report No. 1053 http://www.fao.org/docrep/018/i3422e/i3422e.pdf | |
| Flegel T, Lo CF. Announcement regarding free release of primers for specific detection of bacterial isolates that cause acute hepatopancreatic necrosis disease (AHPND). NACA News, 2014, http://www.enaca.org/modules/library/publication.php?publication_id=1128 | |
| Gomez-Gil B, Soto-Rodríguez S, Lozano R, et al. Draft genome sequence of Vibrio parahaemolyticus strain M0605, which causes severe mortalities of shrimps in Mexico. Genome Announc , 2014, 2 (2) : e14-e55 | |
| Kondo H, Tinwongger S, Proespraiwong P, et al. Draft genome sequences of six strains of Vibrio parahaemolyticus isolated from early mortality syndrome/acute hepatopancreatic necrosis disease shrimp in Thailand. Genome Announc , 2014, 2 (2) : e214-e221 | |
| Lan SF, Huang CH, Chang CH, et al. Characterization of a new plasmid-like prophage in a pandemic Vibrio parahaemolyticus O3: K6 strain. Appl Environ Microb , 2009, 75 (9) : 2659-2667 DOI:10.1128/AEM.02483-08 | |
| Lightner DV, Redman RM, Pantoja CR, et al. Early mortality syndrome affects shrimp in Asia. Global Aquaculture Advocate , 2012, 15 (1) : 40 | |
| Oakey HJ, Owens L. A new bacteriophage, VHML, isolated from a toxin-producing strain of Vibrio harveyi in tropical Australia. J Appl Microbiol , 2000, 89 (4) : 702-709 DOI:10.1046/j.1365-2672.2000.01169.x | |
| Schryver PD, Defoirdt T, Sorgeloos P. Early mortality syndrome outbreaks: a microbial management issue in shrimp farming?. PLoS Pathog , 2014, 10 (4) : 1-2 | |
| Sirikharin R, Taengchaiyaphum S, Sritunyalucksana K, et al. A new and improved PCR method for detection of AHPND bacteria, 2014, http://www.enaca.org/modules/news/article. php?article_id=2030 | |
| Tran L, Nunan L, Redman RM, et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Dis Aquat Organ , 2013, 105 (1) : 45-55 DOI:10.3354/dao02621 | |
| Wang S, Jiang H, Chen J, et al. Isolation and rapid genetic characterization of a novel T4-like bacteriophage. J Med Coll PLA , 2010, 25 (6) : 331-340 DOI:10.1016/S1000-1948(11)60002-6 | |
| Yang YT, Chen IT, Lee CT, et al. Draft genome sequences of four strains of Vibrio parahaemolyticus, three of which cause early mortality syndrome/acute hepatopancreatic necrosis disease in shrimp in China and Thailand. Genome Announc , 2014, 2 (5) : e814-e816 |



