2. 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266237
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266200
细胞色素CYP450 (Cytochrome CYP450, CYP450)酶系是一类亚铁血红素蛋白的超家族酶系,广泛存在于几乎所有生物体中,参与多种内源物质(保幼激素及其类似物、蜕皮甾酮、脂肪酸和信息素等)和外源物质(药物、环境毒物等)在生物体内的代谢(Danielson, 2002; Matthias et al, 2008; 刘晨晖等, 2010)。在CYP450众多的家族成员中,以CYP1−CYP4家族与药物代谢最为相关,其中,CYP1、CYP2和CYP3酶家族承担着人体2/3药物的代谢(Guengerich, 2007; 樊慧蓉等, 2006)。目前,在甲壳动物中已被证实存在的CYP450基因只有CYP2和CYP4家族基因(冯艳艳等, 2014)。CYP2家族是目前已知的CYP450家族基因中数量最大、种类最多、物种之间同源性最低的家族,参与多种低分子化合物及药物在生物体内的代谢(周园等, 2002),其活性高低决定了药物的代谢速率,直接影响药物的清除率(李国昌等, 2004),从而影响治疗效果和毒性效应。同时,药物、环境污染物等诸多外界因素可诱导或抑制CYP450的活性,从而影响药物的相互作用,导致药物不良反应。研究药物与生物体药物代谢酶的相互作用,有助于阐明水产动物体内药物代谢的规律和机制(马玉忠等, 2008),对于保证水产养殖中安全合理用药、避免药物不良反应、保障水产品安全都具有重要价值。目前,海洋甲壳类有关药物与CYP450基因表达及其酶活性的研究十分有限,仅见中国对虾(李小彦等, 2010; 张喆等, 2012)和三疣梭子蟹(冯艳艳等, 2014),凡纳滨对虾有关CYP2基因的研究尚属空白。
恩诺沙星(Enrofloxacin, EF)为人工合成的第三代喹诺酮类广谱抗菌药,对多种水产动物致病菌具有较强的抑制效果,广泛用于水产动物病害防治。鉴于此,本实验选取恩诺沙星作为外源物质,研究其对凡纳滨对虾肝胰腺CYP2基因表达与其标志酶氨基比林-N-脱甲基酶(APND)活性的影响,为进一步了解甲壳类动物CYP450基因的功能和作用机制,探讨CYP450与药物之间的相互作用奠定基础,为药物在水产养殖上中的合理使用及联用提供一定的理论基础。
1 材料与方法 1.1 实验材料 1.1.1 实验动物健康凡纳滨对虾平均体重为(10.5±1.2) g,购自山东省潍坊市昌邑下营海丰水产养殖有限公司。实验前暂养7 d,充气,流水,水温为(26±1)℃,盐度为(25±1),pH为(8.0±0.4),每日投喂不含药物的配合饲料,投喂量为凡纳滨对虾体重的2%。
1.1.2 实验药品和试剂恩诺沙星原粉,纯度≥98.5%,购于武汉刚正生物科技有限公司;TaKaRa TaqTM、PrimerScript® RT Reagent Kit with gDNA Eraser(Perfect Real Time)和TaKaRa SYBR® Premix Ex TaqTMⅡ(Tli RNaseH Plus)均购自TaKaRa公司;氨基比林和1-苯基-2-硫脲(PTU, 98%)、还原型辅酶(NADPHNa4) (含量≥99.9%)、乙二胺四乙酸二钠(EDTANa2)、α-苯甲磺酰氟(PMSF)及1, 4-二硫苏糖醇(DTT) (99.5%)购自Sigma公司;Trizol Reagent购自美国Invitrogen公司;二乙基焦碳酸酯(DEPC)处理水购自Solarbio公司;考马斯亮蓝试剂盒购自南京建成生物技术公司;其他试剂均为国产分析纯。
1.1.3 实验仪器日立CF16RX落地高速冷冻离心机,超微量紫外可见分光光度计,NanoDrop ND-2000C(基因有限公司),电泳仪(Bio-Rad),凝胶成像仪(Kodak Gel Logic 212 Imaging System),多功能样品匀质器(Precellys 24 Dual),酶标仪(Tecan),Applied Biosystems 7500 Real-Time荧光定量PCR仪。
1.2 实验设计 1.2.1 给药方法根据《新编渔药手册》(杨先乐, 2005)的推荐剂量,设计恩诺沙星低、中、高3个剂量梯度:高剂量组(60 mg/kg,HD)、中剂量组(30 mg/kg,MD)和低剂量组(15 mg/kg,LD),另设1个对照组(CK)。按照凡纳滨对虾每天每千克体重摄食20 g饲料计算,分别拌制不同剂量恩诺沙星药饵。实验用400尾凡纳滨对虾,平均饲养于1–8号养殖池,1、2号养殖池设为对照组,3、4号为高剂量组,5、6号为中剂量组,7、8号为低剂量组,暂养7 d。实验前随机取10尾凡纳滨对虾,取肝胰腺、肠、胃、肌肉等组织进行药物残留检测,确保无恩诺沙星、环丙沙星残留。实验组分别投喂不同剂量恩诺沙星药饵,对照组投喂等量基础饲料,每天早、午、晚各投喂1次,连续投喂7 d。
1.2.2 取样方法分别于最后一次投喂后的1、3、6、9、12、24、48、96 h取样,每个时间点随机取凡纳滨对虾6尾,迅速取肝胰腺组织于液氮中保存备用。
另取10尾健康对照组凡纳滨对虾,抽取0.3 ml血淋巴置于预先装有等体积抗凝剂的离心管中,于5000 r/min转速下离心5 min,弃上清液,保留血细胞,加入Trizol保存备用,同时,取肝胰腺、鳃、肌肉、甲壳、肠、胃、心脏和眼柄液氮保存,用于RNA提取,检测凡纳滨对虾CYP2基因在不同组织中的表达水平。
1.3 总RNA的提取与第一链cDNA的合成取健康凡纳滨对虾各组织(血细胞除外)于液氮中研磨,Trizol法提取总RNA,按照Invitrogen说明书进行;用超微量紫外可见分光光度计(NanoDrop ND-2000C)检测总RNA的纯度和浓度;用1.0%的MOPS琼脂糖凝胶电泳检测总RNA的质量及完整性。然后用PrimerScript RT Reagent Kit with gDNA Eraser试剂盒去除基因组DNA后合成第一链cDNA。产物于−40℃冰箱中保存备用。
1.4 CYP2基因mRNA Real Time RT-PCR定量检测通过凡纳滨对虾转录组(编号:SRR346404)得到CYP2基因部分序列,设计特异性引物用于RT-PCR定量分析,选取β-actin为内参基因(表 1)。将各组凡纳滨对虾肝胰腺的cDNA用DEPC处理水稀释至200 ng/μl,分别加入SYBR Premix Ex TaqTM Ⅱ (2×) 10 μl,PCR正反引物(10 μmol/L)各0.8 μl,ROX Reference Dye Ⅱ 0.4 μl,cDNA稀释模板2 μl,灭菌水6 μl,配制成20 μl体系反应液。荧光定量PCR反应条件为: 95℃ 30 s,95℃ 5 s,60℃ 34 s,40个循环。不同时间点同一样品的目的基因和内参基因均在同一个96孔板上进行,每个样品设3个平行。
|
|
表 1 凡纳滨对虾CYP2基因表达量分析所用引物 Table 1 Primers used in the analysis of CYP2 gene mRNA expression in Litopenaeus vannamei |
肝胰腺S9的制备参照张喆等(2012)的方法进行。APND活性的测定参照Schenkman等(1967)改进的方法进行。使用考马斯亮蓝蛋白定量测试盒(南京建成生物研究所)完成组织蛋白含量的测定。
1.6 数据处理与分析采用2−ΔΔCt法分析荧光定量数据,用SPSS 17.0软件对实验结果进行单因素方差分析(当P < 0.05为差异显著,P < 0.01为差异极显著)。
2 结果 2.1 CYP2基因表达量测定 2.1.1 CYP2基因在凡纳滨对虾各组织中的表达利用RT-PCR检测CYP2基因在凡纳滨对虾组织中的转录表达情况。结果显示,CYP2基因在肝胰腺、甲壳、肠、鳃、血淋巴、肌肉、胃、心脏和眼柄中均有表达。以血淋巴中基因表达量为参照,CYP2在肝胰腺中表达量最高,其次是胃,在血淋巴中表达最低(图 1)。

|
图 1 凡纳滨对虾CYP2基因在组织中的表达量 Figure 1 Levels of CYP2 transcript in different tissues of L. vannamei |
利用RT-PCR检测凡纳滨对虾在投喂不同剂量的恩诺沙星后肝胰腺中CYP2基因表达量的变化情况(图 2)。结果显示,连续投喂恩诺沙星7 d后,除1 h、24 h和96 h外,实验组较对照组表达量均显著下调(P < 0.05),各剂量组在取样时间9 h表达量下调幅度最大且极显著低于对照组(P < 0.01);高剂量组除96 h外,其他取样点的表达量均极显著低于对照组(P < 0.01)。对于同一测定时间,恩诺沙星对CYP2基因的抑制作用基本呈现剂量效应,即高剂量组 > 中剂量组 > 低剂量组。
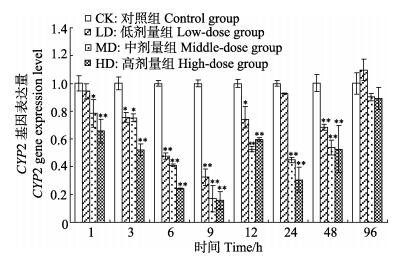
|
图 2 不同浓度恩诺沙星对凡纳滨对虾肝胰腺CYP2基因表达的影响 Figure 2 The expression of CYP2 gene in L. vannamei hepatopancreas after enrofloxacin administration * P < 0.05;** P < 0.01 |
由图 3可知,3个剂量恩诺沙星对凡纳滨对虾肝胰腺APND活性呈现明显的抑制作用,在取样时间12 h,各剂量组APND活性均达到最低值且极显著低于对照组(P < 0.01)。9 h后,低剂量组和中剂量组酶活性均显著低于对照组(P < 0.05),高剂量组除3 h外,其余各时间点酶活性均极显著低于对照组(P < 0.01)。对于同一时间点,恩诺沙星对APND活性的抑制作用基本呈现剂量效应,即高剂量组 > 中剂量组 > 低剂量组。

|
图 3 不同浓度恩诺沙星对凡纳滨对虾肝胰腺APND活性的影响 Figure 3 The APND activity in L. vannamei hepatopancreas after enrofloxacin administration * P < 0.05;** P < 0.01 |
细胞色素CYP450是一个庞大的基因超家族,在生物体中广泛分布且功能多样,能够催化多种外源性化学物质以及内源化合物的氧化反应,负责超过80%药物的代谢。CYP2是CYP450超家族中一类重要的药物代谢酶,在海洋无脊椎动物中的研究主要集中在基因克隆与功能分析方面。本研究首次从凡纳滨对虾转录组获得CYP2基因片段,并通过RT-PCR方法研究其组织表达分布情况。结果显示,CYP2基因在凡纳滨对虾体内呈组成型分布,在肝胰腺中的表达量显著高于其他组织。Gonzalez (1993)研究发现,CYP2A1只在哺乳动物的肝脏中表达;Brown等(1998)研究了CYP450在鱼体各组织中的表达情况,发现CYP450在脾和肾中表达水平较高;朱磊等(2011)研究发现,CYP3A在异育银鲫肝和肠组织中转录水平最高。Matsuo等(2008)等对银大马哈鱼(Oncorhynchus kisutch) CYP1A、CYP2K1、CYP2M1和CYP3A27的表达进行了研究,发现CYP1A、CYP2M1和CYP3A27在各组织中均有表达,而CYP2K1只在肝脏和嗅觉器官中表达。由以上研究可见,CYP基因在不同种属生物体内的表达具有组织选择性,肝脏作为药物代谢的重要器官,其表达优势均强于其他器官,这种表达优势是由不同器官的特异性功能决定的。
甲壳动物由于生活环境的特殊性会接触到许多外来物质,生物体对外来物质的清除主要通过肝脏系统CYP450基因表达进行,这些基因的酶产物催化外来物质极性化,使之更易排出体外(范岚等, 2009)。同时,CYP450的转录表达容易受到外源物质的影响,外源物质可以诱导或者抑制CYP450,从而影响治疗效果或产生毒副作用。刘树民等(2006)发现,黄药子可诱导大鼠肝脏中CYP2E1基因的表达,黄药子和当归配伍后,CYP2E1基因的表达下降。冯艳艳等(2014)研究发现,磺胺嘧啶对三疣梭子蟹CYP2 mRNA的表达有显著诱导作用,且给药剂量越大,基因上调水平越高。本实验研究了不同恩诺沙星剂量及作用时间对CYP2表达的调控,发现该药物可显著抑制凡纳滨对虾体内CYP2 mRNA的表达,呈现出一定的剂量效应和时间效应,这可能与给药次数多、时间长而导致药物在凡纳滨对虾体内的残留时间较长有关。恩诺沙星进入生物体后不断被P450酶代谢生成环丙沙星,环丙沙星也进行自身的代谢,使药物在机体内不断积累。给药浓度越高,药物在组织中的积累量越多,对CYP2的抑制作用越明显。随着给药时间的推移,恩诺沙星及其代谢产物不断被药物代谢及转运链中的Ⅲ相药物流出泵排出体外,组织中药物浓度降低,导致CYP2 mRNA表达量慢慢升高至对照组水平。
在甲壳动物中,APND主要反映CYP2家族同工酶的活性(冷欣夫等, 2001)。很多研究表明,药物剂量能够显著影响药物对酶活性的影响。草鱼(Ctenopharyngodon idellus)连续注射剂量为50 mg/kg和80 mg/kg的利福平3 d后,肝微粒体APND活性被诱导,且随着药物浓度的升高呈现先升高后降低的趋势(Li et al, 2008)。韩华等(2010)研究发现,黄岑苷对牙鲆CYP1A的诱导作用呈现出明显的剂量-效应关系,药物剂量越高,诱导作用越大。本实验在研究恩诺沙星对凡纳滨对虾APND活性影响时也发现了这种剂量影响效应的现象,凡纳滨对虾连续用药7 d后,恩诺沙星对其抑制作用由高到低依次为:高剂量组、中剂量组、低剂量组。在取样初期,实验组APND活性即被抑制,3 h略有上升,这可能是机体在受到外来物质刺激后所表现出的一种自我保护,以此缓解抑制效应对生物体机能产生的影响。随着时间的延长,药物在机体组织中的浓度不断升高,APND活性的下降幅度更大,在12 h各剂量组活性达到最低值且极显著低于对照组(P < 0.01),24 h后APND活性逐渐升高。这与前述的CYP2基因表达量随剂量和作用时间的变化趋势基本一致。区别在于,CYP2基因表达量在9 h达到最低值,96 h与对照组无差异;而APND活性在12 h达到最低值,96 h仍显著低于对照组(P < 0.05)。这可能是由于药物进入机体后首先刺激基因的转录过程,进而影响蛋白质的翻译,最终使酶的蛋白含量和活性降低,所以,恩诺沙星对CYP2基因的抑制效应在时间上早于对酶活性的抑制效应。这与漏芦(Rhaponticum uniflorum)抑制大鼠CYP1A1活性的机制类似(吴宁等, 2007)。
恩诺沙星作为第三代喹诺酮类药物,以其卓越的疗效在水产养殖中得到广泛使用。近年来,由于临床上与喹诺酮类药物联合用药的增多,有关药物相互作用也随之出现,酶抑制引起的药物相互作用约占全部相互作用的70%。药物在体内主要靠P450酶进行代谢,研究表明,喹诺酮类药物对大鼠各组织中的CYP2C活性存在不同程度的抑制作用(姚欣等, 2006);张喆等(2012)研究发现,诺氟沙星对中国对虾(Fenneropenaeus chinensis)肝胰腺、鳃及血清中的APND、ECOD酶均有显著抑制作用,与本研究结果一致。但也有文献报道,氟甲喹对虹鳟(Oncorhynchus mykiss)和异育银鲫(Carassius gibelio) EROD活性具有诱导作用(Mouto et al, 1998; 胡晓等, 2011),虽然同为喹诺酮类药物,但该研究结果与本研究结果并不相同,这可能与药物的分子结构及靶向动物不同有关。有关喹诺酮类药物抑制P450酶的机制,目前尚不清楚。Fuhr等(1993)认为,喹诺酮类药物分子中8位上没有取代基(即萘啶环或奎啉环C8与一个氢相连)或者7位哌嗪基3′和4′无甲基等取代基,则其抑制作用强,这解释了为什么环丙沙星对CYP450有较强的抑制作用。对于恩诺沙星而言,虽然其哌嗪环上7位哌嗪基的4′位有1个乙基取代基,但由于其在生物体内部分被P450酶代谢脱去乙基生成环丙沙星,因此,恩诺沙星仍表现出较强的抑制CYP450的能力。
本研究结果显示,恩诺沙星对凡纳滨对虾CYP2 mRNA表达及APND活性呈现显著抑制作用,且具有一定的时间和剂量效应,提示恩诺沙星可能会导致一些经CYP2代谢的药物生物利用度增加,从而有可能引起药物间的相互作用。此外,恩诺沙星在凡纳滨对虾体内的代谢和残留规律表明,其在凡纳滨对虾体内的半衰期长,消除缓慢(赵海军等, 2010),在药物联用中可能会导致药物相互作用更为严重。因此,在养殖实践中,当恩诺沙星与其他药物合并用药时,应充分考虑恩诺沙星对CYP2的抑制作用,而导致经其代谢的药物在对虾体内的蓄积和毒性增强。
| 马玉忠, 刘玉芝, 仲飞, 等.安妥明对大鼠细胞色素酶P4503A1的影响. 2008, 16(1): 82-84 http://mall.cnki.net/magazine/article/nysb200801017.htm | |
| 冯艳艳, 李健, 张德宁, 等. 三疣梭子蟹(Portunus trituberculatus)CYP2基因的cDNA克隆及表达分析. 海洋与湖沼 , 2014, 45 (5) : 997-1005 | |
| 朱磊, 胡晓, 房文红, 等. 异育银鲫P450家族CYP3A136基因的克隆与表达. 水产学报 , 2011, 35 (10) : 1450-1457 | |
| 刘树民, 张琳, 李颖, 等. 黄药子与当归配伍对大鼠肝脏CYP1A2、CYP2E1基因mRNA表达的影响. 中药药理与临床 , 2006, 22 (3) : 97-98 | |
| 刘晨晖, 乐江. 细胞色素P450 CYP2E1酶构型特征及其表达调控机制的研究进展. 中国药理学与毒理学杂志 , 2010, 24 (2) : 155-160 | |
| 李小彦, 李健, 张喆, 等. 黄芩苷对中国对虾细胞色素P450酶及谷胱甘肽-S-转移酶活性的影响. 中国海洋大学学报 , 2010, 40 (3) : 49-53 | |
| 李国昌, 陈卫军, 蒲宇红. 细胞色素P450酶系与药物的代谢. 农垦医学 , 2004, 26 (1) : 26-29 | |
| 杨先乐. 新编渔药手册. 北京: 中国农业出版社, 2005 : 199 -210. | |
| 吴宁, 李红梅, 吴青青, 等. 漏芦对细胞色素P450酶活性及mRNA表达影响. 中国公共卫生 , 2007, 23 (7) : 827-829 | |
| 冷欣夫, 邱星辉. 细胞色素P450酶系的结构、功能与应用前景. 北京: 科学出版社, 2001 : 84 -95. | |
| 张喆, 李健, 陈萍, 等. 诺氟沙星对中国明对虾鳃和血清ECOD, APND和GST活性的影响. 中国水产科学 , 2012, 19 (3) : 514-520 | |
| 范岚, 谢海棠, 李智, 等. 黄芩苷对Chang Liver细胞CYP3A4、CYP2C9和CYP2C19表达的影响. 中国现代医学杂志 , 2009, 19 (23) : 3546-3550 | |
| 周园, 胡艳丽, 李丽燕, 等. 细胞色素P450酶的研究进展. 农垦医学 , 2002, 24 (3) : 224-226 | |
| 胡晓, 房文红, 汪开毓, 等. 氟甲喹对异育银鲫细胞色素CYP450主要药酶的影响. 中国水产科学 , 2011, 18 (2) : 392-399 | |
| 姚欣, 钱元恕. 氟喹诺酮类药物对大鼠肝外组织药物代谢酶的影响. 中国新药与临床杂志 , 2006, 25 (2) : 87-90 | |
| 韩华, 李健, 李吉涛, 等. 黄芩苷对牙鲆肝CYP1A酶活性及基因表达的影响. 中国水产科学 , 2010, 17 (5) : 1121-1127 | |
| 樊慧蓉, 和凡, 刘昌孝. Cocktail探针药物法用于评价细胞色素P450同工酶影响的研究进展. 中国药学杂志 , 2006, 41 (14) : 1045-1048 | |
| Brown DJ, Clark GC, Van Beneden RJ. A new cytochrome P450(CYP30) family identified in the clam, Mercenaria mercenaria. Comp Biochem Phys C , 1998, 121 (1-3) : 351-360 | |
| Danielson PB. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans. Curr Drug Metab , 2002, 3 (6) : 561-597 DOI:10.2174/1389200023337054 | |
| Fuhr U, Strobl G, Manaut F, et al. Quinolone antibacterial agents: relationship between structure and in vitro inhibition of the human cytochrome P450 isoform CYP1A2. Mol Pharmacol , 1993, 43 (2) : 191-199 | |
| Guengerich FP. Cytochrome P450 and chemical toxicology. Chem Res Toxicol , 2007, 21 (1) : 70-83 | |
| Gonzalez FJ. Cytochrome P450 evolution and nomenclature. Sehenkman JB, Greim H. Handbook of Experimental Pharmacology. Berlin: Springer, 1993 : 211 -219. | |
| Li D, Yang XL, Zhang SJ, et al. Effects of mammalian CYP3A inducers on CYP3A-related enzyme activities in grass carp (Ctenopharyngodon idellus): Possible implications for the establishment of a fish CYP3A induction model. Comp Biochem Phys C: Toxicol Pharmacol , 2008, 147 (1) : 17-29 DOI:10.1016/j.cbpc.2007.07.003 | |
| Matsuo AYO, Gallagher EP, Trute M, et al. Characterization of Phase I biotransformation enzymes in coho salmon (Oncorhynchus kisutch). Comp Biochem Phys C , 2008, 147 (1) : 78-84 | |
| Matthias D, Sabine E, Chimene A, et al. Cloning, expression and characterization of CYP102A7, a self-sufficient P450 monooxygenase from Bacillus licheniformis. Appl Microbiol Biot , 2008, 79 (6) : 931-940 DOI:10.1007/s00253-008-1500-8 | |
| Mouto KA, Burke MD, Houlihan DF. Hepatic P450 monooxygenase response in rainbow trout (Oncorhynchus mykiss (Walbaum) administered aquaculture antibiotics. Fish Physiol Biochem , 1998, 18 (1) : 97-106 DOI:10.1023/A:1007765227501 | |
| Schenkman JB, Remmer H, Estabrook RW. Spectral studies of drug interaction with hepatic microsomal cytochrome. Mol Pharmacol , 1967, 3 : 113-123 |



