2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266237
2. College of Fishery and Life Sciences, Shanghai Ocean University, Shanghai 201306 ;
3. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266200
微孢子虫是由孢子形成的单细胞寄生虫,只能寄生于动物宿主细胞内,属于细胞内寄生虫。大部分的动物物种以及人类会被微孢子虫寄生(Stentiford et al, 2007; Lom et al, 2002),昆虫等无脊椎动物微孢子虫感染也有广泛报道(王维娜等, 2001)。微孢子虫也是甲壳类常见寄生虫疾病的病原。早期发现寄生于对虾体内的微孢子虫属有八孢虫属(Thelohania)、微粒子虫属(Nosema)和匹里虫属(Pleistop hora)(Lightner, 1985)1)。微粒子虫属的微孢子虫主要寄生在对虾肌肉组织。匹里虫属不仅寄生肌肉组织,同时还侵染心脏、鳃、胃、肝脏及肠等组织。中国已经报道的感染微孢子虫的对虾有凡纳滨对虾(Litopenaeus vannamei)、脊尾白虾(Palaemon carincauda)以及中国明对虾(Fenneropenaeus chinensis) (郝斌等, 1984; 王元等, 2013; 吴兴泰, 2010)。
1) Lightner DV. A review of the diseases of cultured penaeid shrimps and prawns with emphasis on recent discoveries and developments. Proceedings of the First International Conference on the Culture of Penaeid Prawns/Shrimps, 1985
虾肝肠胞虫(Enterocytozoon hepatopenaei, EHP)于2009年在泰国养殖的生长缓慢的斑节对虾(Penaeus monodon)中首次被分离和命名(Tourtip et al, 2009),属于微孢子虫科、肠胞虫属。在泰国养殖的出现白便综合征的凡纳滨对虾中也出现较高的检出率,但通过人工感染实验证明,EHP并不是引起凡纳滨对虾白便综合征的病原微生物(Amornrat et al, 2013)。与之前所报道的感染对虾的微孢子虫不同,新报道的EHP只侵染对虾肝胰腺组织。泰国学者已经报道了PCR法、地高辛标记核酸探针原位杂交法以及LAMP检测方法(Amornrat et al, 2013; Suebsing et al, 2013; Tourtip et al, 2009)检测寄生于斑节对虾和凡纳滨对虾肝胰腺中的EHP,但这些检测方法只能对该种病原微生物进行定性描述,无法进行定量研究。
为了定量了解EHP感染对对虾生长的影响,本研究采用SYBR Green I荧光染料法建立了EHP的实时定量PCR(qPCR)检测技术,探讨了实际生产中对虾肝胰腺组织中EHP含量与对虾生长情况的关系。
1 材料与方法 1.1 病料来源分别于2013年7月自浙江台州(样品编号20130722001–20130722003)、2014年8月自江苏赣榆(样品编号20140829001–20140829054)、2014年10月自海南儋州(样品编号20140910101–20140910113和20140911101–20140900118)、2014年12月自山东即墨(样品编号20141222001–20141222012)采集的凡纳滨对虾,采样时逐尾测量对虾生物学体长,并解剖取出对虾肝胰腺,用RNALater分别保存或冰冻,带回实验室。
1.2 样品肝胰腺总DNA的提取取样品肝胰腺组织约20 mg,用3倍体积的70%乙醇洗涤除去RNALater,利用海洋动物组织基因组DNA提取试剂盒(天根生化科技有限公司,北京)提取样品肝胰腺总DNA (HpDNA),核酸分析仪(NanoDrop 2000c, Thermo)测定样品HpDNA浓度后–20℃保存。
1.3 EHP引物设计及常规PCR扩增根据GenBank上公布的肠胞虫属SSU rDNA的一段序列(序列号KF362129),利用Primer Premier 5.0设计1对特异性引物ENF185 (5'-GTA GCG GAA CGG ATA GGG-3')和ENR185 (5'-CCA GCA TTG TCG GCA TAG -3'),预计扩增目的片段大小为185 bp。PCR扩增体系为25 μl,包含2.5 μl 10×PCR缓冲液、1.5 μl MgCl2 (25 mmol/L)、2 μl dNTP (10 mmol/L)、ENF185 (10 mmol/L)和ENR185 (10 mmol/L)各0.5 μl、0.1 μl Taq DNA聚合酶(5 U/ml)(TaKaRa, 大连)。反应程序为94℃预变性3 min,94℃ 20 s、60℃ 20 s和72℃ 30 s共35个循环,72℃延伸5 min。
1.4 标准品模板的制备以EHP阳性样品DNA为模板,用上述设计的引物ENF185/ENR185进行常规PCR扩增获取目的产物,用pMD18-T载体在E. coli DH5α中克隆,克隆的片段送上海生工测序验证。目的产物的克隆经扩大培养后,用质粒提取试剂盒(上海生工)提取质粒DNA。用核酸分析仪(NanoDrop 2000c, Thermo)测定重组质粒DNA浓度为26.3 ng/μl,换算成拷贝数为8.3×109 copies/μl,将该重组质粒作为本实验标准品原液,–80℃保存。
1.5 虾肝肠胞虫实时荧光定量PCR方法的建立以及条件的优化虾肝肠胞虫实时荧光定量PCR (qPCR-EHP)反应体系参照SYBR® Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)试剂盒(TaKaRa, 大连)说明在冰上配制,25 μl的反应体系含SYBR® Premix Ex TaqTM Ⅱ,不同终浓度(0.1– 1.0 μmol/L)的引物ENF185/ENR185和8.3×103 copies/μl标准品为模板。扩增反应在实时荧光定量PCR仪(Bio-Rad CFX96)中进行。95℃预变性30 s后,进行95℃ 10 s和X℃ 45 s (X为退火温度梯度,设定范围为50–65℃)的40个循环扩增,选择最佳退火温度。扩增完成后测定产物的熔解曲线。
1.6 qPCR-EHP标准曲线的绘制将构建好的质粒标准品进行10倍梯度稀释,共得到8.3×109–8.3×100 copies/μl的10个梯度,每个梯度3个平行,利用上述优化的条件进行qPCR,建立质粒标准品拷贝数与Ct值对应的标准曲线。通过分析标准曲线相关系数以及扩增效率来判断标准曲线的质量。
1.7 qPCR-EHP引物的特异性分析分别选择传染性皮下及造血组织坏死病毒(IHHNV)阳性的凡纳滨对虾总DNA、肝胰腺细小病毒(HPV)阳性的中国明对虾总DNA、纯化白斑综合征病毒(WSSV)的核酸、感染副溶血弧菌的凡纳滨对虾总DNA,健康凡纳滨对虾总DNA为阴性对照,以水为模板的空白对照,通过qPCR-EHP检测,分析引物的特异性。
1.8 qPCR-EHP重复性实验重复性实验包括组内重复和组间重复,组内重复利用同一次实验中每个梯度3个平行的Ct均值和方差来分析,并计算组内变异系数;组间重复主要根据标准品–20℃储存30 d后扩增标准曲线的稳定性来评定,利用Excel对Ct值进行方差分析,用SPSS软件进行显著性检验分析。
1.9 qPCR-EHP与常规PCR灵敏度的比较取不同梯度的重组质粒标准品作为模板,采用引物ENF185/ENR185,对1.2常规PCR检测方法和1.4的qPCR-EHP进行比较,以对比两种检测方法的灵敏度。
1.10 qPCR-EHP与套式PCR在样品检测上的比较取采集自海南的31份凡纳滨对虾肝胰腺样品,用qPCR-EHP和Amornrat等(2013)报道的套式PCR检测方法同时进行检测,对比qPCR-EHP与套式PCR两种检测方法结果的差异。
1.11 肝胰腺中EHP载量指数与对虾生长关系的测定对采集自不同地区的怀疑是EHP引起的生长大小差异明显的对虾肝胰腺样品进行了单尾qPCR-EHP检测,以每ng HpDNA中EHP SSU rDNA的相对拷贝数的对数为EHP载量指数(Exponential relative copies, ERC),结合样品采集时测量的对虾单尾生物学体长分析EHP感染后对对虾生长的影响,利用Excel绘制对虾生物学体长与EHP载量指数的散点图,并对相同体长样品SSU rDNA拷贝数求平均值后计算EHP平均载量指数,分析样品生物体长与EHP载量指数二者之间的相关性。
2 结果 2.1 qPCR-EHP扩增条件的建立采用8.3×103 copies/μl的含有SSU rDNA基因的扩增目标产物的克隆质粒DNA的标准品为模板进行qPCR-EHP扩增条件的建立,确定了EHP SSU rDNA基因的qPCR-EHP扩增体系,其中,引物ENF185和ENR185在反应体系中的最佳浓度为0.2 μmol/L。即25 μl qPCR-EHP体系中,含2×SYBR®Premix Ex TaqTM Ⅱ 12.5 μl,10 μmol/L引物ENF185和ENR185各0.5 μl,50 ng/μl DNA模板1 μl。退火温度为60℃时,扩增效率和引物特异性最佳,确定qPCR-EHP反应条件为95℃ 30 s预变性,95℃ 10 s和60℃ 45 s,40个循环。
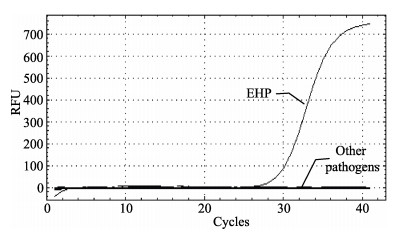
2.2 qPCR-EHP引物特异性检测在NCBI上BLAST本实验设计的EHP SSU rDNA目的片段的引物ENF185和ENR185,没有搜索到与其匹配的其他病原核酸序列。针对IHHNV阳性的凡纳滨对虾总DNA、HPV阳性的中国明对虾总DNA、纯化WSSV的核酸、感染副溶血弧菌的凡纳滨对虾总DNA、健康凡纳滨对虾总DNA以及水为模板的空白对照,用引物ENF185和ENR185进行qPCR-EHP,其扩增曲线显示(图 1),除了EHP的常规PCR为阳性的样品有扩增曲线外,其余样品以及阴性对照均没有检测到荧光信号。
|
图 1 虾肝肠胞虫SSU rDNA qPCR扩增曲线 Figure 1 The amplification curve of specific detection of microsporidian E. hepatopenaei |
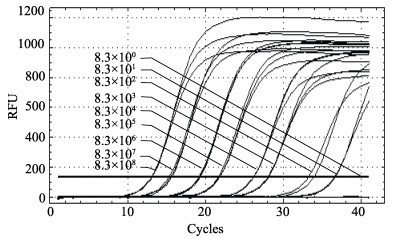
qPCR-EHP结果显示,所用的标准模板在8.3×108– 8.3×101 copies/μl之间均有较强的荧光信号(图 2),而且扩增曲线呈现标准的S型曲线,在模板浓度为8.3× 100 copies/μl时经40个循环扩增,未检测到扩增的荧光信号,说明qPCR-EHP至少可以检测到8.3×101 copies/μl的模板,具有较高的灵敏度。
|
图 2 虾肝肠胞虫SSU rDNA的质粒标准模板的qPCR扩增曲线 Figure 2 Amplification curves of qPCR for E. hepatopenaei SSU rDNA with plasmid standard templates |
常规PCR采用8.3×105–8.3×101 copies/μl质粒标准为模板,经35个循环扩增后产物电泳分析,结果显示,该对引物通过常规PCR能检测到最低为8.3× 102 copies/μl的模板,但在该浓度下电泳条带亮度特别弱,几乎看不到(图 3),说明qPCR-EHP至少比常规PCR定性检测的灵敏度高1个数量级。

|
图 3 虾肝肠胞虫SSU rDNA常规PCR扩增的灵敏度测试 Figure 3 Sensitivity test of normal PCR for E. hepatopenaei SSU rDNA with plasmid standard template M. DL2000; 1. 8.3×100 copies/μl; 2. 8.3×101 copies/μl; 3. 8.3×102 copies/μl; 4. 8.3×103 copies/μl; 5. 8.3×104 copies/μl; 6. 8.3×105 copies/μl |
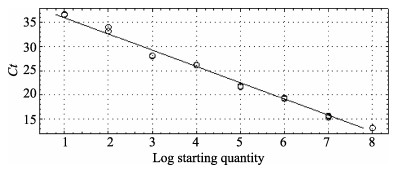
利用优化后的qPCR-EHP体系,对10倍梯度稀释的9个EHP的标准模板(8.3×108–8.3×100 copies/μl)进行扩增,建立扩增产物阈值循环数Ct值与标准模板起始量的对数值[log(Sq)]之间对应关系的标准曲线。质粒标准模板在8.3×108–8.3×101 copies/μl范围内有明显扩增,每个浓度的3个平行Ct值的差异符合qPCR要求。qPCR-EHP的扩增产物阈值循环数Ct值与标准模板起始量的关系曲线为Ct=–3.369 log(Sq) + 39.364,R2=0.992(图 4),扩增效率为98.1%。
|
图 4 虾肝肠胞虫SSU rDNA的qPCR扩增的标准曲线 Figure 4 The standard curve of qPCR for SSU rDNA of microsporidian E. hepatopenaei |
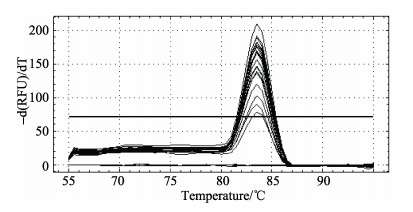
由扩增产物的熔解曲线可以看出(图 5),每个梯度的扩增产物的熔解曲线都是单一的熔解峰,出现位置重叠,Tm值为83.5℃,表明扩增过程中没有非特异性扩增和引物二聚体。样品检测过程中通过扩增产物的熔解曲线(Tm值为83.5℃)分析检测结果的特异性。
|
图 5 虾肝肠胞虫SSU rDNA标准品的qPCR扩增的熔解曲线 Figure 5 Melting curves of qPCR for SSU rDNA of EHP with standard plasmid as the template |
选取8.3×107–8.3×101 copies/μl的7个浓度梯度标准模板,每个梯度3个平行进行qPCR-EHP,计算Ct值的均值、方差以及变异系数(表 1)。结果显示,组内3个平行Ct值基本一致,变异系数小于1%,而且没有显著的模板浓度相关性,表明组内重复性满足要求。
|
|
表 1 虾肝肠胞虫SSU rDNA qPCR检测组内重复性 Table 1 Intra-group variability of qPCR for E. hepatopenaei |
组间重复性实验选用放置在–20℃下8.3×107– 8.3×101 copies/μl的6个浓度梯度标准品进行分析(表 2),对比即时稀释和存放30 d的两组标准品的扩增数据,结果显示,7个浓度梯度显著性分析结果P>0.05,说明储存–20℃下30 d和即时稀释的标准品扩增的标准曲线差异不显著,组内和组间重复性结果均表明,构建的方法具有良好的重复性。
|
|
表 2 虾肝肠胞虫SSU rDNA qPCR检测组间重复性 Table 2 Inter-group variability of qPCR for E. hepatopenaei |
于海南儋州某对虾养殖场,分别采集出现生长缓慢的两个池塘的31份凡纳滨对虾,编号为20140910101–20140910113、20140911101–20140911118共,同时进行套式PCR和qPCR-EHP检测。套式PCR检测结果显示,共有10份样品为阳性,阳性检出率为32.2%。qPCR-EHP检测结果显示,全部样品中21份样品有扩增曲线,阳性检出率为67.7%,根据Ct值换算出的EHP SSU rDNA的量为8.50×101– 1.42×107 copies/μl。qPCR-EHP和套式PCR样品检测结果显示,11份qPCR-EHP为阳性的样品套式PCR检测结果为阴性(表 3),这些检测结果差异显示,qPCR-EHP检测的DNA样品中EHP的SSU rDNA拷贝数低于3.28×102 copies/μl时,套式PCR检测结果均为阴性。在2.3中测定得出qPCR-EHP的检测灵敏度为8.3×101 copies/μl,说明对实际样品的检测时,qPCR-EHP的检测灵敏度比套式PCR高约4倍。
|
|
表 3 肝肠胞虫套式PCR和qPCR-EHP对实际样品检测的比较 Table 3 Comparison between nested PCR and qPCR for detecting E. hepatopenaei samples from farms |
对采集自海南儋州、山东即墨和江苏赣榆3个养殖场的凡纳滨对虾样品进行了逐尾体长测定和肝胰腺组织中EHP的qPCR-EHP检测。这3批凡纳滨对虾样品均为放苗养殖且相同批内来源,但批内均表现出个体大小不均匀,表明部分个体生长缓慢。江苏54尾凡纳滨对虾样品为幼虾,平均体长为(3.26±0.79) cm,分布在2.1–4.7 cm范围内。qPCR-EHP检测结果均为阳性(图 6),平均EHP载量指数(Exponential relative copies of EHP) ERCEHP为3.42±1.23,与对虾体长呈轻微负相关性(R=–0.2681)。体长为2.1–4.2 cm时,ERCEHP均值为3.58±1.18,二者相关性不明显(R=–0.0876);而体长为4.3–4.7 cm时,ERCEHP均值为2.50±1.19,二者呈现出明显的负相关性(R=–0.7128)。ERCEHP在体长为3.41时达到其与生长率相关性变化的拐点,表明EHP在组织中的相对载量为2.6×103 copies/(ng HpDNA)左右时已达到较高的风险水平。
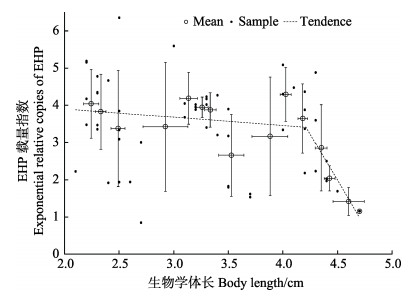
|
图 6 采集自江苏的凡纳滨对虾肝胰腺中EHP载量指数与对虾体长的相关性 Figure 6 Correlation between the body length and exponential relative copies of EHP in hepatopancreas of L. vannamei collected from a farm in Jiangsu Province |
海南27尾凡纳滨对虾样品平均体长为(4.89±1.06) cm,分布在3.4–7.7 cm范围内。qPCR-EHP检测结果统计显示(图 7),ERCEHP与对虾体长呈现负相关性(R=–0.4198)。有9尾对虾在40个循环的qPCR-EHP检测中未出现扩增信号,检测结果为阴性,阴性样品的平均体长为(4.94±0.98) cm。qPCR-EHP检测结果为阳性的对虾为18尾,平均体长为(4.86±1.12) cm,阴性和阳性对虾样品的体长未表现出显著性差异(P > 0.05)。但在阳性检出的样品中,体长为4.0–4.4 cm的12尾对虾肝胰腺中的ERCEHP平均为3.80±2.06,与体长呈较明显的负相关(R=–0.5009),其中,EHP SSU rDNA相对拷贝数高于105 copies/(ng HpDNA)的3尾对虾的体长均在4.3 cm以内;体长5 cm以上的6尾对虾的肝胰腺ERCEHP平均为2.44±1.45,与体长仍呈弱的负相关性(R=–0.4413),但其线性下降显得稍平缓。ERCEHP为2.95时,达到其与体长相关性变化的拐点,表明肝胰腺组织中EHP SSU rDNA相对拷贝数在900 copies/(ng HpDNA)左右时达到较高的风险水平。

|
图 7 采集自海南的凡纳滨对虾肝胰腺中相对EHP载量指数与对虾体长的相关性 Figure 7 Correlation between the body length and exponential relative copies of EHP in hepatopancreas of L. vannamei collected from a farm in Hainan Province |
山东即墨12份样品为养殖4个月的凡纳滨对虾,平均体长为(7.28±1.57) cm,体长分布范围为5.0–10.5 cm,明显小于同期生长正常的对虾,而且体长差异大。qPCR-EHP检测结果分析显示(图 8),ERCEHP平均值为3.13±0.45,与体长呈弱的负相关性(R=–0.2252),EHP SSU rDNA在对虾肝胰腺中的平均相对拷贝数已达(2.07±1.78)×103 copies/(ng HpDNA)水平,即已经是较高的感染水平。
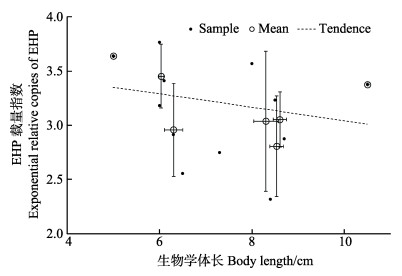
|
图 8 采集自山东的凡纳滨对虾肝胰腺中相对EHP载量指数与对虾体长的相关性 Figure 8 Correlation between the body length and exponential relative copies of EHP in hepatopancreas of L. vannamei collected from a farm in Shandong Province |
虾肝肠胞虫(Enterocytozoon hepatopenaei)自2009年泰国养殖的斑节对虾首次被鉴定和命名(Tourtip et al, 2009),本实验室采集的样品检测结果显示,最早在我国养殖的日本囊对虾、凡纳滨对虾以及罗氏沼虾样品中也检出了该病原。此外,虾肝肠胞虫还在印度、印度尼西亚、越南、马来西亚等国家的养殖对虾中检出(Sritunyalucksana et al, 2014)。目前,未观察到虾肝肠胞虫的感染如同白斑综合征(WSD)、黄头病(YHD)和副溶血弧菌(V. parahaemolyticus)引起的急性肝胰腺坏死(AHPND)等导致对虾大量死亡的情况,但其导致对虾生长缓慢的问题给对虾养殖业带来了巨大损失,而且在AHPND的掩盖下传播范围逐渐扩大,需要引起高度重视。
微孢子虫个体小于细胞,难以通过镜检观察到,分子检测是微孢子虫的有效检测手段,qPCR与常规PCR相比具有灵敏度高、重复性好、高通量等优点,而且qPCR扩增产物无需电泳分析,整个检测过程在封闭的PCR管中进行,结果可以根据扩增曲线直接判定,避免电泳过程中的产物污染,同时,相比常规PCR检测方法缩短了检测时间。常用的两种qPCR方法包括TaqMan探针法和SYBR Green I荧光染料法。TaqMan探针法检测特异性更高,但检测成本也较高,适用于科学研究。SYBR Green I荧光法则具有低成本、简单易行的优点,更加适用于快速检测(Durand et al, 2002)。建立微孢子虫的qPCR方法,不仅能灵敏高效地检测到微孢子虫,而且能确定其数量,这对于分析微孢子虫的载量、开展该病原的防控研究具有重要意义。
qPCR技术对微孢子虫的检测有不少应用报道。Verweij等(2007)利用qPCR检测粪便样品中比氏肠微孢子虫和脑炎微孢子虫属,与常规PCR技术相比,特异性和灵敏度达到了100%。Phelps等(2007)利用该技术检测美鳊微孢子虫,每个反应最低能够检测到10个基因拷贝数,由于微孢子虫SSU rRNA基因不是单拷贝基因,超声波处理孢子再提取DNA,能提高检测灵敏度,使每个反应最低检测到0.14个孢子(王见杨等, 2001)。Samie等(2007)利用qPCR和三色染色法在南非地区验证了PCR-RFLP测定比氏肠微孢子虫在医院病人和学校儿童中的比例。Burgher-MacLellan等(2010)利用双重荧光qPCR同时检测蜜蜂身上的两种不同微孢子虫。
本研究建立的虾肝肠胞虫SYBR Green I的qPCR检测方法的灵敏度均高于常规PCR和套式PCR。通过实际样品检测来比较本研究建立的方法与Amornrat等(2013)建立的套式PCR,结果显示,套式PCR对样品中低于3.28×102 copies/μl的目的DNA片段无法检出,灵敏度只有qPCR-EHP的1/4左右,在一批实际样品的检测中,qPCR-EHP检出率(67.7%)明显高于套式PCR检出率(32.2%)。
本研究采集了海南、江苏以及山东的3批凡纳滨对虾样品,逐尾测量体长,利用建立的qPCR-EHP测定各对虾的EHP载量指数,结果显示,EHP载量指数与对虾体长呈负相关。江苏样品EHP SSU rDNA相对拷贝数在6.98×100–2.24×106 copies/(ng HpDNA)范围内,其中,体长大于4.3 cm的较大对虾中EHP载量指数与体长的负相关性明显(R=–0.7128),而体长小于4.2 cm的对虾的EHP载量指数与体长相关性不明显(R=–0.0876)。海南样品EHP SSU rDNA相对拷贝数在0–7.55×106 copies/(ng HpDNA)范围内,其中,体长<4.4 cm的较小对虾的EHP载量指数与体长的负相关性(R=–0.5009)比体长>5 cm的较大对虾的负相关性(R=–0.4413)更强,而EHP为阴性的样品未表现出特征性的体长分布。山东样品EHP SSU rDNA相对拷贝数为2.08×102–5.84×103 copies/(ng HpDNA),体长分布在5.0–10.5 cm范围内,其体长与EHP载量呈弱的负相关(R=–0.2252),这3批样品在EHP载量指数与生长速率关系的模式上表现出差异,可能与对虾中EHP感染的时间早晚、养殖技术、环境条件、饲料营养、虾苗质量以及抽样随机性等多方面因素相关。总体来看,当对虾肝胰腺中EHP SSU rDNA的相对拷贝数在103 copies/(ng HpDNA)数量级或EHP载量指数在3以上时,对虾的生长均处于明显较慢的水平,表明该载量的EHP对该对虾的生长的影响已经处于一个较高的风险水平。本研究建立的技术及检测数据为虾肝肠胞虫的预防和控制提供了手段和参考。
| 王元, 房文红, 周俊芳, 等. 脊尾白虾肌肉微孢子虫病的病原和病理分析. 上海海洋大学学报 , 2013, 22 (5) : 726-733 | |
| 王维娜, 王安利, 陈丽, 等. 斑节对虾体内微孢子虫的超微结构. 动物学报 , 2001, 47 (S1) : 78-81 | |
| 王见杨, 黄可威, 赵昀, 等. 九种微孢子虫核糖体小亚单位RNA(SSU rRNA)基因拷贝数的研究. 蚕业科学 , 2001, 27 (3) : 200-205 | |
| 吴兴泰. 南美白对虾微孢子虫病的防治方法. 海洋与渔业 , 2010 (6) : 41-42 | |
| 郝斌, 牟仁仆. 中国对虾体内寄生微孢子虫的初步研究. 海洋科学 , 1984 (2) : 47-48 | |
| Amornrat T, Jiraporn S, Saisunee C, et al. The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in whiteleg shrimp Penaeus(Litopenaeus) vannamei. BMC Vet Res , 2013, 9 (1) : 1-10 DOI:10.1186/1746-6148-9-1 | |
| Burgher-MacLellan KL, Williams GR, Shutler D, et al. Optimization of duplex real-time PCR with melting curve analysis for detecting the microsporidian Parasites Nosema apis and Nosema ceranae in Apis mellifera. Can Entomol , 2010, 142 (3) : 271-283 DOI:10.4039/n10-010 | |
| Durand SV, Lightner DV. Quantitative real time PCR for the measurement of white spot syndrome virus in shrimp. J Fish Dis , 2002, 25 (7) : 381-389 DOI:10.1046/j.1365-2761.2002.00367.x | |
| Lom J, Dykoá I. Ultrastructure of Nucleospora secunda n. sp. (Microsporidia), parasite of enterocytes of Nothobranchius rubripinnis. Eur J Protistol , 2002, 38 (1) : 19-27 DOI:10.1078/0932-4739-00844 | |
| Phelps NB, Goodwin AE. Validation of a quantitative PCR diagnostic method for detection of the microsporidian Ovipleistophora ovariae in the cyprinid fish Notemigonus crysoleucas. Dis Aquat Organ , 2007, 76 (3) : 215-221 | |
| Samie A, Obi CL, Tzipori S, et al. Microsporidiosis in South Africa: PCR detection in stool samples of HIV-positive and HIV-negative individuals and school children in Vhembe district, Limpopo Province. T Roy Soc Trop Med H , 2007, 101 (6) : 547-554 DOI:10.1016/j.trstmh.2007.02.005 | |
| Sritunyalucksana K, Sanguanrut P, Salachan PV, et al. Urgent appeal to control spread of the shrimp microsporidian parasite Enterocytozoon hepatopenaei (EHP). 2014, http://www.enaca.org/modules/news/article.php?article_id=2039 | |
| Stentiford GD, Bateman KS. Enterospora sp., an intranuclear microsporidian infection of hermit crab Eupagurus bernhardus. Dis Aquat Organ , 2007, 75 (1) : 73-78 | |
| Suebsing R, Prombun P, Srisala J, et al. Loop-mediated isothermal amplification combined with colorimetric nanogold for detection of the microsporidian Enterocytozoon hepatopenaei in penaeid shrimp. J Appl Microbiol , 2013, 114 (5) : 1254-1263 DOI:10.1111/jam.2013.114.issue-5 | |
| Tourtip S, Wongtripop S, Stentiford GD, et al. Enterocytozoon hepatopenaei sp. nov. (Microsporida: Enterocytozoonidae), a parasite of the black tiger shrimp Penaeus monodon (Decapoda: Penaeidae): Fine structure and phylogenetic relationships. J Invert Pathol , 2009, 102 (1) : 21-29 DOI:10.1016/j.jip.2009.06.004 | |
| Verweij JJ, Robert TH, Brienen EAT, et al. Multiplex detection of Enterocytozoon bieneusi and Encephalitozoon spp. in fecal samples using real-time PCR. Diagn Micr Infec Dis , 2007, 57 (2) : 163-167 DOI:10.1016/j.diagmicrobio.2006.08.009 |



