2. 热带海洋生物资源研究中心 中国热带农业科学院热带生物技术研究所 海口 571101;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266200
2. Research center for tropical marine Bioresource, Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Science, Haikou 571101 ;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
海带(Saccharina japonica)生长和发育受温度影响较大,高温可导致海带吸收光能过剩,光合作用效率下降,CO2同化速率降低。而过剩光能若不及时耗散会造成光损伤,发生光抑制,造成光系统Ⅱ光化学效率和光合效率下降(冯玉龙等,2001; 韩博平等,2003)。高温在诱发光抑制的同时,还会刺激藻体内产生活性氧。为抵御活性氧的破坏,生物体依赖抗氧化系统的作用,通过抑制活性氧生成或缓解活性氧引起的损伤等途径降低活性氧的氧化胁迫(Sies,1993)。王悠等(2005)证实,不同海带品种其抗氧化能力的差异是决定海带耐热的主要原因;鹿宁等(2010)的研究结果显示,龙须菜(Gracilaria lemaneiformis)耐热性与其所含抗氧化活性物质相关;侯和胜等(2008)研究表明,高温对条斑紫菜(Porphyra yezoensis)抗氧化酶活性有显著影响。
本文通过研究高温胁迫对海带幼苗可溶性蛋白、丙二醛(MDA)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、叶绿素荧光参数及叶绿素的影响,探讨高温条件下的海带生理变化机制,为海带良种选育提供理论基础。
1 材料和方法 1.1 材料实验用海水为取自青岛近岸的经过灭菌处理的海水。海带幼苗(10-12 cm)于2014年11月中旬取自山东寻山集团青鱼滩养殖有限公司海带育苗场,经灭菌低温海水清洗数次后,在光照恒温培养箱中暂养7 d。培养条件:白色日光灯,光强为50 μmol/(m2·s),温度为13℃,光周期为12 L:12 D;培养液采用灭菌消毒海水,营养盐添加NO3--N浓度为3 mg/L,PO4--P浓度为0.3 mg/L;海带幼苗在充气悬浮条件下培养。每7 d更换培养海水2次。
1.2 方法 1.2.1 形态变化记录每12 h使用相机(NIKON- D80)记录高温诱导条件下的海带生长状况。
1.2.2 高温诱导条件下的海带幼苗抗氧化酶的测定设置高温组(25℃)和对照组(13℃),每组4个平行,分别培养4、8、12、16、20、24、28、32、36、40、44、48 h后,取样测定。培养条件同1.1。称取0.1 g海带幼苗材料,用1.5 ml提取液(0.1 mol/L磷酸缓冲液pH=7.0;1 mol/L EDTA;1% PVP)在冰浴条件下研磨匀浆。4℃,10000 r/min离心10 min,取上清液待测。可溶性蛋白测定采用考马斯亮蓝蛋白测定试剂盒(A045-2);抗氧化酶使用专业试剂盒测定,包括:超氧化物歧化酶(SOD)测试盒(A001-1)、过氧化氢酶(Catalase CAT)测定试剂盒(A007-1)、过氧化物酶(POD)测试盒(A005)和丙二醛测定试剂盒(A003-1)。
1.2.3 温度胁迫下海带幼苗叶绿素荧光参数的测定设置高温组(25℃)和对照组(13℃),每组9个平行,分别培养4、8、12、16、20、24、28、32、36、40、44、48 h后,取样测定。培养条件同1.1。叶绿素荧光参数的测定均采用DUAL-PAM-100(WALZ,Germany)。海带幼苗进行暗适应20 min后,再测最大潜在量子产量(Fv/Fm)。
1.2.4 温度胁迫下海带幼苗叶绿素含量测定设置高温组(25℃)和对照组(13℃),每组4个平行,分别培养4、8、12、16、20、24、28、32、36、40、44、48 h后,取样测定。培养条件同1.1。海带叶绿素含量测定参照Davison等(1991)和Seely等(1972)的方法。用UV-2802型紫外可见分光度计,测定溶液在665、664、631、582、581、470、480 nm处的吸光度,按Seely等(1972)方法中的公式计算叶绿素质量浓度。
1.3 数据分析采用Origin整理数据及绘制图形,采用SPSS软件进行单因子方差分析(One-way ANOVA)、Duncan多重比较,以P<0.05作为差异显著。数据用平均值±标准差(Mean±SD)形式表示。
2 结果 2.1 形态变化高温胁迫对海带幼苗造成的损伤较明显(图 1)。高温处理12 h后,少数海带幼苗叶片尖端出现烂梢现象;处理24 h后,部分叶片出现腐烂斑点;处理36 h后,叶片中下部褪色,大部分叶片伴有烂梢现象;处理40 h后,叶片出现明显褪色,并伴有大量腐烂斑点,触摸会有黏液,出现典型的绿烂病症状;处理48 h后,海带叶片腐烂面积为70%,绿烂病症状显著。

|
图 1 25℃下不同胁迫时间段海带幼苗形态观察 Figure 1 Morphological observation of S. japonica young sporophytes cultured under 25℃ A: 胁迫12 h; B: 胁迫24 h; C: 胁迫36 h; D: 胁迫40 h; E: 胁迫48 h; F: 对照组 A: 12 h; B: 24 h; C: 36 h; D: 40 h; E: 48 h; F: Control group |
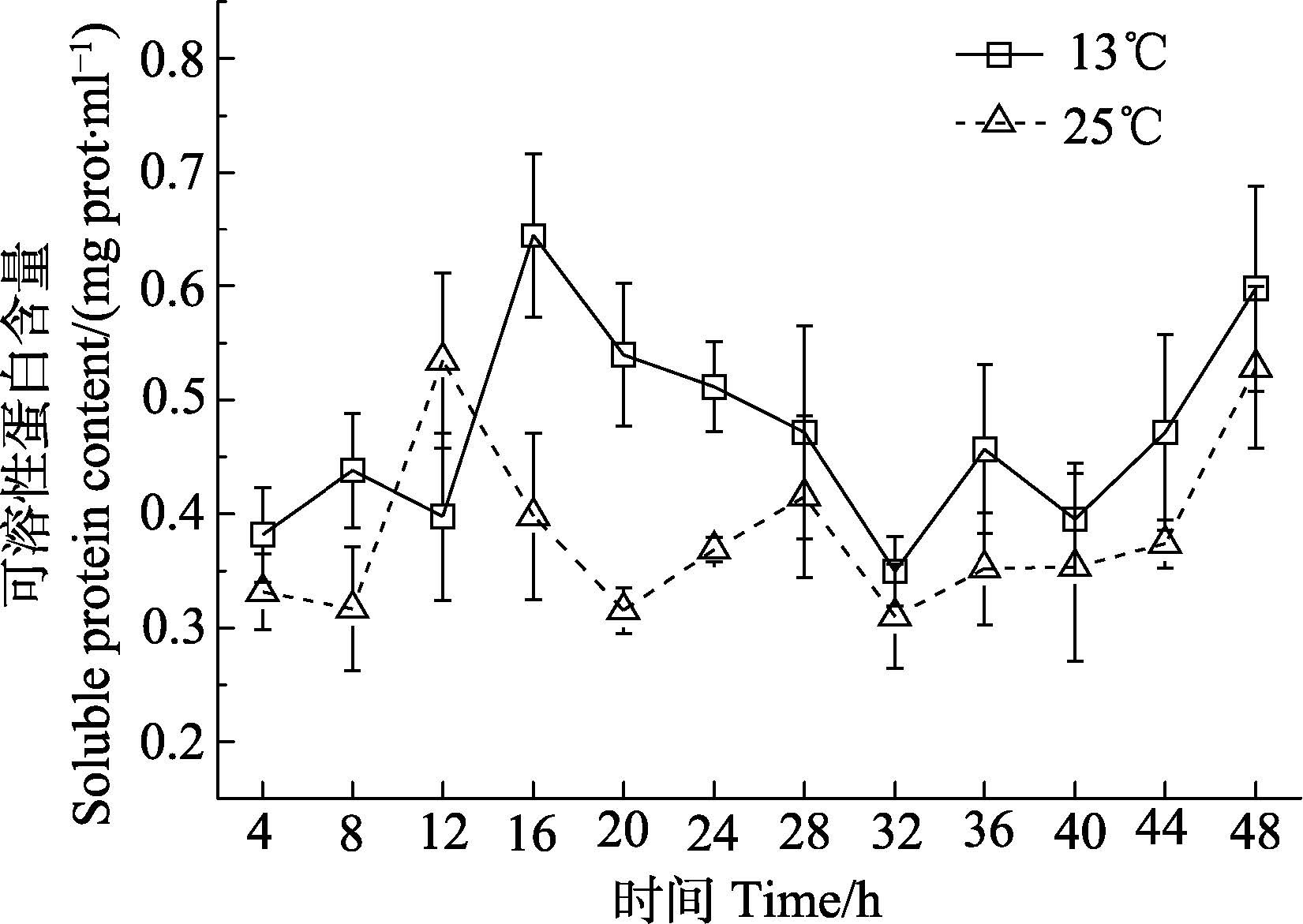
由图 2可知,实验组海带幼苗的可溶性蛋白含量呈先上升后下降的波动趋势,处理12 h后,可溶性蛋白的含量达最大值(P<0.05),与初始值相比升高了37.9%;处理20 h后,可溶性蛋白的含量达最小值;实验组海带幼苗的可溶性蛋白的含量在32-48 h时呈上升趋势。
|
图 2 温度胁迫对海带幼苗可溶性蛋白含量的影响 Figure 2 Effects of temperature on the content of soluble proteins in S. japonica young sporophytes |
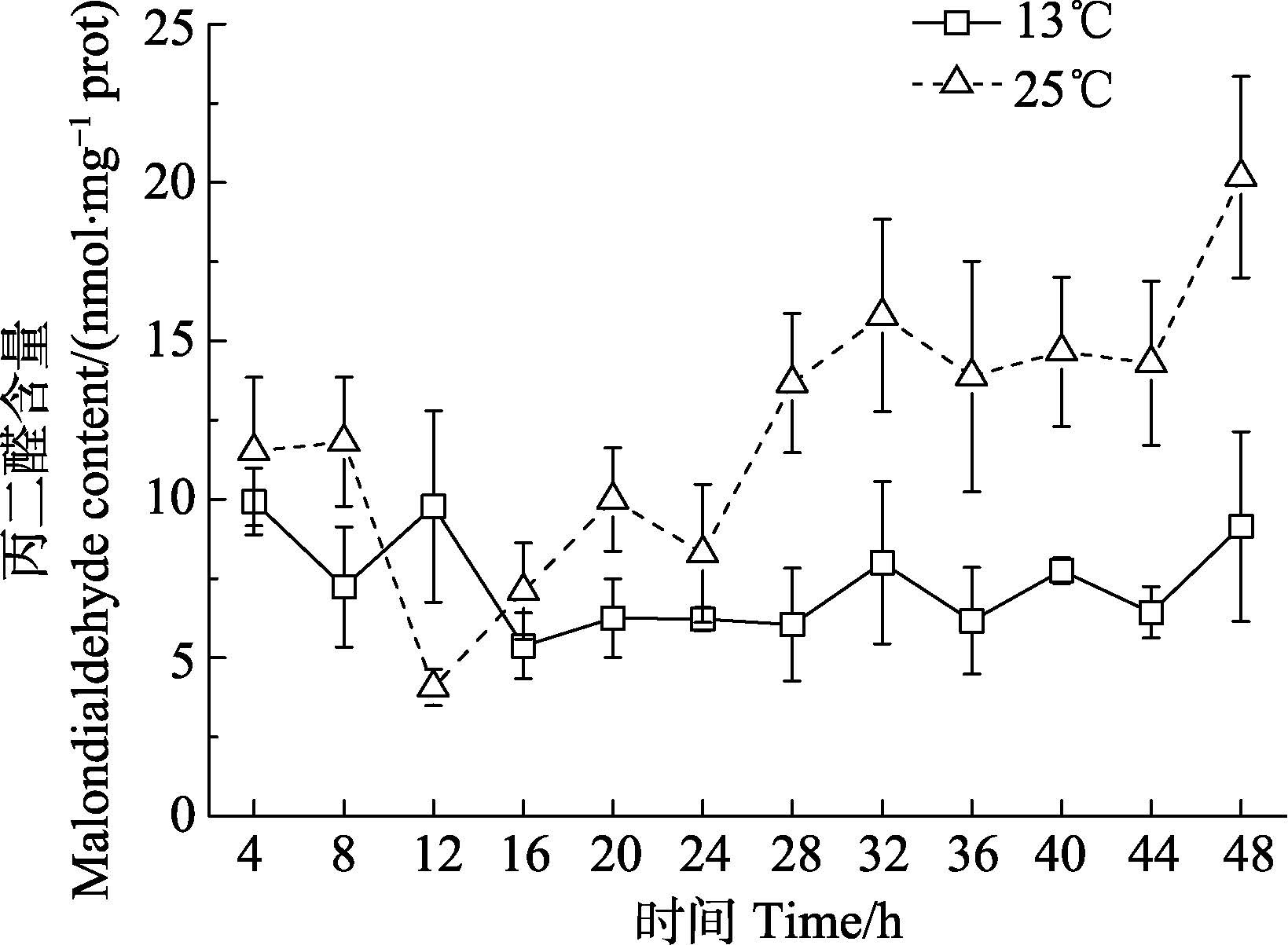
丙二醛(MDA)是自由基作用于脂质发生过氧化反应的最终产物,会引起蛋白质、核酸等大分子的交联聚合,具有细胞毒性。从图 3可以看出,实验组MDA的积累明显增加,在48 h时达最大值,与对照组对比差异性显著(P<0.05)。对照组的MDA含量在实验期间整体变化平稳。
|
图 3 温度胁迫对海带幼苗丙二醛含量的影响 Figure 3 Effects of temperature on the content of malondialdehyde(MDA)in S. japonica young sporophytes |
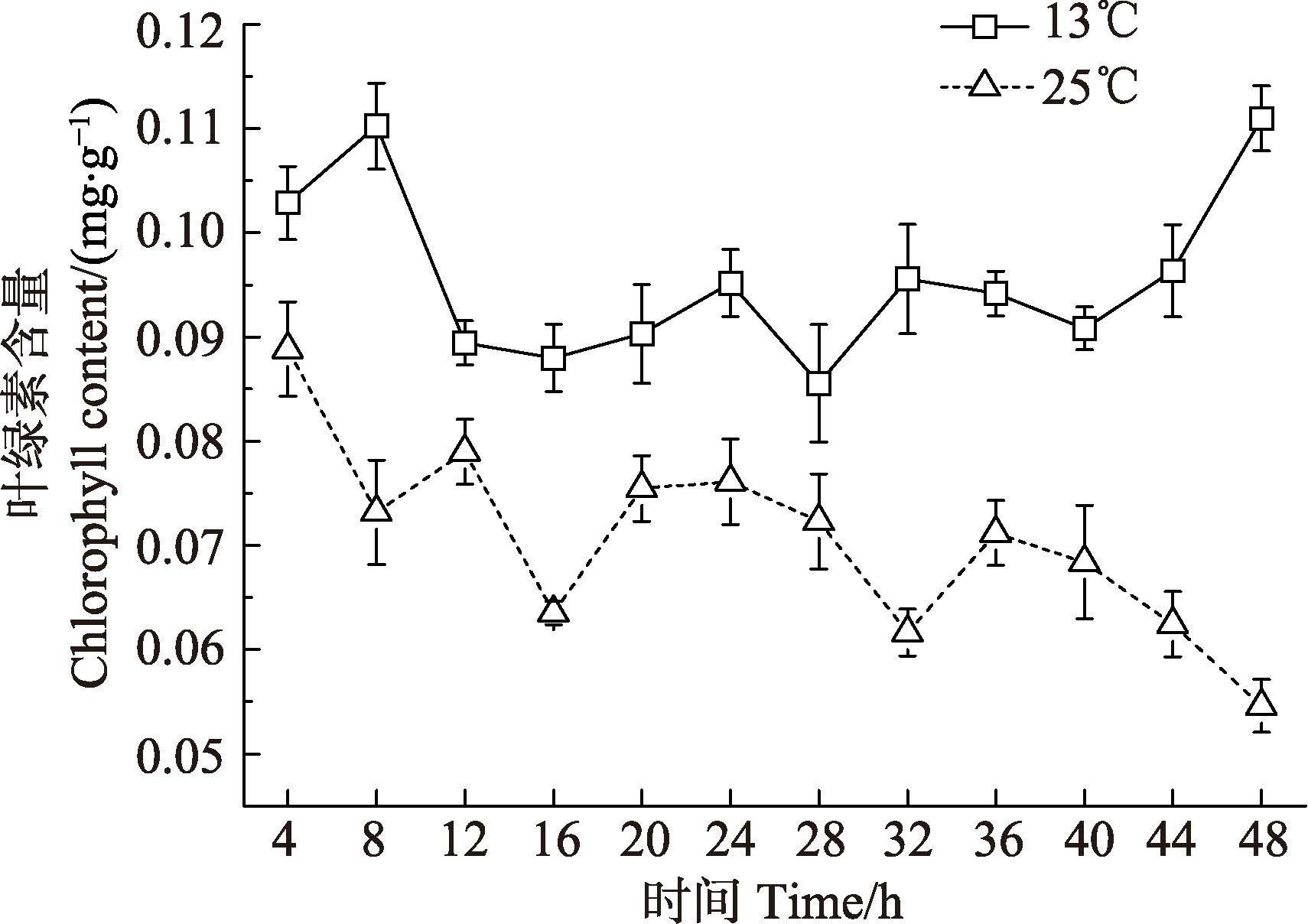
实验组海带幼苗叶绿素含量随胁迫时间延长呈下降趋势(图 4),在胁迫12、20、36 h时叶绿素含量略上升,胁迫48 h时,实验组叶绿素含量达最小值,与初始值相比下降了38.5%,呈显著性差异(P<0.05)。
|
图 4 温度胁迫对海带幼苗叶绿素含量的影响 Figure 4 Effects of temperature on the content of chlorophyll in S. japonica young sporophytes |
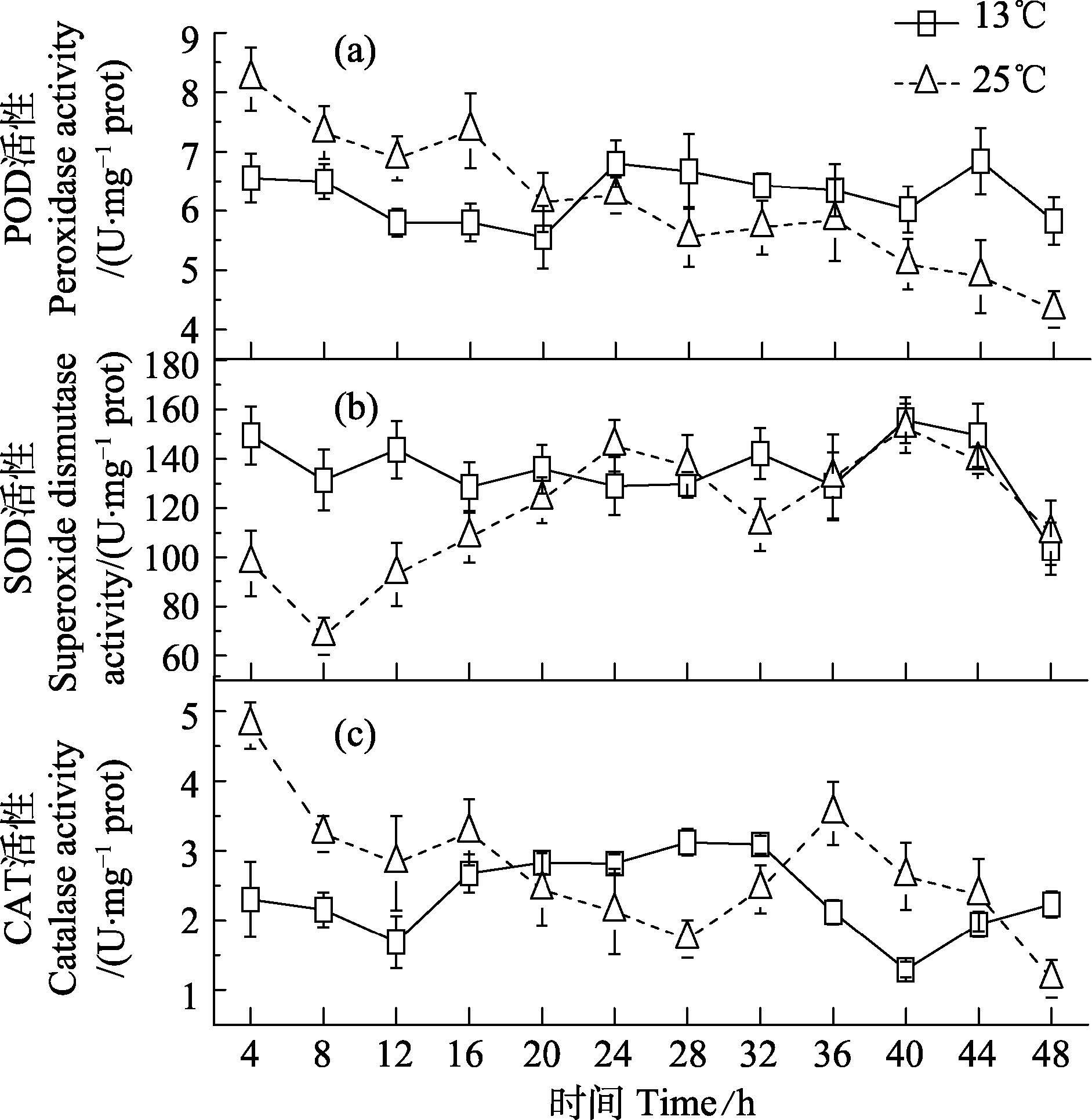
在25℃条件下,海带幼苗POD活性随时间的变化趋势见图 5-(a)。从图 5-(a)中可以看出,与对照组相比,实验组的POD活性随胁迫时间延长逐渐下降,16 h时POD活性略上升,48 h时达最小值,与初始值相比呈显著性差异(P<0.05),下降了47.2%。对照组POD活性呈无显著变化。
|
图 5 温度胁迫对海带幼苗抗氧化酶活性的影响 Figure 5 Effects of temperature on activities of antioxidant enzymes in S. japonica young sporophytes (a)POD活性;(b)SOD活性;(c)CAT活性 (a)Peroxidase activity;(b)Superoxide dismutase activity;(c)Catalase activity |
在25℃条件下,海带幼苗SOD活性随培养时间的变化趋势见图 5-(b)。从图 5-(b)可以看出,实验组的SOD活性呈波动趋势,处理8 h时,SOD活性达最小值;处理24、40 h时,SOD活性达最大值,与初始值相比呈显著性差异(P<0.05),分别上升了33%和36%。对照组的SOD活性变化较平稳。
在25℃条件下,海带幼苗CAT活性随着培养时间的变化趋势见图 5-(c)。从图 5-(c)可以看出,实验组的CAT活性随胁迫时间延长呈下降趋势,处理36 h时,海带幼苗CAT活性略升高,处理48 h时,CAT活性达最小值,与初始值相比具有显著性差异(P<0.05),下降了75.8%。对照组CAT活性较为稳定。
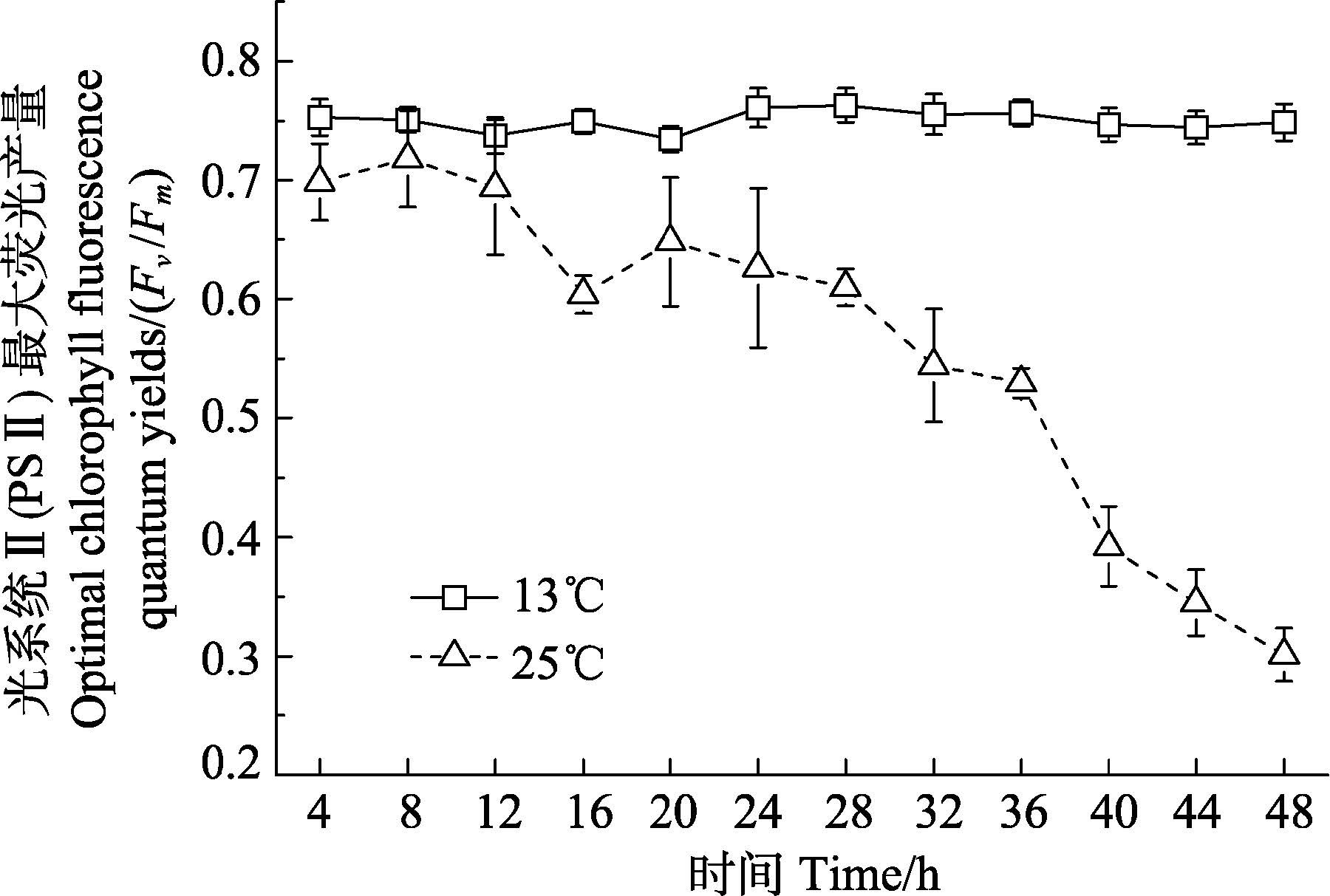
2.3 温度胁迫对海带幼苗叶绿素荧光参数的影响高温胁迫对海带幼苗光系统Ⅱ光化学最大量子产量的影响如图 6所示。高温处理条件下海带幼苗的Fv/Fm随着胁迫时间延长呈现下降趋势,处理48 h后,实验组的Fv/Fm达最小值,与初始条件相比下降了56.8%,呈显著性差异(P<0.05)。对照组的Fv/Fm值在实验过程中较平稳。
|
图 6 温度胁迫对海带幼苗的光化学最大量子产量(Fv/Fm)的影响 Figure 6 Effects of temperature on the optimal chlorophyll fluorescence quantum yields(Fv/Fm)in S. japonica young sporophytes |
细胞膜的稳定性与膜脂的脂肪酸饱和程度有关,高度饱和脂肪酸有利于提高细胞膜的相变温度,但高温会加剧膜脂过氧化作用,损伤细胞膜的稳定性。高温条件下,植物细胞膜被破坏是由膜脂中不饱和脂肪酸发生氧化所致,其氧化产物为丙二醛(MDA)。MDA是脂类过氧化物之一,其含量可以间接反映膜受损程度并指示植物体膜过氧化程度(利容千等,2002)。本研究发现,随着25℃处理时间延长,高海带幼苗的MDA含量逐渐增加,虽在12 h时下降,但在之后胁迫时间内呈增长趋势,48 h时达最大值。这说明在高温培养条件下,海带幼孢子体中活性氧含量升高,可能对其膜系统产生过氧化危害。而对照组海带幼苗的MDA含量一直处于平稳状态。研究表明,可溶性蛋白在抵御温度逆境胁迫过程中起重要作用。细菌、植物及动物体在受到高温胁迫时,其机体内热激蛋白含量均会升高,从而抵御高温胁迫(黄希莲等,2007)。高温处理初期,海带幼苗可溶性蛋白含量明显升高,这可能与幼苗对高温度处理做出的生化应答反应有关,在处理12 h后,可溶性蛋白的含量达最大值,20 h和32 h时分别降低,而对照组变化幅度相对较小。
3.2 温度胁迫对海带幼苗光合作用的影响光合效率的高低可以直接影响藻类发育、生长和繁殖。Santarius等(1991)认为,在高温胁迫过程中,光合磷酸化受阻会导致净光合速率下降。高温会损伤植物叶绿体的结构,造成光合色素降解,抑制光合作用(Senaratna et al,1987);梁英等(2009)研究显示,高温条件可激活海藻类囊体膜上的脂肪酶,降解细胞膜脂,钝化PSⅡ反应中心,同时导致叶绿体结构发生改变,引起叶绿素的降解。本研究中,高温处理16 h后,Fv/Fm值明显下降,叶绿素含量也同样下降了30%,这说明高温对海带幼苗的光合速率有抑制作用,此时海带叶片尖端和中下部发生颜色变化。正常生理状态下,大型藻类的Fv/Fm值约在0.7,当受到胁迫时,其值明显下降(张守仁,1999; Kolber et al,1988)。植物中PSⅡ是一种对热最敏感的色素蛋白复合体,当处于逆境胁迫时其活性受到抑制(Wen et al,2005; Yordanov,1995)。本研究过程中,叶绿素含量相对较低,表现为Fv/Fm值呈下降趋势。
3.3 温度胁迫对海带幼苗抗氧化系统的影响在抗氧化系统中酶促防御体系主要由SOD、CAT、POD等构成,主要清除O2-、羟过氧化物、过氧化氢和酚类等物质。在高温条件下,海带机体活性氧含量增加、活性氧清除平衡遭到破坏及钝化抗氧化酶类活性(王悠,2003)1)。实验发现,POD和CAT酶活性随高温胁迫时间的延长呈降低趋势,在16 h时略有回升,处理48 h后,两种酶都达最低值。此时,海带呈现大的烂洞、颜色变绿,其叶绿素含量显著降低,Fv/Fm达最小值。SOD酶活性总体呈上升趋势,在25℃高温处理40 h后,其活性下降,对照组中海带SOD酶活性变化不大。本研究表明,在高温胁迫条件下,不同酶做出的反应不同,有的酶活性提高,达到抑制毒害作用,有的是通过增加稳定性以达到增强保护的功能。
1) 王悠. 海带对高温胁迫的生理生化响应和耐高温机理的初步研究. 中国海洋大学博士研究生学位论文, 2003
| 王悠, 唐学玺. 不同海带品系抗氧化系统活性与耐热性的相关性研究. 应用生态学报 , 2005, 16 (8) : 1507-1512 | |
| 冯玉龙, 张亚杰, 朱春全. 调控活性氧代谢对渗透胁迫时杨树光合作用光抑制的影响. 植物生态学报 , 2001, 25 (4) : 451-459 | |
| 张守仁. 叶绿素荧光动力学参数的意义及讨论. 植物学通报 , 1999, 16 (4) : 444-448 | |
| 利容千, 王建波. 植物逆境细胞及生理学. 武汉: 武汉大学出版社, 2002 : 9 -10. | |
| 侯和胜, 何文君, 李洪艳, 等. 高温胁迫对条斑紫菜丝状体的生长和生理影响. 辽宁师范大学学报(自然科学版) , 2008, 31 (4) : 487-490 | |
| 鹿宁, 臧晓南, 张学成, 等. 高温胁迫下不同龙须菜品系抗氧化能力的比较. 武汉大学学报(理学版) , 2010, 56 (5) : 570-577 | |
| 黄希莲, 宋丽莎. 植物耐热生理生化指标研究进展. 黔南民族师范学院学报 , 2007, 27 (3) : 23-26 | |
| 梁英, 冯力霞, 田传远. 高温胁迫对球等鞭金藻3011和8701叶绿素荧光特性的影响. 水产学报 , 2009, 33 (1) : 37-44 | |
| 韩博平, 韩志国, 付翔. 藻类光合作用机理与模型. 北京: 科学出版社, 2003 : 24 -29. | |
| Davison IR, Greene RM, Podolak EJ. Temperature acclimation of respiration and photosynthesis in the brown alga Laminaria saccharina. Mar Biol , 1991, 110 (3) : 449-454 DOI:10.1007/BF01344363 | |
| Kolber Z, Zehr J, Falkowski P. Effects of growth irradiance and nitrogen limitation on photosynthetic energy conversion in photosystem Ⅱ. Plant Physiol , 1988, 88 (3) : 923-929 DOI:10.1104/pp.88.3.923 | |
| Santarius K, Exner M, Thebudlassak R. Effects of high- temperature on the photosynthetic apparatus in isolated mesophyll protoplasts of Valerianella-locusta (l) betcke. Mol Microbiol , 1991, 25 (1) : 17-26 | |
| Seely GR, Duncan MJ, Vidaver WE. Preparative and analytical extraction of pigments from brown algae with dimethyl sulfoxide. Mar Biol , 1972, 12 (2) : 184-187 DOI:10.1007/BF00350754 | |
| Senaratna T, Mckersie BD, Borochov A. Desiccation and free radical mediated changes in plant membranes. J Exp Bot , 1987, 38 (12) : 2005-2014 DOI:10.1093/jxb/38.12.2005 | |
| Sies H. Strategies of antioxidant defense. Eur J Biochem , 1993, 215 (2) : 213-219 DOI:10.1111/ejb.1993.215.issue-2 | |
| Wen X, Gong H, Lu C. Heat stress induces an inhibition of excitation energy transfer from phycobilisomes to photosystem Ⅱ but not to photosystem I in a cyanobacterium Spirulina platensis. Plant Physiol Biochem , 2005, 43 (4) : 389-395 DOI:10.1016/j.plaphy.2005.03.001 | |
| Yordanov I. Responses of photosynthesis to stress and plant growth regulators. Plant Physiol , 1995, 21 (2-3) : 51-70 |



