2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
近年来,对虾养殖病害频繁发生,新发疾病危害严重,由病毒、细菌导致的偷死病及早期死亡症已成为危害产业发展的重要原因(Zhang et al,2014; Joshi et al,2014)。弧菌是海水养殖中常见微生物,可导致对虾感染发病的病原弧菌有鳗弧菌(Vibrio anguillarum)(邓欢等,1998)、哈维氏弧菌(Vibrio harveyi)(Liu et al,1996)、副溶血弧菌(Vibrio parahaemolyticus)(Joshi et al,2014)、溶藻弧菌(Vibrio alginolyticus)(Lee et al,1996)和创伤弧菌(Vibrio vulnificus)(Alapide-Tendencia et al,1997)等。
早期的水产养殖动物细菌性疾病控制主要依靠抗生素,近年来,发现持续使用抗生素不仅会导致耐药菌株产生,还会引起药物残留、降低养殖动物免疫力及破坏水体微生态平衡等(Alcaide et al,2005),为此,寻找安全有效的水产养殖病害防治方法成为水产病害防治领域的一个热点。在对虾养殖水体中添加假单胞菌(Das et al,2006)、芽孢杆菌(Ziaei-Nejad et al,2006)、乳酸杆菌(Immanuel et al,2007)等,可以有效控制病原微生物,优化养殖生态环境,减少虾病发生。
本实验从河北黄骅一对虾养殖池中分离出一株对弧菌具有明显拮抗作用的细菌,研究了该拮抗菌株对多株弧菌的拮抗效果,初步评价了该菌的生物安全性,并进行了细菌的分类鉴定。研究结果可为开发对虾养殖用有益菌提供技术支持。
1 材料与方法 1.1 实验材料菌株安全评价用凡纳滨对虾(Litopenaeus vannamei)购于山东潍坊龙威公司,注射感染对虾平均体长为(5.0±1.0)cm,浸泡感染对虾平均体长为(2.0±0.3)cm。攻毒期间对虾养殖平均水温为(28±1)℃,海水盐度为33.0±1.9,pH值为7.7-8.1,溶氧为(5.86±0.44)mg/L。
筛选弧菌拮抗菌用指示菌分别为鳗弧菌、哈维氏弧菌、副溶血弧菌。其他弧菌分别为创伤弧菌、溶藻弧菌、魔鬼弧菌(Vibriodiabolicus)、坎氏弧菌(Vibriocampbellii)、需钠弧菌(Vibrionatriegens)、巴西弧菌(Vibriobrasiliensis)和轮虫弧菌(Vibriorotiferianus)。上述菌株均为作者实验室分离保存。
1.2 菌株采集与分离纯化从山东省潍坊市及青岛市、河北省黄骅市、江苏省盐城市、浙江省杭州市等地的对虾养殖池中,用无菌采样瓶采集水样,低温保存带回实验室。在无菌条件下,取水样于2216E平板上划线分离纯化,对不同的菌株编号入菌种资源库保存备用。
1.3 拮抗菌的筛选参照林敏等(2005)的方法,将活化后的鳗弧菌、哈维氏弧菌以及副溶血弧菌分别接种于2216E液体培养基,28℃摇床振荡培养24 h,用无菌水稀释成浓度为 107 CFU/ml的菌悬液,分别涂布于固体平板。用接种环挑取活化24 h的待筛选菌株,点种于上述平板上(莫照兰等,2001),对各测试菌株编号,于28℃恒温培养箱培养48 h后,观察点种区附近是否出现明显的抑菌透明区或覆盖区,每个平板3个平行。
1.4 拮抗菌的抑菌效果测定采用滤纸片法测定拮抗菌的抑菌效果,具体步骤参照单文荣等(2010)。用无菌镊子在涂布鳗弧菌、哈维氏弧菌以及副溶血弧菌的平板上等距离放置4片直径为6 mm的无菌滤纸片,向两片滤纸片上分别加入5 μl的拮抗菌发酵液(浓度为2.50×108 CFU/ml),另两片加5 μl未接种菌的2216E液体培养基为空白对照,每个平板3个重复。静置20 min后,放入恒温培养箱中,28℃静置培养24 h。观察并用游标卡尺十字交叉法测量抑菌圈直径,结果取平均值。根据抑菌圈的大小设定抑菌效果,定义直径>20 mm的为强抑菌效果,标记为“+++”;11 mm<直径≤20 mm的为中等抑菌效果,标记为“++”;6 mm<直径≤11 mm的为弱抑菌效果,标记为“+”;直径=6 mm的为无抑菌效果,标记为“-”。
1.5 最低抑菌浓度的测定用10倍梯度稀释法稀释拮抗菌株的发酵液(初始浓度为2.50×108 CFU/ml),最低稀释到2.50×102 CFU/ml。参照1.4的方法,选用鳗弧菌、哈维氏弧菌及副溶血弧菌为指示菌,进行各稀释梯度发酵液的抑菌实验,每个平板放4张滤纸片,用未接种菌的2216E液体培养基为空白对照,每个平板3个平行,于28℃恒温培养箱中静置培养24 h,观察抑菌情况。参照李成海等(2013)的判定方法,“+”表示有抑菌活性,“-”表示没有抑菌活性。
1.6 拮抗菌对其他弧菌的拮抗效果参考1.4的方法,取发酵的拮抗菌分别对创伤弧菌、溶藻弧菌、魔鬼弧菌、坎氏弧菌、需钠弧菌、巴西弧菌和轮虫弧菌进行拮抗效果分析,根据抑菌圈的大小分析抑菌效果,抑菌效果参照1.4的设定。
1.7 菌株安全性试验评价 1.7.1 注射感染法试验设待测菌株15组、阳性对照组和空白对照组,阳性对照组的菌株为实验室分离保存的一株对虾病原菌哈维氏弧菌,空白对照组为PBS。将待测菌株发酵后的离心沉淀用PBS稀释成1.29×109、1.29×108、1.29×107、1.29×106、1.29×105 CFU/ml共 5个浓度组;阳性对照菌稀释成2.38×107、2.38×106、2.38×105、2.38×104 CFU/ml共4个浓度组。采用腹部肌肉注射感染的方法,每尾注射菌悬液50 μl,每组对虾12尾。试验期间,每天正常投喂、吸污、换水,记录对虾死亡情况,感染后观察14 d,统计对虾累计死亡率,采用Reed等(1938)的方法计算半致死剂量(LD50)。对死亡对虾进行解剖和菌株的分离鉴定。
1.7.2 浸泡感染法试验设待测菌株15组、阳性对照组和海水对照组,阳性对照组的菌株为实验室分离保存的一株对虾病原菌哈维氏弧菌。将待测菌株、哈维氏弧菌发酵后的离心沉淀用海水分别稀释成1.76×108、1.76×107、1.76×106、1.76×105、1.76×104 CFU/ml共5个浓度及1.10×108、1.10×107、1.10×106、1.10×105、1.10×104 CFU/ml共5个浓度。感染采用浸泡的方法,每组对虾15尾。试验期间不换水,每天正常投喂、吸污,记录对虾死亡情况,感染后观察96 h,统计对虾累计死亡率,采用软件SPSS 16.0计算96 h半致死浓度96 h LC50,对死亡对虾进行解剖和菌株的分离鉴定。
1.8 菌株鉴定 1.8.1 16SrDNA序列分析比对及系统发育分析法参照范文辉等(2005)扩增细菌16S rDNA序列。将扩增产物交由上海桑尼生物工程有限公司测序,所得序列在GenBank数据库中利用BLAST进行同源性比对,选取同源性较高的序列,利用MEGA 5.0进行多重比较后通过邻接法构建系统发育树,以确定分离菌株的分类地位。
1.8.2 细菌全细胞脂肪酸分析鉴定法细菌全细胞脂肪酸的提取按照MIDI公司(美国)提供的标准方法进行,气相色谱系统应用美国Agilent 6850型气相色谱仪,分析软件应用MIDI公司开发的细菌全细胞脂肪酸鉴定及分析系统(MIS)。
2 结果 2.1 拮抗菌的筛选从山东省潍坊市及青岛市、河北省黄骅市、江苏盐城市、浙江杭州市等地的对虾养殖池中,共分离出菌株111株,用平板点种法筛选到1株对鳗弧菌、哈维氏弧菌和副溶血弧菌均具有拮抗作用的菌株,编号为2013082515(简称菌株15)。该菌分离自河北黄骅市一室内对虾养殖池,菌株在2216E平板上的菌落形态为圆形,边缘整齐,单菌落直径约为1 mm,产黄色色素。用菌株15发酵液对鳗弧菌、哈维氏弧菌和副溶血弧菌进行抑菌效果分析,显示该菌对上述3株弧菌的抑菌圈直径分别为(34.90±0.36)mm、(25.74±0.17)mm、(13.07±0.39)mm,如图 1所示。结果表明,菌株15对鳗弧菌及哈维氏菌具有强的抑菌效果(+++),对副溶血弧菌抑菌效果中等(++)。

|
图 1 菌株15对鳗弧菌、哈维氏弧菌和副溶血弧菌的抑菌效果 Figure 1 The antibacterial effect of Strain 15 against V. anguillarum,V. harveyi and V. parahaemolyticus |
菌株15发酵液经梯度稀释,不同稀释浓度的发酵液对鳗弧菌、哈维氏弧菌、副溶血弧菌的最低抑菌浓度分别为2.50×104 CFU/ml、2.50×105 CFU/ml、2.50×105 CFU/ml(表 1)。
|
|
表 1 不同浓度菌株15发酵液的抑菌效果 Table 1 The antibacterial effect of Strain 15 in different concentration |
选用创伤弧菌、溶藻弧菌、魔鬼弧菌、坎氏弧菌、需钠弧菌、巴西弧菌和轮虫弧菌,分别测试菌株15对其抑菌效果,结果见图 2。结果显示,菌株15对7株弧菌均具有一定的拮抗效果,但抑菌效果存在差别。对其抑菌圈大小进行统计,可知产生抑菌圈最大的弧菌分别是巴西弧菌和轮虫弧菌,其次是创伤弧菌、坎氏弧菌和需钠弧菌,魔鬼弧菌与溶藻弧菌抑菌圈较小(表 2)。
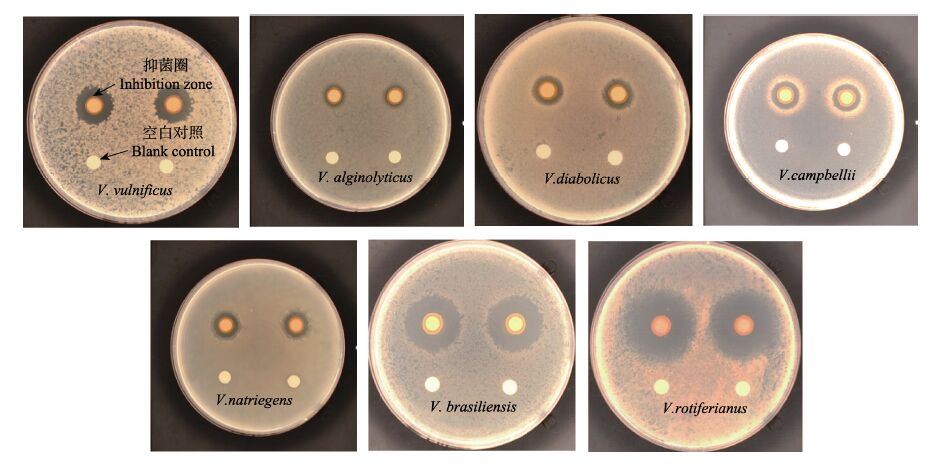
|
图 2 菌株15对创伤弧菌、溶藻弧菌、魔鬼弧菌、坎氏弧菌、需钠弧菌、巴西弧菌和轮虫弧菌的抑菌效果 Figure 2 The antibacterial effect of Strain 15 against V. vulnificus,V. alginolyticus,V. diabolicus,V. campbellii,V. natriegens,V. brasiliensis and V. rotiferianus |
|
|
表 2 菌株15对弧菌的抗菌效果 Table 2 The antibacterial effect of Strain 15 against vibrios |
实验对虾经注射感染后累计死亡率结果见表 3。观察发现,注射高浓度组实验菌(1.29×109 CFU/ml与1.29×108 CFU/ml)的凡纳滨对虾,在24 h后开始出现死亡,对虾停止摄食,空肠胃,对外界反应迟钝,对死亡对虾肌肉和肝胰腺进行细菌的分离鉴定,确定菌株15为优势菌,至第4天时,该组对虾的死亡数趋于稳定。阳性对照哈维氏弧菌注射组中,高浓度组(2.38×107 CFU/ml)的对虾在注射24 h内死亡率达91.7%,症状为肝胰腺发黄,胃肠内无食物,感染后对虾活力较弱。对死亡对虾肌肉和肝胰腺进行细菌的分离鉴定,显示该组的优势菌为哈维氏弧菌。试验期间,阴性对照组对虾无死亡。菌株15与哈维氏弧菌注射感染凡纳滨对虾的LD50分别为2.63×107 CFU/ml与9.21×105 CFU/ml,二者相差28.5倍。
|
|
表 3 凡纳滨对虾人工注射感染菌株15和哈维氏弧菌后的死亡率 Table 3 Mortalities of L. vannamei infected with Strain 15 or V. harveyi by injection |
用菌株15及哈维氏弧菌浸泡感染对虾,各组的累计死亡结果见表 4。观察发现,高浓度组(108 CFU/ml)的对虾,在浸泡24 h后开始出现死亡,对虾停止摄食,空肠胃,感染后对虾活力较弱。对死亡对虾肠道和肝胰腺进行细菌的分离鉴定,菌株15、哈维氏弧菌分别为各组的优势菌。试验期间,阴性对照组对虾无死亡。统计显示,菌株15与哈维氏弧菌的96 h LC50分别为2.70×107、3.50×106 CFU/ml,菌株15的LC50是哈维氏弧菌的7.7倍。综合分析两次感染试验结果认为,用高浓度菌株15感染对虾后,均表现出显著的临床症状,表明该菌株对对虾具有潜在的毒性。
|
|
表 4 凡纳滨对虾人工浸泡感染菌株15和哈维氏弧菌后的死亡率 Table 4 Mortalities of L. vannamei infected with Strain 15 or V.harveyi by immersion |
PCR扩增菌株15 16S rDNA,获得1359 bp序列,将该序列提交到GenBank,序列登录号为KP757027,经BLAST比对分析,发现该菌与杀鱼假交替单胞菌(Pseudoalteromonas piscicida JCM 20779)的亲缘关系最近,同源性达100%。选取假交替单胞菌属及其他属与之同源性相近的16株细菌16S rDNA序列,构建系统发育树,结果见图 3。推断该菌株15为一株假交替单胞菌属(Pseudoalteromonas sp.)细菌。
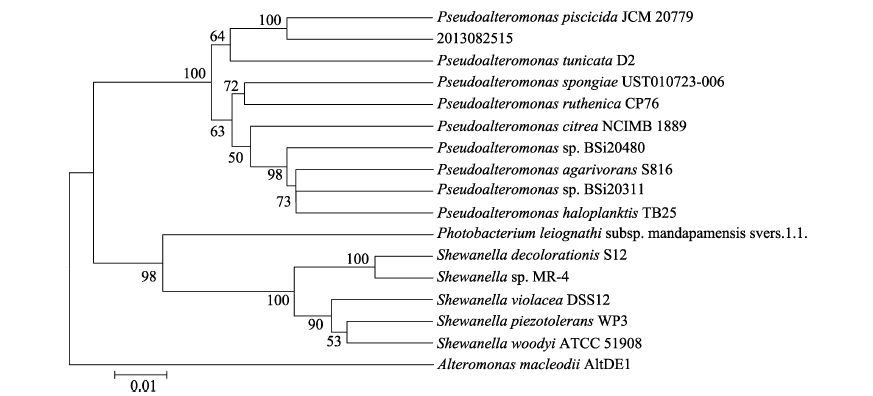
|
图 3 依据16S rDNA基因序列构建的菌株15与相近菌株的系统进化树 Figure 3 Phylogenetic tree of Strain 15 with other similar strains based on 16S rDNA sequences 节点数字表示bootstrap支持率,1000次重复 Numbers at nodes indicate the percentage of bootstrap support after 1000 replicates |
菌株15全细胞脂肪酸的气相色谱分析结果见图 4,MIDI数据库比对结果如表 5所示。在TSBA6(6.10)数据库中,该菌与河豚毒素假交替单胞菌(P. tetraodonis)和产黑假交替单胞菌(P. nigrifaciens)的相似度分别为0.595和0.516,均大于0.5,结合菌株16S rDNA序列比对结果,综合确定该菌为假交替单胞菌(Pseudoalteromonas sp.)。
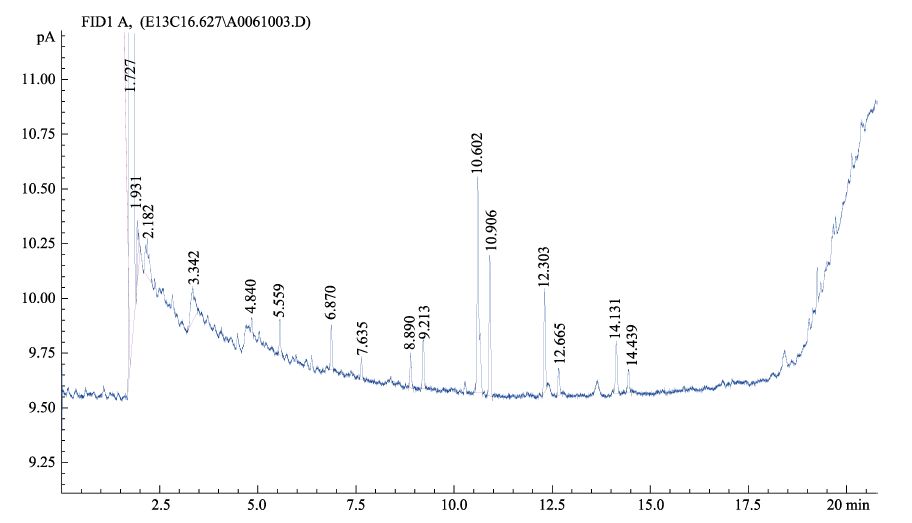
|
图 4 菌株15全细胞脂肪酸气相色谱 Figure 4 Gas chromatographic diagram of Strain 15 whole cell fatty acid |
|
|
表 5 菌株15全细胞脂肪酸的气相色谱鉴定结果 Table 5 Identification result of Strain 15 based on gas chromatographic analysis of whole cell fatty acid |
假交替单胞菌为革兰氏阴性、杆状细菌,目前,已发现30余种来自于海洋的假交替单胞菌属细菌,游海假交替单胞菌(P. haloplanktis ATCC 14393T)为该属的模式菌种(Gauthier et al,1995)。假交替单胞菌在海洋中分布广泛,能够漂浮或营附着生活,甚至在深海、极地等极端海洋环境中也有存在(Skovhus et al,2004)。该属细菌代谢类型多,根据产色素与否,分为产色素种和不产色素种。产色素种通常产生多种胞外生物活性物质,具有抗细菌(Longeon et al,2004)、抗真菌(詹萍等,2007)和溶藻(黄姿等,2008)等活性;而不产色素种类多具有卡拉胶酶、几丁质酶、褐藻酸酶、低温酶的活性,对环境的耐受性较强(Bowman,2007),在海洋生态系统中具有重要的作用。本研究从对虾养殖环境中分离的弧菌拮抗菌株15即为一株假交替单胞菌,产黄色色素,对多种海水养殖动物病原弧菌具有拮抗活性(图 1、图 2)。
在水产养殖中,利用细菌间的拮抗特性控制养殖动物疾病的方法已经有较多的报道(Balcázar et al, 2007; Leyva-Madrigal et al,2011)。研究发现,许多拮抗菌产生的抑菌物质能够杀死或抑制病原菌生长。假交替单胞菌种类较多,至今已发现多个菌株具有拮抗菌特性,多种从珊瑚(Montipora aequituberculata)中分离的假交替单胞菌(P. flavipulchra)能够合成分子量为60 kDa的抗菌蛋白,对耐甲氧西林葡萄球菌株(Staphylococcus aureus)具有强抗菌活力(Chen et al,2010)。从卵石上分离出的一株假单胞菌X153能够分泌分子量为87 kDa的抗菌蛋白,该抗菌蛋白对人皮肤病原及多种鱼类病原弧菌均具有强的抑制效果,还能够提高贝类幼体成活率(Longeon et al,2004)。王树杉(2009)1)从海水养殖环境中分离的杀鱼假交替单胞菌JGl,可分泌蛋白类抑菌物质,能抑制哈维氏弧菌和鳗弧菌的生长,且该菌对养殖动物安全性较高,可作为水产养殖中的有益菌加以研究和应用。本研究分离并鉴定的假交替单胞菌15,对弧菌同样表现出良好的拮抗作用,但其抗菌机理还有待查明。
1)王树杉.2009. 海洋有益菌JG1的分类鉴定及其抑菌活性物质的分离纯化与性质研究. 中国海洋大学硕士研究生学位论文,42-44
对虾养殖是世界渔业经济的支柱产业,近年来,受弧菌病的影响,多地养殖对虾发生早期死亡症(Kumar et al,2014; Joshi et al,2014),为了寻找替代抗生素的防治方法,利用有益微生物拮抗作用进行对虾早期死亡症的微生物防治将成为未来发展的方向之一。尽管研究结果表明,有多种假交替单胞菌对不同病原菌具有良好的拮抗特性,可以作为有益菌使用,但也发现部分菌株(P. undina)对养殖鱼类表现出一定致病性(Pujalte et al,2007)。国内研究也表明,假交替单胞菌可引起养殖刺参溃疡病(孟庆国等,2006)及腐皮综合征(王印庚等,2006)。本研究对所分离菌株15采用注射及浸泡方式进行生物安全性评价,结果显示,两种感染方式的LD50与96 h LC50分别为1.84×107 CFU/ml与2.70×107 CFU/ml,该浓度下,试验对虾出现临床症状,而Vijayan等(2006)发现的生物安全性较高的弧菌拮抗菌(Pseudomonas PS-102),在浸泡浓度达到107 CFU/ml时,浸泡对虾斑节对虾不表现出临床症状,没有出现死亡,表明本研究分离的菌株15在高浓度时对对虾具有潜在的毒性。因此,在对该菌株开发应用之前,尚需开展相关研究,阐明该菌株的致病机制,并寻找减毒方法。
| 王印庚, 方波, 张春云, 等. 养殖刺参保苗期重大疾病“腐皮综合征”病原及其感染源分析. 中国水产科学 , 2006, 13 (4) : 610-616 | |
| 邓欢, 王年斌, 安育新. 日本对虾Penaeus japonicus受弧菌感染的发病情况与感染剂量、温度条件的关系. 水产科学 , 1998, 17 (2) : 3-7 | |
| 李成海, 贠建民, 艾对元, 等. 金黄色葡萄球菌拮抗菌株的筛选及鉴定. 食品工业科技 , 2013, 34 (7) : 195-198 | |
| 范文辉, 黄倢, 王秀华, 等. 养殖大菱鲆溃疡症病原菌的分离鉴定及系统发育分析. 微生物学报 , 2005, 45 (5) : 665-670 | |
| 林敏, 宁喜斌. 具抑菌活性海洋微生物的筛选. 微生物学杂志 , 2005, 25 (5) : 23-25 | |
| 单文荣, 李俊霞, 刘花粉. 滤纸片法筛选不同活性物对棉花黄萎病菌抑制效果研究. 中国农学通报 , 2010, 26 (19) : 285-289 | |
| 孟庆国, 吴刘记, 吴信中, 等. 养殖刺参溃疡病病原学研究. 水产科学 , 2006, 25 (12) : 635-639 | |
| 莫照兰, 俞勇, 李会荣, 等. 弧菌拮抗菌的筛选. 青岛海洋大学学报(自然科学版) , 2001, 31 (2) : 225-231 | |
| 黄姿, 李春强, 于晓玲, 等. 一株溶藻细菌(Pseudoalteromonas sp. )的分离鉴定及溶藻活性初探. 海洋技术 , 2008, 27 (3) : 56-60 | |
| 詹萍, 梁静娟, 庞宗文, 等. 假交替单胞菌JIV-49产抗真菌活性物质的发酵条件研究. 生物技术 , 2007, 17 (1) : 69-72 | |
| Alapide-Tendencia EV, Dureza LA. Isolation of Vibrio spp. from Penaeus monodon (Fabricius) with red disease syndrome. Aquaculture , 1997, 154 (2) : 107-114 | |
| Alcaide E, Blasco MD, Esteve C. Occurrence of drug-resistant bacteria in two European eel farms. Appl Environ Microbiol , 2005, 71 (6) : 3348-3350 DOI:10.1128/AEM.71.6.3348-3350.2005 | |
| Balcázar JL, Rojas-Luna T, Cunningham DP. Effect of the addition of four potential probiotic strains on the survival of pacific white shrimp(Litopenaeus vannamei) following immersion challenge with Vibrio parahaemolyticus. J Invertebr Pathol , 2007, 96 (2) : 147-150 DOI:10.1016/j.jip.2007.04.008 | |
| Bowman JP. Bioactive compound synthetic capacity and ecological significance of marine bacterial genus Pseudoalteromonas. Mar Drugs , 2007, 5 (4) : 220-241 DOI:10.3390/md504220 | |
| Chen WM, Lin CY, Chen CA, et al. Involvement of an L-amino acid oxidase in the activity of the marine bacterium Pseudoalteromonas flavipulchra against methicillin-resistant Staphylococcus aureus. Enzyme Microb Technol , 2010, 47 (1-2) : 52-58 DOI:10.1016/j.enzmictec.2010.03.008 | |
| Das BK, Samal SK, Samantaray BR, et al. Antagonistic activity of cellular components of Pseudomonas species against Aeromonas hydrophila. Aquaculture , 2006, 253 (1-4) : 17-24 DOI:10.1016/j.aquaculture.2005.01.028 | |
| Gauthier G, Gauthier M, Christen R. Phylogenetic analysis of the genera Alteromonas, Shewanella, and Moritella using genes coding for small-subunit rRNA sequences and division of the genus Alteromonas into two genera, Alteromonas (emended) and Pseudoalteromonas gen. nov., and proposal of twelve new species combinations. Int J Syst Bacteriol , 1995, 45 (4) : 755-761 DOI:10.1099/00207713-45-4-755 | |
| Immanuel G, Citarasu T, Sivaram V, et al. Delivery of HUFA, probionts and biomedicine through bioencapsulated artemia as a means to enhance the growth and survival and reduce the pathogenesity in shrimp Penaeus monodon postlarvae. Aquacult Int , 2007, 15 (2) : 137-152 DOI:10.1007/s10499-007-9074-5 | |
| Joshi J, Srisala J, Truong VH, et al. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND). Aquaculture , 2014, 428-429 : 297-302 DOI:10.1016/j.aquaculture.2014.03.030 | |
| Kumar BK, Deekshit VK, Raj JRM, et al. Diversity of Vibrio parahaemolyticus associated with disease outbreak among cultured Litopenaeus vannamei (Pacific white shrimp) in India. Aquaculture , 2014, 433 : 247-251 DOI:10.1016/j.aquaculture.2014.06.016 | |
| Lee KK, Yu SR, Chen FR, et al. Virulence of Vibrio alginolyticus isolated from diseased tiger prawn, Penaeus monodon. Curr Microbiol , 1996, 32 (4) : 229-231 DOI:10.1007/s002849900041 | |
| Leyva-Madrigal KY, Luna-González A, Escobedo-Bonilla CM, et al. Screening for potential probiotic bacteria to reduce prevalence of WSSV and IHHNV in white-leg shrimp (Litopenaeus vannamei) under experimental conditions. Aquaculture , 2011, 322-323 : 16-22 DOI:10.1016/j.aquaculture.2011.09.033 | |
| Liu PC, Lee KK, Yii KC, et al. Isolation of Vibrio harveyi from diseased kuruma prawns Penaeus japonicus. Curr Microbiol , 1996, 33 (2) : 129-132 DOI:10.1007/s002849900087 | |
| Longeon A, Peduzzi J, Barthelemy M, et al. Purification and partial identification of novel antimicrobial protein from marine bacterium Pseudoalteromonas species strain X153. Mar Biotechnol , 2004, 6 (6) : 633-641 DOI:10.1007/s10126-004-3009-1 | |
| Pujalte MJ, Sitjà-Bobadilla A, Macián MC, et al. Occurrence and virulence of Pseudoalteromonas spp. in cultured gilthead sea bream (Sparus aurata L.) and European sea bass (Dicentrarchus labrax L.). Molecular and phenotypic characterization of P. undina strain U58. Aquaculture , 2007, 271 (1-4) : 47-53 | |
| Reed LJ, Muench H. A simple method of estimating fifty percent endpoints. Am J Epidemiol , 1938, 27 (3) : 493-497 | |
| Skovhus TL, Ramsing NB, Holmstrom C, et al. Real-time quantitative PCR for assessment of abundance of Pseudoalteromonas species in marine samples. Appl Environ Microbiol , 2004, 70 (4) : 2373-2382 | |
| Vijayan KK, Bright Singh IS, Jayaprakash NS, et al. A brackishwater isolate of Pseudomonas PS-102, a potential antagonistic bacterium against pathogenic vibrios in penaeid and non-penaeid rearing systems. Aquaculture , 2006, 251 (2-4) : 192-200 DOI:10.1016/j.aquaculture.2005.10.010 | |
| Zhang QL, Liu Q, Liu S, et al. A new nodavirus is associated with covert mortality disease of shrimp. J Gen Virol , 2014, 95 (12) : 2700-2709 | |
| Ziaei-Nejad S, Rezaei MH, Takami GA, et al. The effect of Bacillus spp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus. Aquaculture , 2006, 252 (2-4) : 516-524 |



