2. 上海海洋大学食品学院 上海 201306
2. College of Food Science & Technology, Shanghai Ocean University, Shanghai 201306
木聚糖是植物半纤维素的主要成分,其含量仅次于纤维素,是自然界中最为丰富的可再生资源之一(单志琼等,2012)。木聚糖的主链由D-木糖以β-l,4-糖苷键连接而成(余英鹏等,2014),内切-β-l,4-木聚糖酶作用于木聚糖主链,可以将其水解为低聚木糖(Beg et al,2001)。低聚木糖一般由2-7个木糖残基构成,它在人体肠道内会促进有益菌的生长,改善肠道微环境,增强机体免疫力(凌沛学等,2007)。另外,低聚木糖能有效降低高血压、高血脂和糖尿病的发病率;还可以润肠通便,治疗腹泻(孙毅等,2014)。木聚糖酶也被广泛应用于饲料、造纸及食品等行业。
产木聚糖酶的微生物来源非常广泛,包括细菌(刘程程等,2014; 孙明哲等,2013)、放线菌(朱运平等,2012)、霉菌(江正强等,2007; 郑虹,2014)及酵母(Liu et al,1999; 陆彬等,2014),来源不同的木聚糖酶的酶学性质差异较大。真菌产的木聚糖酶多为酸性且热稳定性不高(Shi et al,2012),细菌产的木聚糖酶多为中性或偏碱性且具有较好的耐碱性和热稳定性。本研究对分离自黄海海域的一株产木聚糖酶的芽孢杆菌进行发酵优化,优化筛选参考马子宾等(2015)、陈世建等(2014)的研究方法,使木聚糖酶产量达到较高水平。
1 材料与方法 1.1 菌株芽孢杆菌YS1069由中国水产科学研究院黄海水产研究所海洋产物资源与酶工程研究室提供。
1.2 培养基及培养条件 1.2.1 培养基种子培养基:淀粉10 g/L,蛋白胨5 g/L,酵母膏5 g/L,K2HPO4 1 g/L,MgSO4·7H2O 0.2 g/L,NaCl 50 g/L,Na2CO3 10 g/L。基础发酵培养基:麸皮40 g/L,豆饼粉20 g/L,Na2CO3 12 g/L。
1.2.2 培养条件将保存的斜面菌种接种于液体种子培养基中,30℃、200 r/min培养22 h,再以4%的接种量将菌液转入基础发酵培养基中,30℃、230 r/min培养96 h。
1.3 方法 1.3.1 酶活性的测定方法发酵液离心(10000×g、15 min)后,上清液用pH=8.0、50 mmol/L的Na2HPO4-NaH2PO4(PBS)缓冲液适当稀释,采用3,5-二硝基水杨酸(DNS)法测定木聚糖酶酶活性(孙丰慧等,2008):在比色管中加入0.4 ml用pH=8.0的PBS缓冲液配制的1%的木聚糖(Sigma公司)溶液,置于55℃水浴中预热10 min,再加入稀释酶液0.1 ml,55℃水浴反应30 min。用冰冷却终止反应,加入1.5 ml DNS,煮沸15 min,加蒸馏水定容至10 ml,用分光光度法测定反应的OD497 nm,以木糖浓度和OD497 nm制作标准曲线。在pH=8.0、55℃反应条件下,以每小时木聚糖酶水解木聚糖产生1 mg木糖所需要的酶量定义为1个酶活力单位。
1.3.2 单因素实验根据单因素实验设计原理,在其他发酵条件不变的前提下,依次考察氮源、碳源、无机盐、接种量、装液量、起始pH、发酵温度和发酵时间对菌株产酶的影响,每个实验重复两次,每次设3个平行,每组数据重复测定两次,通过取各组数据的均值来评价各因素对菌株发酵产酶的影响。
1.3.3 响应面实验在单因素实验的基础上,根据Plackett-Burman实验设计和中心组合实验设计原理,以每毫升发酵液中所含的酶活性单位数作为响应值Y1(U/ml),每个实验重复两次,每次设3个平行,每组数据重复测定两次,取各组数据的均值,利用Design-Expert 8.05软件对实验结果进行响应面回归分析,考察各因素的主效应和交互效应对菌株产木聚糖酶的影响,以获得最佳的产木聚糖酶条件。
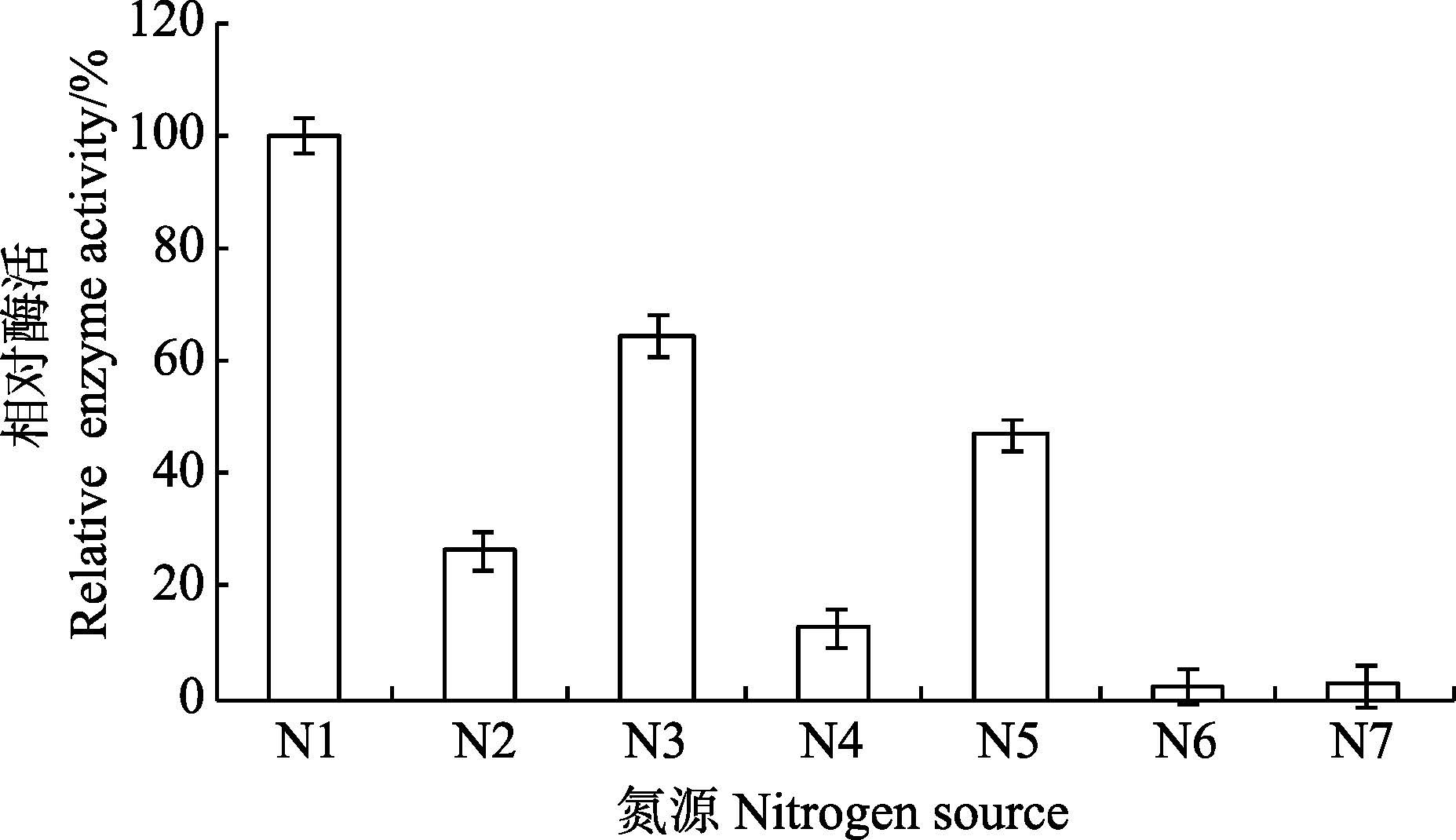
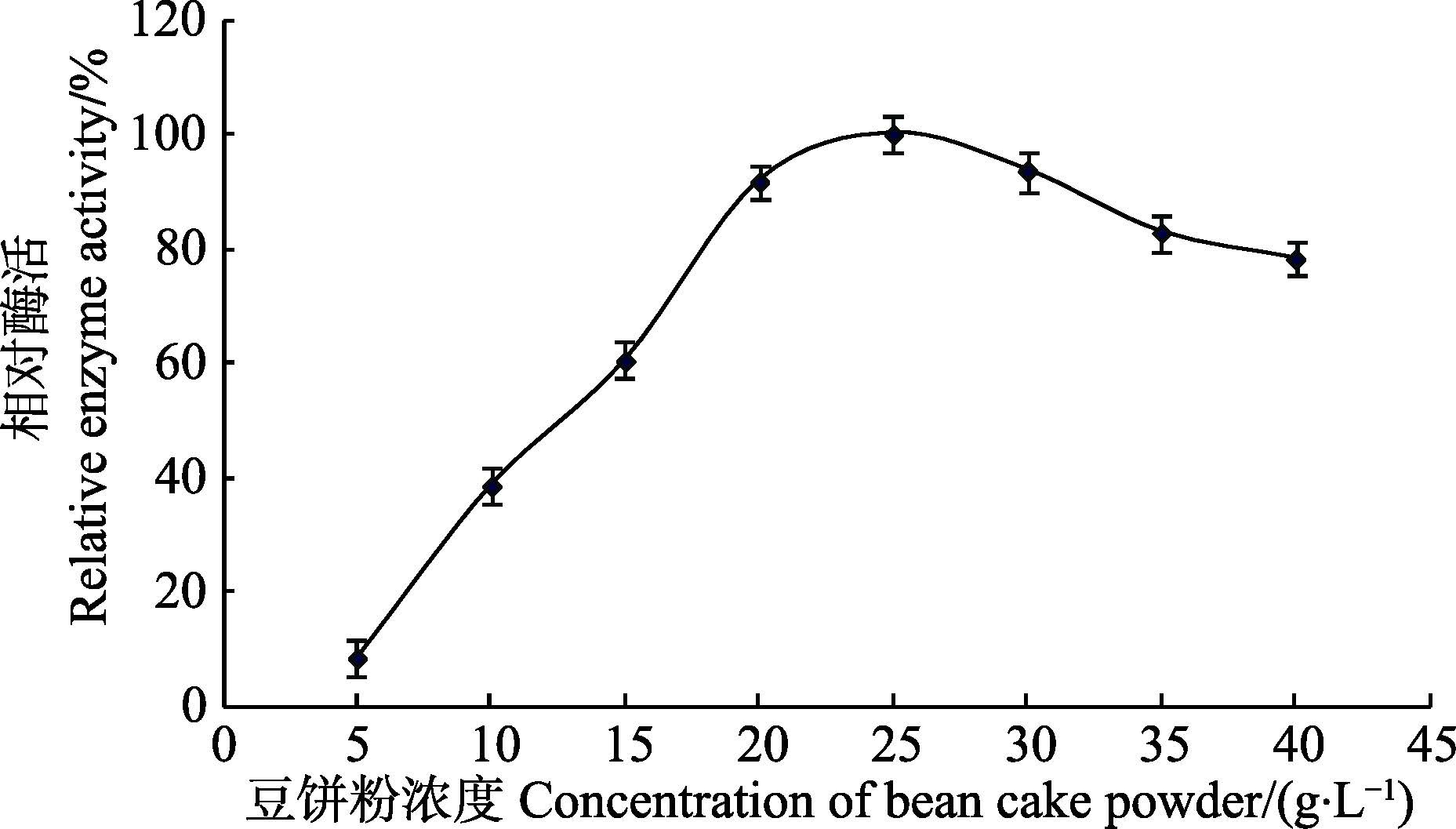
2 结果与分析 2.1 单因素实验设计与分析 2.1.1 氮源对菌株产木聚糖酶的影响从基础发酵培养基出发,研究不同氮源(20 g/L)对菌株产木聚糖酶的影响。结果如图 1所示,其发酵产酶的最佳氮源为豆饼粉。随后进行了不同浓度的豆饼粉对产酶的影响(图 2),当豆饼粉在浓度为25 g/L时,相对酶活力最高。
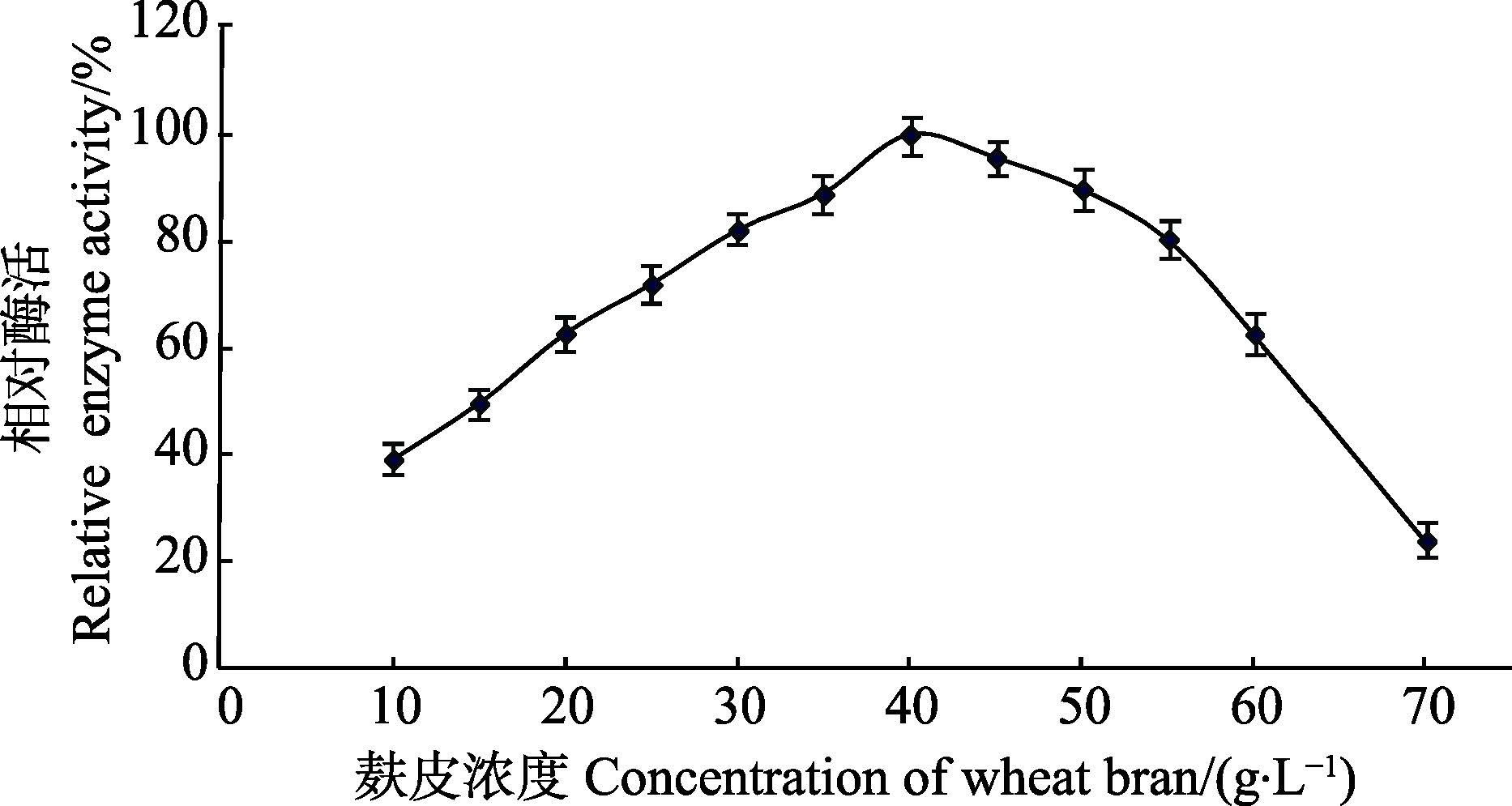
2.1.2 碳源对菌株产木聚糖酶的影响固定氮源为豆饼粉(25 g/L),研究不同碳源(40 g/L)对产酶的影响(图 3和图 4)。相同条件下,麸皮为碳源时,产酶效果最好;麸皮浓度为40 g/L时,获得较高的酶活力。
|
图 1 氮源种类对产酶的影响 Figure 1 Effects of nitrogen source on the production of xylanase N1: 豆饼粉; N2: 酵母粉; N3: 蛋白胨; N4: 玉米浆; N5: 酵母膏; N6: 牛肉膏; N7: 硫酸铵 N1: bean cake powder; N2: yeast powder; N3: peptone; N4: corn paste; N5: yeast extract; N6: beef extract;N7:(NH4)2SO4 |
|
图 2 豆饼粉浓度对产酶的影响 Figure 2 Effects of concentration of bean cake powder on the production of xylanase |

|
图 3 碳源种类对产酶的影响 Figure 3 Effects of carbon source on the production of xylanase C1: 可溶性淀粉; C2: 麦芽糖; C3: 葡萄糖; C4: 蔗糖; C5: 麸皮; C6; 乳糖; C7: 木聚糖; C8: β-环糊精; C9: 甘油; C10: 柠檬酸; C11: 糊精 C1: soluble starch; C2: maltose; C3: glucose; C4: sucrose; C5: wheat bran; C6: lactose; C7: xylan; C8: β-cyclodextrin; C9: glycerin; C10: citric acid; C11: dextrin |
|
图 4 麸皮浓度对产酶的影响 Figure 4 Effects of concentration of wheat bran on the production of xylanase |
NaNO3、K2HPO4、MgSO4·7H2O在添加量分别为0.9 g/L、3 g/L和0.6 g/L时,菌株YS1069产酶量达到最高。
2.1.4 接种量对菌株产木聚糖酶的影响在30 ml的发酵培养基中分别按照体积分数1%、2%、4%、6%、8%、10%和12%接入种子培养液。接种量为4%时,酶活性相对较高。
2.1.5 装液量对菌株产木聚糖酶的影响250 ml三角瓶中,较低装液量水平时(<40 ml),酶产量相对稳定;较高装液量水平时,酶产量快速减少,这主要是由于溶氧较低、供氧不足造成的。
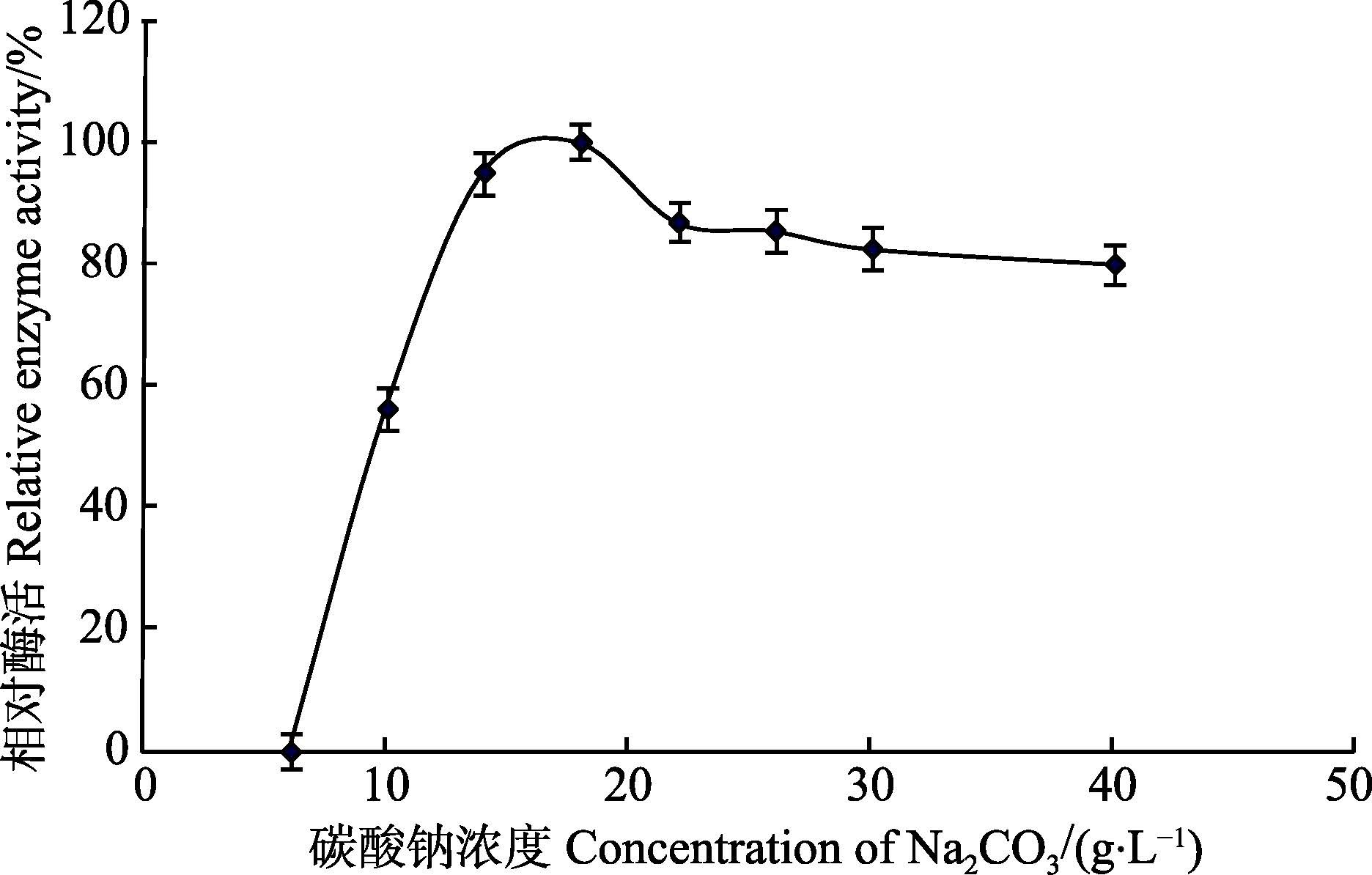
2.1.6 Na2CO3浓度对菌株产木聚糖酶的影响其他条件不变,通过改变Na2CO3的添加量来改变发酵培养基的起始pH,考察其对菌株产酶的影响(图 5)。当Na2CO3添加量为18 g/L、起始pH为9.5时,酶产量相对较高。
|
图 5 Na2CO3 浓度对产酶的影响 Figure 5 Effects of concentration of Na2CO3 on the production of xylanase |
考察不同温度(15℃、20℃、25℃、28℃、30℃、33℃、37℃和40℃)对产酶的影响(图 6),该菌在相对较低温度下(25-33℃),产酶较高;在较高温度下(>37℃),产酶量明显下降。这可能与菌株YS1069来自海洋环境并长期适应低温环境有关。
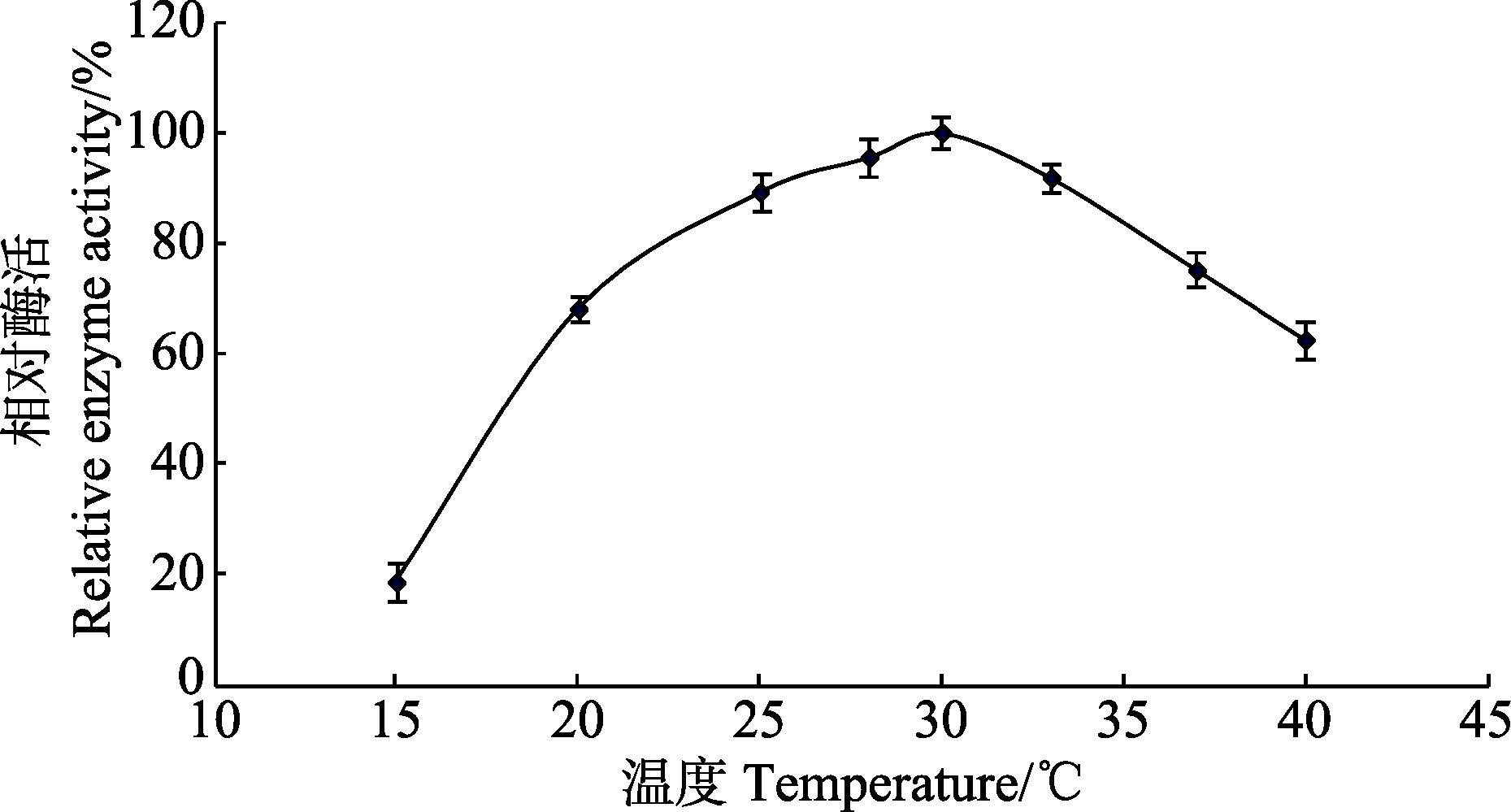
|
图 6 发酵温度对产酶的影响 Figure 6 Effects of temperature on the production of xylanase |
种子培养液按4%(v/v)接种量接种入250 ml三角瓶中的30 ml基础发酵培养基中,30℃、230 r/min培养,间隔取样测定酶活力(图 7),在培养96 h时,酶产量达到最大。因此,确定其最佳培养时间为96 h 。
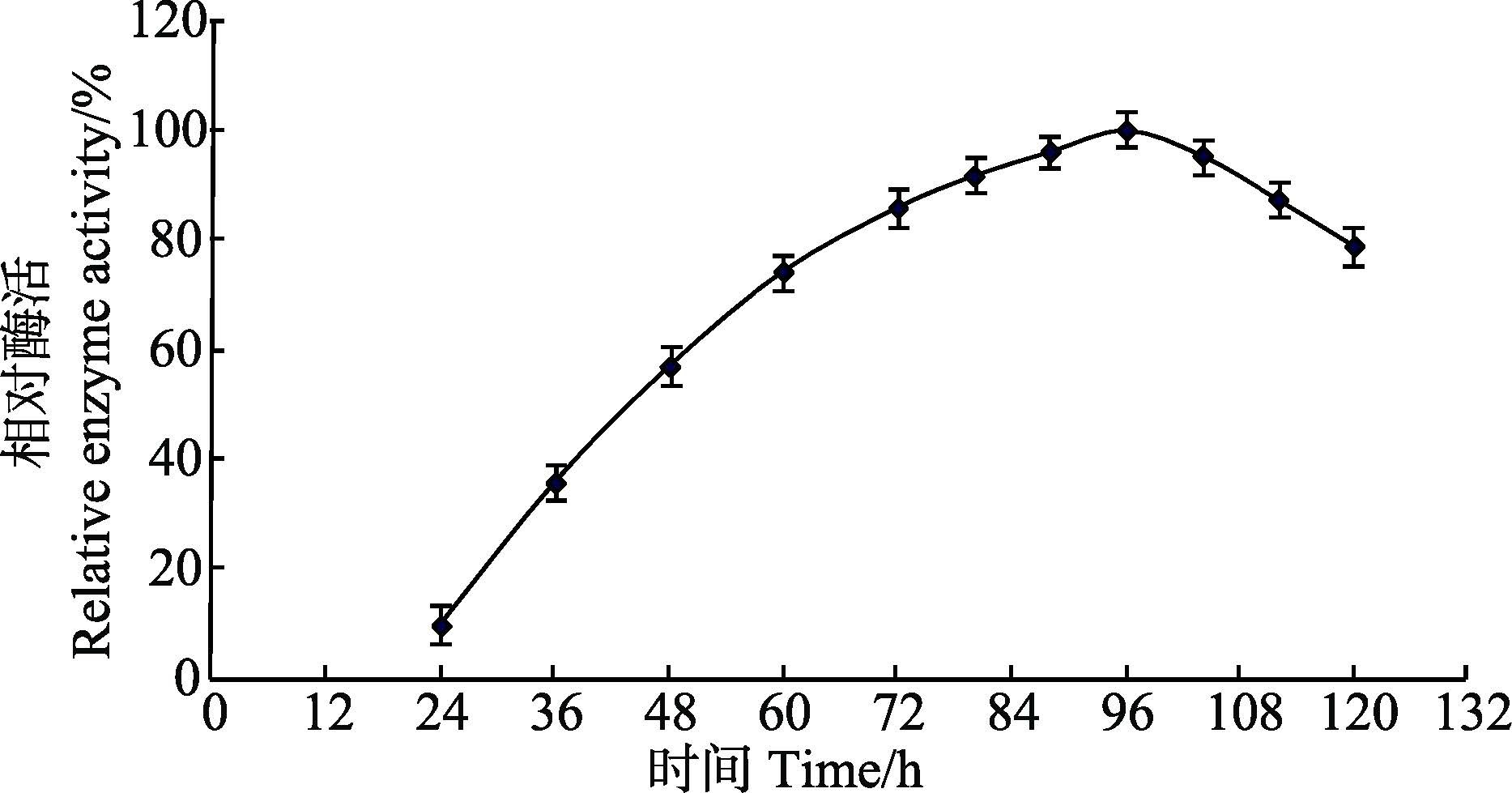
|
图 7 发酵时间对产酶的影响 Figure 7 Effects of culturing time on the production of xylanase |
单因素实验后,为筛选对发酵产木聚糖酶影响较大的因素,用每毫升发酵液中所含的酶活力单位数作为响应值Y1(U/ml),选择麸皮、接种量、装液量、MgSO4·7H2O、豆饼粉、K2HPO4、Na2CO3和NaNO3作为研究对象,另外,在实验运行次数不增加的情况下,选择3个虚拟项,各影响因素的编码水平及PB实验结果分析见表 1和表 2。
|
|
表 1 Plackett-Burman 实验因素水平 Table 1 Levels of independent variables in Plackett-Burman test |
|
|
表 2 Plackett-Burman实验结果分析 Table 2 Analysis of experimental results in Plackett-Burman test |
利用响应面软件分析PB实验结果,可以确定Na2CO3、MgSO4·7H2O、麸皮为主要影响因素(P<0.05),贡献值合计达82.06。
2.2.2 中心组合实验设计与结果为进一步研究因素之间的交互作用并获得最大产酶量,设计3个主要因素5个水平、N=20的中心组合实验,以Design-Expert 8.05软件对中心组合实验结果进行响应面回归分析。因素水平编码见表 3,实验设计及结果见表 4。
|
|
表 3 中心组合实验设计的因素及其编码值 Table 3 Factors and codes in central composite test design |
|
|
表 4 中心组合实验设计及其结果 Table 4 Experimental design and results of central composite test |
通过Design-Expert数据分析软件对中心组合实验结果进行回归分析,得到的方差分析结果如表 5所示。结果显示,实验所用模型P<0.0001,表明该二次方程模型达到极显著水平,并且失拟项P=0.1023>0.05,表明该模型的失拟度不显著,说明回归方程对数据进行了较好的拟合,二次多项回归方程为:
| $\begin{align} & Y=4163.42+661.47{{X}_{7}}+29.10{{X}_{4}}-742.95{{X}_{1}} \\ & +209.02{{X}_{7}}{{X}_{4}}+871.90{{X}_{7}}{{X}_{1}}+105.09{{X}_{4}}{{X}_{1}} \\ & -426.06{{X}_{7}}^{2}-255.59{{X}_{4}}^{2}-1023.05{{X}_{1}}^{2} \\ \end{align}$ |
|
|
表 5 响应面模型方差分析 Table 5 Variance analysis of the response surface quadratic model |
由统计软件分析可知,Y预测最大值为4462.34 U/ml,此时,Na2CO3浓度为21.86 g/L,麸皮浓度为51.41 g/L,MgSO4·7H2O浓度为0.59 g/L。在该条件下对模型预测值进行实验验证,结果为4408.63 U/ml,比发酵优化前(738.21 U/ml)提高了约5倍。实验值与预测值基本相符,说明预测模型可应用于该木聚糖酶发酵条件的优化。
由Design-Expert 8.05软件分析得到三因素交互作用(图 8),其中,Na2CO3和麸皮的交互作用对木聚糖酶活性的影响最为显著。
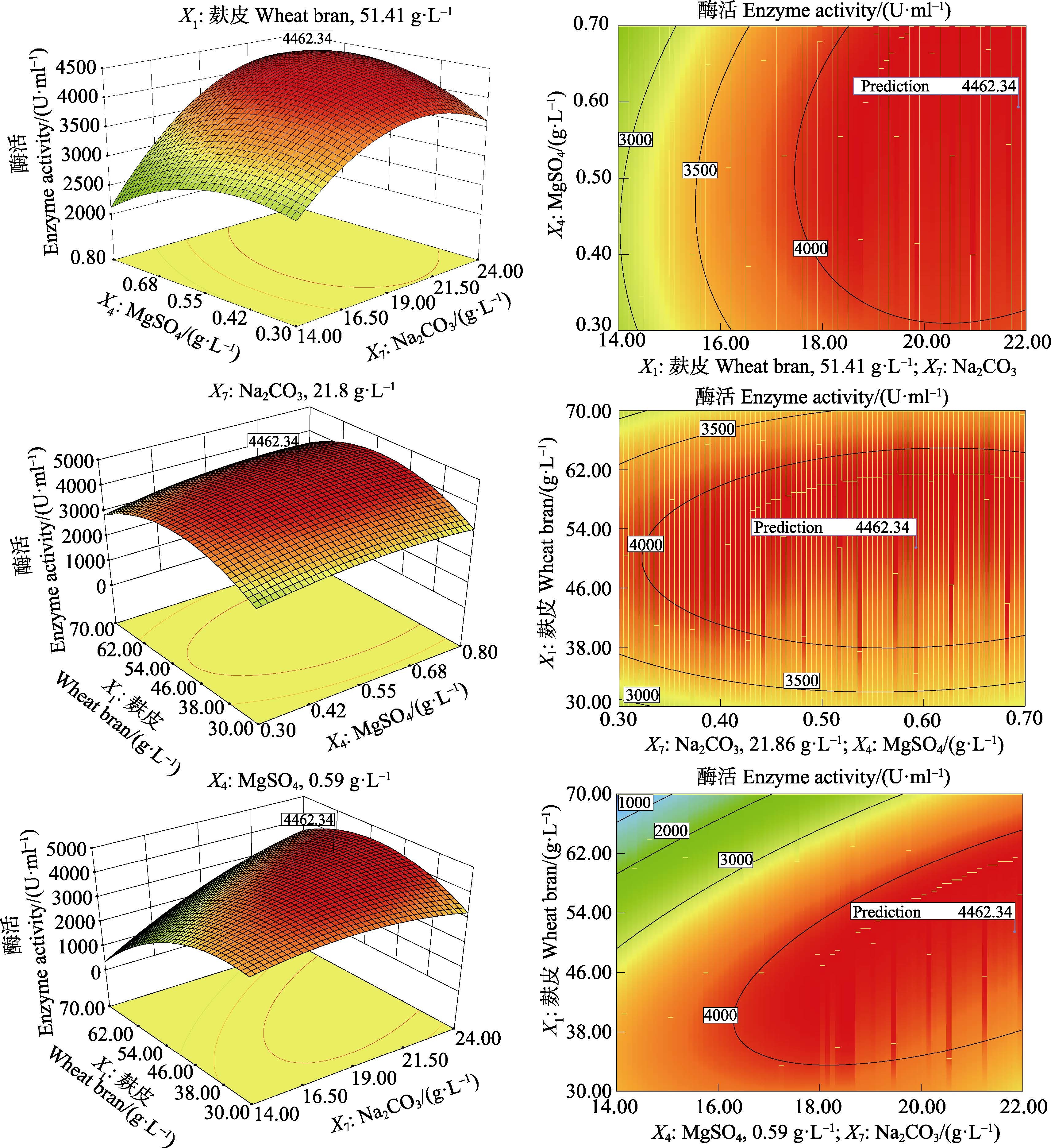
|
图 8 响应面三维图和对应的等高线 Figure 8 Three-dimensional response surface diagrams and the corresponding contour plots |
微生物发酵产酶量的高低受多种因素的影响,因此,为了获得较高的酶产量就需要对各种因素进行优化,从而获得有利于产酶的最优组合。另外,不同来源的菌种发酵产酶量也有很大的差别,因此,目的菌株的选择对于发酵的影响也是至关重要的。海洋环境的低温、高压、高盐环境使海洋微生物表现出许多独特的性质,因此,比来自陆地的微生物更具开发应用前景。
本研究通过单因素实验和响应面实验优化了芽孢杆菌YS1069产木聚糖酶的发酵条件。实验最终确定了发酵培养的最佳碳源麸皮、氮源豆饼粉的浓度分别为51.41 g/L和25 g/L,无机盐NaNO3、K2HPO4、MgSO4·7H2O的最佳浓度分别为0.9 g/L、3 g/L和0.59 g/L。在Na2CO3浓度21.86 g/L、4%接种量、30 ml装液量和30℃的条件下发酵96 h获得最优酶产量。优化后木聚糖酶的酶活力与未优化前相比,提高约5倍,优化效果显著,优化后的摇瓶发酵液1 ml可催化木聚糖生成木糖的速率为483.26 μmol/min。目前,国内外也有许多对微生物产木聚糖酶的研究报道,芽孢杆菌Bacillus sp. QH14(单志琼等,2012)和Bacillus sp. No. X-18(葛方兰等,2009)的摇瓶发酵液1 ml催化生成木糖的速率为648.79 μmol/min和72.41 μmol/min;Bacillus altitudinis DHN8的摇瓶发酵液1 ml催化生成木糖的速率为245 μmol/min(Adhyarua et al,2014)。与其他芽孢杆菌产木聚糖酶的报道相比,芽孢杆菌YS1069的产木聚糖酶酶活力相对较高且培养基原料成本低,为该酶的理论研究和工业应用奠定了基础。
| 马子宾, 郑鸿飞, 刘均忠, 等. 一株海洋中性蛋白酶高产菌S-3685的鉴定及产酶条件. 渔业科学进展 , 2015, 36 (5) : 131-137 | |
| 朱运平, 禇文丹, 李秀婷, 等. 一株产木聚糖酶放线菌的液体发酵条件优化及水解特性研究. 食品科学 , 2012, 33 (21) : 177-182 | |
| 刘程程, 刘波, 蓝江林, 等. 产木聚糖酶芽胞杆菌的筛选及产酶条件优化. 福建农业学报 , 2014, 29 (8) : 757-767 | |
| 江正强, 邓伟, 翟倩, 等. 链霉菌D21产木聚糖酶的发酵条件研究. 林产化学与工业 , 2007, 27 (1) : 52-56 | |
| 孙丰慧, 李安明. 耐碱性木聚糖酶产生菌的筛选及发酵条件研究. 应用与环境生物学报 , 2008, 14 (3) : 436-439 | |
| 孙明哲, 郑宏臣, 孙君社, 等. 产耐高温木聚糖酶菌株的筛选及其产酶条件优化. 中国酿造 , 2013, 32 (8) : 15-20 | |
| 孙毅, 韩春超. 低分子木糖的制备与应用. 化工时刊 , 2014, 28 (6) : 31-34 | |
| 余英鹏, 姜腾飞, 李茜, 等. 黑曲霉木聚糖酶XynB耐热性的定向改造及表达、纯化. 应用与环境生物学报 , 2014, 20 (6) : 1082-1085 | |
| 陆彬, 万红贵. 木聚糖酶发酵工艺在50 L罐中的放大. 生物加工过程 , 2014, 12 (2) : 63-65 | |
| 陈世建, 王伟, 孙谧. 一株海洋过氧化氢酶高产菌的鉴定及产酶条件优化. 渔业科学进展 , 2014, 35 (4) : 103-109 | |
| 郑虹. 应用响应面法优化黑曲霉固态发酵稻谷壳产木聚糖酶条件. 食品工业科技 , 2014, 35 (8) : 210-222 | |
| 单志琼, 周峻岗, 周宇飞, 等. 产碱性木聚糖酶菌株的筛选及酶学性质. 遗传 , 2012, 34 (3) : 356-365 | |
| 凌沛学, 朱希强, 苏移山, 等. 低聚木糖功能与应用研究进展. 食品与药品 , 2007, 9 (9) : 35-39 | |
| 葛方兰, 王宇, 杜良俊, 等. 碱性木聚糖酶产生菌的筛选及培养基成分的优化. 西南农业学报 , 2009, 22 (2) : 311-314 | |
| Adhyarua DN, Bhatt NS, Modi HA. Enhanced production of cellulase-free, thermo-alkali-solvent-stable xylanase from Bacillus altitudinis DHN8, its characterization and application in sorghum straw saccharification. Biocat Agricult Biotech , 2014, 3 (2) : 182-190 | |
| Beg QK, Kapoor M, Mahajan L, et al. Microbial xylanases and their industrial applications: a review. Appl Microbiol Biotech , 2001, 56 (3-4) : 326-338 DOI:10.1007/s002530100704 | |
| Liu W, Lu YL, Ma GR. Induction and glucose repression of endo-β-xylanase in the yeast Trichosporon cutaneum SL409. Process Biochem , 1999, 34 (1) : 67-72 DOI:10.1016/S0032-9592(98)00071-5 | |
| Shi P, Qiu Z, Bai Y, et al. A new xylanase from Streptomyces megasporus DSM41476 with high yield of xylobiose. World J Microbiol Biotechnol , 2012, 28 (2) : 687-692 DOI:10.1007/s11274-011-0863-7 |



