2. 广西壮族自治区水产科学研究院 南宁 530021
2. Guangxi Academy of Fishery Sciences, Nanning 530021
香港巨牡蛎(Crassostrea hongkongensis)为双壳纲(Bivalvia)、牡蛎科(Ostreidae)软体动物,其软体部为白色,生长迅速,是我国南方重要的养殖种类之一,(王海艳,2004)1)。香港巨牡蛎曾长期被误认为是“近江牡蛎”(Crassostrea rivularis,Gould 1861),其现名由Lam等(2003)通过分子系统学和形态学分析重新确定。Wang等(2004)与王海艳等(2007)利用形态分析和DNA证据,证明华南沿海的“白肉蚝”为香港巨牡蛎。
1) 王海艳. 中国近海常见牡蛎分子系统演化和分类的研究. 中国科学院海洋研究所博士研究生学位论文, 2004, 36–38
广西钦州的茅尾海牡蛎养殖基地是中国最大的牡蛎天然采苗区,其海域面积合计2340.1 km2,最高年产苗种约1000亿粒(钟方杰,2013)2)。香港巨牡蛎为茅尾海采苗区的优势种,其幼虫和稚贝数量占比超过97.5%(钟方杰,20132); 宋忠魁等,2010),因其肉质鲜美、营养丰富,形成了特色地标品牌“钦州大蚝”。其苗种不仅在广西茅尾海和大风江入海口等处大量养殖,而且输送到广东、福建和海南等地,对南方牡蛎养殖产业有重要贡献(苏天凤,2006)。尽管每年的5-9月,在茅尾海均可用附苗器采到天然牡蛎幼苗,但附苗的速度和苗种的质量在不同的时间差别很大(钟方杰等,2014)。2008年前后,茅尾海的香港巨牡蛎自然苗种数量出现骤减,养殖户便从广东珠海引进苗种。随后的两年中,引进的养殖牡蛎也出现大量死亡现象。
2) 钟方杰. 广西茅尾海香港巨牡蛎半人工采苗技术研究. 广西大学硕士研究生学位论文, 2013, 1–42
为探明香港巨牡蛎的性腺发育规律和繁殖特性,了解野生和幼苗种群的遗传结构及其变迁规律,并掌握不同海区养殖牡蛎的性腺发育速度的差异,本研究将肉眼观察、活体镜检和组织切片技术相结合,对广西主要采苗区和养殖区的香港巨牡蛎的性腺发育周年变化进行研究,同时建立了肉眼快速判断牡蛎性腺发育程度的方法,并对茅尾海沙井和大风江入海口内外吊养的牡蛎性腺发育的启动和发展过程进行比较,以期为香港巨牡蛎的生产实践和资源动态研究提供理论依据。
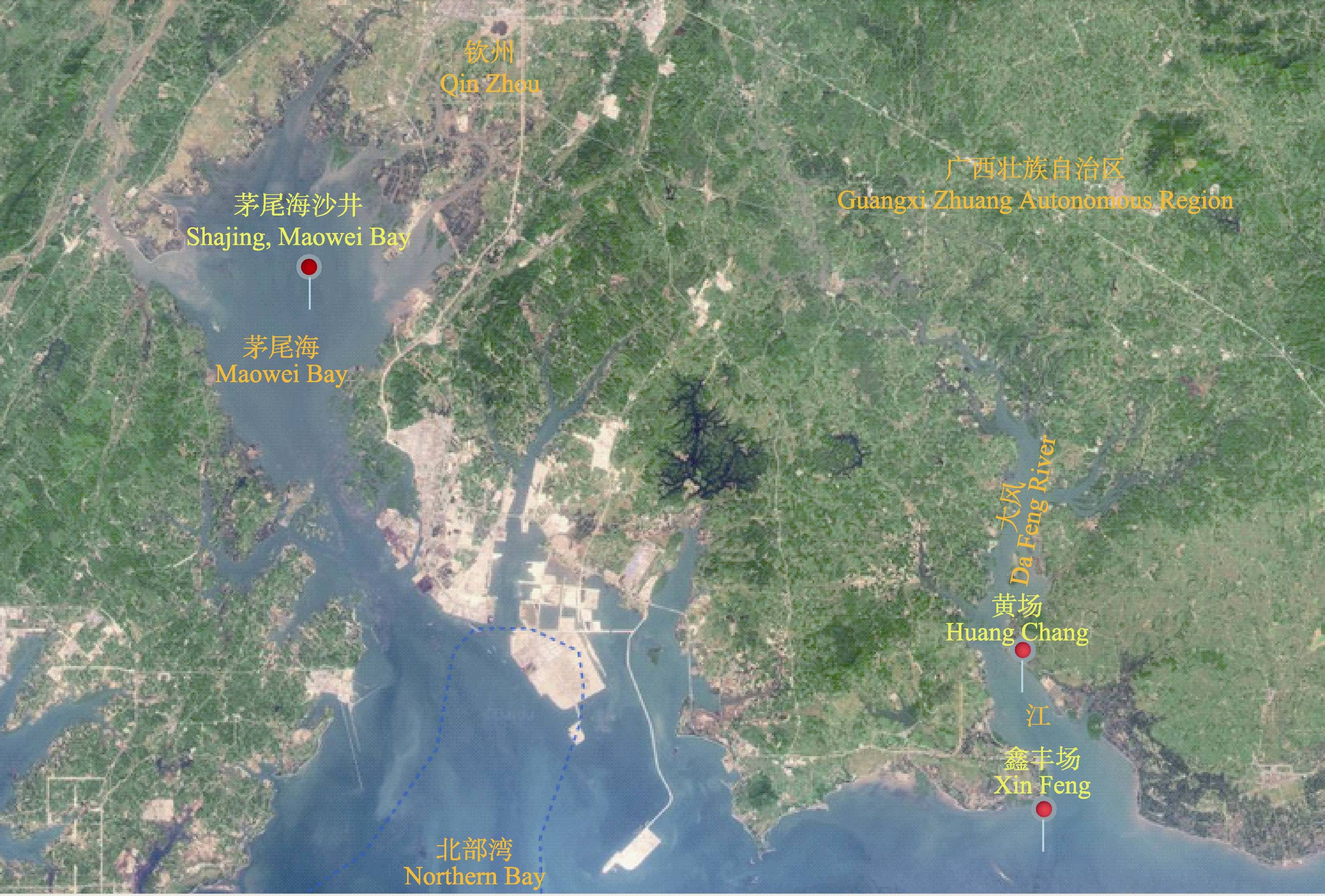
1 材料与方法 1.1 实验材料2012年6月从茅尾海沙井采集牡蛎苗种后吊养于大风江入海口内黄场(HH: N21°39′14.15″,E108°52′6.49″,图 1)。2013年7月-2014年6月,每月随机取样10个,进行性腺发育观察和组织切片。
|
图 1 牡蛎样本采集地点 Figure 1 Sampling sites of Crassostrea hongkongensis |
2011年8月采自茅尾海沙井的同一批牡蛎苗种,分别吊养于茅尾海沙井(MS: N21°49′57.85″,E108°32′ 41.56″)、黄场(HH: N21°39′14.15″,E108°52′6.49″)和大风江入海口外鑫丰牡蛎养殖场(XF: N21°36′15.83″,E108°52′28.14″)(图 1)。2014年1-6月,每月随机取样10个,进行性腺发育观察和组织切片,比较不同养殖区域间性腺发育差异。
1.2 方法将牡蛎样品进行标号和测量,测量其壳长、壳宽、壳高,称量壳重、肉重,肉眼观察性腺发育情况,并用数码相机拍照。
去壳,取软体部,用Bouin’s液固定。从固定的内脏囊后背侧和后腹侧分别切取包括左右外套膜在内的软体部组织块,经系列浓度酒精脱水、石蜡包埋、4-6 μm切片、HE染色后,光学显微镜(Leica DMA2500或OLYMPUS IX71)观察并拍照。结合肉眼观察和组织切片分析,对牡蛎的性腺周年变化进行分期,统计每月各期性腺所占比例,确定香港巨牡蛎的产卵排精高峰,并对比分析3个不同地区吊养牡蛎性腺发育启动和过程的差异。
细胞测量:将牡蛎样品逐个切片,选取所需部位各一张切片,用显微镜附带软件(Leica: LAS V3.7或OLYMPUS: Image-Pro Plus 7.0C)在10×40放大倍数下随机测量每种细胞30个,分别测量单个细胞及其细胞核的长轴和短轴,取其均值进行统计分析。
将盐度(电导率)和温度记录仪(DST-CT,冰岛Star-Oddi公司)放置在茅尾海沙井(MS)水面下0.5 m水深,记录2014年全年茅尾海海水温度和盐度的变化,将每月数据汇总,取平均值作图。而在大风江黄场则于2014年2-7月每月测量温度和盐度2 d,作为参照。
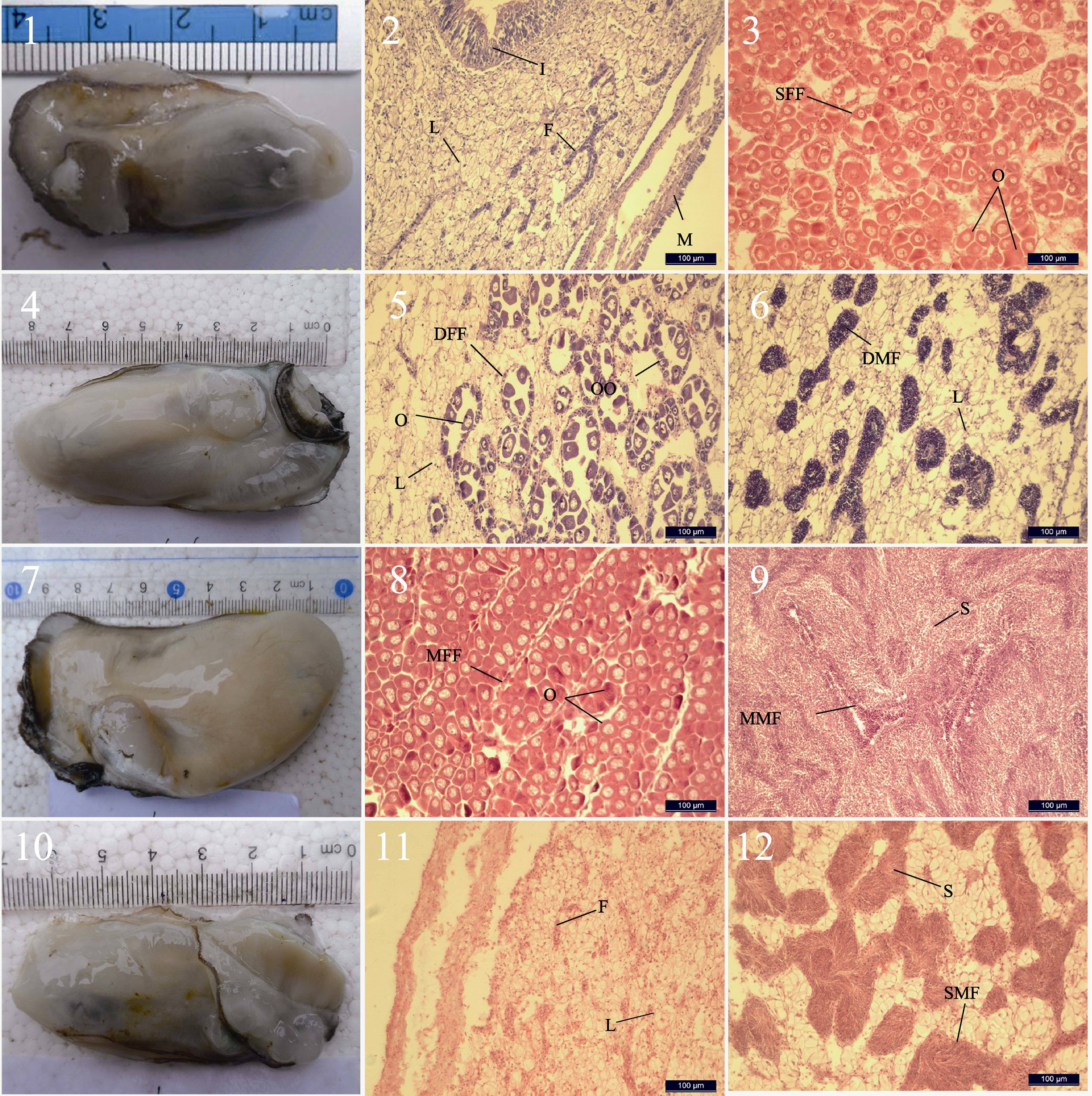
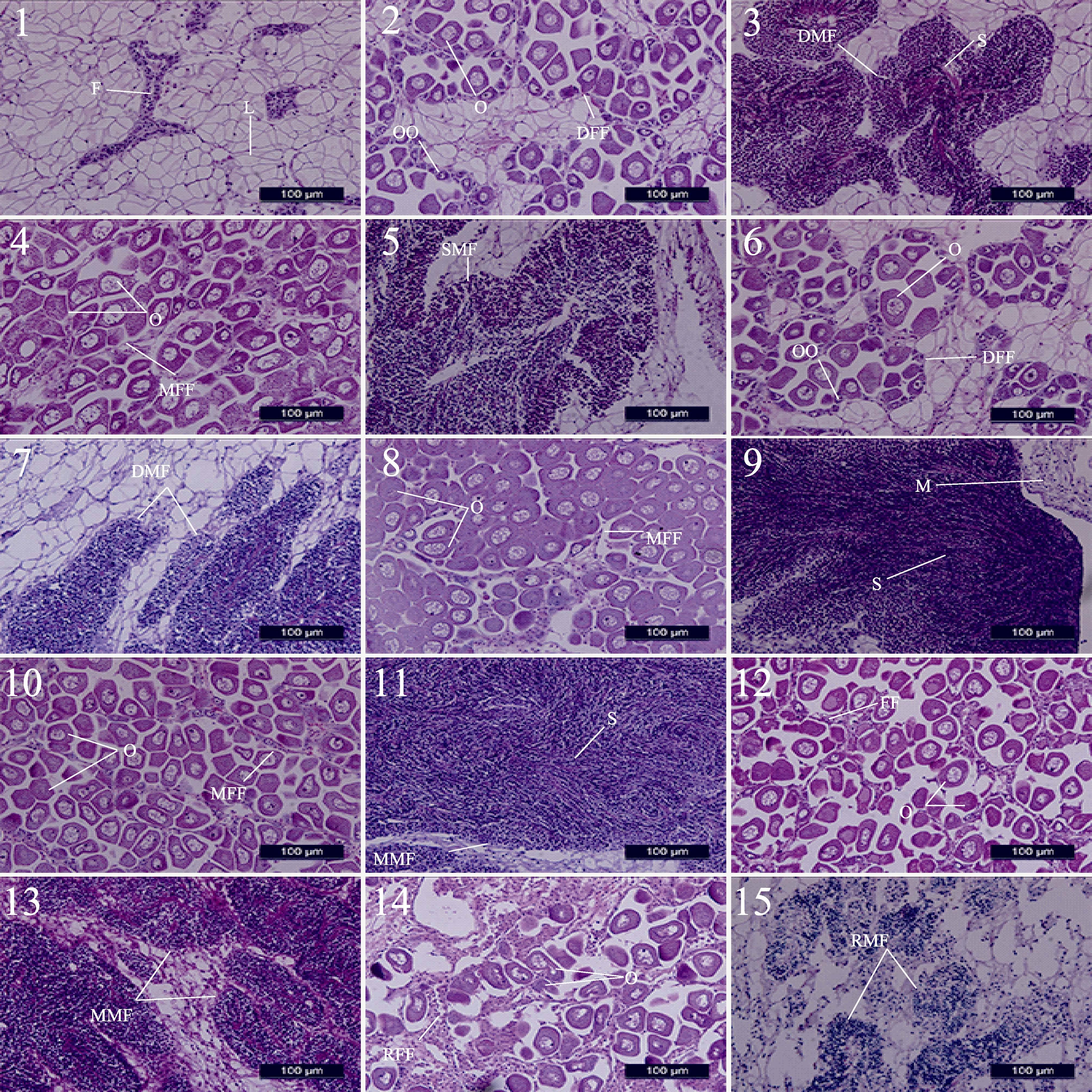
2 结果 2.1 香港巨牡蛎性腺发育分期 2.1.1 未分化期(Ⅰ)性腺刚刚开始发育,肉眼隐约可见在内脏团表面有一层很薄的白色半透明的性腺组织,主要分布于消化腺背部两侧。外套膜半透明,深色消化腺清晰可见(图 2-1)。此时用牙签或细镊子取半透明处组织,显微镜下检测不到生殖细胞。切片观察,在外套膜和消化腺之间是一层染色浅淡的结缔组织,其中不均匀地分布有索状和带状的生殖腺滤泡,不能分辨雌雄(图 2-2)。滤泡细胞直径为(6.43± 0.94)μm,滤泡细胞核直径为(4.11±0.67)μm(表 1)。
|
|
表 1 牡蛎各时期细胞及细胞核平均直径 Table 1 Average diameter of cells and nucleus of C. hongkongensis at different stage(μm) |
|
图 2 牡蛎性腺的周年变化 Figure 2 Annual changes of the gonads of C. hongkongensis 性腺外观: 1. 未分化期; 4. 性分化期; 7. 成熟排放期; 10. 休止期 性腺组织切片: 2. 未分化期; 5. 性分化期卵巢; 6. 性分化期精巢; 8. 成熟卵巢; 9. 成熟精巢; 3. 排放中的卵巢; 12. 排放中的精巢; 11. 休止期 DFF: 发育中的雌性滤泡; DMF: 发育中的雄性滤泡; F: 滤泡; I: 肠道; L: 间质组织; M: 外套膜; MFF: 成熟雌性滤泡; MMF: 成熟雄性滤泡; O: 初级卵母细胞; S: 精子; SFF: 排放时的雌性滤泡; SMF: 排放时的雄性滤泡 Gonad appearance: 1. undifferentiated stage; 4. differentiation stage; 7. mature and discharging stage; 10. resting stage Gonad histological section: 2. undifferentiated stage; 5. female follicle in differentiation stage; 6. male follicle; 8. mature female follicle; 9. mature male follicle; 3. spawning female follicle; 12. spawning male follicle; 11. resting stage DFF: developing female follicle; DMF: developing male follicle; F: follicle; I: intestine; L: leydig tissue; M: mantle; MFF: mature female follicle; MMF: mature female follicle; O: primary oocyte; S: sperm; SFF: spawning female follicle; SMF: spawning male follicle; |
性腺不断加厚,区域增大。肉眼观察呈乳白色或淡黄色,并向腹面扩展,覆盖内脏团的1/3以上。深色消化腺仅局部隐约可见(图 2-4)。以牙签取少量性腺组织在显微镜下观察,可见呈梨形的卵母细胞。组织切片显示,雌雄性腺分化,滤泡数量增多,体积增大,呈圆形或椭圆形,从性腺外膜向内伸展,滤泡间结缔组织减少。雌性滤泡内卵原细胞(直径18.16±4.77 μm,细胞核直径10.53±3.38 μm)分裂增殖,形成卵母细胞(直径30.52±8.73 μm,细胞核直径17.53±5.64 μm),多呈倒梨形,具短柄,附着于滤泡腔壁,细胞质中有稀疏的细小颗粒(图 2-5)。雄性滤泡中体积最大的精原细胞(直径3.86±0.61 μm)位于滤泡边缘,向内分别是较小的初级精母细胞(直径2.64±0.24 μm)和精子细胞(直径2.00±0.13 μm)(图 2-6)。
2.1.3 成熟排放期(Ⅲ)性腺进一步发育,乳白色或淡黄色的性腺厚厚地覆盖了整个内脏团,肥满、具光泽且富有弹性。性腺表面叶脉状生殖导管清晰可见,分支越来越细密和清晰(图 2-7),稍加挤压,精子或卵母细胞可从泄殖孔流出,此时若以毛细管扎入性腺组织,可虹吸出生殖细胞。置海水中于显微镜下可见精子涌动,具很强活力。卵母细胞增大,呈多角形。组织切片观察,可进一步将性腺分为成熟期和排放期。成熟期整个性腺由充满生殖细胞的滤泡组成,滤泡充盈饱满相互挤压呈不规则多角形。卵母细胞发育基本同步(直径33.35±9.72 μm,细胞核直径19.61± 4.37 μm)。雌性滤泡中,卵母细胞进一步发育,卵柄断裂,卵母细胞进入滤泡腔内,胚泡消失,启动减数分裂I(Kennedy et al,1964)。此时卵黄颗粒变大增多,聚集呈泡沫状(图 2-8),雄性滤泡精原细胞(直径4.14±0.74 μm)和精母细胞(直径2.92±0.46 μm)层变薄,界限变模糊。滤泡内充满成熟精子,精子(直径1.55±0.12 μm)聚集成束,沿排出通道密集排列(图 2-9)。排放期由于成熟滤泡中卵母细胞或精子的排放,部分滤泡腔出现大小不等的空腔。雌性滤泡明显缩小,滤泡间结缔组织增多,卵原细胞(直径19.61± 8.18 μm,细胞核直径10.01±2.70 μm)明显,可见少量初级卵母细胞(图 2-3)。排放的雄性滤泡中排出通道清晰可见,周围仍有稀疏的精子(图 2-12)。
2.1.4 休止期Ⅳ性腺萎缩直至消失,软体部表面透明,呈水泡状,内脏团十分明显(图 2-10)。以牙签取性腺部组织在显微镜下看不到生殖细胞。组织切片显示,滤泡萎缩退化,壁变薄,形状不规则。个别滤泡内可观察到极少量的性细胞。血淋巴组织入侵滤泡,滤泡间被结缔组织填充。滤泡细胞(直径4.74±1.59 μm,细胞核直径2.77±0.84 μm),显著小于未分化期滤泡细胞(P<0.05)(图 2-11)。
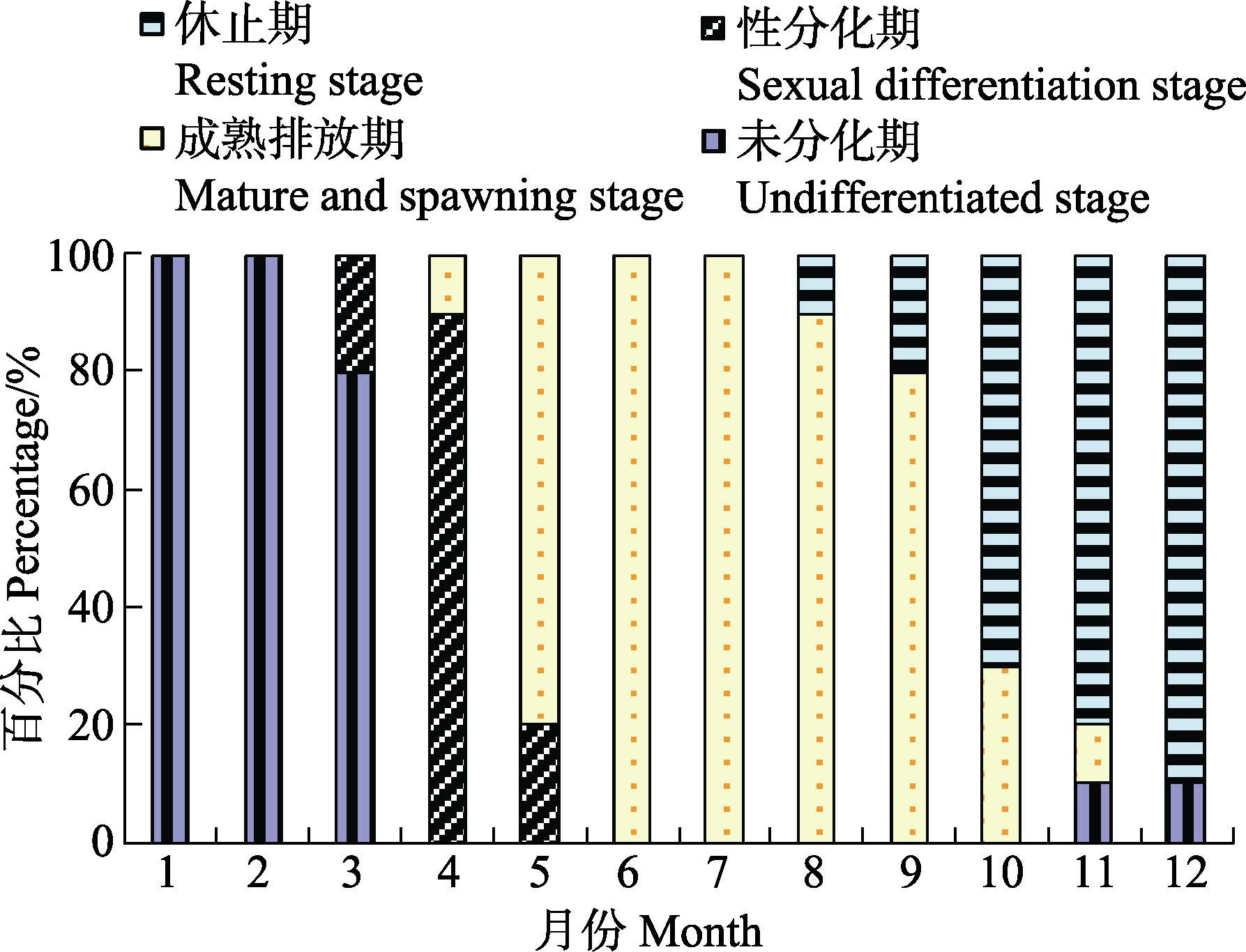
2.2 生殖周期香港巨牡蛎性腺发育各时期所占比例见图 3。1-3月,香港巨牡蛎的性腺处于未分化期,性别无法分辨。3月底-4月中为性分化期,此时雌雄性腺可辨。4月下旬-5月,性腺迅速成熟,进入成熟排放期,这一阶段可一直持续至10月。11-12月,牡蛎生殖腺萎缩至消失,进入休止期。
|
图 3 2013年7月-2014年6月大风江黄场牡蛎不同性腺发育时期的百分比 Figure 3 Percentage of different developmental stages of C. hongkongensis in the Huang hatchery of Dafeng River from July 2013 to June 2014 |
2013年7月-2014年6月,周年性腺的切片观察显示,香港巨牡蛎每年有1个生殖周期,繁殖期为5-10月。在1个生殖周期中,1龄、2龄牡蛎的性腺发育基本同步,雄性发育略快。在实际观察中,牡蛎个体在繁殖季节可多次产卵排精,部分排放期的牡蛎性腺为半透明,呈分散和松软状态,与性分化期的性腺透明度低、结构紧实不同。从排放至性腺再次充盈,间隔时间短,仅需7 d左右。
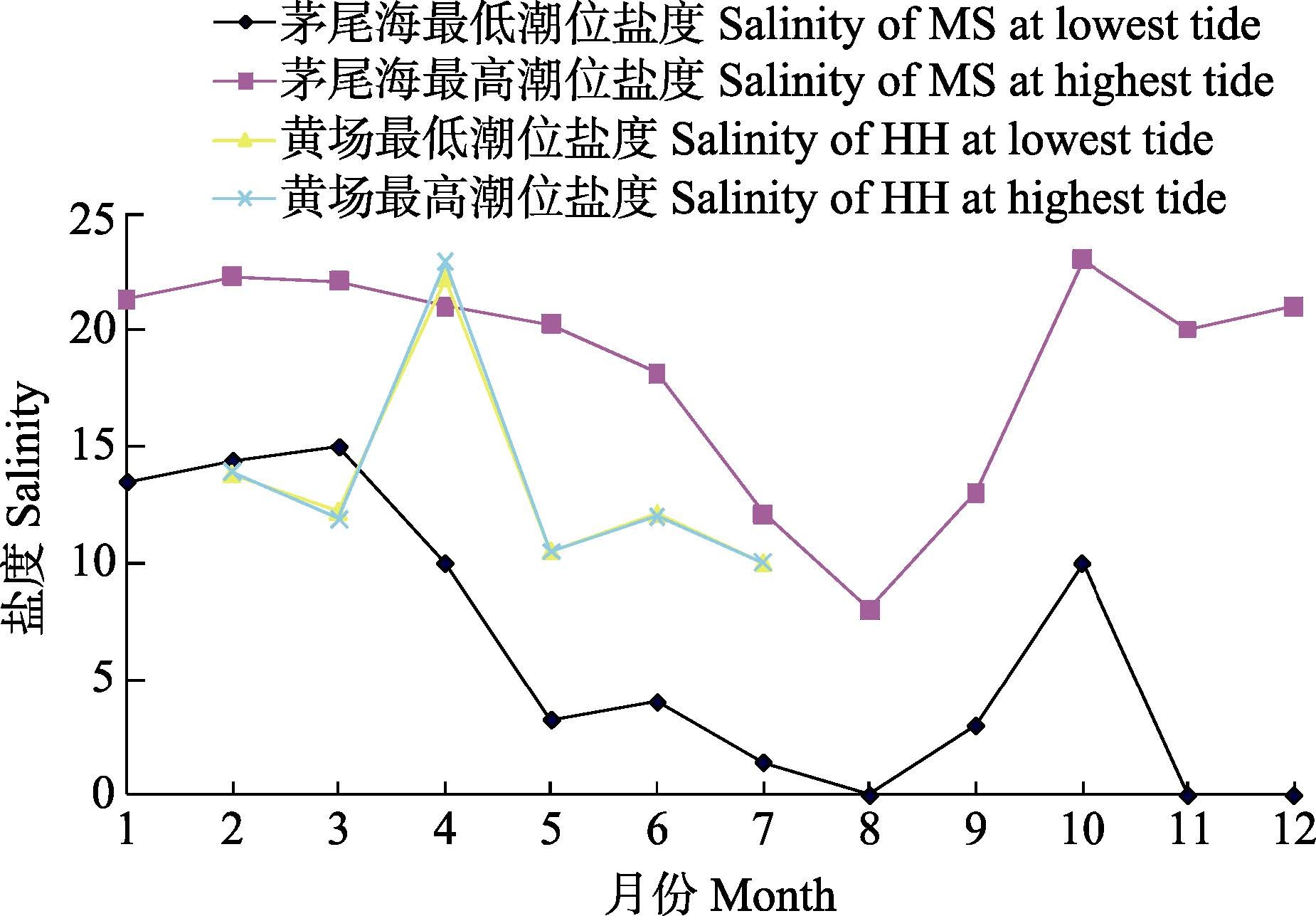
2.3 不同地点香港巨牡蛎性腺发育的差异香港巨牡蛎的主要采苗区是茅尾海沙井(MS),该处周年温度盐度变化趋势都有连续的监控(图 4、图 5)。茅尾海为钦州内海,面积约135 km2,东西径最长(15 km),南北径最长(17 km),距北部湾的连通峡口仅5 km,且其外分布多个岛屿,影响内外海水的交换。其东、北和西面分别由两条钦江支流和茅岭江注入。因此,其盐度取决于涨潮时海水的涌入和钦江注入的淡水量,其周年盐度变化幅度为0-24,变化剧烈。黄场(HH)位于大风江入海口上游,周年盐度比较平稳(10-14),只在4月高温少雨季节,盐度有时会超过20。性腺组织切片显示(图 6),大风江入海口外的XF牡蛎性腺发育比入海口内HH和茅尾海内海MS提前。XF牡蛎性腺发育比MS的提前30 d左右,而HH比MS提前15 d左右。
|
图 4 2013-2014年茅尾海海沙井与大风江黄场盐度变化趋势 Figure 4 Variation of salinity in the Shajing of Maowei Bay and Huang hatchery of Dafeng River during 2013-2014 |
|
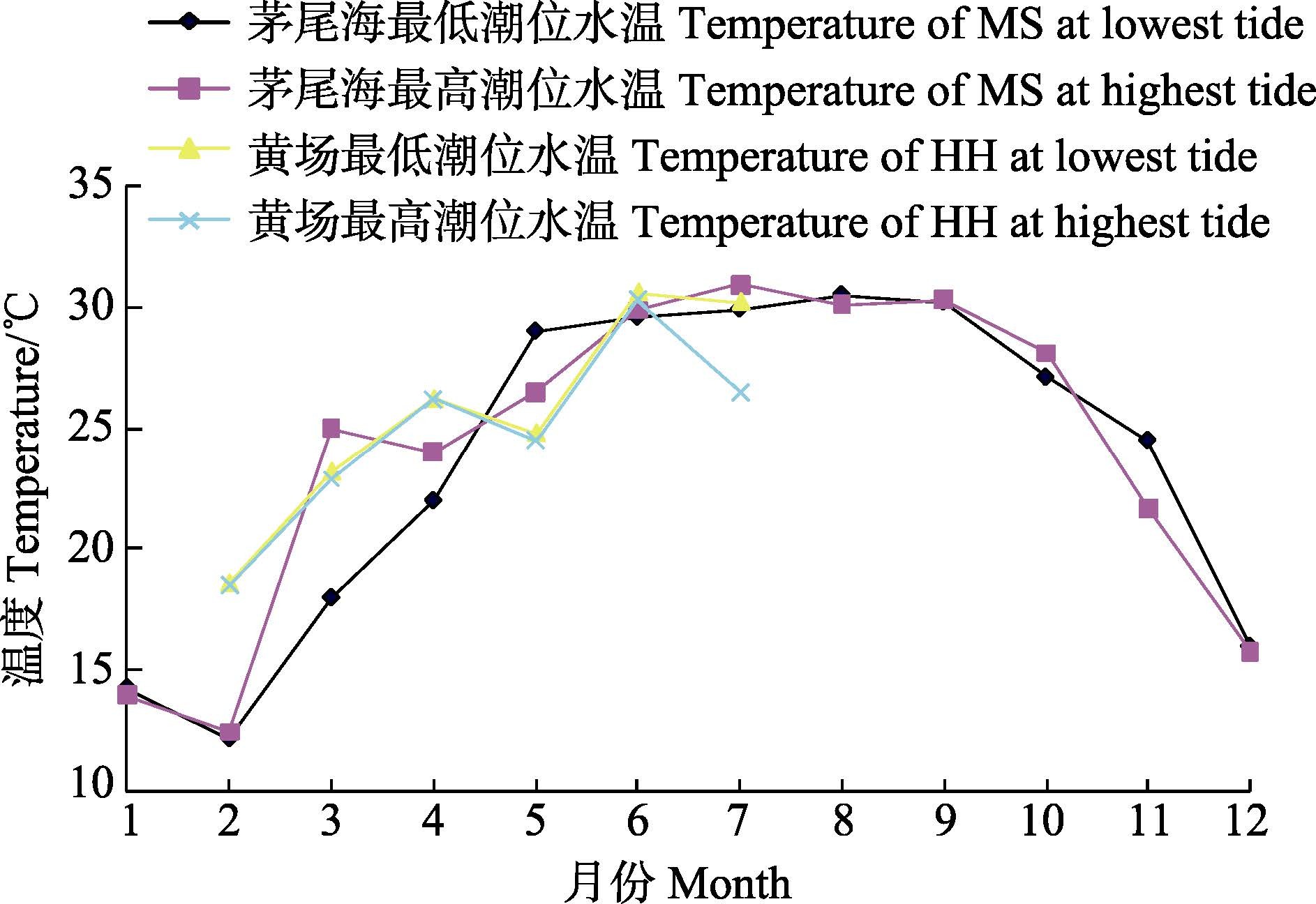
图 5 2013-2014年广西茅尾海沙井与大风江黄场温度变化趋势 Figure 5 Variation of temperature in the Shajing of Maowei Bay and Huang hatchery of Dafeng River during 2013-2014 |
|
图 6 不同吊养地点牡蛎性腺组织切片示性腺发育的差异 Figure 6 Histological section of gonad of C. hongkongensis from different locations,showing the different developmental stages MS: 1. 4月未分化期; 2. 5月卵巢; 3. 5月精巢; 4. 6月卵巢; 5. 6月精巢 HH: 6. 4月卵巢; 7. 4月精巢; 8. 5月卵巢; 9. 5月精巢; 10. 6月卵巢; 11. 6月精巢 XF: 12. 4月卵巢; 13. 4月精巢; 14. 5月卵巢; 15. 5月精巢 DFF: 发育中的雌性滤泡; DMF: 发育中的雄性滤泡; F: 滤泡; L: 间质组织; M: 外套膜; MFF: 成熟雌性滤泡; MMF: 成熟雄性滤泡; O: 初级卵母细胞; OO: 卵原细胞; RFF: 退化的雌性滤泡; RMF: 退化的雄性滤泡; S: 精子; SFF: 排放时的雌性滤泡; SMF: 排放时的雄性滤泡 MS: 1. gonads in April; 2. female follicle in May; 3. male follicle in May; 4. female follicle in June; 5. male follicle in June HH: 6. female follicle in April; 7. male follicle in April; 8. female follicle in May; 9. male follicle in May; 10. female follicle in June; 11. male follicle in June XF: 12. female follicle in April; 13. male follicle in April; 14. female follicle in May; 15. male follicle in May DFF: developing female follicle; DMF: developing male follicle; F: follicle; L: leydig tissue; M: mantle; MFF: mature female follicle; MMF: mature male follicle; O: primary oocyte; OO: oogonium; RFF: regressive female follicle; RMF: regressive male follicle; S: sperm; SFF: spawning female follicle; SMF: spawning male follicle |
MS牡蛎性腺至4月仍处于未分化期,性腺难分雌雄(图 6-1),而HH牡蛎性腺1-3月为未分化期,4月进入性分化期,雌雄滤泡发育并逐渐延展(图 6-6、7),因此,HH牡蛎性腺发育比MS提前15 d左右。5月MS牡蛎雌雄性腺迅速发育,接近或达到成熟期。雌性滤泡成熟,卵母细胞与卵原细胞或未成熟卵母细胞并存(图 6-2),而雄性滤泡之间结缔组织明显,滤泡内成熟的精子清晰可见(图 6-3),HH牡蛎雌性滤泡内可见大量饱满的初级卵母细胞(图 6-8),雄性滤泡中充满成熟精子(图 6-9)。6月,MS牡蛎卵巢饱满,雌性滤泡中充满成熟的卵母细胞(图 6-4),精巢中饱满与排空的雄性滤泡共存,后者只剩下精原和精母细胞层,中央有少量间质细胞(图 6-5),而HH牡蛎性腺同样处于成熟排放期,雌雄滤泡中充塞着成熟的卵母细胞(图 6-10)和成熟精子(图 6-11),雄性滤泡界限模糊,精原和精母细胞层薄。
2.3.2 大风江入海口外XF香港巨牡蛎的性腺发育特点虽然XF牡蛎的性腺在1-3月取样时均处于未分化期,但4月迅速发育至成熟排放期。雌、雄性腺的滤泡饱满(图 6-12、13),有的雄性滤泡边缘精原细胞和精母细胞层不明显,整个滤泡充满精子细胞和精子,显示出精子排放受抑制现象(图 6-13)。5月,雌雄性腺出现不同程度的退化和崩解:卵巢局部滤泡中有大量体小、核圆且染色深的细胞入侵,类似正常性腺排放期后入侵雌性滤泡的血细胞(Kennedy et al,1996)。同时可见卵母细胞变形、融解,细胞核膜皱缩、塌陷(图 6-14)。精巢中,原来椭圆形切面的雄性滤泡结构不完整,间质细胞增生,与精子细胞和精子间杂排列(图 6-15),呈现异常排放状态。由于2014年5月起,XF牡蛎大量死亡,导致6月样本缺失。而6月XF的其他存活牡蛎,被检者均为雌性。
2.3.3 温度与香港巨牡蛎性腺发育的关系就HH性腺发育的周年变化而言,牡蛎性腺发育的启动与水温的升高关系密切。1-3月平均水温低于23℃(图 5),但处于快速回升阶段,牡蛎性腺处于未分化期。随着4-5月水温持续升至25℃以上,牡蛎性腺开始分化并迅速发育至成熟排放期。同样,1-4月茅尾海平均水温持续升高,但低于25℃(图 5),MS牡蛎性腺处于未分化期。至5月平均水温快速升至27.5℃,MS的牡蛎性腺发育也快速接近或达到成熟期。因此,平均水温达到25℃是牡蛎性腺发育启动和快速进入成熟期的标志性环境因子。从图 5可见,大风江HH虽然因温度监测密度低而呈现出较大的波动幅度,但变化趋势与茅尾海相同。平均水温在6-9月维持在30℃高位,之后开始下降,至10月中旬降至27.5℃,之后进入11月即降至25℃以下。香港巨牡蛎性腺的排放期持续至10月,11月后进入休止期。因此,推测其性腺进入和维持成熟排放期的环境温度在25℃以上。
3 讨论 3.1 香港巨牡蛎性腺发育的特点及其对群体遗传结构的影响根据牡蛎性腺在繁殖季节成熟与排放期相重叠而呈多次排放的特点,从肉眼可快速准确观察判断的角度出发,将香港巨牡蛎性腺发育分为4个时期,这与其他双壳贝类如近江牡蛎(Crassostrea ariakensis)(杜玄,2009)1)、菲律宾蛤仔(Rudotapes philippinarum)(李霞等,2007)、文蛤(Meretrix meretrix)(林志华等,2004)、日月贝(Amusium laurenti)(Penchaszadeh et al,2000)等基于组织切片观察,将性腺发育划分为增殖期、生长期、成熟期、排放期和休止期5个时期略有不同。本研究主要是着眼于在生产现场快速准确判读牡蛎的性腺发育状况为目的,便于采苗和收贝。
1)杜玄.2009. 福建沿海巨蛎属牡蛎的主要种类及其分布和近江牡蛎性腺发育的研究. 国家海洋局第三海洋研究所硕士研究生学位论文,36-43
在实际观察中,进入繁殖季节的牡蛎个体性腺发育的速度极快,从开始性分化到进入成熟排放期的过程不足30 d,性分化期很短。同时,性腺排放高峰至性腺再次饱满的时间间隔也很短,可能只需7 d。这一特性一方面显示牡蛎极强的繁殖力,另一方面会使更多参与繁殖的牡蛎个体在变化的环境条件中,以多次机会使自己的后代得以存活。因此,对整个茅尾海区来说,这一特性将增加牡蛎有效群体的大小(Li et al,1998; He et al,2012),增强牡蛎群体遗传结构随时间的稳定性(Hedgecock et al,2011)。
3.2 影响香港巨牡蛎性腺发育的主要因素香港巨牡蛎性腺的发育与海水温度有密切关系。虽然限于设备原因,大风江HH和XF尚缺少连续的海水温度监测数据,但周期性的测量数据显示HH与MS温度变化趋势一致。因此,推断平均水温25℃是牡蛎性腺保持活跃的成熟排放期的温度下限。这与许多研究(毕庶万等,1996; 廖承义等,1983; 曾志南等,1991)证实海洋双壳贝类栖息环境的水温波动与它们的性腺发育有密切的关系相一致。而HH与XF分别位于大风江入海口的内外,相距不过5 km,推测两地海水温度差异很小,XF的盐度或高于HH且相对稳定。但XF牡蛎性腺发育明显早于HH,说明影响香港巨牡蛎性腺发育的因素不仅是温度。
钦州地区通常4月高温少雨,进入5月后降雨增加,海水盐度降低,并持续至8月,9月后降水逐渐减少,这也体现在茅尾海沙井周年最低潮位海水盐度变化趋势上。5月海水的平均盐度迅速降低,诱发性腺成熟牡蛎的第一波排放高峰。这与钟方杰(2013)1)通过检测茅尾海牡蛎幼虫密度所得到的结论基本一致。因此,6月初适宜投放采苗器。
1)钟方杰.2013. 广西茅尾海香港巨牡蛎半人工采苗技术研究. 广西大学硕士研究生学位论文,1-42
事实上,牡蛎性腺的发育除与海水温度、盐度密切相关外,还受饵料、水环境和亲本密度等多重因子的综合影响(王如才等,2008)。大风江入海口外的XF牡蛎性腺的发育早于茅尾海内海MS约30 d,早于大风江入海口内HH约15 d。由于三地邻近,平均水温的差异非常小,不宜简单地以有效积温来解释(周玮,1991)。XF地处入海口,冬季海水搅动剧烈,营养盐丰富,浮游生物相对较多。XF牡蛎性腺发育的提前,应与其摄食饵料更充足有关。因此,相较于茅尾海内海和大风江入海口内,鑫丰场更适宜于吊养牡蛎过冬。
3.3 入海口外侧养殖区牡蛎春季的死亡2014年5月,香港巨牡蛎在北部湾近海、江河入海口外侧养殖区,包括鑫丰场,吊养的牡蛎开始出现大量死亡(近60%的死亡率),而这种发生在江河入海口外侧养殖区春季牡蛎大批死亡的现象,过去也时有发生,却少有研究。2014年XF牡蛎性腺发育快,4月已进入成熟排放期,而此时,恰逢钦州高温少雨,大风江入海口区盐度居高不下(高达23)。降雨的缺乏使香港巨牡蛎精卵的排放受到抑制,进而性腺出现过熟和退化形变,这可能是造成该养殖区牡蛎大量死亡的主要原因。检测6月鑫丰场存活牡蛎,发现几乎全为雌性。这可能与两方面因素有关,一是繁殖盛期,牡蛎雄性性腺逆转为雌性,群体中雌性比例远高于雄性(李霞,2005);另一方面,可能与雄性性腺的发育略提前于雌性而遭遇的性腺过熟压力更大有关。海洋双壳贝类中雄性性腺先成熟比较普遍(王子臣等,1984; 尤仲杰等,1991; 吴洪流等,2002),在性腺组织切片观察中,发现雄性性腺退化和崩解状态确实比雌性性腺更严重。因此,入海口外侧养殖区虽然适宜于牡蛎吊养过冬,但在春天,却需要密切监测牡蛎性腺的发育和海水盐度的变化,一旦性腺进入成熟期,则需及时收获和卖出牡蛎,以获得较高的经济效益。若春季没有收获,则需将吊养牡蛎的蚝排移往河流入海口内过冬,以避免牡蛎性腺在少雨的春季成熟,排放受到抑制而大规模死亡所造成的经济损失。
| 王子臣, 刘吉明, 朱岸, 等. 鸭绿江口中国蛤蜊生物学初步研究. 水产学报 , 1984, 8 (1) : 33-44 | |
| 王如才, 王昭萍. 海水贝类养殖学. 青岛: 中国海洋大学出版社, 2008 : 91 . | |
| 王海艳, 郭希明, 刘晓, 等. 中国近海“近江牡蛎”的分类和订名. 海洋科学 , 2007, 31 (9) : 85-86 | |
| 尤仲杰, 王一农, 叶雄会, 等. 等边浅蛤Gomphina veneriformis的繁殖周期. 台湾海峡 , 1991, 10 (4) : 356-362 | |
| 毕庶万, 徐宗发. 海湾扇贝控温育苗采卵时间的预报方法. 海洋与湖沼 , 1996, 27 (1) : 93-97 | |
| 苏天凤. 华南沿海养殖近江牡蛎的分类研究. 南方水产 , 2006, 2 (6) : 72-75 | |
| 李霞. 水产动物组织胚胎学. 北京: 中国农业出版社, 2005 : 262 -268. | |
| 李霞, 梁峻, 闫喜武, 等. 人工控温促熟条件下不同海域菲律宾蛤仔的性腺发育. 水产学报 , 2007, 31 (6) : 853-859 | |
| 吴洪流, 王红勇, 王珺. 波纹巴非蛤性腺发育分期的研究. 海南大学学报(自然科学版) , 2002, 20 (1) : 41-47 | |
| 宋忠魁, 蔡小辉, 童潼, 等. 广西茅尾海常见牡蛎的分子鉴定. 海洋科学 , 2010, 34 (8) : 11-16 | |
| 林志华, 单乐州, 柴雪良, 等. 文蛤的性腺发育和生殖周期. 水产学报 , 2004, 28 (5) : 510-514 | |
| 周玮. 海湾扇贝性腺发育的生物学零度. 水产学报 , 1991, 15 (1) : 82-84 | |
| 钟方杰, 严雪瑜, 高扬, 等. 广西茅尾海牡蛎天然种苗种类鉴定和群体组成的初步分析. 海洋科学 , 2014, 38 (3) : 91-97 | |
| 曾志南, 李复雪. 青蛤的繁殖周期. 热带海洋学报 , 1991, 10 (1) : 86-91 | |
| 廖承义, 徐应馥, 王远隆. 栉孔扇贝的生殖周期. 水产学报 , 1983, 7 (1) : 1-13 | |
| He Y, Ford SE, Bushek D, et al. Effective population sizes of eastern oyster Crassostrea virginica (Gmelin) populations in Delaware Bay, USA. J Mar Res , 2012, 70 (2-3) : 357-379 | |
| Hedgecock D, Pudovkin AI. Sweepstakes reproductive success in highly fecund marine fish and shellfish: a review and commentary. Bull Mar Sci , 2011, 87 (4) : 971-1002 DOI:10.5343/bms.2010.1051 | |
| Kennedy AV, Battle HI. Cycle changes in the gonad of the American oyster, Crassostrea virginica (Gmelin). Can J Zool , 1964, 42 (2) : 305-321 | |
| Kennedy VS, Newell RIE, Eble AE. The Eastern Oyster Crassostrea virginica. Maryland Sea Grant College , 1996 : 335-364 | |
| Lam K, Morton B. Mitochondrial DNA and morphological identification of a new species of Crassostrea (Bivalvia: Ostreidae) cultured for centuries in the Pearl River Delta, Hong Kong, China. Aquaculture , 2003, 228 (1) : 1-13 | |
| Li G, Hedgecock D. Genetic heterogeneity, detected by PCR- SSCP, among samples of larval Pacific oysters (Crassostrea gigas) supports the hypothesis of large variance in reproductive success. Can J Fish Aquat Sci , 1998, 55 (4) : 1025-1033 DOI:10.1139/f97-312 | |
| Penchaszadeh PE, Paredes C, Salaya JJ. Reproductive cycle of the south American scallop Amusium laurenti (Gmelin, 1791) (Bivalvia, Pectinidae). Aquacult Int , 2000, 8 (2-3) : 227-235 | |
| Wang HY, Guo XM, Zhang GF, et al. Classification of Jinjiang oysters Crassostrea rivularis (Gould, 1861) from China, based on morphology and phylogenetic analysis. Aquaculture , 2004, 242 (1) : 137-155 |



