2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Qingdao National Laboratory for Marine Science and Technology, Function Laboratory of Marine Fisheries Science and Food Production Processes, Qingdao 266071
在高密度工业化水产养殖中,随着残饵和养殖动物的粪便和分泌物的积累,养殖水体中的氨态氮和亚硝酸氮等无机氮浓度不断增加,影响了养殖动物的健康,甚至导致患病及死亡,降低了养殖产量,增加了养殖成本,成为限制水产养殖业可持续发展的重要原因之一(丁彦文等,2000)。在养殖过程中,为了要保持水温和各种条件的稳定,降低成本,也为了减轻养殖产业对环境的污染,不提倡大量换水。因此,在相对密闭的水环境中,如何高效及时地转化或去除无机氮,特别是消除对养殖动物有强烈毒性的氨态氮和亚硝酸氮(丁爱中等,2000),成为水产养殖中亟待解决的重要问题。
淡水养殖中无机氮的去除技术的研究和应用较为全面,而海水养殖脱氮技术受盐度的影响,其应用效果与淡水相比还有待进一步优化,随着集约化海水养殖产业的快速发展,该技术已成为一个重要的产业需求,在减轻和消除海水无机氮污染方面拥有广阔前景(王晓姗等,2009)。微生物在去除水中的氨氮和亚硝氮的过程中具有重要的作用,值得对此开展深入研究,充分开发微生物在高密度和工业化水产养殖业中的应用,为海水养殖可持续发展提供核心技术(李基东,2008)。
抗生素等化学药物常常作为控制海水养殖中的细菌病害的主要手段,频繁的使用导致微生物抗药性的提高,带来了生物安全风险和微生态失衡。通过向水体中添加对病原菌具有拮抗作用的有益微生物的方式来控制病原菌的数量,改善养殖系统的微生态,成为控制疾病发生的一个新的技术发展方向。对虾的急性肝胰腺坏死病(AHPND)是由带有特定致病基因的高毒力副溶血弧菌所致(张宝存等,2012),造成对虾养殖的严重损失。本研究拟从对虾养殖系统中筛选出对副溶血弧菌具有拮抗作用的有益微生物,通过添加抗副溶血弧菌的有益微生物以减少疾病的发生。
1 材料与方法 1.1 实验动物和菌株健康凡纳滨对虾(Litopenaeus vannamei)仔虾于2014年7月6日购自山东日照某育苗场,体长为(1.5±0.3)cm,经PCR方法检测白斑综合征病毒(WSSV)及虾肝肠胞虫为阴性,5000尾/桶,暂养于80 L、28℃的海水中,每天投喂饲料3次。健康日本囊对虾(Marsupenaeus japonicus)于2014年10月27日购自江苏赣榆某养殖场,体长为(5.35±0.23)cm,经PCR方法检测WSSV为阴性,暂养于养殖箱40 L的海水中,海水盐度为28,每天投喂饲料3次。
自2013年在水族试验区养殖的一批来自于海口某育苗场的健康凡纳滨对虾中选取3尾体长约2 cm的对虾,解剖取出对虾肠道,置于无菌1.5 ml离心管中,加入800 μl无菌水,研磨,用于分离和筛选脱氮菌株。
副溶血弧菌(Vibrio parahaemolyticus)来源于本实验室保存的菌种,编号20130629002S01。
1.2 肠道菌群的富集培养将上述研磨后的对虾肠道样品加入装有200 ml的2216E富集液体培养基(5 g蛋白胨,1 g酵母膏,0.1 g FePO4·4H2O,用盐度为28的海水溶解至1000 ml,调节pH为7.2-7.4,经121℃灭菌20 min)的锥形瓶中,28℃、150 r/min振荡培养24 h。
1.3 脱氮菌株的筛选将1 ml上述富集培养液用PBS进行10-3-10-5梯度稀释后,分别取100 μl涂布于固体筛选培养基(23.2 g葡萄糖,14.2 g柠檬酸钠,6.5 g KNO3,4.6 g NH4Cl,1.7 g KH2PO4,19.4 g琼脂,用盐度为30的海水溶解至1000 ml,调节pH为7.2-7.4,经121℃灭菌20 min)平板上,28℃培养12 h,待形成单菌落后挑取单菌落在2216E固体培养基(同2216E液体培养基加琼脂)上进行纯化培养。
1.4 菌株脱氮能力检测挑取上述筛选培养基上的单菌落于250 ml的2216E液体培养基中,28℃、150 r/min摇床培养12 h,按液体筛选培养基(固体筛选培养基不加琼脂)的3%体积加入菌液,采用纳氏试剂法(宋岚,2000)测定初始氨氮浓度,放入28℃摇床培养24 h,再次测定氨氮浓度,并用N-(1-萘基)-乙二胺光度法(周运友等,2005)测定亚硝酸氮的浓度。
1.5 菌株对副溶血弧菌的拮抗实验将所筛选到的脱氮菌株接种到2216E液体培养基中,28℃、150 r/min摇床培养12 h。分别将100 μl浓度为1×108、1×107和1×106 CFU/ml的副溶血弧菌液涂布2216平板,待菌液干后,贴上直径为5 mm的圆形无菌滤纸片,滴加5 μl筛选的浓度为1×108 CFU/ml菌株培养液,28℃培养24 h,测量滤纸片周围的抑菌圈直径,每个样品重复3次(Vaseeharan et al,2003)。
1.6 菌株16S rDNA同源性比对分析取少量菌落放入装有800 μl无菌水的1.5 ml离心管中煮沸15 min,以细菌基因组DNA为模板,用16S rDNA通用引物(27F:5x-AGA GTT TGA TCC TGG CTC AG-3x,1492R:5x-TAC GGC TAC CTT GTT ACG ACT T-3x)(Lane,1991)进行PCR扩增。50 μl扩增体系含2× Ex Taq Premix 25 μl(TaKaRa,大连)、正反向引物各2.5 μl、DNA模板2.5 μl。94℃ 5 min;94℃ 1 min,55℃ 1 min,72℃ 1 min,30循环;72℃ 10 min。将PCR产物交上海生工测序公司测序(Lane,1991)。测序结果经GenBank中已知序列进行同源性筛选,选取同源性最高的序列进行多重序列比较,并以邻接法构建系统发育树(王景峰等,2011)。
1.7 生长曲线的绘制选取具有脱氮能力和对副溶血弧菌拮抗作用的菌株,接种到200 ml的2216E液体培养基中,28℃、150 r/min培养24 h。取10 ml菌液,4000 r/min离心10 min,去除上清液,以10 ml无菌PBS重悬沉淀,取7.5 ml接种到250 ml 2216E液体培养基中,28℃、150 r/min摇床培养,每隔2 h测量菌液的OD600 nm值,绘制生长曲线。
1.8 对虾体内的副溶血弧菌感染拮抗实验将暂养7 d的180尾日本囊对虾随机分为3组,每组3个重复,置于10 L盐度为28的海水中,水温为22-25℃,pH为7.8-8.5。每天投喂3次配合饲料,试验期间不换水。实验组每天接种25 ml约108 CFU/ml的上述筛选到的菌株的海水悬液,使水体中菌液浓度达2.5×105 CFU/ml,对照组为空白组,养殖10 d后感染副溶血弧菌(傅松哲等,2009)。向对虾第二腹节肌肉注射10 μl浓度为1×107 CFU/ml副溶血弧菌菌液,24 h后统计对虾的死亡情况。
1.9 菌株在对虾养殖实验中的应用将1200尾大小约(1.5±0.3)cm的健康凡纳滨对虾随机分为4组,分别为加菌加糖组(A+S)、加菌组(A)、加糖组(S)和空白组(C)。每组设置3个重复的实验桶,加入盐度为28的海水80 L,按100尾/桶进行养殖,水温为22-25℃,pH为7.8-8.5,每3 d吸污并更换约1/3的水。加菌组添加25 ml浓度约108 CFU/ml的上述细菌的培养液,水体中细菌浓度约为3.13×104 CFU/ml,需加糖的组按照前一天饲料添加量70%添加赤砂糖(邓应能,20111); 张许光,20122); 赵培,20113))。每15 d检测氨氮和亚硝酸氮和浓度。
1) 邓应能. 不同养殖系统生物絮团调控模式研究. 上海海洋大学硕士研究生学位论文, 2011
2) 张许光. 生物絮团技术在凡纳滨对虾工厂化养殖中的应用与研究. 中国海洋大学硕士研究生学位论文, 2012
3) 赵培. 生物絮团技术在海水养殖中的研究与应用. 上海海洋大学博士研究生学位论文, 2011
1.10 安全性分析将240尾大小约3 cm的健康凡纳滨对虾随机分为4组,每组3个重复,置于10 L盐度为28的海水中,水温为22-25℃,pH为7.8-8.5。每天投喂3次配合饲料,并吸去残饵和粪便,换水1/3。阴性对照组在对虾第二腹节肌肉中注射10 μl生理盐水,实验组在对虾第二腹节肌肉分别注射10 μl筛选出的20131023A05菌株的1×106 CFU/ml、1×107 CFU/ml和1×108 CFU/ml浓度的PBS悬液,每24 h记录对虾死亡情况,观察7 d。
1.11 数据处理实验数据采用SPSS 17.0统计软件进行分析,数据差异显著时采用Duncan's进行多重比较,显著水平为P<0.05,数据以平均值±标准差表示。
2 结果 2.1 菌株的筛选对虾肠道匀浆液经2216E富集培养和无机氮固体培养基筛选,分离到3株在筛选培养基上生长良好的细菌,编号分别为20131023A00、20131023A01和20131023A05。经测定,3株细菌在28℃条件下,24 h对无机氮含量为0.12%的液体培养基中的氨氮去除能力为38%-50%,其中,菌株20131023A05清除氨氮效果最好,达到(49.9±0.5)%(表 1)。
|
|
表 1 经无机氮筛选培养基获得的3株菌的氨氮去除效果 Table 1 NH3-N removing effect by the three bacterial strains isolated from the inorganic nitrogen screening medium |
5×105 CFU/ml的菌株20131023A05、20131023A00和20131023A01在涂布有一定浓度的副溶血弧菌的2216E平板的滤纸片上生长,并产生对副溶血弧菌具有拮抗作用的分泌物时,滤纸片周围会出现不生长副溶血弧菌的透明圈。初步拮抗实验显示,菌株20131023A00和20131023A01未出现抑菌圈,菌株20131023A05出现抑菌圈。采用不同浓度的副溶血弧菌对具有抑菌圈的菌株的拮抗能力分析显示,随着副溶血弧菌菌液的浓度的降低,抑菌圈变大。其中,菌株20131023A05在副溶血弧菌为1.57×105 CFU/cm2时,抑菌圈直径为(9.14±0.05)mm;副溶血弧菌在1.57×104 CFU/cm2时,抑菌圈直径为(11.57±0.03)mm;副溶血弧菌在1.57× 103 CFU/cm2时,抑菌圈直径为(13.59±0.02)mm(表 2)。
|
|
表 2 候选菌株在不同浓度的副溶血弧菌平板上产生的抑菌圈大小 Table 2 The sizes of inhibition zone of the candidate bacterial isolates on the plates with V. parahaemolyticus at different concentrations(Diameter: mm) |
通过氨氮去除能力和对副溶血弧菌的拮抗能力分析,初步筛选出菌株20131023A05进行菌株的种属鉴定。经16S rDNA序列测定,在GenBank用BLAST比对发现,该菌属于假交替单胞菌属(Pseudoalteromon as spp.),比对结果中有大量未分类的假交替单胞菌属成员的序列信息,筛选结果中已分类的假交替单胞菌种类包括杀鱼假交替单胞菌(P. piscicida)、金丽假交替单胞菌(P. flavipulchra)、解肽假交替单胞菌(P. peptidolytica)、柠檬假交替单胞菌(P. citrea)和温海假交替单胞菌(P. maricaloris)等。下载相关菌株序列,构建系统发育树(图 1),结果显示,该菌株与杀鱼假交替单胞菌(P. piscicida)有最近的亲缘关系,但相近的假交替单胞菌的系统发育树的部分分支存在不同菌种的交叉分布。

|
图 1 菌株20131023A05与相关菌株的16S rDNA序列系统发育树 Figure 1 Phylogenetic tree constructed based on the 16S rDNA sequences of the bacterial isolate 20131023A05 and related strains |

|
图 2 菌株20131023A05在2216E液体培养基中的生长曲线 Figure 2 The growth curve of bacterial isolate 20131023A05 in 2216E broth |
菌株20131023A05在2216E液体培养基中的生长曲线符合典型的“S”型细菌生长曲线。在0-4 h时处在延缓期,在4-20 h进入对数生长期,持续时间较长,20 h后进入稳定期。
2.5 菌株20131023A05对副溶血弧菌感染的保护作用体长为(5.35±0.23)cm的日本囊对虾在菌株20131023A05(2.5×105 CFU/ml)水体中养殖10 d后,在腹节注射105 CFU副溶血弧菌,3 d后菌株20131023 A05浸浴组的日本囊对虾存活率为(50.0±5.6)%,而对照组的平均存活率为(22.0±5.6)%(图 3),菌株浸浴组的相对成活率(RPS)为35%,表明该菌一定程度保护了日本囊对虾免于副溶血弧菌的感染。

|
图 3 菌株20131023A05对日本囊对虾感染副溶血弧菌的保护作用 Figure 3 Protection of bacterial isolate 20131023A05 against V. parahaemolyticus in M. japonicus |
将菌株2013023A05用于凡纳滨对虾养殖试验,将1200尾对虾随机分为加糖加菌、加菌、加糖和对照共4组,分别以1250尾/m3的密度在4组的12个80 L水体中养殖,经60 d养殖,各组对虾存活率分别为(32.7±2.1)%、(24.0±3.0)%、(29.0±2.8)%和(23.0± 1.4)%,即最终密度为408.7±26.3、300±37、362.5±35.0和287.5±17.5尾/m3。15-30 d时,各组之间对虾存活率均有下降,但各组间无显著差异;45 d以后,加菌加糖组对虾存活率显著高于其他3组;60 d时,加菌加糖组存活率显著高于加菌组和对照组,而与加糖组无显著差异(图 4)。
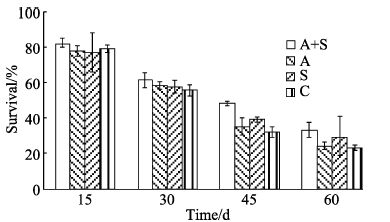
|
图 4 采用菌株20131023A05进行凡纳滨对虾养殖的存活率 Figure 4 Survival rate of cultured L. vannamei immersed in the bacterial strain 20131023A05 A+S: 加菌加糖组; A: 加菌组; S: 加糖组; C: 对照组 A+S: Experiment group with addition of bacteria and sugar; A: Experiment group with addition of bacteria; S: Experiment group with addition of sugar; C: Control group |
定期测定养殖水体的氨氮(图 5),结果表明,在养殖的60 d之内,水体中的氨氮一直呈上升趋势,在15 d时,加菌的实验组出现氨氮更快上升的情况,但15-30 d时氨氮水平保持平稳,在随后的养殖过程中与对照组没有显著差异,而加糖组和加菌加糖组在15 d时氨氮水平与对照组无显著差异,而在30 d以后,氨氮表现出比对照组降低的趋势。在45-60 d养殖中,加菌加糖组氨氮水平明显低于其他3组,在养殖60 d时,加菌加糖组氨氮水平低于加糖组,加菌组与对照组之间差异不显著。
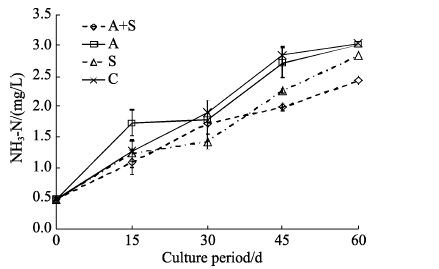
|
图 5 采用菌株20131023A05进行凡纳滨对虾养殖的水体中氨氮含量变化 Figure 5 Changes in the concentration of NH3-N in the water of L. vannamei culture tanks treated with bacterial strain 20131023A05 A+S: 加菌加糖组; A: 加菌组; S: 加糖组; C: 对照组 A+S: Experiment group with addition of bacteria and sugar; A: Experiment group with addition of bacteria; S: Experiment group with addition of sugar; C: Control group |
定期测量养殖水体中的亚硝酸氮(图 6),结果表明,在养殖的60 d之内,水体中的亚硝酸氮一直呈上升趋势,在养殖0-15 d时,养殖水体中亚硝酸氮迅速上升,在15 d时各组与对照组之间无显著差异;在15-45 d时,养殖水体中亚硝酸氮上升缓慢,加菌组中亚硝酸氮水平高于其他3组,而加菌加糖组、加糖组与对照组之间无显著差异;在45-60 d时,加菌加糖组亚硝酸盐水平高于加糖组和对照组。在养殖周期内,水体中添加菌株20131023A05,未观察到加菌组与对照组之间的显著差异。
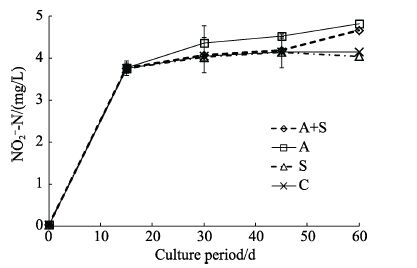
|
图 6 采用菌株20131023A05进行凡纳滨对虾养殖的水体中亚硝酸氮含量变化 Figure 6 Changes in the concentration of NO2--N in the water of L. vannamei culture tanks treated with bacterial strain 20131023A05 A+S: 加菌加糖组; A: 加菌组; S: 加糖组; C: 对照组 A+S: Experiment group with addition of bacteria and sugar; A: Experiment group with addition of bacteria; S: Experiment group with addition of sugar; C: Control group |
在凡纳滨对虾第二腹节肌肉注射104-106 CFU菌株20131023A05悬液,观察7 d以确认菌株的安全性。结果显示,实验组对虾体内注射106 CFU、105 CFU和104 CFU的菌悬液后7 d内,均没有明显病症,只是在个别组出现偶发性死亡,而且死亡的发生迟于对照组,统计上与对照组无显著差异(P>0.05)(表 3),说明该菌株对对虾没有致病作用和致死作用。
|
|
表 3 注射20131023A05安全性试验中各组凡纳滨对虾的累积死亡率 Table 3 The cumulative mortality of L. vannamei injected with bacterial isolate 20131023A05(%) |
随着凡纳滨对虾养殖规模的扩大和产业的持续,近年来的病害越来越严重,2010年在我国南方和越南发生急性肝胰腺坏死病,随后已扩展到马来西亚、泰国、墨西哥等多个国家,对这些国家的对虾养殖业造成了灾难性的打击(FAO,2013)。经研究表明,这一病害是由高致病力的副溶血弧菌所致(张宝存等,2012; Tran et al,2013),对虾养殖过程中,由于残饵以及对虾排泄物的积累,使得养殖水体中的无机氮和高致病力的副溶血弧菌数量增加,导致了急性肝胰腺坏死病的迅速传播。因此,分离和筛选具有降低养殖水体中无机氮、拮抗副溶血弧菌的有益菌,对于急性肝胰腺坏死病的防控具有重要意义。
本研究对兼具无机氮转化能力和拮抗副溶血弧菌能力的有益菌进行了筛选。采用不含有机氮素的筛选培养基分离到3株无机氮转化功能菌株,对其氨氮转化率进行分析,结果显示,在盐度为30的海水中,pH在7.2-7.4范围内,在28℃时,3株菌对氨氮含量为0.12%的液体筛选培养基中氨氮的转化效率在38.9%-49.9%范围内,其中,菌株20131023A05去除氨氮能力最高。胡修贵等(2013)在对虾养殖池的生物絮团中筛选出两株对氨氮具有高转化率的菌株,食物盐单胞菌和胜利盐单胞菌,通过对温度、盐度、pH、碳氮比等各方面的适应性比较研究,筛选出的胜利盐单胞菌在27-42℃的温度范围、盐度为30-50、pH为7-9时,对氨氮含量为1%的液体培养基中氨氮的转化率达80%以上,上述菌株虽然比本研究筛选的菌株的氨氮转化率表现得更好,但缺乏抗病原菌的功能。病原拮抗菌也有大量研究报道,傅松哲等(2009)从海洋沉积物中分离到两株对需钠弧菌有抑制作用的拮抗菌,对凡纳滨对虾弧菌病有明显的预防效果。孙艳等(2013)也从健康中国明对虾消化道分离到多株具有抵抗WSSV感染的芽孢杆菌,其中一株坚强芽孢杆菌添加到对虾饲料中进行投喂,与对照组相比,相对保护率达33.7%。本研究采用纸片法观察上述3株菌在副溶血弧菌平板上产生的抑菌圈,筛选出菌株20131023A05对副溶血弧菌具有拮抗作用,注射副溶血弧菌的日本囊对虾在2.5×105 CFU/ml的该菌浸浴浓度下,与对照组相比的相对存活率达35%。
生物絮团技术是氨氮降解菌在对虾养殖中的最佳应用方式之一,通过在水体中添加糖类,能有效满足利用无机氮的氨氮降解菌的碳源需求。本研究观察到,在凡纳滨对虾养殖实验中添加菌株20131023A05和赤砂糖的方式能获得最佳的对虾存活率和氨氮去除效率,单纯添加糖类或者添加该菌株的效果不如两者同时添加的实验组。这一结果与孙运忠等(2012)在日本囊对虾室内集约化养殖水体中同时添加红糖和枯草芽胞杆菌所观察到的效果类似,但在亚硝酸盐的转化作用上效果不是十分显著,这一问题可能需要针对亚硝酸盐筛选特效的菌株来解决。
本研究筛选到的菌株20131023A05经16S rDNA序列比对鉴定,该菌株与杀鱼假交替单胞菌有最近的亲缘关系,但对该菌的安全性分析表明,对虾腹节肌肉中直接注射106 CFU的该菌,也未导致对虾的明显死亡,表明该菌具有良好的安全性。该菌分离自健康对虾肠道,是对虾的土著菌株,其在使用上具有较好的安全性。本实验室在对虾急性肝胰腺坏死病原菌的研究中,分离到大量副溶血弧菌菌株,感染试验表明副溶血弧菌是导致对虾大规模死亡的病原(张宝存等,2012; Tran et al,2013),但也证明不少副溶血弧菌菌株对对虾完全没有致病作用(另文发表),说明不能仅凭细菌的种类作为判断其是否具有致病性的依据。
本研究结合无机氮转化和病原菌拮抗两种筛选法进行功能有益菌的筛选,在其他的研究中少有报道。所筛选到的菌株兼备去除水体中的氨氮和对虾病原菌副溶血弧菌的功能,有望在对虾生物絮团养殖技术中,起到既能改善对虾养殖的水环境,又能防控对虾急性肝胰腺坏死的作用,将具有广泛的应用前景。下一步值得对该菌株在这两种作用的协同效应的机制及其应用方式上开展进一步深入研究。
| 丁彦文, 艾红. 微生物在水产养殖中的应用. 湛江海洋大学学报 , 2000, 20 (1) : 68-73 | |
| 丁爱中, 陈繁忠, 雷剑泉, 等. 光合细菌调控水产养殖业水质的研究. 农业环境保护 , 2000, 19 (6) : 339-341 | |
| 王晓姗, 刘杰, 于建生. 海洋氮循环细菌研究进展. 科学技术与工程 , 2009, 9 (17) : 5057-5064 | |
| 王景峰, 金敏, 谌志强, 等. 一株好氧脱氮菌的筛选与脱氮特性研究.. 环境科学 , 2011, 32 (8) : 2409-2413 | |
| 孙运忠, 赵培, 王彦怀, 等. 添加红糖和芽胞杆菌对日本囊对虾室内集约化养殖水质的调控作用. 渔业科学进展 , 2012, 33 (3) : 70-76 | |
| 孙艳, 宋晓玲, 刘飞, 等. 一株芽孢杆菌PC024的鉴定及其抗WSSV感染效果的研究. 水产学报 , 2013, 37 (4) : 574-583 | |
| 李基东. 反硝化脱氮碳源研究现状. 山西建筑 , 2008, 34 (8) : 8-9 | |
| 宋岚. 纳氏试剂光度法测定水中氨氮的影响因素分析. 青海科技 , 2000, 7 (3) : 42-43 | |
| 张宝存, 刘飞, 边慧慧, 等. 一株凡纳滨对虾病原菌的分离、鉴定及其致病力分析. 渔业科学进展 , 2012, 33 (2) : 56-62 | |
| 周运友, 佘世科, 卢琴, 等. N-(1-萘基)-乙二胺荧光光度法测定痕量亚硝酸根. 光谱学与光谱分析杂志 , 2005, 25 (8) : 1318-1321 | |
| 胡修贵, 赵培, 李玉宏, 等. 生物絮团中异养亚硝化菌的分离鉴定及其特性. 渔业科学进展 , 2013, 34 (5) : 97-103 | |
| 傅松哲, 宋奔奔, 刘鹰, 等. 弧菌拮抗菌的筛选及其对凡纳滨对虾的抑菌防病作用. 中国环境科学 , 2009, 29 (8) : 867-872 | |
| FAO. Report of the FAO/MARD Technical Workshop on Early Mortality Syndrome (EMS) or Acute Hepatopancreatic Necrosis Syndrome (AHPNS) of Cultured Shrimp (under TCP/VIE/3304) Hanoi, Vietnam, 2013 | |
| Lane DJ. 16S/23S rRNA sequencing. Nucleic Acid Techniques in Bacterial Systematics, 1991, 125-175 | |
| Tran L, Nunan L, Redman RM, et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp. Dis Aquat Org , 2013, 105 (1) : 45-55 DOI:10.3354/dao02621 | |
| Vaseeharan B, Ramasamy P. Control of pathogenic Vibrio spp. by Bacillus subtilis BT 23, a possible probiotic treatment for black tiger shrimp Penaeus monodon. Lett Appl Microbiol , 2003, 36 (2) : 83-87 |



