海萝(Gloiopeltis furcata)隶属于红藻门(Rhodophyta)内枝藻科(Endocladiaceae),在日本和中国广泛分布,可供食用、药用(具有治肠炎、痔疾、干咳痰结和抗癌作用)及作为工业原料(曾呈奎等,1962; 夏邦美,2004; 余杰等,2007)。因其用途广泛,价格颇高(约1500元/千克),导致过度采摘,自然资源遭到严重破坏。为满足市场的需求,亟待进行海萝人工养殖。
日本采用去除海萝生长岩礁上杂藻的方法来进行海萝的海区增殖,并在自然海区采苗(网帘、投石、移植种藻和孢子喷洒法)后进行人工养殖(末廣恭雄等,1957; 九万田一巳等,2000)。这些增养殖手段效果较差,部分方法已逐渐被淘汰(九万田一巳等,2000)。然而,目前仍未发现更加行之有效的养殖方法。中国也一直在自然海区开展海萝的增殖,直到近几年,陈素文等(2014b)才开始利用海萝陆地工厂化育苗及用培养的苗种进行海区养殖实验,针对海萝藻体较小,不易于夹苗养殖的特点,发明了适合海萝藻体海区养殖的装置及方法(吕国敏等,2007; Chen et al,2014; 张汉华等,2013)。尽管上述方法在海区养殖方面已初具成效,但海区养殖的可控性差,海萝容易被杂藻、附着生物及浮泥等遮盖而死亡。海萝的价格远高于其他海藻,甚至高于鲍鱼价格。因此,开展低成本、高效率的陆地工厂化养殖,可以开创海萝养殖新局面。
开展海萝工厂化养殖,首先要探明藻体培养所需的适宜条件。近年来,对海萝藻体生理生态学的研究主要包括:广东沿海海萝属藻类生态调查(吴进锋等,2007);山东小黑山岛海萝生物量及长度时空变化特征调查(刘洪亮等,2013);干露、光照对海萝光合活性的影响(刘洪亮等,2014)及三十烷醇和环境因子对海萝藻体生长的影响(陈素文等,2011、2014a)。而对于进行海萝工厂化养殖所需的适宜藻体规格、培养密度及培养容器等条件尚无相关报道。此外,每年自然海区海萝可采集时间较短(约2个月)且采集时机受限(需在退潮期进行)。为保证藻体工厂化养殖及相关研究的开展,藻体的保存必不可少。作者研究了不同海萝藻段长度和截取部位对其生长的影响、合适培养密度和装置,以及不同处理方式保存藻体后对其成活率的影响,以期为海萝藻体工厂化养殖提供参考。
1 材料与方法实验设备为专业气候培养箱。所用天然海水,经黑暗沉淀10 d以上,盐度为31。
1.1 海萝苗种规格和断裂部位对其生长的影响实验于2013年2月28日在中国水产科学研究院南海水产研究所生态实验室内进行。实验材料为人工育苗培养的藻体(0.5-2 cm):A组为从基部断开的整丛藻体,B组为切藻体顶端部位,C组为藻体分叉处断裂出来的部位。每组分别取3种藻体规格:0.5 cm(A1、B1和C1)、1 cm(A2、B2和C2)、1.5 cm(A3、B3和C3)。每个实验组各取0.25 g藻体,置于装有400 ml 16℃海水的锥形瓶中,各设3个平行组,所有实验组均放入培养箱(设置温度为16℃,光照为8500 lx)里充气培养。实验周期为60 d,期间每7 d全换水 2次,每次换水时,每升海水添加10 mg硝酸钠(NaNO3)与1 mg磷酸氢二钾(K2HPO4)。每隔20 d,各组海萝藻体经纸巾吸掉水分后称重。
1.2 不同培养密度和装置对海萝生长的影响实验在中国水产科学研究院南海水产研究所深圳试验基地室外大棚(顶棚半透明)内进行。研究了不同培养容器(E组)和不同培养密度(F组)对海萝藻体(采自深圳杨梅坑,藻体长度为1-2 cm)生长的影响。E1为蓝色方形水槽(0.45 m×0.45 m×0.45 cm);E2为研制的透明塑料薄膜柱状培养装置(图 1-B),其直径为30 cm,长为1.5 m(加入水位为1.2 m);E3-E5为不同直径亚克力筒(图 1-A),直径依次为20、30、40 cm,筒高均为1.2 m(水位1 m)。每种培养容器按照0.5 g/L海萝藻体密度进行培养。F组采用E2作为培养容器(图 1),F1-F4分别对应海萝藻体密度0.5、1、2、4 g/L。各实验组设置3个平行组,充气培养。E组培养20 d后称重,F组培养30 d后称重。实验期间,每7 d全换水2次,换水时适量添加NaNO3和K2HPO4,使海水中N和P浓度分别为10 mg/L和1 mg/L。

|
图 1 海萝藻体在亚克力筒(A)及塑料薄膜装置(B)中培养 Figure 1 G. furcata incubated in acrylic cylinder(A)and plastic membrane culture device(B) |
特定生长率(Specific growth rate,SGR,%/d)=(lnWt-lnW0)/t×100%
式中,Wt为藻体终末质量,W0为藻体初始质量,t为培养天数。
1.3 不同处理方式对藻体保存效果的影响海萝藻体(1.5-2 cm)采自深圳杨梅坑海区,用毛巾吸干水份后,进行3种方式风干处理(D1,D2和D3):D1组置于室内自然风干(温度为18-19℃)、D2组置于培养箱风干(温度为18℃)、D3组用空调冷气加上风扇直吹干(温度为17-18℃)。每种处理方式用海萝藻体40 g,分别风干到10 g左右并记录风干时间。将风干处理后的各组海萝藻体进行分装(每个密封袋装0.5 g海萝藻体)后,1/2冷藏(4℃),1/2冷冻(-18℃)。保存3、30、180 d后,分别取冷藏和冷冻条件下的每个处理组各取3袋藻体,分别置于12℃海水(2 L)中,在温度为16℃、光照强度为8000 lx的培养箱中培养7 d后称重(期间,换水1次,水温为16℃)。
成活率(Survival rate,%)=培养7 d后质量/初始质量×100%。
1.4 数据分析采用SPSS 21.0软件进行数据处理和统计分析。不同处理先做单因素方差分析(One-way ANOVA),再通过Duncan比对差异,以P<0.05作为差异显著水平。所有数据均为平均值±标准差(Mean±SD)。
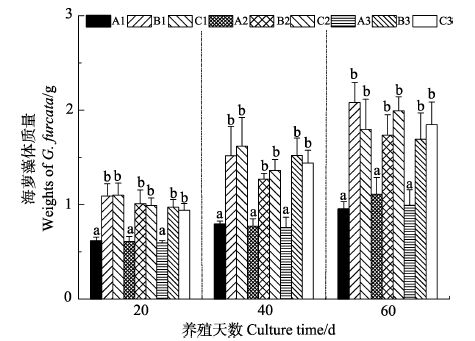
2 结果 2.1 海萝藻体规格和断裂部位对其生长的影响3个阶段(20、40、60 d)的测定结果显示,相同生长阶段中,相同规格藻体间所呈现的组间(A,B和C)质量差异不显著(P>0.05);而不同规格藻体间,小规格藻体(0.5 cm:A1、B1和C1)的终末质量显著低于较大规格藻体(1 cm:A2、B2和C2;1.5 cm:A3、B3和C3)(P<0.05);随着培养天数的增加,各组藻体质量呈缓慢增长趋势(图 2)。
|
图 2 不同规格和断裂方式的海萝藻体经不同时间培养后的质量 Figure 2 Weights of different size and part of G. furcata by incubated for various period 注: 柱图上方不同字母代表在相同的养殖天数时海萝藻体质量的组间差异显著(P<0.05) Note: Different letters above the columns denoted significant difference in the weight among groups on the same day of culture(P<0.05) |
培养于水槽(E1)中的海萝藻体,在充气条件下,藻体分布不均匀,部分藻体成团堆积,其生长速率显著低于其他培养容器中的藻体;培养于透明塑料薄膜培养装置(E2)与亚克力筒(E3-E5)的海萝藻体,充气时,藻体呈悬浮状态,形成立体式培养,因此,其生长速率可达水槽培养条件下的2倍(表 1)。不同直径的亚克力筒和透明塑料薄膜养殖装置培养中,海萝藻体生长速率差异不显著,然而,直径较大的亚克力筒(直径为40 cm)需较大的充气量,才能使海萝呈悬浮状态。
|
|
表 1 不同培养容器中海萝的特定生长率 Table 1 Special growth rate of G. furcata incubated in different containers |
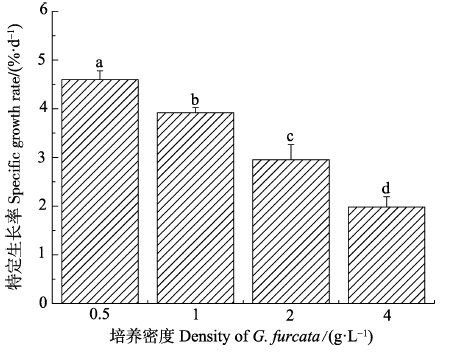
不同培养密度下,海萝特定生长率的组间差异显著(P<0.05)。随着培养密度的增加,海萝日特定特长率呈下降趋势:密度最小组(F1)的特定生长率可达4.596%,密度最大组(F4)的特定生长率仅为1.98%(图 3)。
|
图 3 不同培养密度海萝特定生长率
Figure 3 Daily SGR of G. furcata incubated with
different densities
注: 不同字母表示组间明显的差异性(P<0.05)
Note: Different letters denoted significant differences among groups(P<0.05) |
D1、D2和D3组所需的风干时长依次为78、60、2 h。保存期为3 d时,各组藻体置于冷冻和冷藏环境中均可存活,且以D3组最高(P<0.05);保存30 d后,各组藻体冷藏保存(4℃)的成活率都为0,而冻冷保存(-18℃)的成活率则与保存3 d的差异不显著(P>0.05)。保存180 d后,各组藻体冷冻保存的成活率显著低于保存期为30 d的成活率(P<0.05)。冷冻保存后的成活率,D1组和D2组之间差异不显著(P>0.05),D3组则显著高于D1组和D2组(P<0.05)(表 2)。
|
|
表 2 不同处理方式下海萝藻体的成活率 Table 2 Survival rates of G. furcata treated with different methods |
对于海藻切段离体再生的研究,如对江蓠(Gracilaria tenuistipitata)、顶群藻(Acrosorium yendoi Yamada)、舌状蜈蚣藻(Grateloupia livida Yamada)和长心卡帕藻(Kappaphycus alvarezii)的研究,大部分都是切藻体不同部位来试验不同部位长出新芽的情况(赵素芬等,1999; 陈昌生等,1987; 张丽娟,2000; 唐贤明等,2014)。海藻的生长不仅体现在长出新芽,还包括藻体的增粗,这两方面的综合衡量指标是质量变化。本研究旨在探索海萝工厂化养殖的适宜海萝藻段长度,故以质量作为生产性产量衡量指标。
实验结果显示,海萝藻体采取从基部断开、藻体切顶端部位或分叉处断裂出来的部位进行培养对其质量增长影响不大,而小规格(0.5 cm)藻体的质量增长速率小于大规格藻体(1 cm以上)。实验采用的是人工育苗培养的苗种,这些苗种比海区采集的同等规格藻体纤细,在培养过程中易被其他杂藻附着,尤其是0.5 cm规格,因外形小,附着物不易被清洗干净而影响其生长。所以,人工育苗的海萝最好培养到0.5 cm以上,再进行藻体悬浮养殖,可采用切藻体顶端部位作为苗种,留下基部于附着器上继续生长。
3.2 不同培养密度和装置对海萝藻段生长的影响在进行实验之前,作者曾尝试把海区采集的海萝藻体培养于半透明顶棚下的方形水泥池(3 m×3 m)中,然而无论充气量多大都无法使大部分藻体悬浮。培养4 d后,藻体逐渐腐烂死亡,出现负增长。表明水池不适合离体海萝藻体的工厂化养殖,必须寻找更合适的容器。这是进行不同培养装置对海萝生长影响实验的原因。
实验中的方形蓝色水槽,相当于小型水泥池,因高度较矮,接受光照充分且有小部分藻体能悬浮,所以藻体略有生长,但与透明的塑料薄膜袋和亚克力筒相比,其效果较差。海萝藻体在塑料薄膜袋与亚克力筒中主体上呈悬浮状态,充分利用阳光,生长速度快;因为这两种容器培养的藻体生长差异不显著,且透明塑料薄膜袋柱状培养装置的成本远远低于亚克力筒,故将透明塑料薄膜袋柱状培养装置作为海萝藻体进行工厂化培养装置较为合适。实验结果显示,柱状培养装置的直径对藻体的生长影响不明显,从提高工作效率及充分利用场地的角度出发,塑料薄膜袋的直径可增加到50 cm左右。采用透明塑料薄膜袋培养装置进行海萝属藻类工厂化养殖的方法已获国家发明专利授权(陈素文等,2014b)。
实验表明,海萝藻体培养密度为0.5 g/L时,其生长速率达到最大,从提高单位水体产量的角度出发,应该适当增加培养密度。藻体密度为1 g/L时,其生长速率比0.5 g/L时的低,但却显著高于密度为 2、4 g/L时的生长速率。因此,海萝藻体合适培养密度范围为0.5-1 g/L。
3.3 不同处理方式对藻体保存后成活率的影响陈素文等(2012)对海萝属藻类种藻保存的研究阐明了藻体风干到原鲜重的1/4时,孢子的保存效果最好。存在于藻体中的孢子与藻体的存活密切相关,即藻体保存得好,孢子也就保存好。所以,在进行实验设计时,根据种藻保存实验的结果,把全部藻体都风干为原鲜重的1/4。
实验结果显示,经不同方式风干处理的海萝藻体,达到相同重量(相同含水量)所需时间不同,其成活率也不同。采用空调加风扇进行风干的海萝(D3)所用时间最短(2 h),其成活率最高。刘洪亮等(2014)在光照培养箱中进行干露对海萝光合活性的影响(控温为11℃),表明干露72 h的藻体(含水量为5.9%)重新浸入海水中12 h后可完全恢复光合活性,而干露108 h的(含水量为3.2%)藻体完全不能恢复光合活性。本研究中,保存3 d后重新浸入海水的各组海萝(D1,D2和D3),实际的干露时间已为150 h,但D3组的最高成活率仍可达95%以上,这可能与不同保存温度及含水量有关。尽管没有进行D组藻体含水量的测算,但从藻体质量减少为原鲜重1/4可估算含水量比刘洪亮等(2014)实验中干露108 h的多。此外,刘洪亮实验中的海萝干露时都处于11℃,而实验中的D3组处于18℃的时间为2 h(最短),其余的148 h都是在4℃以下进行保存的,D1组的则处于18℃的时间78 h,处于4℃以下的时间为72 h。显然藻体的含水量影响其成活率,而在干露状态下,温度越低,成活率越高。
有关种藻冷冻保存的报道表明,孢子的保存效果符合细胞在冷冻后的活性随着时间的延长而降低,随着冷冻温度的降低而提高的原理(陈素文等,2012; Taylor et al,1999)。本研究中藻体的保存也符合这一原理。
| 吕国敏, 吴进锋, 陈素文, 等. 海萝属藻类的生态与人工增养殖技术. 水产科技 , 2007 (4) : 5-9 | |
| 刘洪亮, 李雪萌, 南国宁, 等. 潮间带红藻—海萝光合活性对干露胁迫的响应. 应用生态学报 , 2014, 25 (5) : 1491-1498 | |
| 刘洪亮, 唐永政, 于永强, 等. 山东小黑山岛海萝生物量和长度的时空变化及影响因素. 应用生态学报 , 2013, 24 (11) : 3259-3264 | |
| 吴进锋, 陈素文, 陈利雄, 等. 广东沿海海萝属藻类生态与分布调查. 南方水产 , 2007, 3 (5) : 7-13 | |
| 余杰, 许肇成, 颜璐璐, 等. 海萝多糖抗突变与抗肿瘤作用的研究. 汕头大学学报(自然科学版) , 2007, 22 (2) : 59-63 | |
| 张汉华, 陈素文, 朱长波, 等.一种海萝属藻类海区养殖装置及使用该装置的养殖方法. 申请专利号: 201210051178. X, 2013 | |
| 张丽娟. 舌状蜈蚣藻切段离体再生的初步研究. 集美大学学报(自然科学版) , 2000, 5 (3) : 35-39 | |
| 陈昌生, 章景荣. 顶群藻切段离体培养的研究. 福建水产 , 1987 (1) : 44-49 | |
| 陈素文, 吴进锋, 陈利雄, 等. 三十烷醇对海萝孢子萌发、幼苗及藻体生长的影响. 华南农业大学学报 , 2011, 32 (1) : 78-82 | |
| 陈素文, 吴进锋, 陈利雄. 海萝种藻冷冻保存对其释放孢子量及孢子附着的影响. 热带海洋学报 , 2012, 31 (1) : 67-71 | |
| 陈素文, 陈利雄, 朱长波, 等. 环境因子对海萝藻体生长及成活的影响. 南方水产科学 , 2014a, 10 (3) : 92-96 | |
| 陈素文, 陈利雄, 黄忠, 等.一种海萝属藻类工厂化养殖方法、养殖棚及养殖装置. 申请专利号: 201210124825.5, 2014b | |
| 赵素芬, 庄承纪. 2种江蓠藻体切段的再生. 湛江海洋大学学报 , 1999, 19 (2) : 25-29 | |
| 夏邦美. 中国海藻志: 第2卷, 红藻门, 第3册, 隐丝藻目. 北京: 科学出版社, 2004 : 50 -53. | |
| 唐贤明, 王瑛睿, 刘翠, 等. 长心卡帕藻切段培养的初步研究. 南方水产科学 , 2014, 10 (2) : 36-41 | |
| 曾呈奎, 张德瑞. 中国经济海藻志. 北京: 科学出版社, 1962 : 123 -178. | |
| 九万田一巳, 小松光男, 新村巖, 等. 鹿児島県水産技術のあゆみ,第3編増·養殖部門-1. 日本: 鹿児島県水産技術者OB なぎさ会, 2000 | |
| 末廣恭雄, 大島泰雄, 檜山義夫. 水産學集成//須藤俊造. フノリの養殖(A). 日本: 東京大學出版會, 1957, 819-828 | |
| Chen SW, Chen LX, Zhu CB, et al. 2014. Spore culture of red seaweed, Gloiopeltis furcata. J World Aquacult Soc , 2014, 45 (4) : 355-492 | |
| Taylor R, Fletcher RL. Cryopreservation of eukaryotic algae-a review of methodologies. J Appl Phycol , 1999, 10 (5) : 481-501 |



