2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
凡纳滨对虾(Pacific white shrimp,Litopenaeus vannamei),又名南美白对虾,隶属于节肢动物门(Arthro- poda)、甲壳纲(Crustacea)、十足目(Decapoda)、游泳亚目(Natantia)、对虾科(Penaeidae)、滨对虾属(Litopena- eus),是世界重要的对虾类养殖品种之一(张伟权,1990)。凡纳滨对虾适应性广泛、对不良环境抗逆性强、生长速度快、肉质鲜美,深受人们的喜爱,有着十分广阔的市场前景(王兴强等,2004)。
为了促进我国凡纳滨对虾产业的进一步发展,培育具有优良经济性状的优质苗种已经成为凡纳滨对虾育种领域的重要目标。然而,由于我国不是凡纳滨对虾的原产地,需从国外引进种源,引进的亲本群体的遗传信息未知,种群间个体内的亲缘关系远近未知,如果盲目的进行选育,容易造成严重的近交衰退(张凯,20131); Luo et al,2014)。近交衰退的危害在于,不但会降低已经改良性状的性能,同样会引起其他性状退化。如存活率和繁殖力降低等现象,从而最终导致育种工作功亏一篑(孔杰等,2009)。所以,为了选育工作能够长久的进行下去,必须对选育群体进行亲权鉴定,明确亲缘关系。
1) 张凯. 凡纳滨对虾引进群体分子系谱构建及中国对虾分子标志家系放流效果评估.中国海洋大学硕士研究生学位论文, 2013, 8-9
在家系选育过程中,建立完整、准确的系谱信息,可以明确各家系间的亲缘关系远近(苗贵东等,2011)。目前,系谱信息的构建主要通过对个体采用荧光标记来实现,但是荧光标记易脱落、难弥补、可持续时间短、对幼体无法标记,这些缺点会对系谱信息的准确率产生影响(张涛等,2010)。随着分子标记的发展,微卫星标记以其分布广、多态性高、重复性和稳定性好、共显性等优点,被应用于家系识别和亲缘关系的分析中,可以很好的解决物理标记的缺点,提高亲权分析的效率和准确率。
微卫星多重PCR(Multiplex PCR)是指在1个PCR反应体系中,同时进行多个微卫星位点的特异扩增,产生出多个PCR扩增产物(张博等,2012)。利用微卫星多重PCR技术进行水产动物的亲权分析,可以极大地提高基因分型的效率并节约成本。目前,在许多水产动物中都有相关的研究报道,如大菱鲆(Scophthalmus maximus)(苗贵东等,2011)、大黄鱼(Larimichthys crocea)(李佳凯等,2014)、中国对虾(Fenneropenaeus chinensis)(李伟亚等,2012)、斑节对虾(Penaeus monodon)(Li et al,2007)、皱纹盘鲍(Haliotis discus hannai Ino)(聂鸿涛等,2013)、美洲牡蛎(Crassostrea virginica)(Wang et al,2010)等。
虽然关于应用微卫星分子标记对凡纳滨对虾进行家系识别(王鸿霞等,2006)、群体遗传多样性分析(Zhang et al,2014)、亲缘关系分析(王霞,2009)1)等方面的研究已有不少,然而这些研究均局限于单个位点,有关凡纳滨对虾微卫星多重PCR的研究鲜有报道。本研究利用已报道的凡纳滨对虾微卫星位点,建立了1个五重PCR,2个四重PCR和1个三重PCR反应体系,并将其应用于凡纳滨对虾家系亲权鉴定中,旨在为凡纳滨对虾家系选育、亲权鉴定和遗传多样性分析等方面的研究提供高效、准确的检测手段。
1) 王霞. 微卫星分型技术用于凡纳滨对虾遗传多样性和亲缘关系分析. 西北农林科技大学硕士研究生学位论文,2009, 35-40
1 材料与方法 1.1 实验材料实验所用材料来自于2013年中国水产科学研究院黄海水产研究所农业部海水遗传育种中心构建的75个物理系谱已知的凡纳滨对虾家系。从中选取11个家系,其中,2个家系为父系半同胞家系,2个家系为母系半同胞家系,其余家系为全同胞家系。每个家系随机选取10-20尾个体,加上每个家系对应的亲本,共计211个样品。对样品进行肌肉组织取样,并保存在-80℃冰箱中备用。
1.2 实验方法 1.2.1 凡纳滨对虾基因组DNA的提取与检测参照王伟继(2008)2)的方法提取凡纳滨对虾基因组DNA。用0.8%的琼脂糖凝胶电泳检测DNA的完整性。用超微量紫外分光光度计对DNA进行定量检测,检测浓度和吸光值(260 nm/280 nm,最佳范围在1.8-2.0),定量后将DNA溶液稀释至50 ng/μl,-20℃冷冻保存备用。
2)王伟继.2008. Ⅰ中国对虾(Fenneropenaeus chinensis)AFLP分子标记遗传连锁图谱的构建以及相关性状的QTL定位分析 Ⅱ蓝鳃太阳鱼(Lepomis macrochirus)AFLP分子标记遗传连锁图谱的构建及性别决定机制初探. 中国海洋大学博士研究生学位论文,19-20
1.2.2 凡纳滨对虾微卫星引物的筛选及多重PCR体系的优化本研究从Meehan等(2003)、Zhang等(2007)、Alcivar-Warren等(2007)、Garcia等(2007)和于洋(2014)3)等研究中公布的微卫星数据中筛选多态性微卫星位点。根据每个微卫星位点扩增片段长度的差异性和退火温度进行多重PCR位点组合,同时利用MPEprimers软件(申志勇,20094); 王稳等,2010)检测筛选好的多重PCR组合反应体系中的引物是否会产生错配、引物二聚体和发卡结构,去除或替换影响整个体系稳定性的引物对。通过优化多重PCR反应体系中各引物浓度、退火温度、循环次数以及反应体系中各成分的浓度,达到多重PCR体系的最佳扩增效果。
3) 于洋. 凡纳滨对虾分子标记的开发及其在遗传育种中的应用.中国科学院研究生院(海洋研究所)博士研究生学位论文, 2014, 49-57
4) 申志勇. PCR 引物特异性评估体系及多重PCR 引物设计系统的构建与应用. 中国人民解放军军事医学科学院硕士研究生学位论文, 2009, 23-37
1.2.3 荧光标记修饰及基因分型本研究采用 4种不同的荧光标记来修饰引物,分别是6-FAM、ROX、HEX、TAMRA,保持每个多重PCR组合中扩增片段大小相邻的位点引物修饰的荧光种类不同。利用ABI3130xl测序仪对PCR产物进行基因分型。荧光引物合成由金唯智生物技术公司完成。
1.3 数据分析利用GeneMapper4.0软件进行基因分型数据分析。利用Cervus3.0软件对基因型数据进行亲权分析,主要分析内容包括等位基因数(Na)、观测杂合度(Ho)、期望杂合度(He)和多态信息含量(PIC),计算微卫星累积排除概率以及哈迪-温伯格(Hardy-Weinberg)平衡,模拟家系配对率,最后进行家系鉴定,根据已知的亲缘关系估计亲权鉴定准确率。
2 结果与分析 2.1 凡纳滨对虾多重PCR反应体系的构建及产物的基因分型本研究从已报道的凡纳滨对虾微卫星位点中,选取多态性较高的位点,通过不断进行位点组合和优化反应条件,最终构建出1个五重PCR反应体系,2个四重PCR反应体系和1个三重PCR反应体系。 四组多重PCR体系中16个微卫星位点的信息及修饰荧光种类见表 1。四组凡纳滨对虾多重PCR的反应体系和反应程序见表 2。
|
|
表 1 凡纳滨对虾微卫星多重PCR位点信息及其修饰荧光种类 Table 1 The information and the fluorescence labeling of microsatellite multiplex PCR for L. vannamei |
|
|
表 2 凡纳滨对虾微卫星多重PCR反应体系和程序 Table 2 The multiplex PCR systems and corresponding programs for L. vannamei |
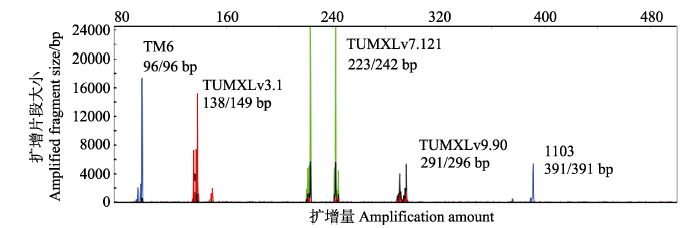
基因分型结果显示,四组凡纳滨对虾微卫星多重PCR反应体系均可以获得较好的扩增效果。其中,五重PCR、四重PCR 1和四重PCR 2的基因分型峰值分别见图 1、图 2和图 3。
|
图 1 凡纳滨对虾五重PCR经ABI 3130xl测序仪分型结果 Figure 1 The genotyping of multiplex PCR of 5 loci for L. vannamei using ABI 3130xl platform |

|
图 2 凡纳滨对虾四重PCR 1经ABI 3130xl测序仪分型结果 Figure 2 The genotyping of multiplex PCR 1 of 4 loci for L. vannamei using ABI 3130xl platform |

|
图 3 凡纳滨对虾四重PCR 2经ABI 3130xl测序仪分型结果 Figure 3 The genotyping of multiplex PCR 2 of 4 loci for L. vannamei using ABI 3130xl platform |
四组多重PCR体系的16个微卫星位点在211个凡纳滨对虾实验样品中获得等位基因数为2-12,平均等位基因数(Na)为6,平均多态信息含量(PIC)为0.581,平均观测杂合度(Ho)为0.513,平均期望杂合度(He)为0.636。除位点TM6和TUMXLv10.117观测杂合度略高于期望杂合度外,其余位点观测杂合度均低于期望杂合度,表现为杂合子的缺失。对16个微卫星位点进行Hardy-Weinberg平衡检验,结果显示,有7个位点偏离不显著(P>0.05),9个位点极显著偏离(P<0.001)。16个微卫星位点在凡纳滨对虾11个家系中参数信息见表 3。
|
|
表 3 16个微卫星在11个凡纳滨对虾家系中的参数信息 Table 3 The information of 16 loci in 11 families of L. vannamei |
利用四组微卫星多重PCR体系进行家系的亲权分析,当双亲基因型未知情况下,单亲本排除率(E-1P)在0.046-0.614之间,平均值为0.264;当只有一个亲本已知,另一亲本的排除率(E-2P)在0.130-0.763之间,平均值为0.408;当双亲基因型已知时,双亲排除率(E-PP)处在0.213-0.913之间,平均值为0.565。16个微卫星位点的排除率见表 4。
|
|
表 4 16个微卫星位点的排除率 Table 4 The exclusion probability for 16 microsatellite loci |
利用Cervus3.0软件中模拟分析模块(Simulation of parentage analysis)来进行微卫星多重PCR组合与累积排除率和模拟配对率之间关系的分析。模拟分析相关参数为:置信度为95%,子代样本数为10000个,基因分型错误率为1%,真实亲本采样率为1。分析结果显示,五重PCR双亲累积排除率为95.11%,四重PCR 1和四重PCR 2双亲累积排除率分别为99.13%、95.70%,三重PCR双亲累积排除率为99.24%。四组多重PCR组合可以达到100%的模拟配对率,其16个微卫星位点第一亲本累积排除率(CE-1P)为0.99525487,第二亲本累积排除率(CE-2P)为0.99990862,双亲累积排除率(CE-PP)为0.99999986。四组多重PCR的累积排除概率及模拟配对率见表 5。
|
|
表 5 四组多重PCR的累积排除概率和模拟配对率 Table 5 Combined exclusion probability and simulated assignment rate of four multiplex PCR system |
在亲本总数为20个,置信度为95%的情况下,实验验证了四组微卫星多重PCR体系亲权鉴定的准确率。从图 4可以看出,随着不断累加多重PCR体系,其亲权鉴定准确率逐渐提高。当同时使用四组多重PCR体系进行亲权分析时,无论亲本性别是否已知,其亲权鉴定准确率均为100%。半同胞和全同胞家系均鉴别效果良好,验证结果与模拟结果基本吻合,说明亲权分析的结果具有较高的准确度和可信度。

|
图 4 微卫星多重PCR组合的亲权鉴定准确率 Figure 4 The accuracy rates of parentage identification for different multiplex PCR sets |
微卫星多重PCR即在1次PCR反应中,可以同时进行多个位点的特异扩增,技术难度较大。理想的多重PCR体系的构建,需要从位点选择、引物组合、反应条件优化等多方面进行全面的分析和反复的试验。本实验在构建凡纳滨对虾微卫星多重PCR体系时发现,微卫星位点选择和引物组合是影响多重PCR构建成功与否的主要因素之一。这与张毅等(2008)的研究结果相一致。要在同一PCR反应中得到多个扩增片段产物,首先,每个位点的扩增片段长度必须有所差异。罗伟等(2013)认为多个位点的产物大小两两之间的差异应大于20 bp。在本研究中,相邻位点之间扩增片段长度相差不小于30 bp,使相邻位点间的荧光信号不会相互干扰,从而不会对基因分型结果产生影响。其次,同一位点上下游引物间,不同位点的引物之间不能形成错配、二聚体及发卡结构。本研究利用多重PCR引物设计软件MPEprimers对多重PCR组合中的引物进行二聚体结构检测,排除影响多重PCR体系稳定的引物对。在引物组合过程中,很少有引物之间完全没有影响。在这种情况下,可以挑选二聚体结构不稳定的引物组合,来尝试构架多重PCR体系。
在确定多重PCR组合后,对多重PCR的反应条件进行优化是必不可少的。任宪云等(2011)研究结果显示,对于多重PCR的成功扩增,退火温度、MgCl2浓度、引物相对浓度等参数是关键影响因素。多重PCR反应要求每个位点的引物扩增效率要尽量一致。否则,扩增效率高的引物会抑制其他引物,造成多重PCR构建失败。调整各引物间的浓度比例,是使各引物达到相同扩增效率的主要方法。各引物间的浓度比例,需要反复的实验才能确定。本研究首先以相同的引物浓度来进行多重PCR的扩增,再通过条带的明亮度来判断每个引物的扩增效率,适当地增加扩增效率低的引物浓度和降低扩增效率高的引物浓度,使每个引物扩增效率相近。另外,引物的总体浓度过高会大幅度增加形成引物二聚体的可能,严重影响多重PCR的扩增效果,要注意控制引物总体浓度。
引物的退火温度是影响多重PCR扩增效果的主要因素之一。Kong等(2006)研究表明,多重PCR各引物退火温度最好相近,相差不超过5℃。作者认为大多数情况下,引物的退火温度是一个温度范围,在此范围内,引物均可有效扩增。所以,本研究在优化多重PCR体系的最佳退火温度时,利用Touch down程序,从1个较高的退火温度开始,每1个循环降低一定的温度,这样可以覆盖一定范围的温度值,使每对引物都能达到期望的退火值,往往能获得较好的扩增效果,这与Markoulatos等(2000)的研究结果相符。
Markoulatos等(2000)的研究还表明,在聚合酶反应过程中,Mg2+的浓度会影响PCR扩增的效果。Mg2+浓度过大,会造成非特异性扩增;浓度过小,会减少PCR产物量。本研究在多重PCR体系其他组分浓度不变的前提下,针对Mg2+设计了一系列浓度梯度,通过正交实验的方法确定Mg2+的最佳浓度,使多重PCR得到最佳的扩增效果。
除以上3个主要方面外,PCR反应的循环次数也是多重PCR反应体系优化的内容之一。循环次数的多少直接影响着PCR反应的产量,但是,并非循环次数越多越好。当PCR反应循环次数过多时,体系中某一组分消耗殆尽时,引物错配的几率会增大,极易产生杂带,从而影响PCR反应的效果(任宪云等,2011)。所以,建议普通PCR的循环次数为25-35次,而多重PCR则需要更多的循环次数。本研究所建立的4个多重PCR体系,分别采用38、40、40、40个循环,均能得到较好的扩增效果。
3.2 凡纳滨对虾遗传多样性及亲权分析多态信息含量(PIC)是一个遗传标记多态性可提供的信息量的度量,是衡量基因变异程度高低的重要指标(贾舒雯,2012)1)。Bostein等(1980)提出衡量基因变异程度高低的多态信息量指标:PIC≥0.5时为高度多态,0.25≤PIC<0.5为中度多态,PIC<0.25为低度多态。本实验所利用的16个微卫星位点中,有13个位点为高度多态(PIC≥0.5),其余3个位点为中度多态(0.25≤PIC<0.5),PIC值介于0.259-0.871之间,平均多态信息含量(PIC)为0.5813,为高度多态。表明,16个微卫星位点在实验群体中有较高的遗传多样性,可以用于后续的家系亲权分析。
1)贾舒雯.2012. 脊尾白虾微卫星引物筛选及群体遗传多样性分析. 中国海洋大学硕士研究生学位论文,28-31
微卫星标记因具有符合孟德尔遗传模式,且呈共显性遗传,现已广泛应用于水产动物亲权鉴定、遗传连锁图谱的绘制以及群体遗传研究等多个方面。微卫星多重PCR,因具有省时、高效和节约等特点,使得微卫星标记识别在实际应用中可以更加方便和快捷。于洋等(2014)2)利用15个多态性微卫星位点,构建了凡纳滨对虾多重PCR体系,并对8个家系的子代及其亲本进行亲权分析,其结果显示,在亲本性别已知和亲本性别未知的情况下,模拟分析配对率均为100%,除3个家系鉴定准确率较低外,其余的家系均达到100%的亲权鉴定准确率,平均鉴定准确率为98%。虽然于洋等建立的多重PCR已经有了较高的鉴定准确率,但其研究也发现,对于亲缘关系较近的个体仍然出现了较高的错判率,其最高鉴定准确率仅能达到93%。在本研究中,增加了用于亲权分析的微卫星位点数量和家系数量,使亲权分析结果具有更高的准确性和可信度。本研究利用16个凡纳滨对虾多态性微卫星位点,构建了1个五重,2个四重和1个三重PCR体系,在亲本性别已知和亲本性别未知的情况下,应用四组多重PCR体系对11个家系子代及其亲本进行亲权分析时,其模拟配对率和亲权鉴定准确率均达到100%,对2个父系半同胞家系和2个母系半同胞家系也均能准确鉴别。相比于洋等(2014)2)的研究,本研究在微卫星位点数量上仅有较少增加,但是对更多的家系进行亲权分析时,均能达到100%的鉴定准确率,尤其是对亲缘关系更近的半同胞家系鉴别效果较好,显示出建立的四组微卫星多重PCR拥有较高的鉴别能力和实际应用效果。
2)于洋.2014. 凡纳滨对虾分子标记的开发及其在遗传育种中的应用.中国科学院研究生院(海洋研究所)博士研究生学位论文,49-57
4 结论本实验构建了1个五重,2个四重和1个三重PCR体系,凡纳滨对虾多重PCR体系扩增效果良好。利用已建立的四组多重PCR体系,对11个家系子代及其亲本进行亲权分析,得到的模拟配对率和亲权鉴定准确率均达到100%。显示出,该组多重PCR可以实际应用在凡纳滨对虾家系育种的过程中,为凡纳滨对虾家系选育、亲权分析、群体遗传多样性等方面的研究提供高效、准确的检测手段。
| 王兴强, 马甡, 董双林. 凡纳滨对虾生物学及养殖生态学研究进展. 海洋湖沼通报 , 2004 (4) : 94-100 | |
| 王鸿霞, 吴长功, 张留所, 等. 微卫星标记应用于凡纳滨对虾家系鉴别的研究. 遗传 , 2006, 28 (2) : 179-183 | |
| 王稳, 屈武斌, 申志勇, 等. 利用MPprimer设计引物并优化扩增条件以提高多重PCR效率的实验研究. 生物化学与生物物理进展 , 2010, 37 (3) : 342-346 | |
| 孔杰, 金武, 栾生, 等. 水产动物选择育种的近交分析. 自然科学进展 , 2009, 19 (9) : 917-923 | |
| 任宪云, 刘萍, 李健, 等. 三疣梭子蟹微卫星多重PCR技术建立及条件的优化. 渔业科学进展 , 2011, 32 (3) : 76-83 | |
| 李伟亚, 王伟继, 孔杰, 等. 中国对虾微卫星四重PCR技术的建立及其在模拟放流效果评估方面的应用. 海洋学报(中文版) , 2012, 34 (5) : 213-220 | |
| 李佳凯, 王志勇, 韦信键, 等. 大黄鱼微卫星多重PCR体系的建立及其应用. 水产学报 , 2014, 38 (4) : 472-477 | |
| 张伟权. 世界重要养殖品种——南美白对虾生物学简介. 海洋科学 , 1990 (3) : 69-73 | |
| 张涛, 庄平, 章龙珍, 等. 可视荧光硅橡胶标志用于西伯利亚鲟幼鱼标志的初步评价. 水生生物学报 , 2010, 34 (3) : 639-641 | |
| 张博, 宋文平. 微卫星多重PCR在水生动物亲权分析中的研究进展. 海洋渔业 , 2012, 34 (3) : 350-356 | |
| 张毅, 孙东晓, 俞英, 等. 家养水牛30个微卫星标记的多重PCR体系建立及其多态性检测. 遗传 , 2008, 30 (1) : 59-64 | |
| 苗贵东, 杜民, 杨景峰, 等. 大菱鲆亲子鉴定的微卫星多重PCR技术建立及应用. 中国海洋大学学报(自然科学版) , 2011, 41 (1/2) : 97-106 | |
| 罗伟, 高泽霞, 曾聪, 等. 团头鲂微卫星多重PCR体系的建立及应用. 大连海洋大学学报 , 2013, 28 (5) : 418-423 | |
| 聂鸿涛, 李琪, 孔令锋. 皱纹盘鲍微卫星多重PCR体系构建及其在家系鉴定中的应用. 水产学报 , 2013, 37 (2) : 207-215 | |
| Alcivar-Warren A, Meehan-Meola D, Park SW, et al. Shrimp Map: A low-density, microsatellite-based linkage map of the pacific white-leg shrimp, Litopenaeus vannamei: Identification of sex-linked markers in linkage group 4. J Shellfish Res , 2007, 26 (4) : 1259-1277 DOI:10.2983/0730-8000(2007)26[1259:SALMLM]2.0.CO;2 | |
| Botstein D, White RL, Skolnick M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms. Am J Hum Genet , 1980, 32 (3) : 314-331 | |
| Garcia DK, Alcivar-Warren A. Characterization of 35 new microsatellite genetic markers for the pacific white-leg shrimp, Litopenaeus vannamei: their usefulness for studyinggenetic diversity of wild and cultured stocks, tracing pedigree in breeding programs, and linkage mapping. J Shellfish Res , 2007, 26 (4) : 1203-1216 DOI:10.2983/0730-8000(2007)26[1203:CONMGM]2.0.CO;2 | |
| Kong F, Gilbert GL. Multiplex PCR-based reverse line blot hybridization assay (mPCR/RLB)-a practical eqidemio- logical and diagnostic tool. Nat Protoc , 2006, 1 (6) : 2668-2680 | |
| Li YT, Wongprasert K, Shekhar M, et al. Development of two microsatellite multiplex systems for black tiger shrimp Penaeus monodon and its application in genetic diversity study for two populations. Aquaculture , 2007, 266 (1-4) : 279-288 DOI:10.1016/j.aquaculture.2007.01.038 | |
| Luo K, Kong J, Luan S, et al. Effect of inbreeding on survival, WSSV tolerance and growth at the postlarval stage of experimental full-sibling inbred populations of the Chinese shrimp Fenneropenaeus chinensis. Aquaculture , 2014, 420-421 (3) : 32-37 | |
| Markoulatos P, Georgopoulou A, Kotsovassilis C, et al. Detection and typing of HSV-1, HSV-2, and VZV by a multiplex polymerase chain reaction. J Clin Lab Anal , 2000, 14 (5) : 214-219 DOI:10.1002/(ISSN)1098-2825 | |
| Meehan D, Xu Z, Zuniga G, et al. High frequency and large number of polymorphic Microsatellites in cultured shrimp, Penaeus (Litopenaeus)vannamei [Crustacea:Decapoda]. Mar Biotechnol , 2003, 5 (4) : 311-330 DOI:10.1007/s10126-002-0092-z | |
| Wang Y, Wang X, Wang A, et al. A 16-microsatellite multiplex assay for parentage assignment in the eastern oyster (Crassostrea virginica Gmelin). Aquaculture , 2010, 308 (S1) : 28-33 | |
| Zhang K, Wang W, Li W, et al. Analysis of genetic diversity and differentiation of seven stocks of Litopenaeus vannamei using microsatellite markers. J Ocean Univ China , 2014, 13 (4) : 647-656 DOI:10.1007/s11802-014-2208-2 | |
| Zhang L, Yang C, Zhang Y, et al. A genetic linkage map of Pacific white shrimp (Litopenaeus vannamei): sex-linked microsatellite markers and high recombination rates. Genetica , 2007, 131 (1) : 37-49 DOI:10.1007/s10709-006-9111-8 |



