对虾白斑综合征病毒(White spot syndrome virus,WSSV)严重危害着全球对虾养殖业,造成巨大的经济损失。WSSV致病宿主范围非常广,致病力也非常强,对虾感染该病毒后死亡率高达100%。然而,WSSV全基因组序列测序的完成,使研究者对WSSV的结构基因及其表达的蛋白的性质和功能有了全面的认识(陈文博等,2009)。运用蛋白质组学的方法,已经鉴别出40多种WSSV的结构蛋白,其中22种是囊膜蛋白,主要的囊膜蛋白有VP19、VP28、VP31、VP36B、VP38A、VP51B和VP53A等,主要的囊膜被膜蛋白有VP26、VP36A、VP39A和VP95等(Tsai et al,2006; Leu et al,2009)。通过免疫共沉淀法和酵母双杂交法研究了WSSV结构蛋白之间的互相作用,发现VP28、VP51A、VP19和VP37这4种蛋白位于病毒颗粒的最外层,预测它们可能在识别宿主细胞表面的模式、识别受体方面具有重要的作用(Chang et al,2010)。Yi等(2004)研究发现,VP28是WSSV侵入对虾细胞所必需的,而VP26负责将VP28蛋白与核衣壳蛋白连接起来(Wan et al,2008) 。
一般认为,对虾缺乏获得性免疫系统,只能依赖天然性免疫系统来抵抗外源病原体的入侵。然而,现在越来越多的研究发现,DNA疫苗(Rajeshkumar et al,2009; Mu et al,2012)和蛋白质亚单位疫苗(丁晶等,2013; Satoh et al,2008)可以激活对虾的免疫系统、增强对虾抵抗病毒侵染的能力,这些研究颠覆了人们对对虾免疫认识的传统思维,为寻求防治WSSV的有效途径带来了希望。DNA疫苗是在分子生物学技术基础上发展起来的特殊疫苗,它具有免疫效果好、生产成本低和临床应用方便等优点(杨海等,2013)。但DNA疫苗的本质毕竟是核酸,存在着基因转移到宿主的可能性,其使用的安全性必须放在最关键的位置。蛋白质亚单位疫苗的本质是蛋白质,生物体利用蛋白质并将其用于机体本身的生命活动,不会造成危害,是一种安全的疫苗。
本研究选取VP28和VP26这两种WSSV囊膜蛋白作为研究对象,利用毕赤酵母表达系统来组成型分泌表达这两种目的蛋白,以期为规模化制备对虾免疫增强剂提供基础数据。
1 材料与方法 1.1 材料 1.1.1 质粒与菌种表达质粒pGAPZαA和X-33毕赤酵母(Invitrogen)为本实验室-80℃保存。E.coli Competent Cells Top10购自北京天根生物科技有限公司。WSSV粗提液为本实验室-80℃保存。
1.1.2 实验试剂pEASY-T1 simple Cloning Kit和T4 DNA Ligase购于北京全式金生物技术有限公司;Zeocin购自Invitrogen公司;快速琼脂糖凝胶DNA回收试剂盒、2 kb/5 kb DNA Marker、高纯度质粒小提试剂盒、常规PCR用2×Es Taq MasterMix和蛋白银染试剂盒购自康为世纪生物公司(CWBIO,北京);限制性内切酶EcoRⅠ、XbaⅠ和AvrⅡ购于TaKaRa公司;葡萄糖为AMRESCO公司产品;酵母提取物(Yeast Extract)、胰蛋白胨(Tryptone)和琼脂粉均购于BBI公司,其他均为国药分析纯。
1.1.3 引物设计根据NCBI中提交的WSSV的全基因组cDNA序列(GenBank:AF332093.3) ,设计含EcoRⅠ和XbaⅠ酶切位点的VP28基因引物xVP28-F、xVP28-R,VP26基因引物xVP26-F、xVP26-R。根据Invitrogen公司pGAPZαA手册提供的引物序列pGAP-F、AOX1-R,委托生工生物工程(上海)股份有限公司合成,xVP28-F(5'-3'):CCGGAATTCATGGATCTTTCTTTCAC,xVP28-R(5´-3´):GCTCTAGATTACTCGGTCTCAGTGC。xVP26-F(5´-3´):CCGGAATTCATGGAATTTGGCAACC,xVP26-R(5´-3´):GCTCTAGATTACTTCTTCTTGATTTCG。PGAP-F(5´-3´):GTCCCTATTTCAATCAATTGAA,AOX1-R(5´-3´):GCAAATGGC ATTCTGACATCC。引物中加下划线部分序列分别为EcoR I、Xba I酶切识别位点,且在酶切位点前引入了保护碱基。
1.2 方法 1.2.1 VP28和VP26基因的获得取-80℃保存的WSSV粗提液作为模板,以引物对xVP28-F/xVP28-R和xVP26-F/xVP26-R分别进行普通PCR扩增,反应体积为50 μl,反应条件为:94℃预变性5 min;94℃变性30 s,62℃/58℃退火30 s(VP28/VP26) ,72℃延伸1 min,35个循环;72℃延伸10 min。采用快速琼脂糖凝胶DNA回收试剂盒回收VP28和VP26目的片段。
pGAPZaA目的基因重组表达载体的构建使用EcoRⅠ和XbaⅠ对空载pGAPZaA、VP28和VP26基因进行双酶切,切胶回收后T4连接酶于25℃连接30 min。转化大肠杆菌Top10感受态细胞,在含25 μg/ml Zeocin LB平板上进行抗性筛选,挑取阳性克隆委托生工生物工程(上海)股份有限公司测序,将测序正确的重组表达质粒分别命名为pGAPZaA、pGAPZaA-VP28和pGAPZaA-VP26。
1.2.3 重组表达质粒电转化毕赤酵母使用AvrⅡ酶切线性化重组质粒pGAPZaA、pGAPZaA-VP28和pGAPZaA-VP26。参照Invitrogen公司毕赤酵母操作手册制备X-33酵母感受态细胞。将线性化质粒电击转化X-33酵母,然后涂布于含100 μg/ml Zeocin YPDS平板上,30℃培养3 d左右,筛选阳性克隆。提取阳性酵母基因组DNA作为模板,以pGAP-F和AOX1-R作为上下游引物进行普通PCR扩增,阳性重组酵母分别为X-33/pGAPZaA-VP28和X-33/pGAPZaA-VP26,X- 33/pGAPZaA作为空白对照。
1.2.4 重组酵母的表达与检测挑取阳性重组酵母分别接种至5 ml Zeocin抗性的YPD液体培养基中,在30℃、250 r/min的条件下过夜培养。取200 μl上述活化菌液接种至装有50 ml新鲜YPD培养基的250 ml三角摇瓶中,30℃、250 r/min振荡培养72 h。4℃、12000×g离心3 min,上清液经液氮速冻后,保存于-80℃冰箱。
分别取40 μl X-33/pGAPZaA-VP28、X-33/pGAP ZaA-VP26和X-33/pGAPZaA蛋白发酵上清液,加入10 μl 5×蛋白质上样缓冲液,混匀后,99℃金属浴10 min,然后12000 ×g离心2 min,取离心后的上清液上样,取5 μl蛋白质分子量标准作为分子量参照,进行SDS- PAGE蛋白质电泳。电泳结束后,分别采用R-250考马斯亮蓝染色和蛋白质银染来检测目的蛋白。
2 结果 2.1 VP28 和VP26基因的扩增VP28和VP26的基因是以WSSV的DNA粗提液为模板,进行普通PCR扩增得到的,琼脂糖凝胶电泳结果如图 1所示,在500-750 bp之间有明显的条带,这与预测的VP28和VP26基因的片段大小均为632 bp相符。
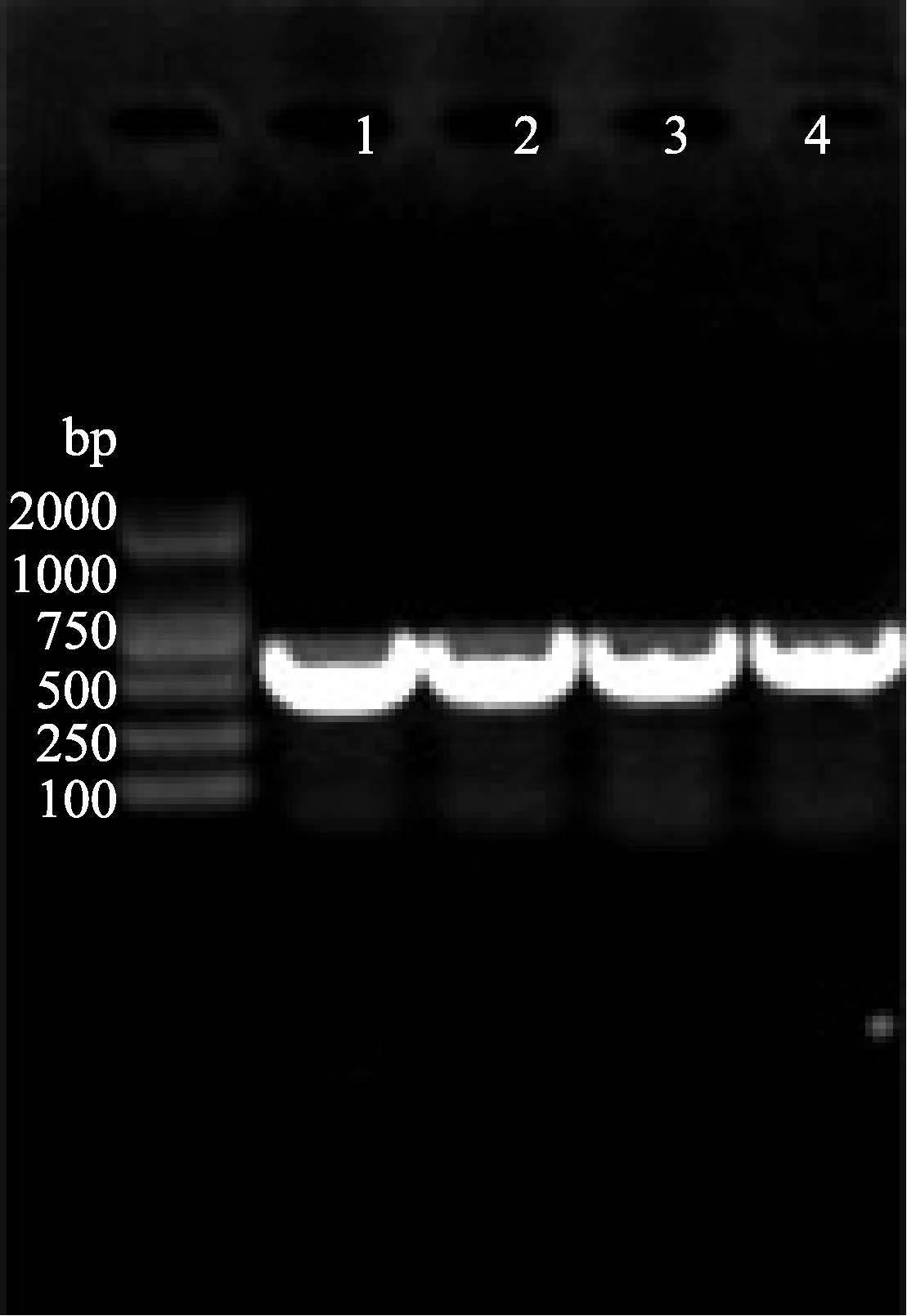
|
图 1 VP28和VP26 PCR扩增结果 Figure 1 PCR amplification of VP28 and VP26 gene 1-2: VP28; 3-4: VP26 |
用T4 DNA Ligase将酶切后的片段与具有相同黏性末端的pGAPZaA表达载体连接,从而构建好重组表达载体,将得到的连接产物转化大肠杆菌Top10,经Zeocin抗性筛选后,挑取抗性单克隆进行菌落PCR鉴定,PCR产物电泳结果见图 2,与目的条带应为1172 bp的理论值相符。取阳性克隆测序,测序结果经MEGA 5.05软件分析,可证明重组表达载体序列完全正确,无移码错配。
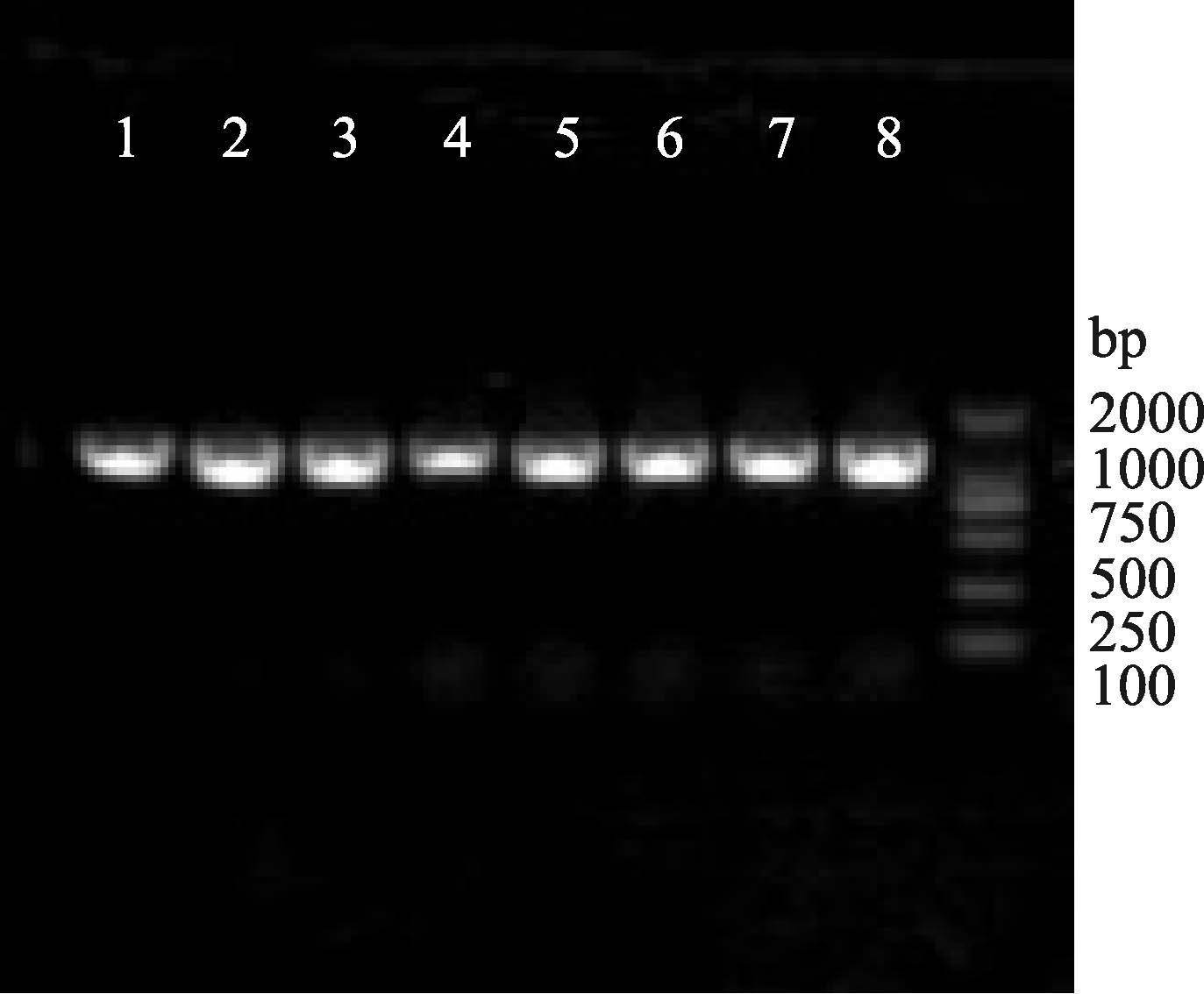
|
图 2 重组质粒菌落PCR Figure 2 PCR identification of the recombinant plasmid 1-4: pGAPZaA-VP28; 5-8: pGAPZaA-VP26 |
挑取阳性酵母转化子进行发酵,发酵上清液用于蛋白质凝胶电泳,电泳结束后采用考马斯亮蓝R-250染色,染色结果见图 3,结果显示,与空载pGAPZaA相比,含有VP28和VP26目的基因的酵母上清液的电泳没有特异的条带。因此,需要采用更灵敏的检测方法来确定目的蛋白是否成功表达。
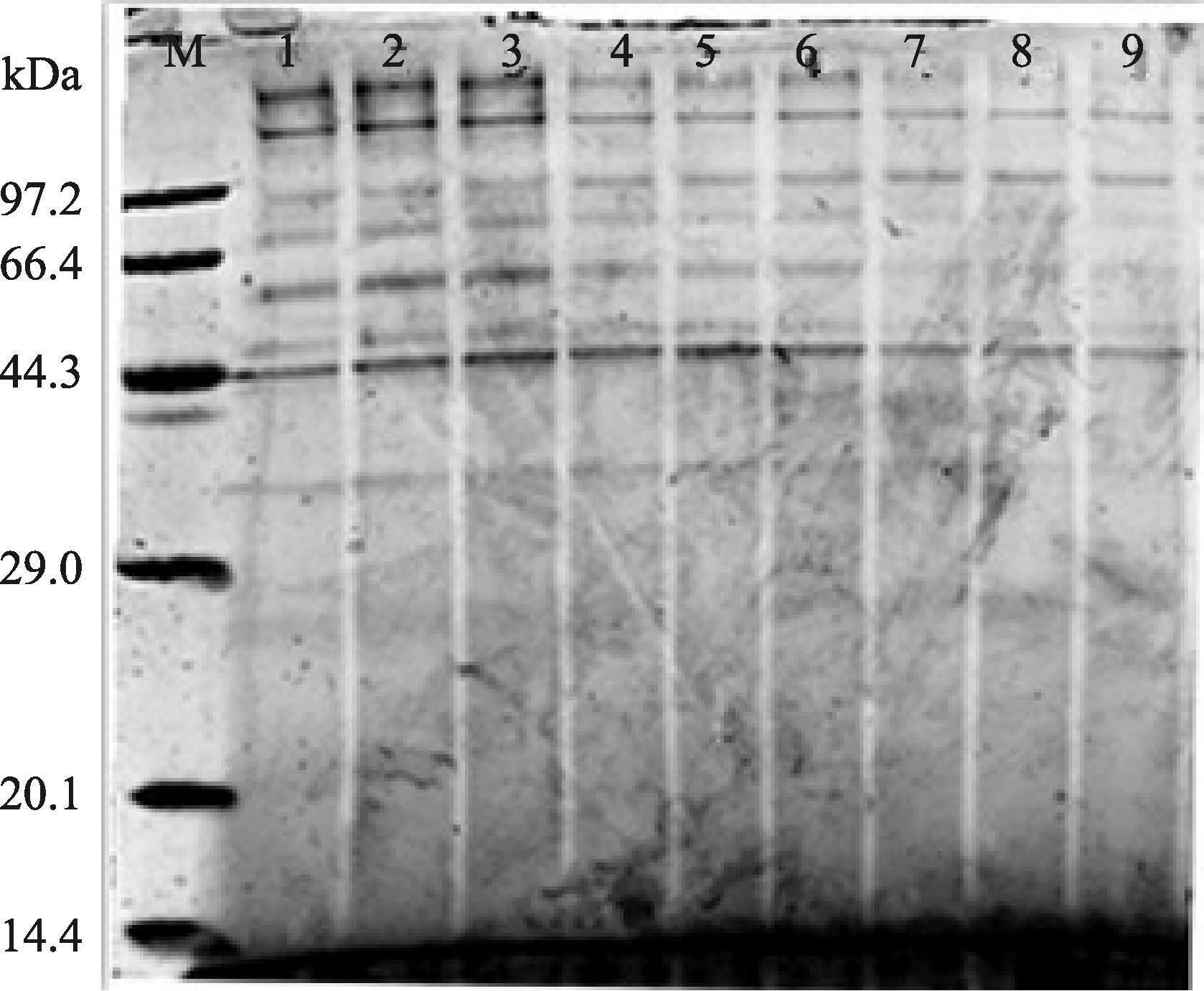
|
图 3 VP28、VP26和空载重组酵母 SDS-PAGE电泳考染结果 Figure 3 SDS-PAGE analysis(R-250 staining)of the VP28 and VP26 recombinant protein expressed in X-33 1-3: X-33/pGAPZaA-VP28; 4-6:X-33/pGAPZaA-VP26; 7-9: X-33/pGAPZaA |
利用蛋白质银染法来进一步检测酵母发酵上清液中的目的蛋白,银染结果见图 4,与空载pGAPZaA酵母表达上清液组相比,pGAPZaA-VP28和pGAPZaA- VP26酵母表达上清液组在箭头所指的平行位置有明显的特异性条带。根据蛋白分子量标准预测VP28和VP26的蛋白分子量在32 kDa左右。

|
图 4 重组酵母SDS-PAGE电泳银染结果 Figure 4 SDS-PAGE analysis(silver staining)of the VP28 and VP26 recombinant protein expressed in X-33 P: X-33/pGAPZaA; 1-3: X-33/pGAPZaA-VP28; 4-6: X-33/pGAPZaA-VP26 |
随着基因工程和生物技术的发展,在体外表达功能蛋白已经成为一种高效可行的获取蛋白疫苗的方法。在对虾白斑综合征防治的研究中,WSSV重组蛋白可以诱发虾体产生抗WSSV侵染反应的结果已被许多研究者所证明,而这些WSSV重组蛋白被称为蛋白质亚单位疫苗,其中研究最多的是VP28病毒囊膜蛋白。魏克强等(2005) 利用杆状病毒感染家蚕蛹来成功表达VP28蛋白,Fu等(2008) 构建了pBS-H1-VP28枯草芽孢杆菌表达载体,并在枯草芽孢杆菌成功表达VP28蛋白,Satoh等(2008) 利用大肠杆菌成功表达了VP28和VP26蛋白,养殖实验均证明WSSV重组蛋白具有增强虾体抗WSSV感染的能力。
本研究使用毕赤酵母表达系统分泌性表达VP28和VP26目的蛋白,选用的表达载体是pGAPZaA,它属于组成型的表达载体,因为该表达载体的启动子是pGAP(三磷酸甘油醛脱氢酶启动子),使用该启动子表达目的蛋白时不需要使用甲醇诱导。毕赤酵母表达系统属于真核表达系统,对翻译后的蛋白质可以进行一定的加工,有利于真核生物蛋白的表达和活性的保持,优于原核表达系统。此外,表达产物可以分泌到细胞外,便于目的蛋白的纯化与分离,适合规模化生产。目前,利用该表达系统已经成功表达很多功能蛋白,如β-半乳糖苷酶、β-葡萄糖醛酸酶、羧肽酶B和羧酸酯酶等(Waterham et al,1997; Sears et al,1998; 张平涛,20081) ; Delroisse et al,2005)。使用组成型表达系统不需要更换碳源,发酵周期短,且可以采用连续发酵的方式进行大规模发酵,这些都给酵母发酵产业带来了新的视角和机遇。但是,使用毕赤酵母组成型表达系统外源蛋白时,有一个最主要的限制,就是本系统不能用于表达对酵母细胞有害的蛋白质。此外,毕赤酵母组成型表达系统能否高效分泌性表达外源蛋白,还与目的基因插入酵母基因组的位置与拷贝数、选用何种信号肽序列以及酵母培养条件(如温度、pH值、溶氧和营养物等)等有密切关系。
1) 张平涛. 鼠羧肽酶原B和蛇毒金属蛋白酶Alfimeprase两种蛋白在毕赤酵母中表达研究. 厦门大学硕士研究生学论文,2008
本研究首次尝试在毕赤酵母中组成型分泌表达VP28和VP26目的蛋白,经检测成功表达,但目的蛋白的表达量较低,推测有以下原因:(1) 发酵条件不合适:实验采用摇瓶小量发酵,无法控制发酵液的pH值、溶氧量以及营养物质的供给;(2) 没有筛选到高效表达的菌株:目的基因不同拷贝数的插入,甚至不同的阳性菌株,目的蛋白的表达量都有可能不同,实验缺乏有效的检测高效表达菌株的方法;(3) 信号肽选用不合适:本研究采用的是酵母本身的信号肽序列-α-交换因子,该信号肽可能不适合引导VP28和VP26分泌表达;(4) VP28和VP26蛋白本身可能不适合在毕赤酵母中组成型分泌表达。因此,还需要大量相关的研究来解释这一现象的真实原因。尽管如此,本研究还是能为研究WSSV蛋白亚单位疫苗的研究提供实践经验和基础数据,为WSSV蛋白亚单位疫苗的规模化使用的前景奠定一些基础。
| 丁晶, 彦波, 傅玲琳. 以枯草芽孢杆菌递呈VP28对南美白对虾免疫相关基因表达和细胞特异性吞噬的影响. 水生生物学报 , 2013, 37 (4) : 705-711 | |
| 陈文博, 侯林, 刘庆慧. 对虾白斑综合征病毒亚单位疫苗研究进展. 动物医学进展 , 2009, 29 (12) : 73-76 | |
| 杨海, 王芳宇. DNA疫苗的研究进展. 中国畜牧兽医 , 2013, 40 (1) : 72-6 | |
| 魏克强, 许梓荣. 家蚕蛹表达的重组VP28疫苗对克氏原螯虾的抗病毒保护效应. 实验生物学报 , 2005, 38 (3) : 190-198 | |
| Chang YS, Liu WJ, Lee CC, et al. A 3D model of the membrane protein complex formed by the white spot syndrome virus structural proteins. PLoS One , 2010, 5 (5) : e10718 DOI:10.1371/journal.pone.0010718 | |
| Delroisse JM, Dannau M, Gilsoul JJ, et al. Expression of a synthetic gene encoding a Tribolium castaneum carbo?xyl-esterase in Pichia pastoris. Protein Expres Purif , 2005, 42 (2) : 286-294 DOI:10.1016/j.pep.2005.04.011 | |
| Fu LL, Li WF, Du HH, et al. Oral vaccination with envelope protein VP28 against white spot syndrome virus in Proc-ambarus clarkii using Bacillus subtilis as delivery vehicles. Lett Appl Microbiol , 2008, 46 (5) : 581-586 DOI:10.1111/j.1472-765X.2008.02355.x | |
| Leu JH, Yang F, Zhang X, et al. Whispovirus//Lesser Known Large dsDNA Viruses. Springer Berlin Heidelberg, 2009: 197-227 | |
| Mu Y, Lan JF, Zhang XW, et al. A vector that expresses VP28 of WSSV can protect red swamp crayfish from white spot disease. Dev Comp Immunol , 2012, 36 (2) : 442-449 DOI:10.1016/j.dci.2011.08.009 | |
| Rajeshkumar S, Venkatesan C, Sarathi M, et al. Oral delivery of DNA construct using chitosan nanoparticles to protect the shrimp from white spot syndrome virus (WSSV). Fish Shellfish Immunol , 2009, 26 (3) : 429-437 DOI:10.1016/j.fsi.2009.01.003 | |
| Satoh J, Nishizawa T, Yoshimizu M. Protection against white spot syndrome virus (WSSV) infection in kuruma shrimp orally vaccinated with WSSV rVP26 and rVP28. Dis Aquat Organ , 2008, 82 (2) : 89-96 | |
| Sears IB, O'Connor J, Rossanese OW, et al. A versatile set of vectors for constitutive and regulated gene expression in Pichia pastoris. Yeast , 1998, 14 (8) : 783-790 DOI:10.1002/(ISSN)1097-0061 | |
| Tsai JM, Wang HC, Leu JH, et al. Identification of the nucleocapsid, tegument, and envelope proteins of the shrimp white spot syndrome virus virion. J Virol , 2006, 80 (6) : 3021-3029 DOI:10.1128/JVI.80.6.3021-3029.2006 | |
| Wan Q, Xu L, Yang F. VP26 of white spot syndrome virus functions as a linker protein between the envelope and nucleocapsid of virions by binding with VP51. J Virol , 2008, 82 (24) : 12598-12601 DOI:10.1128/JVI.01732-08 | |
| Waterham HR, Digan ME, Koutz PJ, et al. Isolation of the Pichia pastoris glyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter. Gene , 1997, 186 : 37-44 DOI:10.1016/S0378-1119(96)00675-0 |



