2. 大连海洋大学食品工程学院 大连 116023;
3. 蓬莱中柏京鲁船业有限公司 蓬莱 265601
2. 2.Department of Food Engineering, Dalian Ocean University, Dalian 116023 ;
3. 3.Penglai Zhongbai Jing Ship Industry Co., Ltd., Penglai 265601
日本枪乌贼(Loligo japonica),又称小鱿鱼,头足纲软体动物,广泛分布于我国黄、渤海等沿海地区。枪乌贼具有典型的高蛋白、低脂肪特点,且富含多种人体必需氨基酸。因此,枪乌贼这种大宗渔业资源的开发利用具有广阔的市场前景。
水产鲜品的品质不易保持,极易腐败变质。大宗水产品原料一般采用冷冻贮藏的方式。大量研究表明,水产品在冷冻贮藏过程中,由于水渗透力的改变、肌球蛋白变性、机械损伤及肌原纤维蛋白的交联和聚合,使得水产品原料的一些品质发生劣变(Xia et al,2003)。国内外对鱿鱼冻藏过程中生化变化进行了一定的研究,Atayeter等(2011) 在-20℃、-40℃和-80℃条件下,对冻藏欧洲鱿鱼触手和酮体的基本成分及脂质氧化进行了对比分析;路钰希等(2013) 研究发现,秘鲁鱿鱼在-30℃下冻藏能更好保持品质且经济成本低。虽然研究的鱿鱼种类很多,但目前针对日本枪乌贼冻藏的研究报道较少。
作为远洋渔获物,枪乌贼一般需要经历较长时间的冷冻贮藏和运输。对枪乌贼在该冷链环节中品质变化规律进行研究,有助于监测、控制及预测其品质变化的程度。本研究以TVB-N值、肌原纤维蛋白含量、Ca2+-ATPase活性、巯基含量、TBARS值等为指标,结合感官评定和组织结构观察,研究了不同冻藏温度下枪乌贼品质的变化情况,以期为枪乌贼冷链流通过程中的品质控制提供理论依据。
1 材料与方法 1.1 材料鲜活枪乌贼由捕捞船在黄、渤海海域捕获,靠岸后冰藏条件下3 h内运至实验室。
1.2 方法 1.2.1 样品前处理将新鲜枪乌贼放入保鲜袋中,随机分为3组,模拟工厂冻藏模式,分别直接置于-20℃、-30℃和-50℃的条件下恒温冻藏,每隔15 d进行一次测定。
原料的解冻采用流水解冻的方式:冷冻枪乌贼经流水(约18℃)解冻15 min后,去头去皮去内脏,备用。
1.2.2 感官评定参考Vaz-Pires等(2008) 方法评价,将枪乌贼制备成5 cm×5 cm×0.5 cm的薄片,依据表 1的标准,经10名专业的感官评定员对枪乌贼的气味、色泽、质地三方面进行感官评分。运用加权平均的方法,设定权重分别为0.4、0.4、0.3,计算加权平均分,满分为30分,18分以上为新鲜度良好,10分以下为腐败不可接受。
|
|
表 1 枪乌贼感官评定(满分30) Table 1 Sensory evaluation of squid(full score 30) |
根据GB/T5009.44-2003《肉与肉制品卫生标准分析方法》,采用微量扩散法测定。
1.2.4 肌原纤维蛋白的提取及含量的测定准确称取5.00 g枪乌贼样品,加入0.1 mol/L KCl-20 mmol/L Tris-HCl缓冲液50 ml,匀浆机均质1 min,4℃条件下8000 r/min离心5 min,弃上清液,重复操作3次。沉淀中加入0.5 mol/L KCl-20 mmol/L Tris-HCl缓冲液50 ml,浸提1 h,8000 r/min离心10 min,取上清液即为肌原纤维蛋白溶液,用双缩脲法测定含量。
1.2.5 Ca2+-ATPase活性的测定参照万建荣等(1993) 方法,稍作修改。在离心管中分别加入0.5 mol/L Tris-Maleate 5 ml、0.1 mol/L CaCl2 0.5 ml、2 mol/L KCl 2.25 ml、肌原纤维蛋白液1 ml,混合完全后,加入ATP开始反应2 min,最后加入15% 三氯乙酸(TCA)终止反应。6000 r/min离心10 min后,取上清液1 ml,加入2.5 ml H2O、1 ml 2.5%硫酸钼酸、0.5 ml Elon试剂,充分混合,常温放置45 min,在640 nm处比色。空白组为加入ATP之前先加入TCA。以磷酸二氢钠溶液系列浓度(0.0-1.0 mmol/L)制备标准曲线,计算Ca2+-ATPase活性值。
1.2.6 活性巯基含量的测定根据Benjakul等(2003) 的方法,将2.0 ml肌原纤维蛋白溶液加入8.0 ml 8.0 mol/L尿素,充分混合。取3.0 ml混合液于试管中,加入0.02 ml DTNB溶液,混匀,放置15 min,412 nm比色。以未加入DTNB的混合液为空白组。根据下式计算活性巯基含量:
| ${{C}_{0}}=\frac{A}{\varepsilon }\times \frac{D}{{{C}_{1}}}$ |
式中,C0为活性巯基含量(mol/g),A为412 nm处吸光度,e为分子吸光系数13600(mol·cm/L),D为稀释倍数,C1为肌原纤维蛋白含量(mg/ml)。
1.2.7 脂肪氧化(TBARS)的测定参照Paola(2014) 的方法,称取10.00 g研匀后的样品,加入50 ml 5% TCA溶液。振荡2 min后静置10 min,8000 r/min离心10 min,上清液过滤。滤液适度稀释后,取5 ml于25 ml具塞试管中,加入5 ml 0.02 mol/L TBA溶液。95℃水浴45 min后,冷却。532 nm测定吸光度值。以1,1,3,3-四乙氧基丙烷(TEP)为标准液绘制标准曲线,并计算TBARS值。
1.2.8 肌肉组织结构的切片制作将枪乌贼样品切成5 mm×5 mm×1.5 mm的薄片,放入10%的甲醛溶液固定12-24 h,流水冲洗4-6 h,用浓度梯度分别为70%(2 h)、80%(2 h)、90%(2 h)、95%(1.5 h)和100%(1.5 h)的乙醇溶液进行脱水处理,再用二甲苯溶液对样品透明处理(30 min),最后石蜡包埋,用切片机切成厚度为5 μm的切片,染色后光学显微镜下观察(邓敏,2013)1) 。
1) 邓敏. 浸渍冻结流速及冻藏对草鱼块品质影响的研究. 华南理工大学硕士研究生学位论文, 2013, 17-18
1.2.9 数据处理采用SPSS 11.0对实验数据进行统计分析,结果以平均值±标准差表示,组间分析采用t检验,显著性界值以P<0.01为极显著,P<0.05为显著。
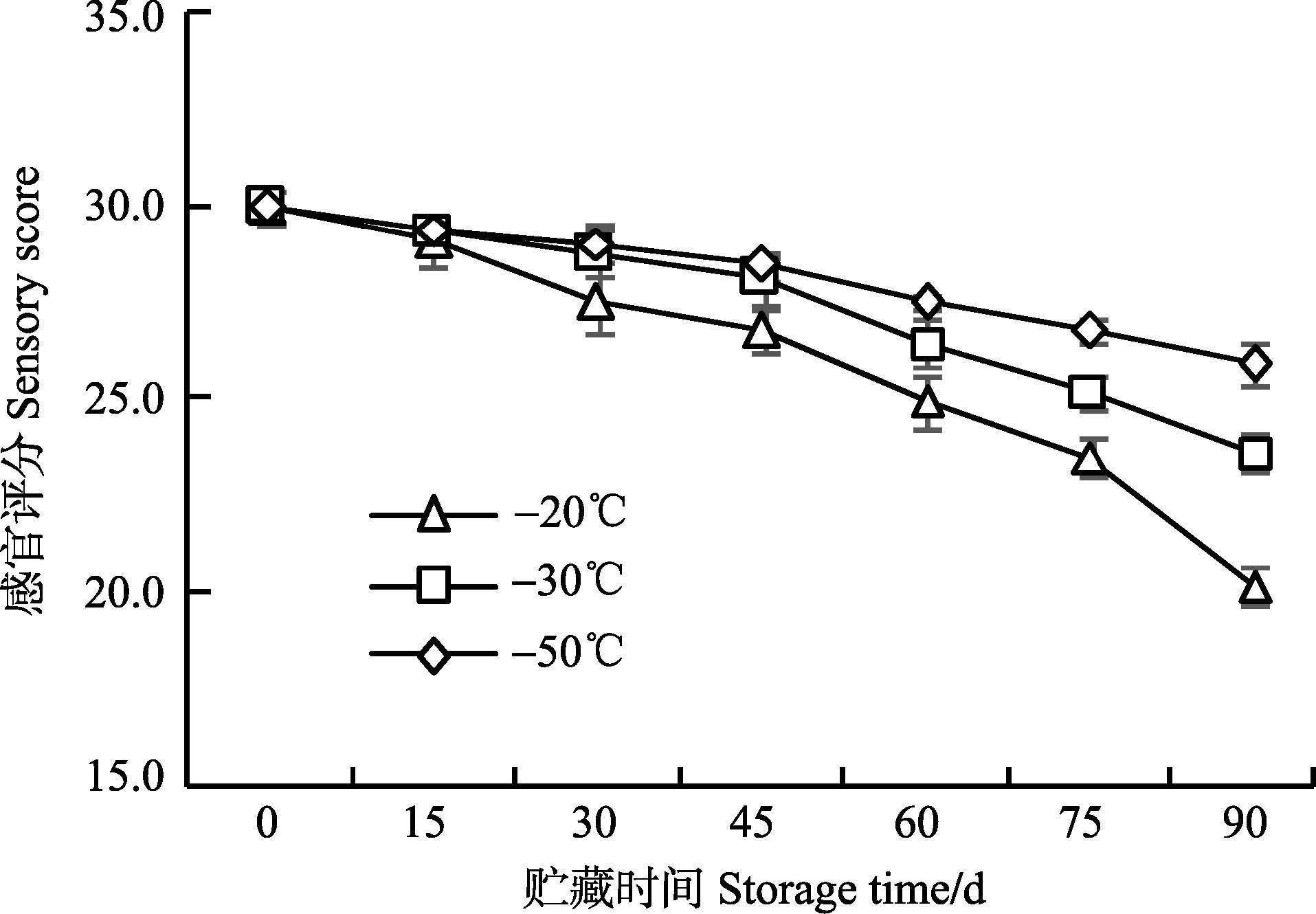
2 结果与讨论 2.1 枪乌贼冻藏过程中感官评分变化枪乌贼的感官评分随冻藏时间的延长呈下降的趋势,且冻藏温度越高,感官评分下降速率越快(图 1)。在冻藏第15天时,-20℃、-30℃和-50℃条件下贮藏的枪乌贼样品感官评分无显著差异(P>0.05) 。第30天时,-20℃组样品的评分明显下降,显著低于-50℃组(P<0.05) ,而-30℃组与其他两组无显著差异。从第60天开始,-20℃组、-30℃组和-50℃组的样品在感官评分上呈现出明显差异(P<0.05) 。冻藏第90天时,-20℃、-30℃、-50℃下枪乌贼感官评分分别为20.2、23.7和26.0,3组之间有极显著差异(P<0.01) 。
|
图 1 枪乌贼冻藏过程中感官评分变化 Figure 1 Changes in the sensory scores of squid at different storage temperatures |
Nurkhoeriyati等(2012) 研究发现,冻藏过程中,肌原纤维蛋白发生变性及凝聚,导致肌肉功能特性的改变,脂肪氧化则影响了肉的气味和颜色,从而降低了鱼肉的感官品质。另外,冻藏温度越低,冻结速度越快,鱼肉品质越好,冻结速率对鱼肉的光泽度、气味、质地等有着显著影响(Ruiz-Capillas et al,2005)。
2.2 枪乌贼冻藏过程中TVB-N含量变化TVB-N是衡量水产品及肉类制品新鲜度的常用指标。新鲜捕获鱼类的TVB-N值一般在5-20 mg/ 100 g之间,而冷冻贮藏鱼类的可接受极限为30-35 mg/100 g(Özogul et al,2007)。根据GB 2733-2005《鲜、冻动物性水产品卫生标准》,头足类TVB-N≤30 mg/100 g为合格品。
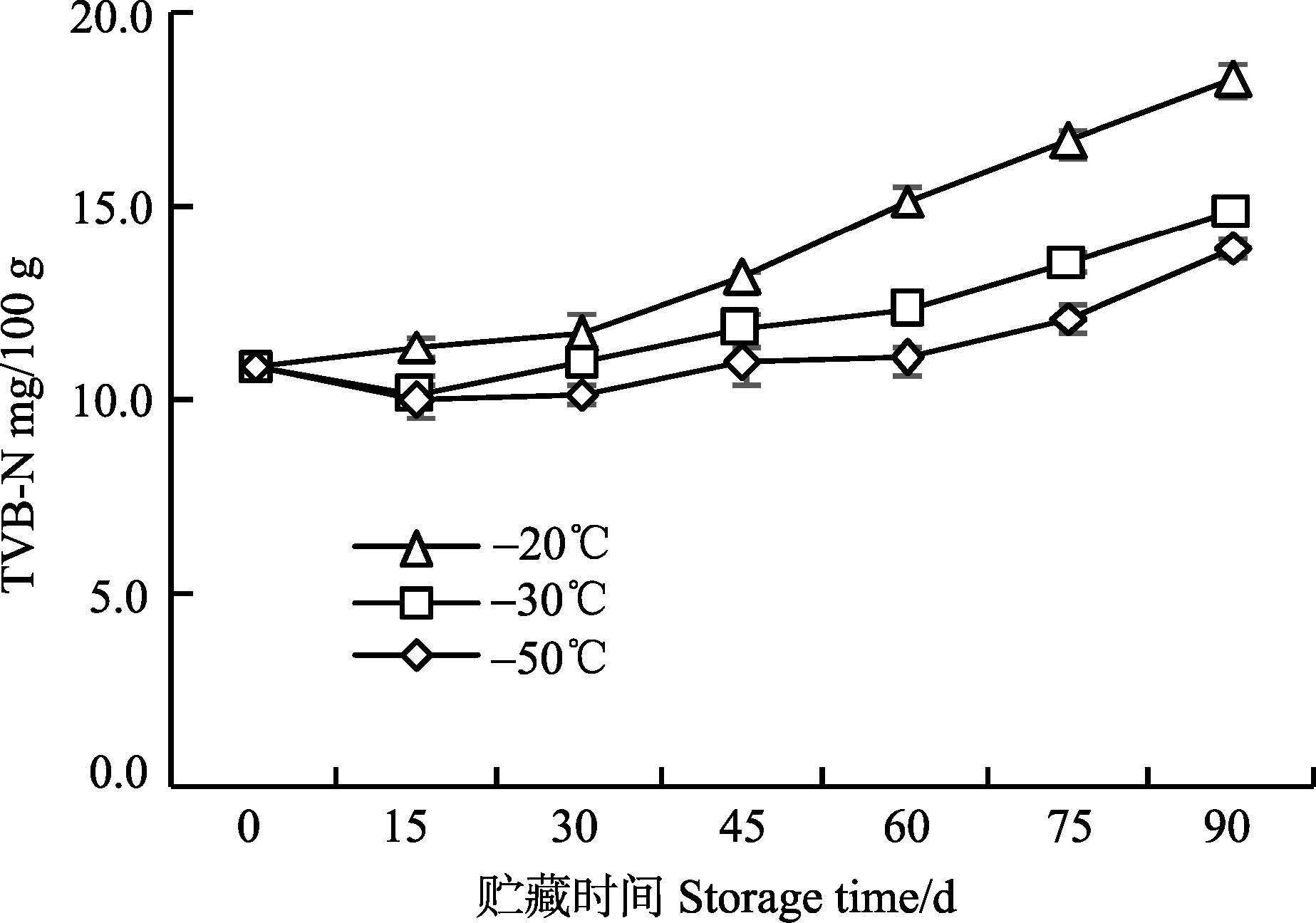
新鲜枪乌贼的TVB-N值为10.91 mg/100 g,这与路钰希等(2013) 的研究结果基本一致。枪乌贼的TVB-N值较其他水产品高,这可能是由于枪乌贼中蛋白质含量较高,内源性蛋白酶分解蛋白生成更多的氨类及三甲胺等挥发性含氮化合物,使得TVB-N值升高(李艳萍等,2014)。不同冻藏温度条件下,枪乌贼TVB-N值均呈上升的趋势(图 2)。冻藏第30天时,3个温度组的TVB-N值变化不大,无显著性差异(P>0.05) 。-20℃组冻藏枪乌贼的TVB-N值从第30天开始快速增大。而-30℃组和-50℃组的TVB-N值则从第60天开始明显增大。第45天时,3组之间差异显著(P<0.05) 。至冻藏第90天时,-20℃、-30℃、-50℃3组对应的TVB-N值分别为18.28 mg/100 g、14.93 mg/100 g和13.97 mg/100 g,均小于30 mg/100 g,符合国家标准。
|
图 2 枪乌贼冻藏过程中TVB-N值的变化 Figure 2 Changes in the TVB-N values of squid at different storage temperatures |
随着冻藏时间的延长,枪乌贼肌原纤维蛋白含量总体呈下降趋势。水产品冻藏过程中,肌原纤维蛋白含量的下降与多种因素有关。Pan等(2010) 认为,巯基氧化成二硫键,使蛋白质重链聚合,导致了肌原纤维蛋白含量降低。此外,Sriket等(2007) 研究表明,蛋白质三级结构被破坏,分子间产生交联,也是蛋白变性的原因之一。
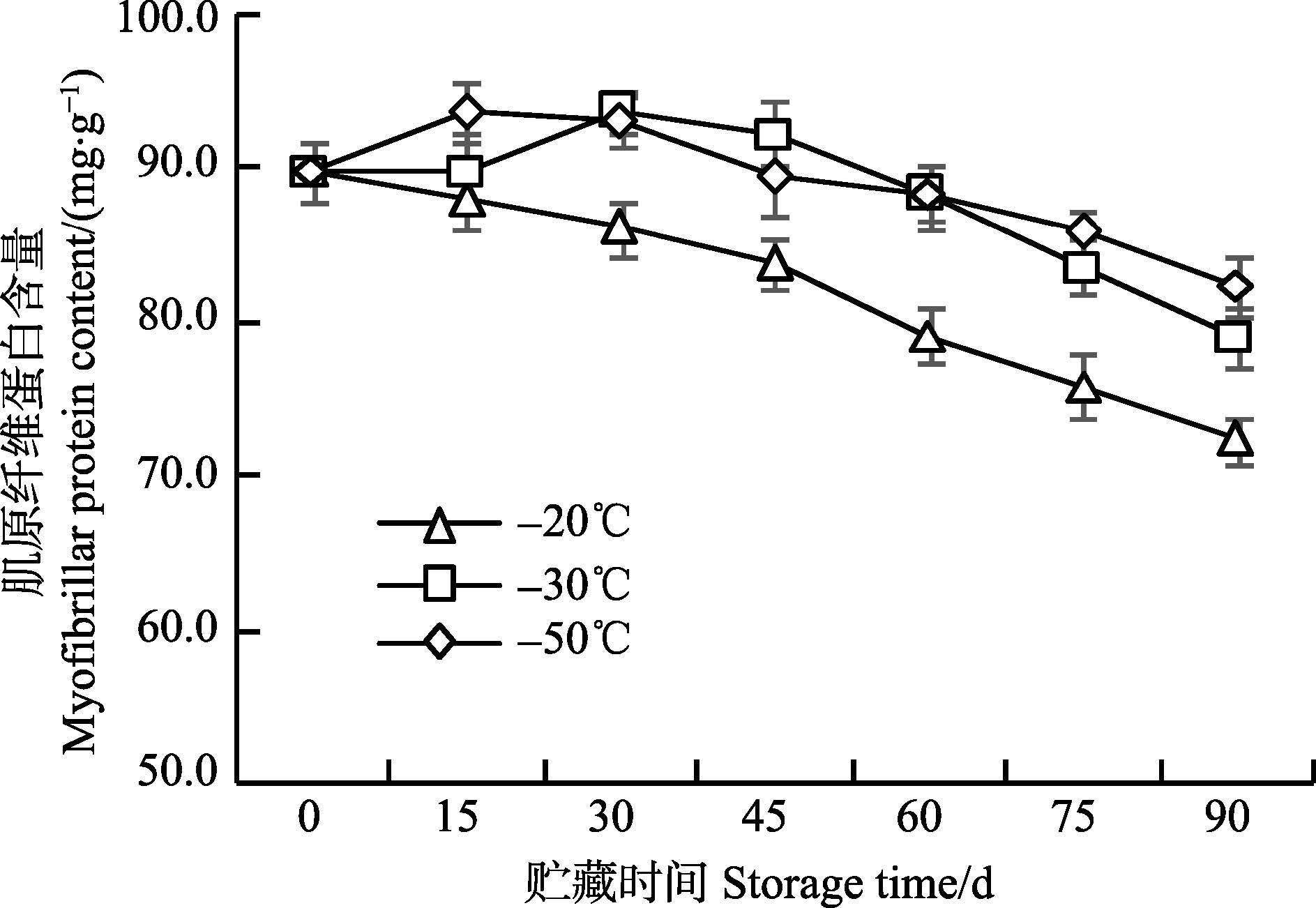
由图 3所示,与-20℃条件下枪乌贼肌原纤维蛋白含量一直下降略有不同,-30℃条件下冻藏的枪乌贼样品,肌原纤维蛋白含量在前15 d无明显变化,第30天时略有增加,-50℃条件下的枪乌贼样品,前15 d也出现肌原纤维蛋白含量略微增加现象。这一现象与曾名勇等(2003) 的研究结果类似,认为这是由肌原纤维蛋白提取过程中的实验误差引起的。而陶欢等(2010) 则认为,动物死后肌肉中ATP逐渐消耗,使得肌球蛋白和肌动蛋白发生不可逆的结合,形成大分子物质沉降所导致。在冻藏第45天时,-30℃组与-50℃组肌原纤维蛋白含量差异不大,极显著高于-20℃组(P<0.01) 。至第90天时,-20℃、-30℃、-50℃对应的肌原纤维蛋白含量分别为72.33 mg/g、79.12 mg/g和82.44 mg/g,3组之间存在显著差异(P<0.05) 。
|
图 3 枪乌贼冻藏过程中肌原纤维蛋白含量的变化 Figure 3 Changes in the myofibrillar protein content of squid at different storage temperatures |
水产动物的肌球蛋白头部具有ATPase活性,而Ca2+可以激活酶活性(郭园园等,2011)。冻藏中肌球蛋白头部构象发生变化,蛋白质分子之间相互作用使得其空间结构重新排列,造成了Ca2+-ATPase失活。Eymard等(2009) 研究发现,脂质在冻藏中产生的过氧化物会与蛋白质发生反应,导致蛋白变性,从而使Ca2+-ATPase失活。因此,冻藏过程中,Ca2+-ATPase活性可以表征肌原纤维蛋白的完整性和变性程度。
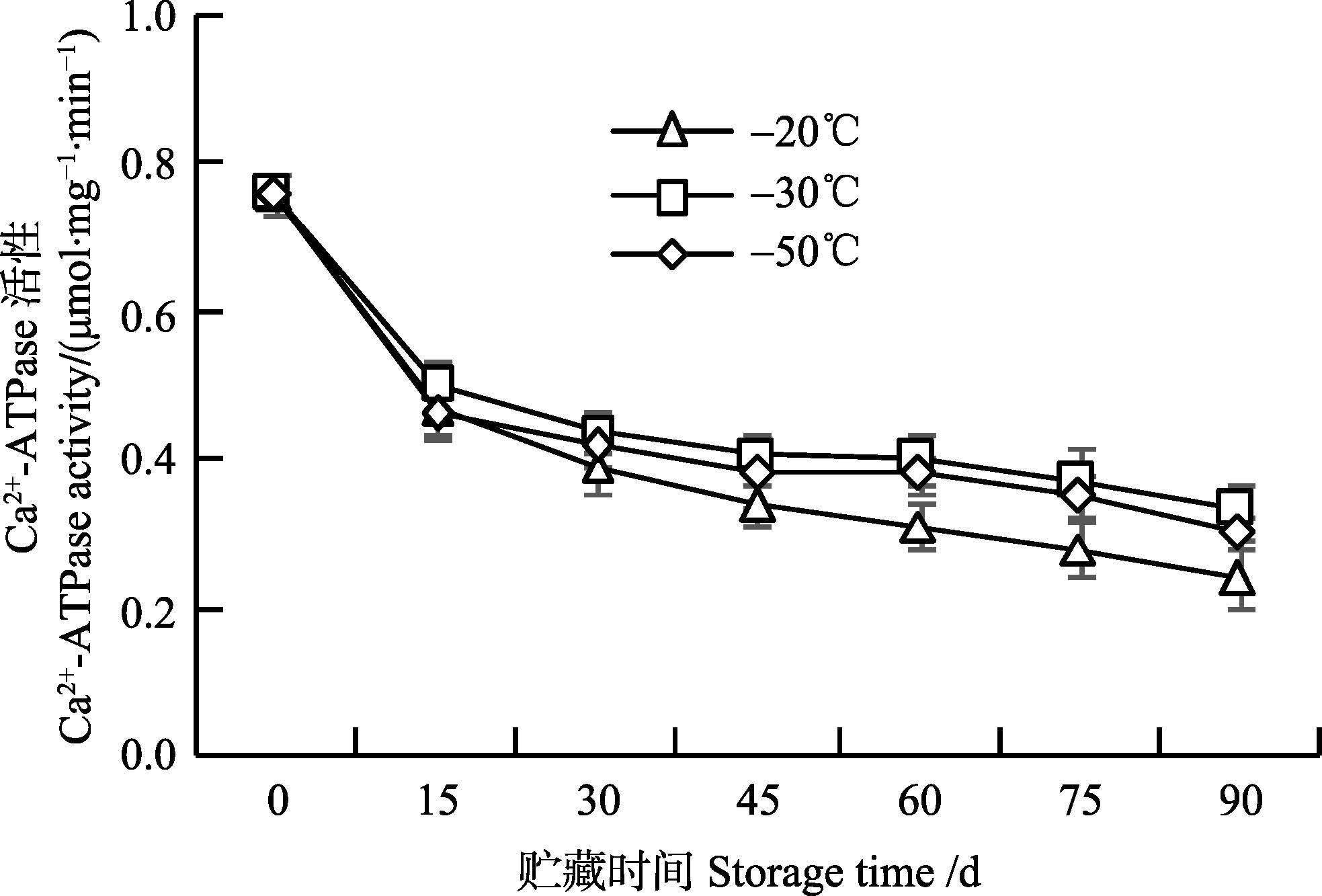
由图 4可知,在冻藏期90 d内,3个温度条件下,枪乌贼肌原纤维蛋白Ca2+-ATPase活性不断下降,这与Benjakul等(1997) 的研究结果类似。冻藏前15 d内,Ca2+-ATPase活性下降的速率最快,-20℃组、-30℃组和-50℃组由新鲜鱿鱼的0.74 μmol/mg·min分别下降到0.47 μmol/mg·min、0.50 μmol/mg·min、0.46 μmol/mg·min,降幅分别达36.48%、32.43%、37.84%,但3个温度之间Ca2+-ATPase活性无显著差异(P>0.05) 。冻藏45 d后,-20℃下枪乌贼Ca2+-ATPase活性显著低于其他两个温度组(P<0.05) ,而-30℃与-50℃相比,Ca2+-ATPase活性在冻藏过程中始终无显著差异(P>0.05) 。
|
图 4 枪乌贼冻藏过程中Ca2+-ATPase活性的变化 Figure 4 Changes in the Ca2+-ATPase activity of squid at different storage temperatures |
蛋白质结构中的巯基是所有蛋白质氨基酸残基中最活泼的基团,在体内抗氧化、亚硝基化等多种重要生理反应中具有重要作用(Wedemeyer et al,2000)。通过测定活性巯基含量,可以直观表明蛋白质内部结构的变化。从图 5可以看出,冻藏第15天时,3个温度组活性巯基含量无明显变化。冻藏第30天时,鱿鱼在-30℃和-50℃下的活性巯基含量由最初的5.56x 10-5 mol/g分别增加到5.61x10-5 mol/g、5.85x10-5 mol/g。这可能是在冻藏初期,过低的温度影响了蛋白质空间结构,隐藏的巯基暴露出来所造成的。随后,活性巯基含量快速下降,从第60天开始,3个温度组的活性巯基含量出现显著差异(P<0.05) 。至冻藏第90天时,-20℃、-30℃和-50℃下活性巯基含量分别下降至4.75x10-5 mol/g、4.99x10-5 mol/g和5.07x10-5 mol/g。
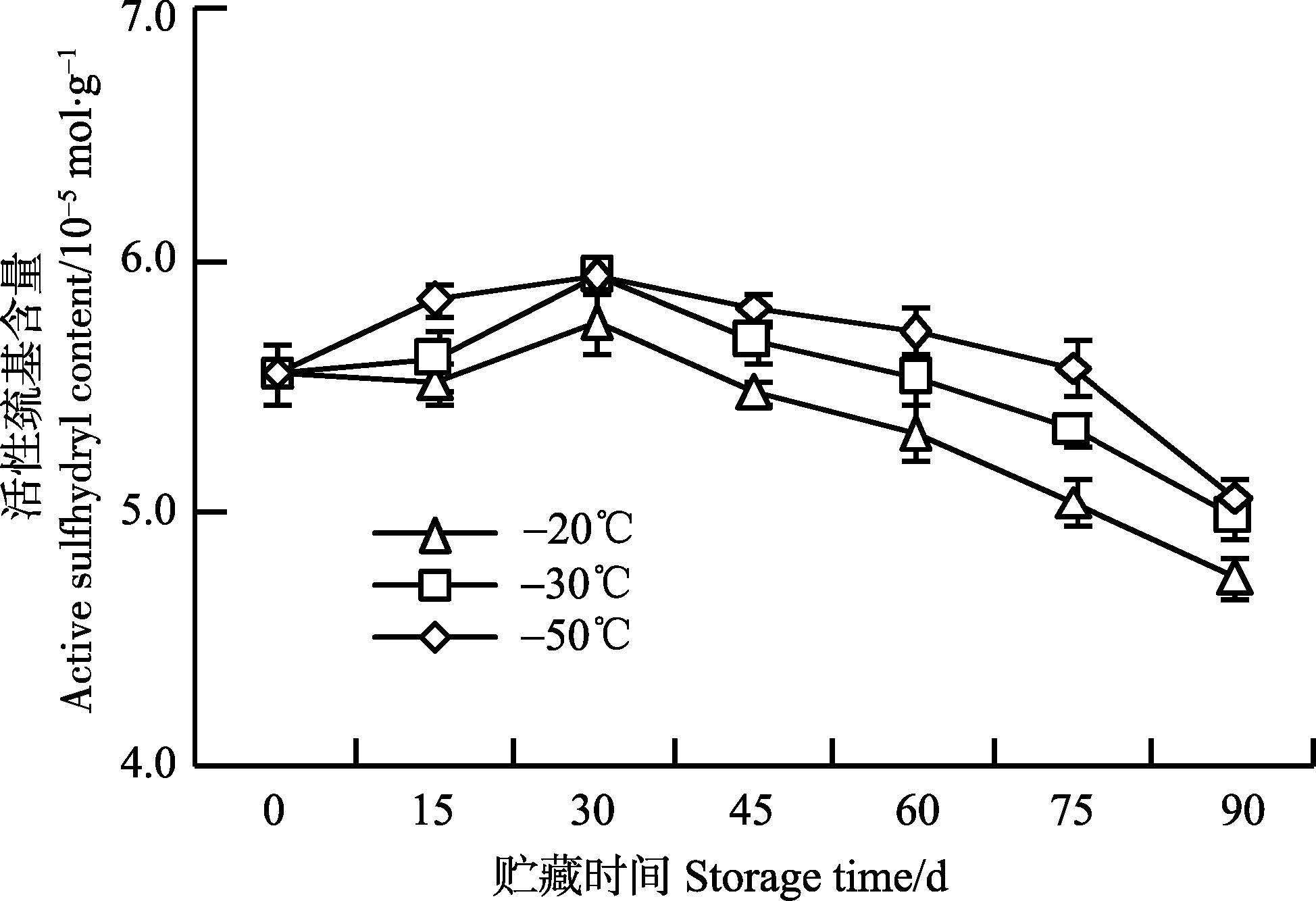
|
图 5 不同冻藏温度对巯基含量的影响 Figure 5 Effects of different frozen temperatures on the sulfhydryl content |
活性巯基与肌原纤维蛋白、Ca2+-ATPase活性有着密切的联系。Benjakul等(2003) 认为,巯基含量下降是由于蛋白内部结构改变,巯基暴露氧化成二硫键所致。由于大量巯基和二硫键的存在,使得蛋白分子间的网络结构得到加强,肌原纤维蛋白发生变性,影响了肌原纤维蛋白的溶解性。此外,冻藏过程中巯基的氧化特别是位于肌球蛋白头部巯基的氧化进一步导致了Ca2+-ATPase活性的下降(Badii et al,2002)。
2.6 枪乌贼在冻藏过程中TBARS含量的变化脂肪氧化酸败是冻藏过程中水产品发生品质劣变的主要原因之一。硫代巴比妥酸还原值(TBARS值)可以准确反映脂质氧化程度。由图 6可知,3个温度下,枪乌贼TBARS值随冻藏时间的延长显著升高(P<0.05) 。冻藏第15天时,-20℃条件下冻藏的枪乌贼TBARS值显著高于-30℃和-50℃条件下的样品(P<0.01) 。这可能是由于冻藏过程中,-20℃冻结速率要远低于其他两个温度,形成的冰晶较大且分布不均匀,造成肌纤维细胞破裂氧化剂释放,加快了脂肪氧化。冻藏至第45天时,-30℃组和-50℃组冻藏鱿鱼的TBARS值有明显的增加,分别上升了82.46%、49.52%,但均极显著低于-20℃组(P<0.01) 。第90天时,在 -20℃、-30℃和-50℃条件下枪乌贼TBARS值分别增长至0.58 mg/kg、0.42 mg/kg和0.37 mg/kg,均没有超过脂肪酸败临界值1-2 mg/kg(迟海等,2011)。
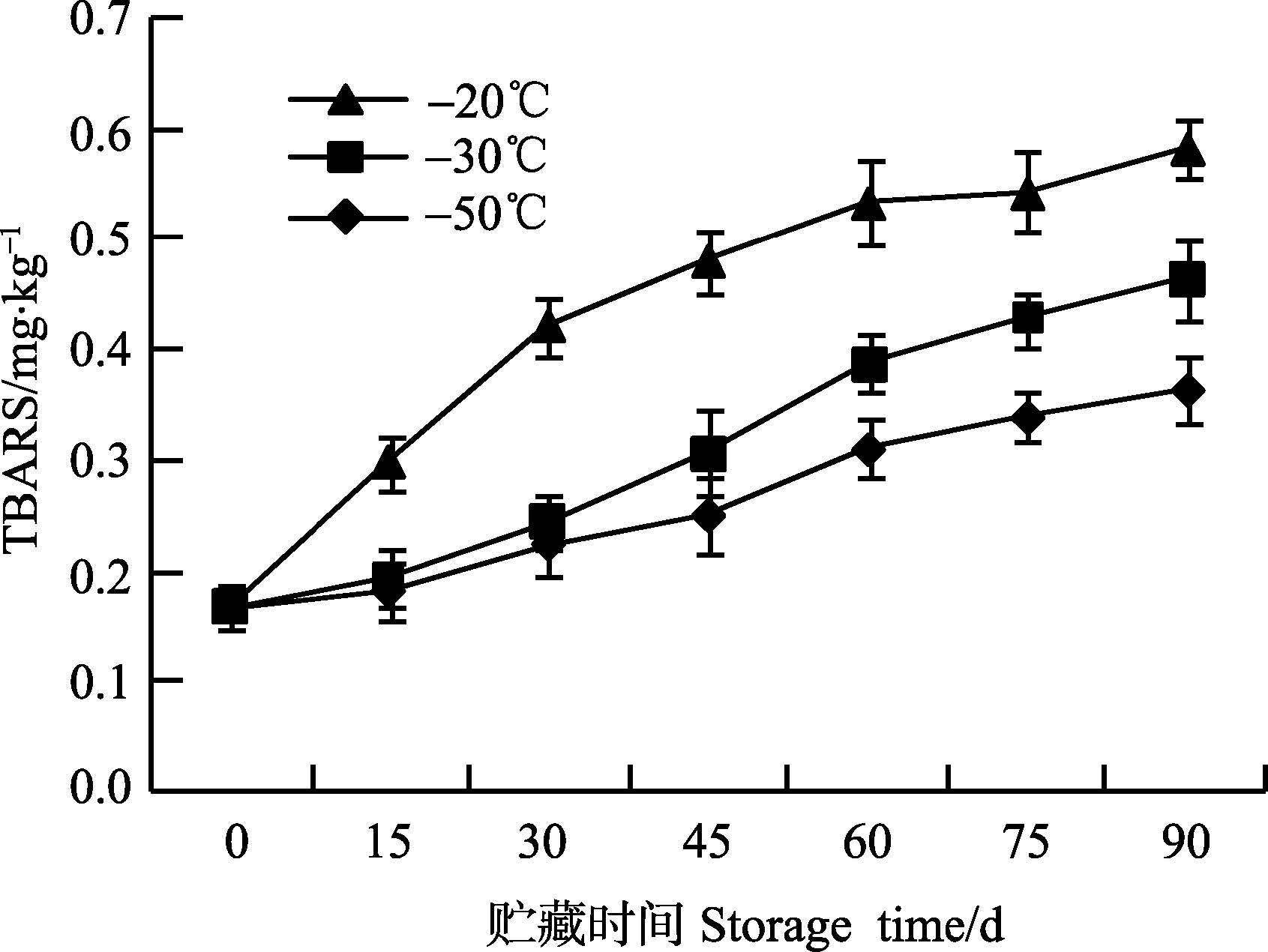
|
图 6 不同冻藏温度对TBARS值的影响 Figure 6 Effects of different frozen temperatures on the TBARS values |
枪乌贼TBARS值在冻藏过程中的变化规律与其他研究(Hong et al,2013)一致。肌肉纤维中冰晶逐渐升华,增加了氧气与脂肪的接触面积,促进了脂肪氧化的发生。胡亚芹等(2014) 研究表明,冻藏的温度不同,脂肪氧化速率存在显著差异;温度越低,对脂肪氧化的抑制效果越好。
2.7 枪乌贼在冻藏过程中肌肉组织形态变化从图 7可以看出,冻藏30 d内,-30℃、-50℃组枪乌贼肌肉的组织结构与新鲜枪乌贼样品相比,变化相差不大,肌纤维几乎没有间隙,肌纤维束结合紧密,无断裂现象存在,-20℃组,肌纤维间隙开始加大,肌纤维束发生轻微松散。到冻藏第60天,-20℃组的肌纤维间隙继续增大,与此同时,-30℃组的肌纤维束开始松散,但-50℃组肌肉组织结构依旧完好。冻藏第90天时,-20℃组枪乌贼的肌纤维分离程度进一步变大,轮廓变得模糊,且出现了一定程度的断裂;-50℃组的枪乌贼,其肌纤维也发生了轻微的分离,但-30℃和-50℃组的肌纤维并没有出现断裂现象,肌纤维形状较为完整。
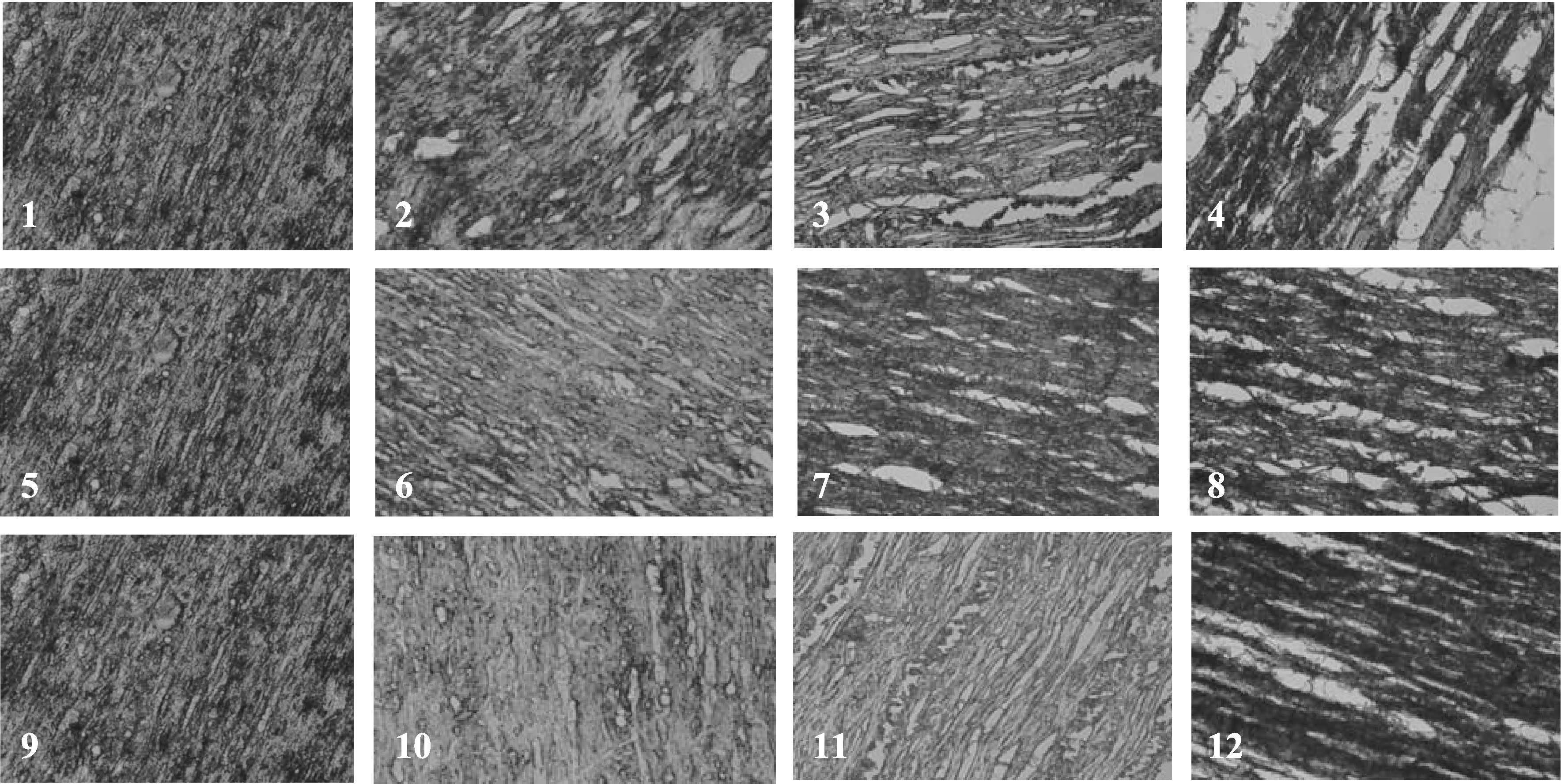
|
图 7 不同冻藏温度对肌肉组织结构的影响 Figure 7 Effects of different frozen temperatures on the structure of muscle tissues 冻藏温度和时间Storage temperature and time: 1. -20℃,0 d; 2. -20℃,30 d; 3. -20℃,60 d; 4. -20℃,90 d; 5.-30℃,0 d; 6. -30℃,30 d; 7. -30℃,60 d; 8. -30℃,90 d; 9. -50℃,0 d; 10. -50℃,30 d; 11. -50℃,60 d; 12. -50℃,90 d |
杨利艳(2012) 1) 对凡纳滨对虾在不同冻结方式下的肌肉组织结构进行研究时发现,不同的冻结方式对肌肉组织的影响较大,研究表明,在冻结过程中,冻结速率对肌肉组织结构产生较大影响,速率越慢,对肌肉结构的破坏程度越大。
1) 杨利艳. 冻结方式对凡纳滨对虾贮藏特性的影响. 广东海洋大学硕士研究生学位论文, 2012, 37-40
3 结论在冻藏过程中,随着时间的延长,枪乌贼的TVB-N值、TBARS值不断上升,肌原纤维蛋白含量、Ca2+-ATPase活性、巯基含量和感官评分呈不断下降趋势。在冻藏初期45 d内,除枪乌贼Ca2+-ATPase活性外,其他品质指标变化趋势较为平缓,而在60 d后,冻藏枪乌贼的各项指标有迅速变化。此外,冷冻贮藏枪乌贼对其肌肉组织结构和理化特性有显著影响。在不同的温度下,冻藏肌肉中冰晶均逐渐增大,脂质发生氧化,降低了枪乌贼的感官品质和营养价值,破坏了肌肉组织的微观结构,导致枪乌贼品质发生劣变。
不同冻藏温度对枪乌贼各项指标有不同程度的影响。总体上,冻藏的温度越低,枪乌贼的品质保持越好。在冻藏90 d内,-30℃和-50℃下冻藏枪乌贼的各项指标均优于-20℃。在相同的冻藏时间内,-20℃与其他两个温度相比,加速了枪乌贼脂质和蛋白质的氧化,使肉质变色,改变了肌原纤维蛋白的结构,降低了肌原纤维蛋白的功能特性,表明-30℃冻藏枪乌贼可较好地保持其品质,与-50℃相比又可降低能耗。
| 万建荣, 洪玉菁, 奚印慈, 等. 水产食品化学分析手册. 上海: 上海科学技术出版社, 1993 : 198 -202. | |
| 李艳萍, 李振兴, 郭晓华, 等. 鱿鱼丝质构及鲜度指标在加工中的动态变化. 中国渔业质量与标准 , 2014, 4 (5) : 1-5 | |
| 迟海, 杨峰, 杨宪时, 等. 不同解冻方式对南极磷虾品质的影响. 现代食品科技 , 2011, 27 (11) : 1291-1295 | |
| 胡亚芹, 胡庆兰, 杨水兵, 等. 不同冻结方式对带鱼品质影响的研究. 现代食品科技 , 2014, 30 (2) : 23-30 | |
| 陶欢, 陈舜胜. 3种淡水对虾在冻藏过程中蛋白质特性的变化. 水产学报 , 2010, 34 (3) : 389-394 | |
| 郭园园, 孔保华. 冷冻贮藏引起的鱼肉蛋白质变性及物理化学特性的变化. 食品科学 , 2011, 32 (7) : 335-340 | |
| 曾名勇, 黄海, 李八方. 不同冻藏温度对鲈鱼肌肉蛋白质生化特性的影响. 青岛海洋大学学报(自然科学版) , 2003, 33 (4) : 525-530 | |
| 路钰希, 李学英, 杨宪时, 等. 贮藏温度对鱿鱼品质变化的影响及其货架期分析. 食品工业科技 , 2013, 34 (14) : 318-321 | |
| Atayeter S, ErcoŞkun H. Chemical composition of European squid and effects of different frozen storage temperatures on oxidative stability and fatty acid composition. J Food Sci Technol , 2011, 48 (1) : 83-89 DOI:10.1007/s13197-010-0139-5 | |
| Badii F, Howell NK. Changes in the texture and structure of cod and haddock fillets during frozen storage. Food Hydrocolloids , 2002, 16 (4) : 313-319 DOI:10.1016/S0268-005X(01)00104-7 | |
| Benjakul S, Seymour TA, Morrissey MT, et al. Physicochemical changes in Pacific whiting muscle proteins during iced storage. J Food Sci , 1997, 62 (4) : 729-733 DOI:10.1111/jfds.1997.62.issue-4 | |
| Benjakul S, Visessanguan W, Thongkaew C, et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage. Food Res Int , 2003, 36 (8) : 787-795 DOI:10.1016/S0963-9969(03)00073-5 | |
| de Gonzalez MTN, Hafley BS, Boleman RM, et al. Antioxidant properties of plum concentrates and powder in precooked roast beef to reduce lipid oxidation. Meat Sci , 2008, 80 (4) : 997-1004 DOI:10.1016/j.meatsci.2008.04.014 | |
| Eymard S, Baron CP, Jacobsen C. Oxidation of lipid and protein in horse mackerel (Trachurus trachurus) mince and washed minces during processing and storage. Food Chem , 2009, 114 (1) : 57-65 DOI:10.1016/j.foodchem.2008.09.030 | |
| Hong H, Luo Y, Zhou Z, et al. Effects of different freezing treatments on the biogenic amine and quality changes of bighead carp (Aristichthys nobilis) heads during ice storage. Food Chem , 2013, 138 (2) : 1476-1482 | |
| Nurkhoeriyati T, Huda N, Ahmad R. Physicochemical properties and sensory analysis of duck meatballs containing duck meat surimi-like material during frozen storage. J Food Sci , 2012, 77 (1) : S91-S98 DOI:10.1111/j.1750-3841.2011.02519.x | |
| Özogul Y, Özogul F, Olgunoglu IA, et al. Bacteriological and biochemical assessment of marinating cephalopods, crustaceans and gastropoda during 24 weeks of storage. Int J Food Sci Nutr , 2007, 59 (6) : 465-476 | |
| Pan J, Shen H, Luo Y. Changes in salt extractable protein and Ca2+-ATPase activity of mince from silver carp (Hypophthalmi- chthys mollitrix) during frozen storage: a kinetic study. J Muscle Foods , 2010, 21 (4) : 834-847 DOI:10.1111/jmf.2010.21.issue-4 | |
| Paola AS, Isabel YM. Effect of frozen storage on biochemical changes and fatty acid composition of mackerel (Scomber japonicus) muscle. J Food Res , 2014, 4 (1) : 135 DOI:10.5539/jfr.v4n1p135 | |
| Ruiz-Capillas C, Moral A. Sensory and biochemical aspects of quality of whole bigeye tuna (Thunnus obesus) during bulk storage in controlled atmospheres. Food Chem , 2005, 89 (3) : 347-354 DOI:10.1016/j.foodchem.2004.02.041 | |
| Sriket P, Benjakul S, Visessanguan W, et al. Comparative studies on the effect of the freeze-thawing process on the physicochemical properties and microstructures of black tiger shrimp (Penaeus monodon) and white shrimp (Penaeus vannamei) muscle. Food Chem , 2007, 104 (1) : 113-121 DOI:10.1016/j.foodchem.2006.11.004 | |
| Vaz-Pires P, Seixas P, Mota M, et al. Sensory, microbiological, physical and chemical properties of cuttlefish (Sepia officinalis) and broadtail shortfin squid (Illex coindetii) stored in ice. LWT-Food Sci Technol , 2008, 41 (9) : 1655-1664 DOI:10.1016/j.lwt.2007.10.003 | |
| Wedemeyer WJ, Welker E, Narayan M, et al. Disulfidebonds and protein folding. Biochemistry , 2000, 39 (15) : 4207-4216 DOI:10.1021/bi992922o | |
| Xia X, Kong B, Liu J, et al. Influence of different thawing methods on physicochemical changes and protein oxidation of porcine longissimus muscle. LWT-Food Science and Technology , 2012, 46 (1) : 280-286 DOI:10.1016/j.lwt.2011.09.018 |



