2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
在细胞的胞吞和胞吐过程中,会在膜上形成不同的包被小泡,由不同的蛋白所包被,从而特异性地完成大分子及颗粒物质的运输,目前在细胞中发现3种不同类型的有被小泡:网格蛋白有被小泡,COPⅡ被膜小泡,COPⅠ被膜小泡。它们具有不同的物质运输作用,其中,COPⅠ被膜小泡主要负责将蛋白质由高尔基体运回到内质网中,包括将外侧和内侧高尔基体中的蛋白质运回到内质网,COPⅠ被膜小泡在高尔基体表面的形成主要是胞浆中两大部分的聚集,分别是ARF家族G蛋白和大小在550 kDa左右的coatomer复合体,其中,coatomer复合体由α、β、β´、γ、δ、ε、ζ 7个亚基共同组成(Waters et al,1991; Serafini et al,1991)。coatomer复合体通过ARF-GTP附着于膜的表面,然后组装形成笼型有被小泡(Bremser et al,1999; Nickel et al,1998)。目前,COPⅠ笼型结构的电子显微镜重建以及coatomer复合体的晶体结构已经被报道,coatomer复合体的7个亚基分别组合为两部分(βδ/γζ-COP和αβxε-COP),而coat-ε是其中比较小的亚基,coat-ε蛋白是酵母生长所必需的,它的缺失会造成coat-α的不稳定(Duden et al,1998)。
研究发现,COPⅠ不仅在高尔基体的物质运输中发挥作用,而且在细胞的内吞作用或内吞小泡的维持方面发挥作用(Styers et al,2008; Gabriely et al,2007)。COPⅠ在细胞表面受体的表达及细胞膜脂质成分的调节起到了重要作用(Misselwitz et al,2011)。Coatomer复合体功能的多样性为病毒利用这一复杂蛋白提供了机会。本研究通过cDNA末端快速扩增(Rapid amplification of cDNA end,RACE)法扩增出中国明对虾(Fenneropenaeus chinensis)coat-ε基因全序列,为进一步研究coat-ε基因表达蛋白甚至COPⅠ被膜小泡在各种病毒侵染过程中的作用打下基础。
1 材料与方法 1.1 材料实验用中国明对虾购自山东昌邑水产养殖公司,体长6 cm,经PCR检测不携带WSSV,在(22±1) ℃室温下的海水箱中暂养3 d。TRIzol试剂、pMD18-T载体、PrimeScript RT Reagent Kit with gDNA Eraser试剂盒购自TaKaRa,大肠埃希菌Top10感受态细胞购自TIANGEN公司,引物及测序均在上海生工生物技术有限公司完成,荧光定量PCR试剂盒购自Roche公司。
1.2 cDNA合成利用RNAiso Plus(TaKaRa)提取中国明对虾总RNA,经1%琼脂糖凝胶电泳查看RNA的提取效果,根据3´端RACE和5´端RACE的不同,3´端加入3´-CDS合成3´ RACE cDNA模板;5´端加入5´-Adapter,5´- CDS合成5´RACE cDNA模板。设计3´-和5´-RACE特异性引物(表 1),3´端第一次扩增以混合的UPM和Gsp1为引物,反应条件:94℃,5 min;94℃ 30 s,72℃ 2 min,5个循环;94℃ 30 s,70℃(68℃)30 s,72℃ 2 min,5个循环;94℃ 30 s,65℃ 30 s,72℃ 2 min,25个循环;72℃ 5 min,4℃。以第一次PCR产物为模板,以NUP和Gsp2为引物,进行巢式PCR,反应条件与第一步相同。5´端扩增在第一次扩增过程中以UPM和Gsp3为引物,巢式PCR扩增过程中以UPM和Gsp4为引物,反应条件与3´端相同。
|
|
表 1 引物序列 Table 1 Sequences of the primers |
3´-和5´-RACE扩增产物经1%琼脂糖凝胶电泳后,条带按照DNA回收试剂盒(TIANGEN)说明书切胶回收,将目的片段1 µl与pPMD18-T(TaKaRa)载体16℃连接30 min,取5 µl连接产物加入Top10感受态细胞中,置于冰上30 min,42℃热激60 s,将连接产物转化入感受态细胞中,加入750 µl LB液体培养基,37℃摇菌1 h,取100 µl菌液涂布在LB(Amp+,50 µg/ml)平板上,37℃培养14 h,挑取单菌落,接种于LB(Amp+,50 µg/ml)液体培养基,在摇床上培养4 h后,进行菌落PCR。经琼脂糖凝胶后,电泳条带正确的菌液送测序。
1.4 生物信息学分析经测序获得的结果通过DNAMAN进行比对、拼接。完成拼接的序列通过在线ORG Finder找出开放阅读框,运用Translate Tool将开放阅读框的核苷酸序列翻译为氨基酸序列,应用SignalP 3.0 Server预测氨基酸序列有无信号肽,用TMHMM Server v. 2.0软件预测氨基酸序列有无跨膜结构,用在线软件ProtParam tool分析氨基酸序列组成以及等电点和分子量,用PSORTⅡ Prediction预测蛋白的亚细胞定位,利用在线软件NPS Network Protein Sequence Analysis分析蛋白的二级结构,用三级结构预测软件SWISS-MODEL预测该蛋白的空间结构,应用BLAST比对同源氨基酸序列,并用MEGA 5.05构建系统发育树。
1.5 coat-ε基因的各组织表达分别取3只中国明对虾的附肢、肝胰腺、上皮、心脏、胃、肠、眼柄、肌肉、鳃、类淋巴、血淋巴组织,加入RNAiso,依照RNAiso试剂盒说明书提取RNA,采用1.0%琼脂糖凝胶电泳与紫外分光光度计分析提取RNA质量和完整性。使用PrimeScript RT Reagent Kit with gDNA Eraser试剂盒(TakaRa)将提取的RNA反转录为cDNA,-20℃保存备用。以得到的cDNA稀释10倍为模板,分别用β-actin(内参)、coat引物进行荧光定量PCR(表 1)。qPCR反应体系包括SYBR Premix Ex TaqTM(2×)12.5 µl,cDNA模板1 µl,上下游引物各0.5 µl(10 µmol/L),DEPC处理水10.5 µl。PCR反应条件:94℃,5 min;94℃ 30 s,58℃ 30 s,72℃ 30 s,40 个循环;65℃ 5 s,95℃ 50 s。
利用Bio-Rad CFX Connect自带软件,采用2-DDCt法计算coat-ε基因的相对表达量,以肝胰腺coat-ε转录表达作为标准1。
2 结果 2.1 coat-ε基因全序列分析根据3´端和5´端RACE得到的目的片段测序结果拼接,得出coat-ε基因序列全长为1402 bp,其中,5´非编码区(UTR)84 bp,3´非编码区(UTR)310 bp,通过在线ORF Finder找出开放阅读框(ORF)1008 bp,编码335个氨基酸。在3´非编码区内有加尾信号(AAATAA),且3´末端具有polyA尾巴。经过DNAMAN将coat-ε基因序列开放阅读框预测编码氨基酸序列(图 1)。全长序列提交GenBank数据库(No: KT253584) 。
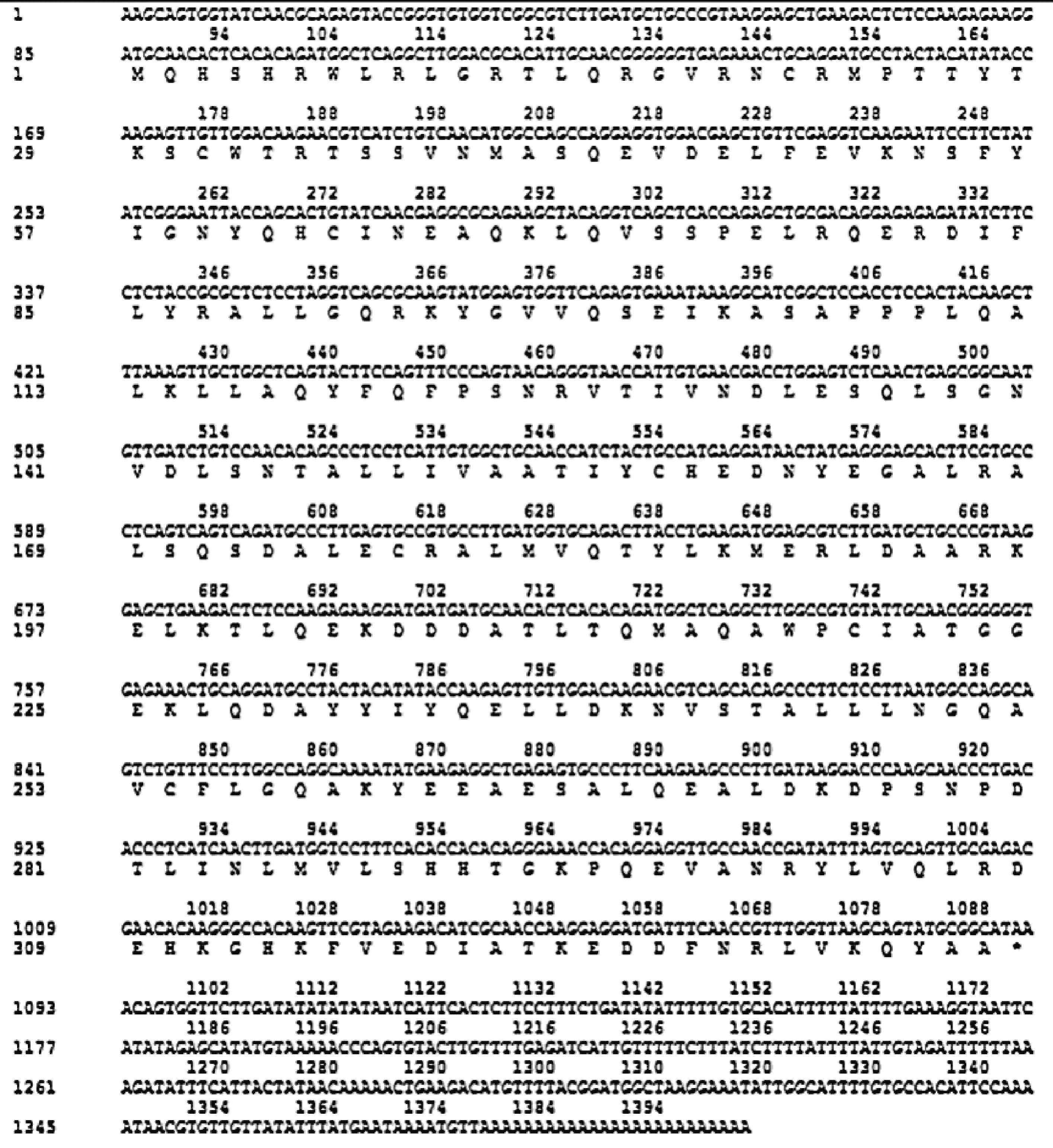
|
图 1 中国明对虾coat-ε基因全长cDNA序列及相应的氨基酸序列推测 Figure 1 Predicted amino acid sequences of coat-ε cDNA in F. chinensis |
将中国明对虾coat-ε基因编码的氨基酸序列使用BLAST进行同源性分析,发现其与欧洲熊蜂的同源性最高(图 2)。中国明对虾coat-ε基因编码的氨基酸在230-300之间属于TPR超家族(图 3),该蛋白质的等电点为5.95,分子量为38143.25 Da,此氨基酸序列没有信号肽和跨膜结构,带负电荷的氨基酸(Asp+ Glu)43个,占总蛋白的12.8%,带正电荷氨基酸(Arg + Lys)有38个,占总蛋白的11.3%,蛋白序列中有7个半胱氨酸,不稳定指数为40.51,是一种不稳定蛋白,脂溶性为87.4,总平均亲水性为-0.468。预测蛋白质亚细胞定位于线粒体的可能性为78.3%,细胞质的可能性为17.4%,内质网的可能性为4.3%,内质网上的保留信号为:在C末端有KKXX-类似的序列,而在该序列中C末端为KQYA。二级结构分析显示,coat-εα螺旋占比例很高,为55.52%,β-转角占7.46%,延伸链占10.75%(图 4)。预测的中国明对虾coat-ε蛋白的空间结构模型见图 5。

|
图 2 中国明对虾coat-ε氨基酸序列与其他物种coat-ε氨基酸序列的比较 Figure 2 Multiple alignments of amino acid sequences of coat-ε in F. chinensis and other species 各物种coat-ε序列登录号: 欧洲熊蜂(XP012169272.1) 、毕氏粗角蚁(XP011333357.1) 、 佛州文昌鱼(XP002586747.1) 、长牡蛎(XP011436400.1) The GenBank accession numbers of coat-ε: Bombus terrestris(XP012169272.1) ,Cerapachys biroi(XP012169272.1) , Branchiostoma floridae(XP002586747.1) ,Crassostrea gigas(XP011436400.1) |

|
图 3 预测的中国明对虾coat-ε蛋白功能域 Figure 3 Putative conserved domains of coat-ε in F. chinensis |
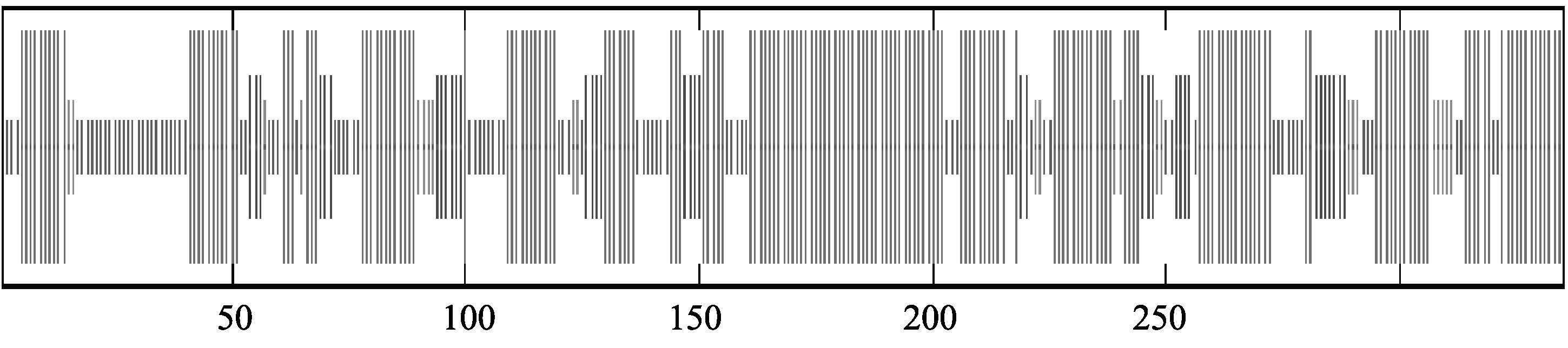
|
图 4 coat-ε蛋白二级结构分析 Figure 4 Secondary structure analysis of coat-ε |

|
图 5 coat-ε蛋白的空间结构模型 Figure 5 The spatial structure of coat-ε protein |
通过coat-ε全基因的开放阅读框翻译,得出预测的氨基酸序列,将此序列输入到NCBI的protein blast序列框中,比对得出同源的氨基酸序列。结果显示,中国明对虾coat-ε氨基酸序列与欧洲熊蜂(Bombus terrestris)、毕氏粗角蚁(Cerapachys biroi)、木蚁(Camponotus floridanus)、爪蟾(Xenopus laevis)、佛州文昌鱼(Branchiostoma floridae)、长牡蛎(Crassostrea gigas)等的相似性分别为64%、63%、62%、59%、58%、57%。从基于MEGA 5.05建立的系统发育树可以看出(图 6),该基因进化过程中与膜翅目的蜂、蚁的亲缘关系相近,它们都属于节肢动物门,而与野猪、骆驼等哺乳动物的亲缘关系相对远一些。

|
图 6 不同物种coat-ε氨基酸序列的系统进化树 Figure 6 Phylogenetic tree based on coat-ε amino acids of different species 野猪(XP003123584.1) 、野骆驼(XP006186292.1) 、星鼻鼹(XP004688653.1) 、非洲象(XP003413572.1) 、灰短尾负鼠(XP001363383.1) 、爪蟾(NP001085327.1) 、雀鳝(XP006640066.1) 、佛州文昌鱼(XP002586747.1) 、中国明对虾、欧洲熊蜂(XP012169272.1) 、苜蓿切叶蜂(XP003699284.2) 、毕氏粗角蚁(XP011333357.1) 、木蚁(XP011267506.1) Sus scrofa(XP003123584.1) ,Camelus ferus(XP006186292.1) ,Condylura cristata(XP004688653.1) ,Loxodonta Africana(XP003413572.1) ,Monodelphis domestica(XP001363383.1) ,Xenopus laevis(NP001085327.1) ,Lepisosteus oculatus(XP006640066.1) ,Crassostrea gigas(XP011436400.1) ,Branchiostoma floridae(XP002586747.1) ,Fenneropenaeus chinensis,Bombus terrestris(XP012169272.1) ,Megachile rotundata(XP003699284.2) ,Cerapachys biroi(XP011333357.1) , Camponotus floridanus(XP011267506.1) |
通过Real-time PCR技术分析coat-ε mRNA在中国明对虾不同组织中的表达,结果显示,coat-ε基因在中国明对虾的这11个组织中均有表达(图 7),其中,在肌肉、鳃、附肢中的表达量最高。经统计分析,除鳃之外,肌肉与附肢中的表达量差异显著(P<0.05) ,与其他组织的差异均极显著(P<0.01) 。
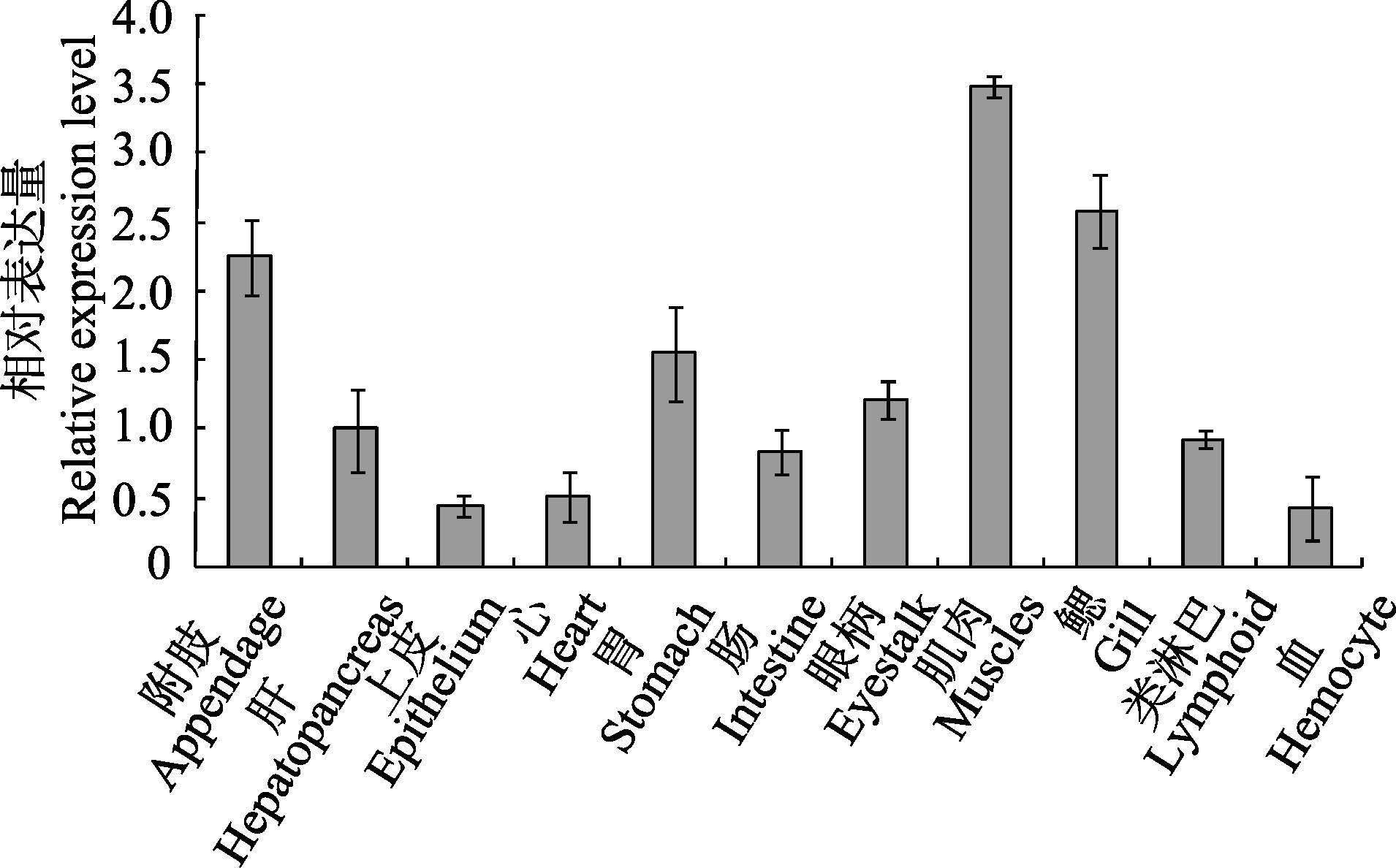
|
图 7 中国明对虾coat-ε基因在各组织的分布 Figure 7 Tissues distribution of F. chinensis coat-ε |
目前,在节肢动物门的蚂蚁、蜜蜂及脊椎动物亚门的野猪、野骆驼等的coat-ε基因的全长已经克隆,而在甲壳动物中的报道非常少。本研究首次克隆出中国明对虾的coat-ε基因全长,所表达的蛋白是coatomer复合体的一个小亚基,coat-ε基因编码的蛋白无跨膜区和信号肽,亚细胞定位预测其是一种胞内蛋白,可能在细胞内发挥各种功能。从构建的系统发育树可以发现,中国明对虾与欧洲熊蜂、苜蓿切叶蜂、毕氏粗角蚁、木蚁聚为一类,它们都属于节肢动物门,与其他脊索动物门的野骆驼、佛周文昌鱼等聚类关系都较远,而且在同源性方面与其他种类的相似性均在60%-50%左右,说明在进化过程中保守性不高。转录分析显示其在肌肉、鳃和附肢组织有较高的分布。
coat-ε基因表达的蛋白是组成coatomer复合体的βδ/γζ-COP必不可少的,虽然对于COPⅠ普遍认为是将内质网上的逃逸蛋白从高尔基体运回到内质网,但是许多研究发现其还存在很多其他功能,例如通过未感染细胞的COPⅠ功能的研究发现,COPⅠ在病毒的复制中发挥着一定作用,通过siRNA干扰实验发现,COPⅠ在牛痘、脊髓灰质炎和流感病毒的复制中起作用(Zhang et al,2009; Cherry et al,2006; Konig et al,2010)。通过更深一步的研究发现,COPⅠ在病毒的生活周期中起着多种作用,包括病毒的入侵、RNA的复制和病毒的胞内运输。通过COPⅠ的4个亚基的RNA干扰实验,发现它们是流感病毒在体内复制的重要因素(Konig et al,2010)。细胞中缺乏coat-ε会使疱疹性口炎(Vesicular stomatitis,VSV)和塞姆利基森林病毒(Semliki Forest viruses)的感染降低(Daro et al,1997),并且在进一步的RNA干扰试验中印证了这一结论(Cureton et al,2012)。coat-ε基因是否参加对虾病毒感染过程尚不清楚,本研究所获得的coat-ε基因全长为研究COPⅠ在对虾病毒感染中的作用提供基础。
| Bremser M, Nickel W, Schweikert M, et al. Coupling of coat assembly and vesicle budding to packaging of putative cargo receptors. Cell , 1999, 96 (4) : 495-506 DOI:10.1016/S0092-8674(00)80654-6 | |
| Cherry S, Kunte A, Wang H, et al. COPI activity coupled with fatty acid biosynthesis is required for viral replication. PLoS Pathogens , 2006, 2 (10) : 900-912 | |
| Cureton DK, Burdeinick-Kerr R, Whelan SPJ. Genetic inactivation of COPI coatomer separately inhibits vesicular stomatitis virus entry and gene expression. J Virol , 2012, 86 (2) : 655-666 DOI:10.1128/JVI.05810-11 | |
| Daro E, Sheff D, Gomez M, et al. Inhibition of endosome function in CHO cells bearing a temperature-sensitive defect in the coatomer (COPⅠ) component ε-COP. J Cell Biol , 1997, 139 (7) : 1747-1759 DOI:10.1083/jcb.139.7.1747 | |
| Duden R, Kajikawa L, Wuestehube L, et al. ε-COP is a structural component of coatomer that functions to stabilize ?-COP. EMBO J , 1998, 17 (4) : 985-995 DOI:10.1093/emboj/17.4.985 | |
| Fuhrman JA. Marine viruses and their biogeochemical and ecological effects. Nature , 1999, 399 (6736) : 541-8 DOI:10.1038/21119 | |
| Gabriely G, Kama R, Gerst JE. Involvement of specific COPⅠ subunits in protein sorting from the late endosome to the vacuole in yeast. Mol Cell Biol , 2007, 27 (2) : 526-540 DOI:10.1128/MCB.00577-06 | |
| Konig R, Stertz S, Zhou Y, et al. Human host factors required for Influenza virus replication. Nature , 2010, 463 (7282) : 813-817 DOI:10.1038/nature08699 | |
| Misselwitz B, Dilling S, Vonaesch P, et al. RNAi screen of Salmonella invasion shows role of COPI in membrane targeting of cholesterol and CDC42. Mol Sys Biol , 2011, 7 (1) : 474 | |
| Nickel W, Malsam J, Gorgas K, et al. Uptake by COPI-coated vesicles of both anterograde and retrograde cargo is inhibited by GTPgammaS in vitro. J Cell Sci , 1998, 111 (5) : 3081-3090 | |
| Serafini T, Orci L, Amherdt M, et al. ADP-ribosylation factor is a subunit of the coat of Golgi-derived COP-coated vesicles: a novel role for a GTP-binding protein. Cell , 1991, 67 (2) : 239-253 DOI:10.1016/0092-8674(91)90176-Y | |
| Styers ML, O’Connor AK, Grabski R, et al. Depletion of beta-COP reveals a role for COP-I in compartmentalization of secretory compartments and in biosynthetic transport of caveolin-1. Am J Physiol Cell Physiol , 2008, 294 (6) : 1485-1498 DOI:10.1152/ajpcell.00010.2008 | |
| Waters MG, Serafini T, Rothman JE. ‘Coatomer’: a cytosolic protein complex containing subunits of non-clathrin-coated Golgi transport vesicles. Nature , 1991, 349 (6306) : 248-251 DOI:10.1038/349248a0 | |
| Zhang L, Lee SY, Beznoussenko GV, et al. A role for the host coatomer and KDEL receptor in early vaccinia biogenesis. Proc Natl Acad Sci , 2009, 106 (1) : 163-168 DOI:10.1073/pnas.0811631106 |



