2. 广东省水产经济动物病原生物学及流行病学重点实验室 湛江 524088;
3. 广东绿百多生物科技有限公司 湛江 524022
2. Guangdong Province Key Laboratory of Pathogen Biology and Epidemiology of Aquatic Economic Animals, Zhanjiang 524088 ;
3. Guangdong Lvbaiduo Biotechnology Company, Zhanjiang 524022
正常生理状态下,鱼类的消化道中寄生着数量庞大、种类多样的菌群,它们形成复杂的微生态系统,与鱼体之间形成互利共生的关系,这是各种生物在漫长进化过程中相互适应的结果。鱼体消化道中各菌群比例的相对平衡,对维持其内环境稳态和应答病原入侵等都起着重要的作用(宋增福等,2007)。益生菌制剂以其无毒性、无残留、无耐药性、低成本,并可有效补充动物消化道内的有益菌群、调节微生态平衡,从而促进养殖动物生长、提高其抗病力等特点,被公认为是理想的抗生素替代品(向枭等,2000)。而中草药含有多种营养成分,如蛋白质、氨基酸、维生素、多糖类、常量和微量元素等,能够提高机体的特异性和非特异性免疫力,在一定程度上会影响肠道菌群组成和数量(田海军等,2005),还有一些未知的促生长活性物质。因此,中草药制剂在水产养殖领域具有广阔的应用前景(向枭等,2000)。而有关中草药益生菌联合使用在畜禽上的研究较多(王永芬等,2011; 赵乐乐等,2013; 田浪等,2015),在水产方面的研究报道仅见于凡纳滨对虾(Litopenaeus vannamei)(文国樑等,2009; 于明超等,2010; 马良骁等,2013; 王振怀等,2005)、吉富罗非鱼(Oreochromis niloticus)(汤保贵等,2007)和建鲤(Cyprinus carpiovar Jian)(肖拉,2012)1) ,但上述研究均为在饲料中联合添加益生菌和中草药,而用复合益生菌发酵中草药,形成中草药复合微生态制剂产品添加到饲料中,应用到罗非鱼养殖中的研究尚未见报道。本研究即采用此种方法,获得中草药复合微生态制剂后,添加到罗非鱼基础饲料中,经过一段时间的投喂,测定其对吉富罗非鱼生长、肠道菌群和抗病力等指标的影响,为中草药复合微生态制剂在罗非鱼养殖业中的推广应用提供一定的理论基础。
1) 肖拉. 枯草芽孢杆菌JS01和黄芪多糖对建鲤生长及免疫功能的影响. 四川农业大学硕士研究生学位论文,2012
1 材料与方法 1.1 吉富罗非鱼与无乳链球菌吉富罗非鱼苗由高州朗业畜牧渔业科技养殖公司提供。挑选同批同龄、体格健硕、规格整齐、平均体重为19.5±0.5 g的鱼苗作为试验用鱼。暂养与养殖实验均在高州朗业畜牧渔业科技养殖公司提供的15个水泥池中进行,每个水泥池的规格为8.0 m(长)× 5 m(宽)×1.0 m(高),水深0.8 m。暂养期间投喂商品罗非鱼饲料,7 d后进行随机分组实验。无乳链球菌由本实验室提供。
1.2 中草药复合微生态制剂中草药(ZL 200910132065.0) 由本实验室提供,菌种由广东绿百多生物科技有限公司提供。芽孢杆菌制剂由3株芽孢杆菌(纳豆、枯草、地衣)组成,中草药芽孢杆菌制剂由中草药经3株芽孢杆菌发酵而成,复合微生态制剂由3株芽孢杆菌、粪肠球菌和嗜酸乳杆菌等比例混合而成,中草药复合微生态制剂由中草药经混合菌发酵而成(混合菌由3株芽孢杆菌、粪肠球菌和嗜酸乳杆菌组成)。
1.3 实验设计将暂养后的吉富罗非鱼随机分到15个水泥池中,每池200尾;实验共分为5组,标记为A、B、C、D、E组,每组3个重复,分别饲喂基础饲料和实验饲料(表 1)。
|
|
表 1 实验饲料 Table 1 Design of experimental feeds |
按1.3设计的方案投喂相应饲料,早晚各投饵1次,每天饲料投喂量按罗非鱼体重的3%-5%计。根据实验鱼的实际生长情况,每7 d对投喂量进行适当调整。全过程不间断充气增氧,使用经消毒、过滤处理的地下水,每7 d换水清污1次,水温为(28.5±1.5) ℃,试验周期为56 d。
1.5 样品采集和处理养殖实验结束后(第57天),先对各个池中的罗非鱼进行计数、称重,然后从每个池中随机挑取10尾鱼,用酒精对其体表进行消毒处理后,在超净工作台上采集肠道。各池中采集10尾鱼肠道混合成一个样品,放入灭菌的10 ml离心管中待测。
1.6 生长指标测定生长指标按下面公式计算:
成活率(%)=试验结束时收鱼尾数×100/试验开始时放鱼尾数
增重率(%)=(终末体重-初始体重)×100/初始体重
饲料系数(FCR)=摄食量/(终末体重-初始体重)
1.7 肠道细菌测定肠道菌群测定以及方法如表 2所示。
|
|
表 2 肠道菌群测定所用培养基及培养方法 Table 2 Cultural mediums and methods for intestinal flora |
养殖实验结束后(第57天),分别从A、B、C、D和E组的每个池中随机抽取20尾鱼,用浓度为1×108 CFU/ml无乳链球菌活菌悬液进行腹腔注射感染,注射剂量为0.1 ml/尾,观察14 d,同时记录试验鱼在感染过程中的发病和死亡情况,对濒临死亡的试验鱼进行解剖和病原分离,以确定实验鱼是否为感染无乳链球菌而死亡。
死亡率(%)=(死亡鱼体尾数/试验初鱼体尾数)× 100%
免疫保护率(%)=(1-试验组死亡率/对照组死亡率)×100%
1.9 数据处理用SPSS 19.0分析软件对试验数据进行单因素方差分析处理,实验结果均以平均值±标准差(Mean±SD)表示,若存在显著性差异,则进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果 2.1 中草药复合微生态制剂对吉富罗非鱼生长性能指标的影响中草药复合微生态制剂对吉富罗非鱼生长性能指标的影响见表 3。B、C、D、E 4个实验组罗非鱼成活率分别比对照组A提高了2.33%、3.12%、3.38%和3.90%,增重率分别比对照组A提高了20%、46%、39.03%、46.20%和63.50%,饲料系数分别比对照组A降低了1.65%、3.31%、4.96%和7.44%。研究结果表明,饲料中添加一定量的芽孢杆菌制剂、中草药芽孢杆菌制剂、复合微生态制剂和中草药复合微生态制剂均可以显著提高罗非鱼的增重率(P<0.05) ,成活率、饲料利用率也有一定程度的提高,但影响不显著(P>0.05) 。中草药复合微生态制剂对罗非鱼的促生长效果最佳。
|
|
表 3 中草药复合微生态制剂对吉富罗非鱼的 生长及饲料利用的影响 Table 3 Effects of probiotics combined with Chinese herbal medicine on the growth and feed utilization of Nile tilapia |
中草药复合微生态制剂对吉富罗非鱼肠道菌群的影响见表 4。B、C、D、E 4个实验组罗非鱼肠道中的细菌总数、芽孢杆菌数量、乳酸杆菌数量和双歧杆菌数量均显著高于对照组A(P<0.05) ,大肠杆菌数量显著低于对照组(P<0.05) 。说明饲料中添加一定量的微生态制剂、中草药微生态制剂均可以改善罗非鱼的肠道菌群结构,以中草药复合微生态制剂的改善效果最佳。
|
|
表 4 中草药复合微生态制剂对吉富罗非鱼肠道菌群的影响 Table 4 Effects of probiotics combined with Chinese herbal medicine on the intestinal flora of Nile tilapia |
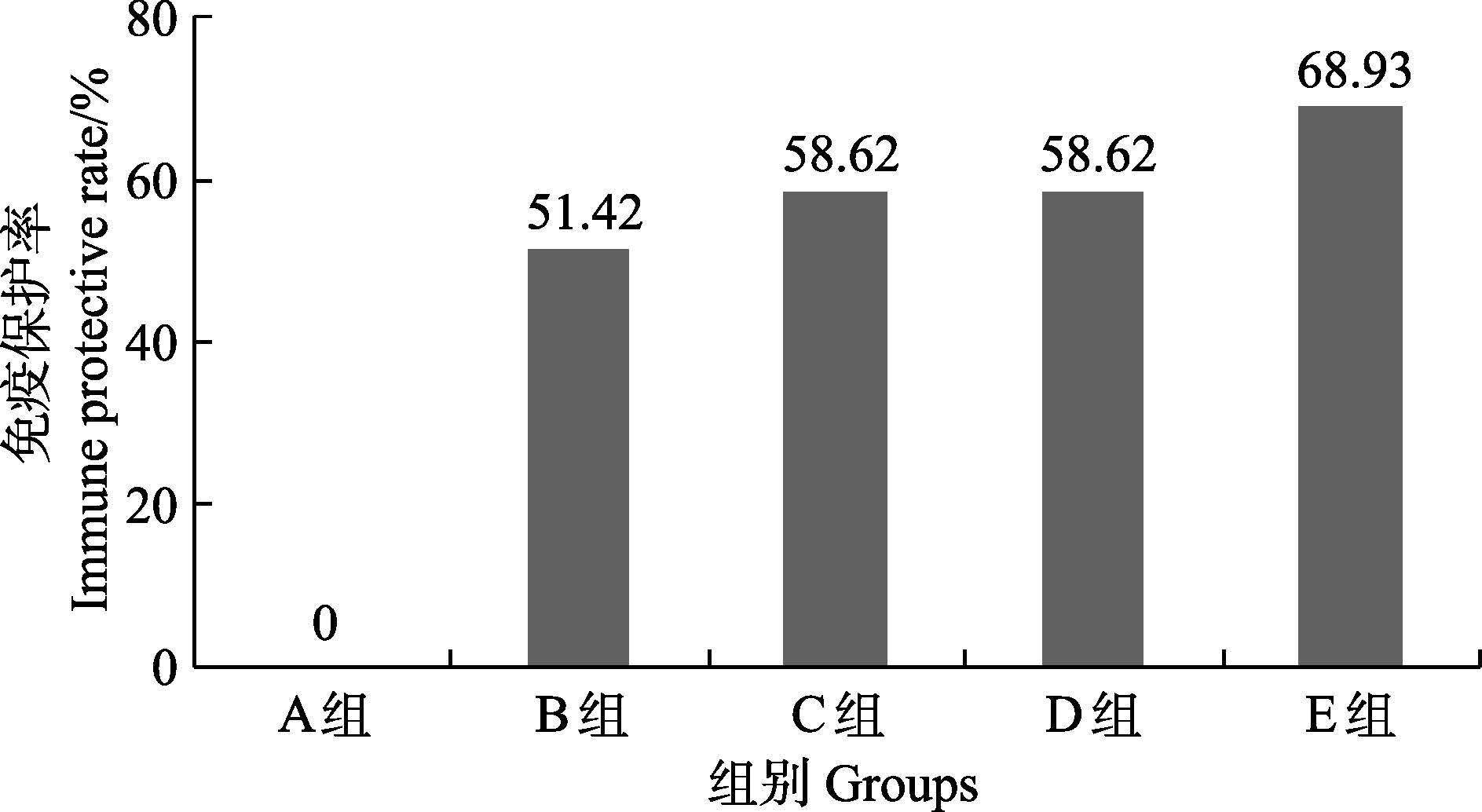
经腹腔注射感染无乳链球菌后,对照组A的罗非鱼全部死亡,B、C、D、E 4个实验组的吉富罗非鱼有部分死亡(图 1)。通过鉴定发现,吉富罗非鱼的死亡都是由于感染无乳链球菌所致,因此,数据可以用于免疫保护率的计算。最终得出免疫保护率:E组(68.93%)> D组>C组(58.62%)>B组(51.42%),E组免疫保护率最高。
|
图 1 中草药复合微生态制剂对吉富罗非鱼感染 无乳链球菌后免疫保护率的影响 Figure 1 Effects of probiotics combined with Chinese herbal medicine on the immune protective rate of Nile tilapia after infection with Streptococcus agalactiae |
于明超等(2010) 在饲料中添加中草药和芽孢杆菌能促进对虾的生长,且二者联合应用的效果好于单独使用。汤保贵等(2007) 发现,微生物和中草药联合制剂能显著促进罗非鱼幼鱼生长和提高饲料的利用率。韩亚超等(2014) 在饲料中添加中草药复合微生态制剂后,仔猪的增重率和料肉比等指标均优于抗生素组和复合益生菌组。本研究结果显示,饲料中添加芽孢杆菌制剂、中草药芽孢杆菌制剂、复合益生菌制剂和中草药复合微生态制剂均能够促进吉富罗非鱼的生长性能,且添加中草药复合微生态制剂组的促生长效果最好。此结果与汤保贵等(2007) 、于明超等(2010) 和韩亚超等(2014) 的研究结果相符,也进一步证明中草药和益生菌联合使用可以产生协同增效作用(丁轲等,2004)。中草药富含多种营养物质和一些未知的诱食因子,可以增强养殖动物的食欲,促进机体代谢和消化酶的分泌,提高营养物质的利用率,从而加速养殖动物的生长发育、降低饲料系数(宋世民,2013)。另一方面,益生菌制剂中的芽孢杆菌和乳酸杆菌可以产生多种消化酶类(肖拉,2012)1) ,可提高动物消化道内消化酶的生物活性,促使动物机体可以更好地消化和吸收胃肠道中的营养物质,提高饲料利用率。此外,乳酸杆菌还可分解转化饲料中一些机体难以吸收的有机物质,将一些糖类发酵成乳酸,使动物肠道中的pH值降低,进而形成酸性的内部环境,有利于动物机体对钙、铁等矿物质和维生素的吸收和利用,从而促进了罗非鱼的生长。
1) 肖拉. 枯草芽孢杆菌JS01和黄芪多糖对建鲤生长及免疫功能的影响. 四川农业大学硕士研究生学位论文,2012
3.2 中草药复合微生态制剂对吉富罗非鱼肠道菌群的影响正常肠道微生物菌群在机体内构成了一道天然屏障,对动物的营养、生长、健康、防病、免疫等方面起着重要作用(郭兴华,2002)。而芽孢杆菌的生长繁殖需求大量氧气,能够在水生动物的肠道中形成利于优势菌(双歧杆菌和乳酸杆菌)繁殖的厌氧环境,从而有利于厌氧菌(乳酸杆菌、双歧杆菌)的生长繁殖,并减少好氧致病菌如大肠杆菌的数量。本研究在饲料中添加4种微生态制剂后可以明显提高罗非鱼肠道乳酸杆菌、双歧杆菌和芽孢杆菌的数量,而大肠杆菌的数量明显减少,这与其他学者在鲫鱼、草鱼和凡纳滨对虾上的研究结果相符(尹军霞等,2007; 沈涛等,2012; 胡毅等,2008)。中草药复合微生态制剂对罗非鱼肠道菌群的改善效果最为明显,这可能与所选择的中草药为补益类药物,富含双歧生长因子有关;此外,芽孢杆菌的生长会耗尽罗非鱼肠道中的氧气,有利于乳酸杆菌和双歧杆菌的生长繁殖,中药发酵过程产生的一些有机酸也能促进乳酸杆菌生长,抑制病原菌的生长繁殖。因此,推测中草药复合微生态制剂产生了比单一使用中草药或益生菌更好的效果。
3.3 中草药复合微生态制剂对吉富罗非鱼抗病力的影响肠道细菌可提高宿主免疫机能,能在宿主肠道内表面形成生物保护膜,抵抗外来病原菌的入侵、定植,可刺激机体产生“自然抗体”拮抗作用,减少宿主对有害物质的吸收。此外,乳酸菌的一些代谢产物对抑制病原菌及腐败菌、提高免疫力等也有重要作用(胡毅等,2008)。李桂英等(2011) 研究发现,在饲料中添加肠道益生菌及其灭活菌体,能提高南美白对虾的免疫应答水平和抗病力。Salinas等(2008) 在饲料中添加灭活的德式乳酸杆菌和枯草芽孢杆菌可以显著增加乌颊鱼体液中自然补体含量,增强非特异性免疫功能,提高其抗病力。温俊(2008) 在基础饲料配方中分别添加黄霉素和合生素后,罗非鱼机体的吞噬活力和血清补体活力均显著高于对照组(P<0.05) 。本研究结果表明,在饲料中添加4种益生菌制剂后均可提高吉富罗非鱼的抗病能力,这与李桂英等(2011) 、Salinas等(2008) 和温俊(2008) 的研究结果相符,且中草药复合微生态制剂组的免疫保护率要好于其他实验组,表明中草药联合益生菌群发酵后的使用效果对罗非鱼的免疫保护率更优。本研究首次使用复合益生菌发酵中草药后在罗非鱼中进行试验应用,该种制剂对罗非鱼的生长性能、肠道菌群和抗病力方面都有很好的效果,这为中草药复合微生态制剂在水产养殖领域的应用提供了一定的理论与实践基础。
| 丁轲, 倪学勤, 潘康成, 等. 益生菌与协同剂的协同效应研究. 兽药与饲料添加剂 , 2004, 9 (4) : 17-19 | |
| 于明超, 李卓佳, 林黑着, 等. 饲料中添加芽孢杆菌和中草药制剂对凡纳滨对虾生长及肠道菌群的影响. 热带海洋学报 , 2010, 29 (4) : 132-137 | |
| 马良骁, 冯宪斌, 韦新兰, 等. 微生态制剂联合中草药制剂在南美白对虾高位池养殖应用. 海洋与渔业 , 2013 (9) : 98-100 | |
| 王永芬, 乔宏兴, 席磊, 等. 益生菌-黄芪复合生物制剂的制备及其对肉仔鸡的影响. 中国农业大学学报 , 2011, 16 (1) : 54-59 | |
| 王振怀, 高才全, 李春岭, 等. 微生物和中药制剂在南美白对虾养殖中的应用试验. 河北渔业 , 2005 (2) : 30 | |
| 文国樑, 于明超, 李卓佳, 等. 饲料中添加芽孢杆菌和中草药制剂对凡纳滨对虾免疫功能的影响. 上海海洋大学学报 , 2009, 18 (2) : 181-186 | |
| 尹军霞, 陈瑛, 孟丽丽. 益生菌剂对鲫鱼肠道菌群影响的初步研究. 水产科学 , 2007, 26 (11) : 610-613 | |
| 田海军, 郑曙明. 中草药与鱼体肠道菌群的相互影响. 水利渔业 , 2005, 25 (4) : 94-95 | |
| 田浪, 魏文康, 魏堂鸿, 等. 中草药-益生菌复合制剂对断奶仔猪生产性能的影响. 黑龙江畜牧兽医 , 2015 (5) : 197-199 | |
| 向枭, 周兴华. 中草药添加剂在水产养殖上的作用. 粮食与饲料工业 , 2000 (3) : 27-29 | |
| 汤保贵, 孙建华. 微生物和中草药联合制剂对罗非鱼生长和水质的影响. 水利渔业 , 2007, 27 (4) : 62-63 | |
| 李桂英, 宋晓玲, 孙艳, 等. 几株肠道益生菌对凡纳滨对虾非特异免疫力和抗病力的影响. 中国水产科学 , 2011, 18 (6) : 1358-1367 | |
| 沈涛, 邓斌, 陈南南. 饲料中添加复合芽孢杆菌对草鱼消化道酶活性及肠道菌群的影响. 淡水渔业 , 2012, 42 (1) : 41-46 | |
| 宋世民. 中草药饲料添加剂在水产养殖中的应用. 农村养殖技术 , 2013 (6) : 37 | |
| 宋增福, 吴天星. 鱼类肠道正常菌群研究进展. 水产科学 , 2007, 26 (8) : 471-474 | |
| 赵乐乐, 陈鲁勇, 陈颖超, 等. 益生菌和中草药添加剂对北京油鸡屠体性状和肉品质的影响. 上海交通大学学报(农业科学版) , 2013, 31 (2) : 40-43 | |
| 胡毅, 谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响. 中国水产科学 , 2008, 15 (2) : 245-251 | |
| 郭兴华. 益生菌基础与应用. 北京: 北京科学技术出版社, 2002 : 124 . | |
| 韩亚超, 何永高, 张新红, 等. 中草药复合微生态制剂对断奶仔猪生长性能指标和血液生化指标的影响. 江苏农业科学 , 2014, 42 (8) : 218-221 | |
| 温俊. 合生素对罗非鱼非特异性免疫力的影响. 饲料研究 , 2008 (8) : 69-70 | |
| Salinas I, Abelli L, Bertoni F. Monospecies and multispecies probiotic formulations produce different systemic and local immunostimulatory effects in the gilthead seabream (Sparus aurata L.). Fish Shellfish Immunol , 2008, 25 (1-2) : 114-123 DOI:10.1016/j.fsi.2008.03.011 |



