2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
热激蛋白(Heat shock proteins, HSPs)是一类在进化上高度保守的蛋白,广泛存在于生物体中。根据同源性和分子量大小,HSPs可分为Hsp110、Hsp100、Hsp90、Hsp70、Hsp60、Hsp40和小分子Hsp (sHsp)家族(Feder et al, 1999)。生物体细胞受到环境高温、缺氧、饥饿、病原感染、重金属、农药等各种刺激时,会激活HSPs的表达和合成,作为分子伴侣抑制细胞凋亡,保护细胞及其胞内转运功能,维持机体的自身稳定性(Vabulas et al, 2010)。此外,HSPs还参与宿主的免疫应答反应,在抗原呈递、激活淋巴细胞和巨噬细胞、激活和熟化抗原呈递细胞中发挥作用(Suzue et al, 1997; Osterloh et al, 2008)。同样,HSPs可作为免疫佐剂,在抗肿瘤和抗病原感染中发挥作用(Colaco et al, 2013)。
Hsp90是机体细胞中主要的伴侣蛋白,在非应激条件下的表达量占细胞蛋白总量的1%–2%,在诱导条件下的表达量可增至4%–6%(Pratt, 1997)。在脊椎动物中,Hsp90有多种异构体,有胞浆型的Hsp90α和Hsp90β、内质网型的Grp94、线粒体型的TRAP,它们参与细胞的多个过程,如信号传导、细胞分化、细胞增殖和凋亡、形态发生和发育、免疫反应等(Zhao et al, 2005; Wandinger et al, 2008)。在鱼类中,Hsp90参与胚胎肌肉发育(Du et al, 2008)、变态(Manchado et al, 2008)、氧化应激(Padmini et al, 2009、2011)、抗细菌感染(Cha et al, 2013)等多个过程。牙鲆(Paralichthys olivaceus)是重要的海水经济鱼类,已发现牙鲆有多种Hsp,包括Hsp10、Hsp40A4、Hsp40B6、Hsp40B11、Hsp60、Hsp70、Grp78、Hsp90α、Hsp90β和Grp94(Cha et al, 2013),其中,Hsp90α和Hsp90β的基因序列已经公布,但它们的功能和作用机制尚未清楚。本研究拟对牙鲆Hsp90α和Hsp90β在mRNA水平的组织分布、表达及对温度和病原菌刺激的响应进行探索,为进一步阐明牙鲆Hsp90的功能和作用机制提供理论基础。
1 材料与方法 1.1 实验动物实验用健康牙鲆购于山东海阳市水产有限公司养殖基地,暂养于实验室,常规养殖管理,养殖水温(19±1)℃。实验前,每批随机取3尾鱼的内脏组织进行细菌分离,确定未经细菌感染的鱼用于后续实验。
1.2 引物设计根据NCBI收录牙鲆Hsp90α (GenBank No. DQ662233.1)和Hsp90β(GenBank No. DQ662234.1) mRNA序列设计荧光定量PCR上下游引物,以牙鲆β-actin基因(GenBank No. HQ386788.1)为内参,引物序列详见表 1。
|
|
表 1 实验所用qRT-PCR引物及序列 Table 1 Sequences of primers used in the qRT-PCR analysis |
选取1月龄(20±5) g、8月龄(200±50) g、12月龄(500±50) g、24月龄(1000±100) g牙鲆各3尾,迅速取肝脏、脾脏、头肾、后肾、心、肌肉、背皮、胃、肠、鳃、腹鳍、脑和血液13个组织,放入液氮中冻存后,转至–80℃冰箱保存。
1.3.2 温度刺激对牙鲆Hsp90基因表达的影响实验选用8月龄(200±50) g牙鲆。检测不同温度刺激对Hsp90基因表达影响,设置7个温度实验组(5、10、16、19、22、28和32℃),每个温度组设置3个平行组,每平行组12尾牙鲆,每组在不同温度海水中放置1 h后,迅速取肝脏和脾脏放入液氮中冻存,后转至–80℃冰箱中保存。
设置2种温度(10℃和28℃)来研究温度刺激对Hsp90基因表达的影响,每个温度设置3个平行组,每组12尾,分别刺激1、3、5、8 h,处理结束后,迅速取肝脏和脾脏放入液氮中冻存,转至–80℃冰箱保存。
1.3.3 鳗弧菌感染对牙鲆Hsp90基因表达的影响实验选用8月龄(200±50) g牙鲆,分感染组和对照组,每组20尾,设3个平行组。感染组每尾鱼腹腔注射0.1 ml浓度为1×106CFU/ml的鳗弧菌M3活菌,对照组注射生理盐水。在注射后的0、6、12、24、72 h,分别迅速取3尾鱼脾脏组织放入液氮中冻存,转至–80℃冰箱保存。
1.4 RNA提取、cDNA的合成和定量PCR取–80℃保存的牙鲆组织90–100 mg,用RNAiso Plus(TaKaRa)抽提总RNA,各组织RNA采用反转录试剂盒(TOYOBO)按照说明步骤合成cDNA,保存于–20℃备用。
使用TransStart Top Green qPCR Super Mix(全式金)试剂盒对牙鲆各组织cDNA在实时荧光定量PCR仪(Bio-Rad)上进行检测。并利用SPSS进行统计学分析,P < 0.05为差异显著。
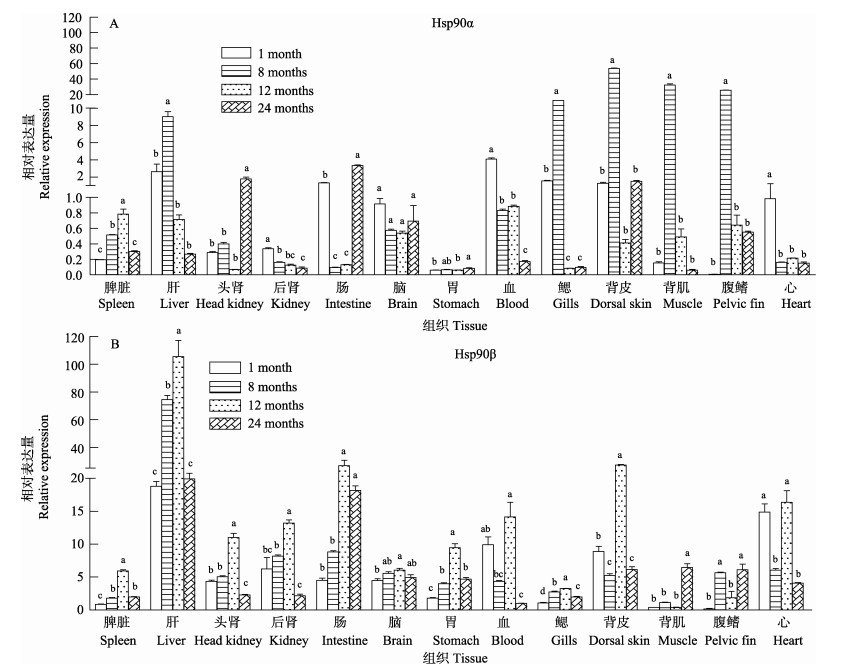
2 结果 2.1 Hsp90 mRNA在牙鲆组织中的表达和分布通过qPCR检测牙鲆Hsp90α和Hsp90β基因的mRNA在不同月龄牙鲆的组织分布,结果显示,2个基因在4种月龄牙鲆(1、8、12和24月龄)的13种组织中均有表达和分布(图 1-A、图 1-B),Hsp90α在8月龄的牙鲆组织中的表达量较高,其中,在牙鲆的体表组织(鳃、背皮、背肌和腹鳍)和肝脏的表达量高于同组织其他3组(P < 0.05),在内脏组织(脾脏、肾、肠、脑、胃、血和心脏)的表达量较低;Hsp90β的表达水平整体上高于Hsp90α,其中,在肝和肠的表达量较高,而在部分体表组织(鳃、背肌和腹鳍)的表达量较低。
|
图 1 不同月龄牙鲆Hsp90 mRNA的相对表达水平
Figure 1 Relative expression of Hsp90 mRNA in different tissues of P. olivaceus at various growth stages
A. Hsp90α mRNA; B. Hsp90β mRNA a、b、c和d代表各月龄组之间的差异性,相同字母为差异不显著(P > 0.05),不同字母表示差异显著(P < 0.05) Letters a, b, c and d present the differences among the various fish age groups; the same letters indicate no significant difference (P > 0.05) and the different letters indicate significant difference (P < 0.05) |
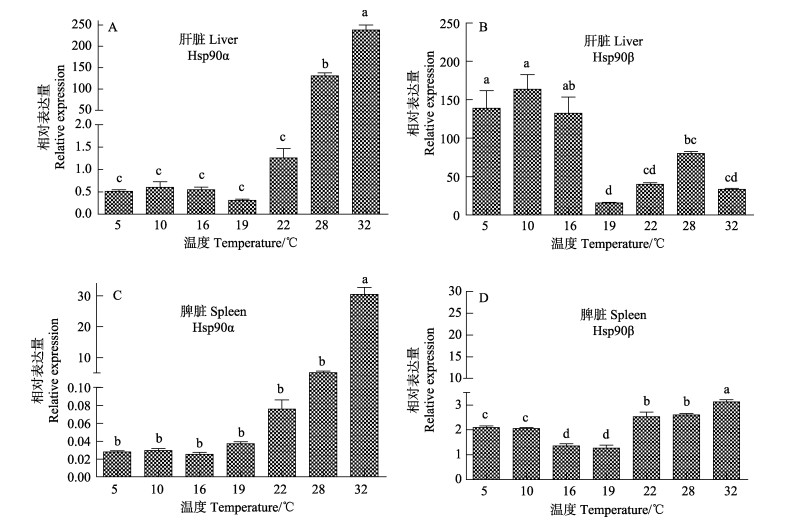
将8月龄(200±50) g牙鲆放置于不同温度海水1 h后,取肝脏和脾脏检测Hsp90基因mRNA表达水平。结果显示,在较低温(5℃和10℃)和适宜养殖温度(16℃和19℃),各处理组牙鲆肝脏和脾脏的Hsp90α的相对表达量较低,分别为0.51–0.60和0.03–0.04,各组之间无显著性差异(P > 0.05)(图 2-A、图 2-C);当水温高于19℃时,肝脏Hsp90α的相对表达量显著升高(P < 0.05),由22℃的1.26升高到32℃的238.74;而当水温高于28℃时,脾脏Hsp90α的mRNA相对表达量略升高,由28℃的5.13升高到32℃的30.49。
|
图 2 不同温度刺激下Hsp90α和Hsp90β mRNA在牙鲆肝脏和脾脏中的表达 Figure 2 Expression of Hsp90α and Hsp90β mRNAs in the liver and spleen of P. olivaceus after stimulation at different temperatures A:肝脏Hsp90α mRNA的相对表达量;B:肝脏Hsp90β mRNA的相对表达量;C:脾脏Hsp90α mRNA的相对表达量;D:脾脏Hsp90β mRNA的相对表达量;a、b、c和d代表各组之间的差异性,相同字母为差异不显著(P > 0.05),不同字母表示差异显著(P < 0.05) A: Liver Hsp90α mRNA expression level; B: Liver Hsp90β mRNA expression level; C: Spleen Hsp90α mRNA expression level; D: Spleen Hsp90β mRNA expression level; Letter a, b, c and d present the differences among various fish groups; the same letters indicate no significant difference (P > 0.05) and the different letters indicate significant difference (P < 0.05) |
在较低温度(5、10和16℃),牙鲆肝脏Hsp90β的相对表达量为132.36–139.11,显著高于高温处理组(19、22、28和32℃)的33.51–89.2 (P < 0.05) (图 2-B);在适应养殖水温(16℃和19℃)中,脾脏Hsp90β的相对表达量较低(1.27–1.35),而经过低温(5℃和10℃)和高温处理(22、28和32℃),脾脏Hsp90β的相对表达量显著升高(P < 0.05),为2.15–3.12(图 2-D)。
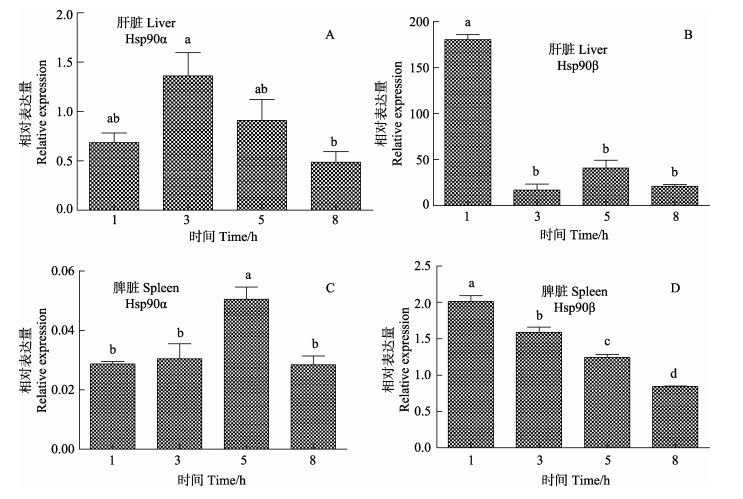
2.3 两个温度刺激对牙鲆Hsp90 mRNA表达的影响在10、28℃下放置不同时间,检测牙鲆肝脏和脾脏Hsp90α和Hsp90β的mRNA相对表达量。总体上,经过低温和高温的连续刺激,牙鲆Hsp90α和Hsp90β的mRNA相对表达量呈现先升高后降低的变化趋势。
在10℃处理时,肝脏的Hsp90α和Hsp90β的mRNA表达量分别在3 h和1 h时达到最大值(P < 0.05) (图 3-A、图 3-B),脾脏的Hsp90α和Hsp90β的mRNA表达量分别在5 h和1 h达到最大值(P < 0.05) (图 3-C、图 3-D)。同时,肝脏和脾脏中Hsp90β mRNA表达量整体显著高于Hsp90α mRNA的表达水平(P < 0.05)。
|
图 3 10℃处理8 h牙鲆Hsp90 mRNA在肝脏和脾脏中的表达 Figure 3 Relative expression of Hsp90 mRNA in the liver and spleen of P. olivaceus treated at 10℃ for 8 h A:肝脏Hsp90α mRNA的相对表达量;B:肝脏Hsp90β mRNA的相对表达量;C:脾脏Hsp90α mRNA的相对表达量;D:脾脏Hsp90β mRNA的相对表达量;a、b、c、d代表各组之间的差异性,相同字母为差异不显著(P > 0.05),不同字母表示差异显著(P < 0.05) A: Liver Hsp90α mRNA expression level; B: Liver Hsp90β mRNA expression level; C: Spleen Hsp90α mRNA expression level; D: Spleen Hsp90β mRNA expression level; Letter a, b, c and d present the differences among various fish groups; the same letters indicate no significant difference (P > 0.05) and the different letters indicate significant difference (P < 0.05) |
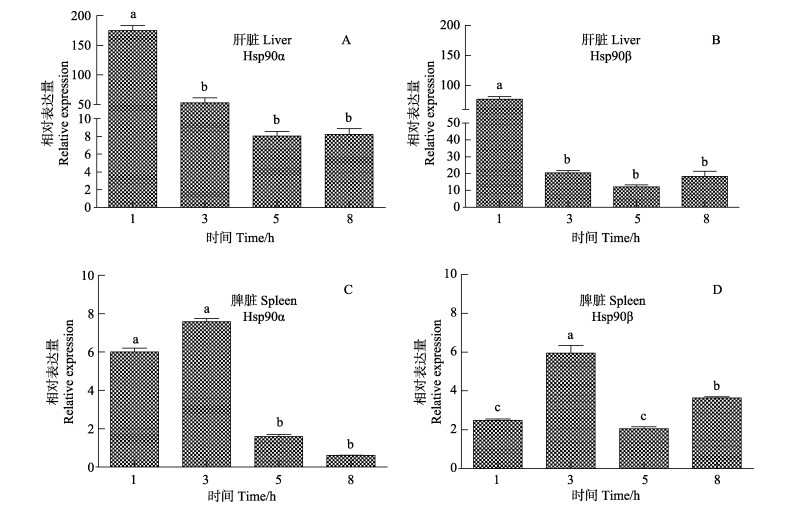
在28℃处理时,肝脏的Hsp90α和Hsp90β mRNA表达量均在1 h时达到最大值(P < 0.05)(图 4-A、图 4-B);脾脏的Hsp90α和Hsp90β mRNA表达量均在3 h时达到最大值(P < 0.05)(图 4-C、图 4-D),而在最大值时,Hsp90α mRNA的表达水平显著高于Hsp90β mRNA的表达水平(P < 0.05),且可以维持在一个较高水平。同时,肝脏和脾脏中Hsp90β mRNA表达量整体显著高于Hsp90α mRNA的表达水平(P < 0.05)。
|
图 4 28℃处理8 h牙鲆Hsp90 mRNA在肝脏和脾脏中的表达 Figure 4 Relative expression of Hsp90 mRNA in the liver and spleen of P. olivaceus treated at 28℃ for 8 h A:肝脏Hsp90α mRNA的相对表达量;B:肝脏Hsp90β mRNA的相对表达量;C:脾脏Hsp90α mRNA的相对表达量;D:脾脏Hsp90β mRNA的相对表达量;a、b、c、d代表各组之间的差异性,相同字母为差异不显著(P > 0.05),不同字母表示差异显著(P < 0.05) A: Liver Hsp90α mRNA expression level; B: Liver Hsp90β mRNA expression level; C: Spleen Hsp90α mRNA relative expression; D: Spleen Hsp90β mRNA relative expression level; Letter a, b, c and d present the differences among various fish groups; the same letters indicate no significant difference (P > 0.05) and the different letters indicate significant difference (P < 0.05) |
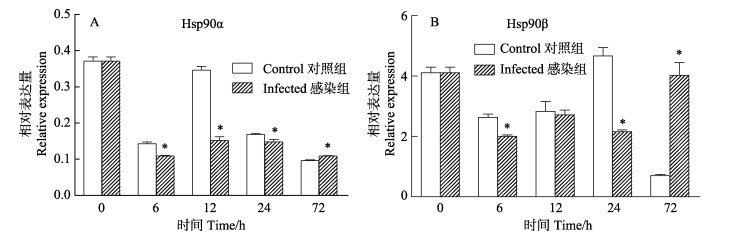
以鳗弧菌M3感染牙鲆,感染后72 h内检测脾脏Hsp90 mRNA的表达水平变化。与注射生理盐水的对照组相比,感染组脾脏Hsp90α的表达量在6–12 h呈现下降(P < 0.05),在24–72 h的表达量回升(P < 0.05),在感染后的6–24 h的表达量低于对照组,表达量仅在72 h时高于对照组(图 5-A)。同样,感染组牙鲆脾脏Hsp90β的表达量在6–24 h呈现下降;在感染后的6–24 h的表达量低于对照组,在72 h表达量急剧上升(P < 0.05)(图 5-B)。鳗弧菌感染后,牙鲆脾脏Hsp90β的变化幅度比Hsp90α大。
|
图 5 牙鲆感染鳗弧菌后脾脏Hsp90 mRNA的表达水平 Figure 5 Relative expression of Hsp90 mRNA in the spleen of P. olivaceus infected with V. anguillarum *代表差异显著(P < 0.05) * presents significant difference(P < 0.05) |
Hsp90的表达和分布在鱼类研究中已有较多的报道。在模式生物斑马鱼的研究中发现,Hsp90在脑、肝脏与肌肉中均有表达(Murtha et al, 2003),在塞纳加尔鳎(Solea senegalensis)的心脏、骨骼肌、皮肤和胃等多个组织中也检测到Hsp90的表达(Manchado et al, 2008)。本研究检测不同发育时期牙鲆13个组织中Hsp90的表达情况,同样发现,Hsp90α和Hsp90β在牙鲆多个组织中均有表达,预示Hsp90在牙鲆的发育阶段及各部分组织中具有一定作用。Hsp90在不同组织的表达量有一定差异,Hsp90α在24月龄成年牙鲆的肠和头肾表达量较高,Hsp90β在脑、肠和脾脏中表达量较高,这与之前的研究报道相吻合(张俊玲等, 2010),Hsp90在不同组织中的差异表达可能与组织的功能有关。
已有研究证明,Hsp90α主要为诱导型表达,而Hsp90β在大多数组织中主要为组成型表达(Millson et al, 2007)。本研究发现,相比较于Hsp90β的相对表达量,Hsp90α在各个组织中大多处于较低水平,Hsp90α在8月龄牙鲆的肝脏、鳃、背皮、肌肉和腹鳍相对表达量高于其他3组的同组织(P < 0.05),Hsp90β在24月龄肌肉和腹鳍中高于其他3组的同组织,其他组织均在12月龄牙鲆中表现为高表达(P < 0.05),整体呈现随体重增加而上升的趋势,说明Hsp90α和Hsp90β可能在不同的生长发育时期和细胞周期调控等生理过程中起作用(Sreedhar et al, 2004)。
热休克蛋白的产生体现了生物的进化,它可以提高生物体的适应能力,特别是耐热能力。Lindquist (1986)研究表明,HSPs的生成量与热耐受呈正相关。在草鱼(Ctenophryngodon idellus)(周鑫等, 2013)和鳟鱼(Oncorhynchus mykiss)(Sathiyaa et al, 2001)的研究中,Hsp90同样随温度的升高而上调。本研究同样发现,在牙鲆的肝脏和脾脏组织中,Hsp90α mRNA表达量随温度的增高而增加,且反应迅速。经不同温度刺激后,牙鲆Hsp90α的表达水平迅速变化,在高温时变化幅度较Hsp90β明显,说明牙鲆Hsp90α的表达比Hsp90β更容易受高温的影响。通过10℃和28℃刺激发现,Hsp90α和Hsp90β mRNA表达量有所差异,在低温时Hsp90β mRNA的表达量高于Hsp90α的表达量,说明Hsp90β可能在低温时发挥不同的作用。
HSPs在鱼类免疫反应中发挥作用。例如,当虹鳟(Oncorhynchus mykiss)受到肾杆菌或鳗弧菌感染时,Hsp70表达升高(Forsyth et al, 1997; Ackerman et al, 2001);当鲈鱼(Sparus sarba)受到藻胶弧菌感染时,Hsp70的表达量下降,而Hsp60和Hsp90的表达量不变(Deane et al, 2005)。本研究发现,当牙鲆受到鳗弧菌感染时,Hsp90α和Hsp90β的表达先缓慢下降,而后分别在感染后24 h、72 h升高,变化的趋势与之前的研究有所不同(Cha et al, 2013),当牙鲆受到链球菌感染后6 h,包括Hsp90α和Hsp90β在内的多个HSPs基因的表达量升高,之后出现下降趋势。Hsp90可以识别病原模式分子(Pathogen-associated molecular pattern, PAMP),参与宿主的先天性免疫反应(Colaco et al, 2013)。链球菌和鳗弧菌分别为革兰氏阳性和阴性菌,具有不同的PAMP分子,与牙鲆Hsp90存在不同的识别机制,这可能是导致两个结果存在差异的原因之一。
Hsp90广泛的生物学功能,在人类的抗氧化、抗衰老、抗损伤和抗肿瘤药物等多个领域受到广泛的关注(Eustace et al, 2004; Li et al, 2007)。然而,目前,水生动物HSPs的研究相对滞后。本研究系统分析了不同发育期牙鲆Hsp90在各组织中的表达差异,以及对温度、病原菌的应激反应,为更好地利用Hsp90提供了理论数据。
张俊玲, 施志仪, 程琦, 等. 牙鲆变态中两种HSP90基因的不同表达及其与甲状腺激素的关系.
水产学报 , 2010, 34 (10) : 1478-1485 ( 0) 0)
|
|
周鑫, 董云伟, 王芳, 等. 草鱼hsp70和hsp90对温度急性变化的响应.
水产学报 , 2013, 37 (2) : 216-221 ( 0) 0)
|
|
Ackerman PA, Iwama GK. Physiological and cellular stress responses of juvenile rainbow trout to vibriosis.
J Aquat Anim Health , 2001, 13 (2) : 173-180 DOI:10.1577/1548-8667(2001)013<0173:PACSRO>2.0.CO;2 ( 0) 0)
|
|
Cha IS, Won JK, Park SB, et al. Heat shock protein profiles on the protein and gene expression levels in olive flounder kidney infected with Streptococcus parauberis.
Fish Shellfish Immun , 2013, 34 (6) : 1455-1462 DOI:10.1016/j.fsi.2013.03.355 ( 0) 0)
|
|
Colaco CA, Bailey CR, Walker KB, et al. Heat shock proteins: stimulators of innate and acquired immunity.
Biomed Res Int , 2013 (1) : 461230 ( 0) 0)
|
|
Deane E, Woo NYS. Evidence for disruption of Na+-K+-ATPase and hsp70 during vibriosis of sea bream, Sparus (=Rhabdosargus) sarba Forsskål.
J Fish Dis , 2005, 28 (4) : 239-251 DOI:10.1111/jfd.2005.28.issue-4 ( 0) 0)
|
|
Du SJ, Li HQ, Bian YH, et al. Heat-shock protein 90α1 is required for organized myofibril assembly in skeletal muscles of zebrafish embryos.
Proc Nat Sci USA , 2008, 105 (2) : 554-559 DOI:10.1073/pnas.0707330105 ( 0) 0)
|
|
Eustace BK, Sakurai T, Stewart JK, et al. Functional proteomic screens reveal an essential extracellular role for hsp90α in cancer cell invasiveness.
Nat Cell Biol , 2004, 6 (6) : 507-514 DOI:10.1038/ncb1131 ( 0) 0)
|
|
Feder ME, Hofmann GE. Heat-shock proteins, molecular chaperones, and the stress response: evolutionary and ecological physiology.
Annu Rev Physiol , 1999, 61 (1) : 243-282 DOI:10.1146/annurev.physiol.61.1.243 ( 0) 0)
|
|
Forsyth R, Candido EPM, Babich SL, et al. Stress protein expression in coho salmon with bacterial kidney disease.
J Aquat Anim Health , 1997, 9 (1) : 18-25 DOI:10.1577/1548-8667(1997)009<0018:SPEICS>2.3.CO;2 ( 0) 0)
|
|
Li W, Li Y, Guan SX, et al. Extracellular heat shock protein-90α: linking hypoxia to skin cell motility and wound healing.
EMBO Journal , 2007, 26 (5) : 1221-1233 DOI:10.1038/sj.emboj.7601579 ( 0) 0)
|
|
Lindquist S. The heat-shock response.
Annu Rev Biochem , 1986, 55 (1) : 1151-1191 DOI:10.1146/annurev.bi.55.070186.005443 ( 0) 0)
|
|
Manchado M, Salas-Leiton E, Infante C, et al. Molecular characterization, gene expression and transcriptional regulation of cytosolic HSP90 genes in the flatfish Senegalese sole (Solea senegalensis Kaup).
Gene , 2008, 416 (1-2) : 77-84 DOI:10.1016/j.gene.2008.03.007 ( 0) 0)
|
|
Millson SH, Truman AW, Racz A, et al. Expressed as the sole Hsp90 of yeast, the α and β isoforms of human Hsp90 differ with regard to their capacities for activation of certain client proteins, whereas only Hsp90β generates sensitivity to the Hsp90 inhibitor radicicol.
FEBS Journal , 2007, 274 (17) : 4453-4463 DOI:10.1111/j.1742-4658.2007.05974.x ( 0) 0)
|
|
Murtha JM, Keller ET. Characterization of the heat shock response in mature zebrafish (Danio rerio).
Exp Gerontol , 2003, 38 (6) : 683-691 DOI:10.1016/S0531-5565(03)00067-6 ( 0) 0)
|
|
Osterloh A, Breloer M. Heat shock proteins: linking danger and pathogen recognition.
Med Microbiol Immun , 2008, 197 (1) : 1-8 ( 0) 0)
|
|
Padmini E, Rani MU. Seasonal influence on heat shock protein 90α and heat shock factor 1 expression during oxidative stress in fish hepatocytes from polluted estuary.
J Exp Mar Biol Ecol , 2009, 372 (1-2) : 1-8 DOI:10.1016/j.jembe.2009.01.018 ( 0) 0)
|
|
Padmini E, Rani MU. Heat-shock protein 90 alpha (HSP90α) modulates signaling pathways towards tolerance of oxidative stress and enhanced survival of hepatocytes of Mugil cephalus.
Cell Str Chap , 2011, 16 (4) : 411-425 DOI:10.1007/s12192-011-0255-9 ( 0) 0)
|
|
Pratt WB. The role of Thehsp90-based chaperone system in signal transduction by nuclear receptors and receptors signaling via map kinase.
Annu Rev Pharmacol , 1997, 37 (1) : 297-326 DOI:10.1146/annurev.pharmtox.37.1.297 ( 0) 0)
|
|
Sathiyaa R, Campbell T, Vijayan MM. Cortisol modulates HSP90 mRNA expression in primary cultures of trout hepatocytes.
Comp Biochem Physiol B: Biochem Mol Biol , 2001, 129 (2-3) : 679-685 DOI:10.1016/S1096-4959(01)00373-6 ( 0) 0)
|
|
Sreedhar AS, Csermely P. Heat shock proteins in the regulation of apoptosis: new strategies in tumor therapy: a comprehensive review.
Pharmacol Therapeut , 2004, 101 (3) : 227-257 DOI:10.1016/j.pharmthera.2003.11.004 ( 0) 0)
|
|
Suzue K, Zhou X, Eisen HN, et al. Heat shock fusion proteins as vehicles for antigen delivery into the major histocompatibility complex class I presentation pathway.
Proc Nat Aca Sci , 1997, 94 (24) : 13146-13151 DOI:10.1073/pnas.94.24.13146 ( 0) 0)
|
|
Vabulas RM, Raychaudhuri S, Hayer-Hartl M, et al. Protein folding in the cytoplasm and the heat shock response.
CSH Perspect Biol , 2010, 2 (12) : 1882-1890 ( 0) 0)
|
|
Wandinger SK, Richter K, Buchner J. The Hsp90 chaperone machinery.
J Biol Chem , 2008, 283 (27) : 18473-18477 DOI:10.1074/jbc.R800007200 ( 0) 0)
|
|
Zhao R, Davey M, Hsu YC, et al. Navigating the chaperone network: an integrative map of physical and genetic interactions mediated by the hsp90 chaperone.
Cell , 2005, 120 (5) : 715-727 DOI:10.1016/j.cell.2004.12.024 ( 0) 0)
|



