三疣梭子蟹(Portunus trituberculatus)生长快、个体大、肉质鲜美,是重要的海水养殖产品之一。象山港是浙江省宁波市重要的水产养殖基地,目前对该养殖区的研究大多数以水质分析(张丽旭等, 2007)、浮游植物和底栖生物研究(刘莲等, 2008)为主,缺乏对微生物的研究,尤其是对古菌的研究(刘晶晶等, 2010; 王海丽等, 2011)。完整且精确地描述生物体的多样性和相对丰度对于了解任何生态系统都是至关重要的(Chaban et al, 2006)。自然界中85%以上的微生物不可培养(Amann et al, 1995),因此,传统的分离、纯化、鉴定等方法无法研究微生物的生理生化、细胞组成结构以及形态学。近年来,随着分子生物学技术的发展,环境微生物DNA提取方法不断改进(Cho et al, 1996),基于PCR技术的分子生物学方法在水体微生物生态的研究中应用越来越广泛。末端限制性片段长度多态性(T-RFLP)技术是一种较先进的生态学指纹分析方法,具有高灵敏度、高通量等特点,且因其易操作、能获得半定量结果等优势,在微生物研究中被广泛应用(Marsh et al, 1999)。
古菌在生态系统的物质循环和能量转换中扮演重要的角色(Könneke et al, 2005),广泛存在于各类海域环境以及高盐、高热等环境中。古菌界主要由泉古菌门(Crenarchaeota)和广域古菌门(Euryarchaeota)组成(Madigan et al, 2008)。蔡小龙等(2012)结合15N-稳定性同位素探针技术与克隆技术研究养殖水体中氮循环转化及相关功能微生物的群落结构,发现参与氮循环的古菌主要有奇古菌门、泉古菌门和广古菌门。属于泉古菌门的氨氧化古菌以及广古菌门的产甲烷古菌和硫酸盐还原菌等均在海洋的碳、氮、硫等元素循环中必不可少,也是目前研究的热点(Hurtgen, 2012; Lazar et al, 2011; Pitcher et al, 2011; Valentine, 2011)。研究养殖水体古菌群落的变化,对了解养殖水体物质循环等至关重要。但目前关于宁波市象山港三疣梭子蟹养殖塘水体古菌的研究尚未见报道。
本研究通过T-RFLP技术结合克隆测序的方法,对象山港三疣梭子蟹–脊尾白虾混养模式下改良塘(塘底铺网、四周铺砂的养殖塘)以及传统塘(土塘)不同季节水体古菌群落结构和多样性进行分析,试图探讨养殖过程水体环境中古菌群落的变化,为象山港三疣梭子蟹养殖的生态评价提供微生态基础信息。
1 材料与方法 1.1 水样采集三疣梭子蟹养殖塘位于浙江省宁波市象山港东胜养殖区,采样点及样品处理同陈逸斐等(2015)所述。共2种类型养殖塘:一为改良塘(M1),底铺网、四周铺砂,设置2个平行塘;二为传统土塘(M2),设置3个平行塘。养殖塘的基本情况见表 1。样品采集于2013年6–12月中旬,2 h内采集所有养殖塘的水样,将单个塘中不同站位养殖水混合后,取200 ml水样过滤(0.22 μm,Millipore),所得滤膜用于微生物DNA的提取,水体用于氮磷含量的分析。所有样品低温运回实验室,–20℃冻存备用。
|
|
表 1 两种养殖塘基本情况 Table 1 The basic condition of the two ponds |
水体理化测定参考陈逸斐等(2015),养殖水体的水温、溶解氧、盐度、pH和透明度按照《海洋监测规范》在原位进行测定,过滤所得水体带回实验室,测定其中的总氮、总磷、氨氮以及亚硝酸氮。
1.3 总DNA的提取和PCR扩增将滤膜放于2 ml裂解管中进行养殖水总DNA的提取,提取方法参考Noll等(2005),采用古菌16S rRNA基因的通用引物109f (ACKGCTCAGTAACACGT)和915r (GTGCTCCCCCGCCAATTCCT)进行PCR扩增。反应体系(50 μl):5 μl 10×Buffer,4 μl 2.5 mmol/L dNTPs,1 μl 10 μmol/L引物,1 μl 2.5 U Taq DNA聚合酶(TaKaRa),1 μl DNA模板,加水至50 μl,混匀。反应程序为94℃变性5 min,30个循环包括94℃ 30 s,53℃ 45 s,72℃ 90 s,最后72℃延伸10 min。此外,PCR扩增产物若用于T-RFLP分析,其后引物用FAM进行荧光标记。
1.4 T-RFLP分析将乙醇沉淀法纯化后的PCR产物用限制性内切酶TaqⅠ(TaKaRa)进行酶切,反应体系及条件参考陈明明等(2014)。酶切产物用乙醇–醋酸钠沉淀法进行纯化。酶切纯化后进行限制性片段的基因扫描:取1–3 μl酶切纯化样品,与10 μl HiDi-甲酰胺和0.2 μl内标混合,95℃变性3 min,马上置于冰浴。通过ABI 3130XL Genetic Analyzer进行限制性片段扫描,结果由ABI GeneMap分析软件直接导出。
1.5 克隆/测序和系统发育分析选取M2养殖塘7月水体样品构建古菌16S rRNA基因克隆文库。采用无荧光标记引物109f/ 915r进行PCR扩增,其余PCR条件同上。以切胶纯化后PCR产物为插入片段,以pMD-19T Vector (TaKaRa)为载体,4℃过夜连接。连接产物转入大肠杆菌JM109感受态细胞(TaKaRa)中,并在含X-gal、IPTG的LB培养基上进行蓝白斑筛选。筛选得到24个阳性克隆进行测序,利用ARB软件的NJ算法(Neighbor-Joining)对测序结果进行系统发育分析。
1.6 数据处理古菌16S rRNA基因T-RFLP图谱中每一个限制性片段(T-RF)为1个OTU (Operational Taxonomic Unit),以各个T-RF的相对峰高值(每个T-RF的峰高占累积峰高的百分比)为各个OTU的相对丰度,相对丰度低于5%的OTU不予考虑(Noll et al, 2005)。计算古菌的Shannon多样性指数(H′)和均匀度指数(E′),计算公式如下:
| $ \begin{align} & H'=-\sum{{{P}_{i}}\ln {{P}_{i}}}; \\ & E'=H'/\ln S \\ \end{align} $ |
式中,Pi为第i个OTU的相对丰度,S为OTU总数。根据各T-RF的相对丰度,得到古菌T-RFLP百分比图,利用Past软件对T-RFLP结果进行主成分分析(PCA),结合环境因子,利用CANOCO 4.5软件对各点进行冗余分析(RDA),同时,利用Past进行古菌16S rRNA基因与环境相关性以及线性回归分析。
2 结果 2.1 基于T-RFLP的古菌群落结构以及多样性分析对养殖塘水体古菌DNA进行16S rRNA T-RFLP分析(图 1)。整个养殖过程中,M1和M2养殖水体古菌群落主要由78 bp、188 bp、111 bp、339 bp、793 bp组成,不同养殖塘古菌群落组成随时间的变化有差异。
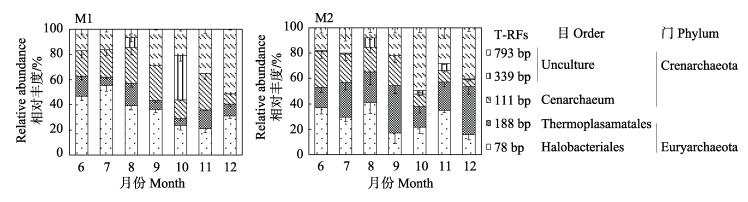
|
图 1 养殖塘水体古菌16S rRNA基因T-RFLP百分比 Figure 1 T-RFLP profiles of archaeal 16S rRNA in the aquaculture water |
养殖起始期(6月),M1水体占优势的T-RF片段为78 bp,相对丰度为46%,其次为111 bp,相对丰度为20%左右,188 bp和793 bp含量在16%左右;M2水体占主要优势的T-RF片段亦为78 bp,但相对丰度在36%左右,其次为111 bp,相对丰度为28%左右,188 bp和793 bp含量为16%–17%;从数据上来看,6月时2种水体古菌群落组成相似。7月时,M1水体古菌群落组成中占绝对优势的T-RF为78 bp,相对丰度达54%左右,其次为88 bp和793 bp,相对丰度分别为21%和16%,各个片段的比例相差较大;而M2的群落组成中,78 bp、188 bp、111 bp、793 bp比例分配较为均匀,在20%–30%之间;说明7月时2种水体古菌群落结构组成差异较大。8月时,M1和M2水体古菌群落组成较为相似,78 bp占群落组成的40%左右,111 bp和188 bp在5%–10%之间波动。9月时,M1和M2水体古菌群落结构组成有较大差异,M1水体以78 bp、111 bp、793 bp为优势菌,相对丰度均在30%以上,188 bp占比小于10%;而M2水体188 bp的相对丰度最大,达37%以上,其他片段(78 bp、111 bp、793 bp)相对丰度较为均匀。10月时,2种水体古菌群落组成也存在很大差异,M1水体以339 bp相对丰度最大,其次为78 bp,而M2水体则以793 bp相对丰度最大。11月2种养殖塘水体古菌群落组成差异较大,M1水体以78 bp、111 bp、188 bp、793 bp为主,相对丰度大小为793 bp > 111 bp > 78 bp > 188 bp;M2水体以78 bp、188 bp、793 bp为主,相对丰度大小为78 bp > 793 bp > 188 bp。
从古菌群落组成来看,从养殖初期到养殖结束,水体古菌群落结构发生变化,且不同养殖塘水体古菌群落结构的变化有所不同。基于古菌16S rRNA基因T-RFLP的末端限制性片段长度的数目以及相对丰度,计算了M1和M2各月养殖水体中古菌的Shannon多样性指数H′以及均匀度指数E′,结果如表 2所示。M1水体10月时古菌多样性最大,7月和12月最小;而M2水体8、11月养殖水体古菌群落多样性大于其他月。由此可见,2种养殖塘水体古菌多样性的变化不同。
|
|
表 2 基于T-RFLP图谱的古菌多样性分析 Table 2 Analysis of diversity of archaea based on T-RFLP profiles (Mean±SE, n=3) |
为了确定各个T-RF属于哪些菌属,从构建好的M2七月养殖水体样品古菌16S rRNA基因文库中随机选出24个阳性克隆进行测序,所得测序结果利用ARB软件及数据库构建古菌系统发育树,分析样品中古菌的分类地位。系统发育分析结构表明,养殖水体古菌群落主要由泉古菌门(Crenarchaeota)和广古菌门(Euryarchaeota)组成。T-RFLP中占优势的T-RF78bp属于广古菌门(Euryarchaeota)、嗜盐杆菌目(Halobacteriales),T-RF188 bp属于广古菌门(Euryarch-aeota)热原体目(Thermoplasamatales),793 bp、339 bp属于泉古菌门(Crenarchaeota),111 bp属于泉古菌门(Crenarchaeota)餐古菌属(Cenarchaeum)。
为了进一步比较2种不同底质养殖塘水体古菌群落结构的季节性变化,对各个点古菌16S rRNA基因的T-RFLP结果进行主成分分析(图 2)。从养殖初期到养殖结束,M1从广古菌门(T-RF 78 bp)向泉古菌门(T-RF 793 bp)演替比较明显,M2的这种演替趋势并不明显。各个时间点M1和M2水体古菌在主成分分析轴上的分散程度不同,整个养殖过程中,M1养殖水体古菌在主成分分析轴上的分散程度小于M2,说明M1水体古菌群落结构随时间的变化幅度小于M2。
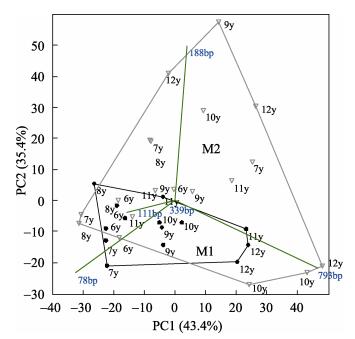
|
图 2 古菌16S rRNA基因T-RFLP的主成分分析 Figure 2 Principal components analysis of the archeal 16S rRNA gene T-RFLP |
为了研究环境因子对古菌群落结构变化的影响,将环境因子水温、溶氧、盐度、pH、透明度、总氮、总磷、氨氮以及亚硝酸氮与T-RFLP结果进行RDA分析(图 3)。选取的9个环境因子对M1、M2养殖塘水体各时间点古菌分布的解释量分别为84.2%和35.7%,其中,主轴RDA1解释量分别为66.8%和22.9%,说明所选取的环境因子对M1水体古菌分布的影响程度大于M2养殖水体。M1水体11月古菌分布受pH的影响较为显著,12月受总氮、氨氮、温度和溶解氧影响较为显著,8月与12月相似,但受各个环境因子的影响效应与12月相反,6、7、9月受透明度、盐度的影响较为明显,10月古菌分布受到环境的影响最小。M2水体12月古菌分布受环境影响与M1相似,除了受总氮、氨氮、温度和溶解氧影响较为显著,还受总磷的影响;9月受亚硝酸盐、盐度和透明度影响较为显著,11月和8月受到环境因子的影响最小。从图 3可以看出,从养殖初期开始,2种不同养殖塘水体各个月古菌分布受环境的影响不同,但到养殖结束时,2种养殖水体较为相似。
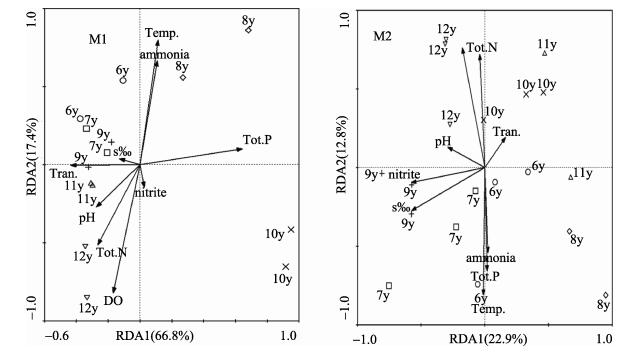
|
图 3 不同时间养殖塘水体古菌群落结构与环境因子的冗余分析 Figure 3 Redundancy analysis for archaeal community compositions and environmental factors in the aquaculture water at different time points |
为了了解环境因子对各个T-RF的影响,将环境因子与各个T-RF片段进行相关性分析(表 3),广古菌门(T-RF78bp、T-RF188bp)在M1水体中受环境的影响比在M2中大,在M1中受温度、亚硝酸盐以及溶解氧的影响显著,在M2中与各个环境因子的相关性均不显著。泉古菌门在M1和M2中受环境的影响不同。在M1水体中,339 bp受总磷的影响较为显著,111 bp受溶解氧影响较大,793 bp受温度影响较大,而在M2养殖环境中,339 bp受pH影响显著,111 bp受温度、总磷、总氮影响较大,793 bp受温度、溶解氧影响较大。泉古门细菌在M2养殖水体中受环境的影响大于M1。由此可见,在2种养殖水体中,温度、溶解氧、总氮、总磷对古菌群落的影响较大,同种T-RF片段,在不同养殖塘受环境的影响有差异。
|
|
表 3 不同时间养殖塘水体古菌群落结构与环境因子的冗余分析 Table 3 Redundancy analysis for archaeal community compositions and environmental factors in the aquaculture water at different time points |
古菌群落结构的研究表明,养殖水体古菌群落结构在养殖过程中发生变化,不同养殖塘水体古菌群落结构的变化不同。微生物群落结构及功能受到环境因子的制约(Cotner et al, 2002)。以往对不同水体生态过程微生物群落结构的研究结果显示,环境因子显著影响微生物的分布,且不同的生态环境受到的调控因子不同(刘敏, 2011)1)。对海洋生态系统中古菌群落的研究发现,古菌在不同海域中的分布有所不同,且其分布受到盐度、含氧量、温度、各营养元素的含量与分布等因素的影响(Ren et al, 2006)。王晓霞(2010)1)研究表明,总磷和总盐是影响古菌群落变化的主要因素。RDA分析结果显示,改良塘中古菌分布受盐度的影响较小,传统塘古菌分布受盐度影响较大。同时,相关性分析结果显示,改良塘中339 bp以及传统塘中111 bp与总磷显著相关,且这2种片段也是古菌群落组成变化较显著的片段,由此可见,总磷是这2种养殖塘水体古菌群落变化的主要因素之一,底铺网、四周铺砂改良后减少了盐度对养殖塘水体古菌分布的影响。2种养殖塘水体古菌多样性指数的变化不同,但RDA分析结果显示,多样性指数高的月份受所选环境因子的影响最小。在以往的研究中也发现,营养盐以及pH等环境因子是影响古菌多样性的重要因素(陈明明等, 2014),由此可见,养殖塘水体古菌多样性指数降低是受环境的影响。
1)刘敏.我国黄、东海典型生态过程中的微生物群落结构.中国科学院研究生院(海洋研究所)博士研究生学位论文, 2011
1)王晓霞.乌鲁木齐河源1号冰川前缘微生物原生演替.新疆大学硕士研究生学位论文, 2010
研究表明,水体微生物群落结构具有高度时空动态性(Gilbert et al, 2009; Or et al, 2012; Teeling et al, 2012)。本研究结果中,养殖起始期(6月),2种养殖塘水体古菌群落结构差异不是很明显,但随着养殖时间的推移,不同养殖塘水体古菌群落差异越来越大,传统土塘养殖水体古菌群落结构随时间的差异性大于改良养殖塘,且这种差异性是由属于广古菌门、热原体目的188 bp引起。但相关性分析显示,所选取的9个环境因子对热原体目的影响较小。从底质差异的角度出发,改良塘底铺网四周铺砂可以有效减少沉积物的累积,从而减少养殖生物对沉积物的影响,传统土塘沉积物的累积会更快,养殖生物对底泥沉积物的扰动也更加明显。李大鹏等(2010)研究表明,底泥的扰动促进易释放态磷向难释放态磷转变,从而减少了水体中有效态磷的含量,同时土壤中有机质也能影响氮磷在水体的分布(Huang et al, 2008)。因此,2种养殖塘养殖生物对底泥沉积物扰动的差异可能是引起古菌群落结构变化差异的原因之一。微生物群落结构的变化与生态功能的改变有关,研究表明,微生物群落结构变化可能改变其生态功能(Xiong et al, 2010; Comte et al, 2011)。由此可见,底铺网、四周铺砂改良措施使水体古菌群落结构变化幅度小于传统塘,从而使其生态功能的稳定性大于传统塘。
综上所述,本研究采用T-RFLP与克隆测序的方法,通过PCA、RDA以及相关性分析古菌群落分布与环境因子之间的关系,结果表明,多样性指数高时,古菌分布受环境的影响较小;2种养殖塘水体古菌分布受温度、溶解氧、总氮和总磷的影响显著;底铺网、四周铺砂改良措施可以减少养殖水体古菌群落的变化幅度。
王海丽, 杨季芳. 象山港海域硫酸盐还原菌的时空分布及其影响因素.
生态学杂志 , 2011, 30 (12) : 2857-2862 ( 0) 0)
|
|
刘莲, 任敏, 陈丹琴, 等. 象山港乌沙山电厂附近海域的底栖生物状况.
海洋环境科学 , 2008, 27 (s1) : 19-22 ( 0) 0)
|
|
刘晶晶, 曾江宁, 陈全震, 等. 象山港网箱养殖区水体和沉积物的细菌生态分布.
生态学报 , 2010, 30 (2) : 377-388 ( 0) 0)
|
|
李大鹏, 黄勇, 范成新. 底泥间歇扰动-沉降过程对静止水体中生物有效磷的影响.
环境科学 , 2010, 31 (8) : 1795-1800 ( 0) 0)
|
|
张丽旭, 蒋晓山, 蔡燕红, 等. 近4年来象山港赤潮监控区水质状况综合评价.
海洋湖沼通报 , 2007 (4) : 98-103 ( 0) 0)
|
|
陈明明, 王少璞, 韦梦, 等. 象山港网箱养殖区沉积物的古菌空间分布.
生态学报 , 2014, 34 (14) : 4099-4106 ( 0) 0)
|
|
陈逸斐, 韦梦, 裘琼芬, 等. 两种三疣梭子蟹(Portunus trituberculatus)养殖塘中浮游细菌的季节变化.
渔业科学进展 , 2015, 36 (5) : 119-125 ( 0) 0)
|
|
蔡小龙, 罗剑飞, 林炜铁, 等. 珠三角养殖水体中参与氮循环的微生物群落结构.
微生物学报 , 2012, 52 (5) : 645-653 ( 0) 0)
|
|
Amann RI, Ludwig W, Schleifer KH. Phylogenetic identification and in situ detection of individual microbial cells without cultivation.
Microbiol Rev , 1995, 59 (1) : 143-169 ( 0) 0)
|
|
Chaban B, Voisin S, Kelly J, et al. Identification of genes involved in the biosynthesis and attachment of Methanococcus voltae N-linked glycans: insight into N-linked glycosylation pathways in Archaea.
Mol Microbiol , 2006, 61 (1) : 259-268 DOI:10.1111/mmi.2006.61.issue-1 ( 0) 0)
|
|
Cho JC, Lee DH, Cho YC, et al. Direct extraction of DNA from soil for amplification of 16S rRNA gene sequences by polymerase chain reaction.
J Microbiol , 1996, 34 (3) : 229-235 ( 0) 0)
|
|
Comte J, Giorgio PAD. Composition influences the pathway but not the outcome of the metabolic response of bacterioplankton to resource shifts.
PLoS One , 2011, 6 (9) : 3679-3694 ( 0) 0)
|
|
Cotner JB, Biddanda BA. Small players, large role: microbial influence on biogeochemical processes in pelagic aquatic ecosystems.
Ecosystems , 2002, 5 (2) : 105-121 DOI:10.1007/s10021-001-0059-3 ( 0) 0)
|
|
Gilbert JA, Field D, Swift P, et al. Seasonal succession of microbial communities in the Western English Channel using 16S rDNA-tag pyrosequencing.
Environ Microbiol , 2009, 11 (12) : 3132-3139 DOI:10.1111/emi.2009.11.issue-12 ( 0) 0)
|
|
Huang CJ, Dong QX, Lin JD, et al. Sediment water, organic matter, nitrogen and phosphorus contents in a large-scale mariculture located in Zhelin Bay, eastern Guangdong Province, China.
Acta Oceanol Sin , 2008, 30 (2) : 38-49 ( 0) 0)
|
|
Hurtgen MT. The Marine Sulfur Cycle, Revisited.
Science , 2012, 337 (6092) : 305-306 DOI:10.1126/science.1225461 ( 0) 0)
|
|
Könneke M, Bernhard AE, De la Torre JR, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon.
Nature , 2005, 437 (7058) : 543-546 DOI:10.1038/nature03911 ( 0) 0)
|
|
Lazar CS, Parkes RJ, Cragg BA, et al. Methanogenic diversity and activity in hypersaline sediments of the centre of the Napoli mud volcano, Eastern Mediterranean Sea.
Environ Microbiol , 2011, 13 (8) : 2078-2091 DOI:10.1111/j.1462-2920.2011.02425.x ( 0) 0)
|
|
Madigan MT, Martinko JM, Dunlap PV, et al. Brock Biology of Microorganisms 12th edn.
Int Microbiol , 2008, 11 : 65-73 ( 0) 0)
|
|
Marsh ME. Coccolith crystals of Pleurochrysis carterae: crystallographic faces, organization, and development.
Protoplasma , 1999, 207 (1-2) : 54-66 DOI:10.1007/BF01294713 ( 0) 0)
|
|
Noll M, Matthies D, Frenzel P, et al. Succession of bacterial community structure and diversity in a paddy soil oxygen gradient.
Environ Microbiol , 2005, 7 (3) : 382-395 DOI:10.1111/emi.2005.7.issue-3 ( 0) 0)
|
|
Or A, Shtrasler L, Gophna U. Fine-scale temporal dynamics of a fragmented lotic microbial ecosystem.
Scientific Report , 2012, 2 (1) : 207 ( 0) 0)
|
|
Pitcher A, Villanueva L, Hopmans EC, et al. Niche segregation of ammonia-oxidizing archaea and anammox bacteria in the Arabian Sea oxygen minimum zone.
ISME J , 2011, 5 (12) : 1896-1904 DOI:10.1038/ismej.2011.60 ( 0) 0)
|
|
Ren LC, Li MY, Bao SX. The investigation of the marine archaea diversity.
Life Sci Res , 2006, 10 (2) : 67-70 ( 0) 0)
|
|
Teeling H, Fuchs BM, Becher D, et al. Substrate-controlled succession of marine bacterioplankton populations induced by a phytoplankton bloom.
Science , 2012, 336 (6081) : 608-611 DOI:10.1126/science.1218344 ( 0) 0)
|
|
Valentine DL. Emerging topics in marine methane biogeochemistry.
Annu Rev Mar Sci , 2011, 3 : 147-171 DOI:10.1146/annurev-marine-120709-142734 ( 0) 0)
|
|
Xiong J, Wu L, Tu S, et al. Microbial communities and functional genes associated with soil arsenic contaminationand rhizosphere of the arsenic hyper-accumulating plant Pteris vittata L.
Appl Environ Microbiol , 2010, 76 (21) : 7277-7284 DOI:10.1128/AEM.00500-10 ( 0) 0)
|


