2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
对虾养殖是世界性产业,也是我国海水养殖代表性产业。中国明对虾(Fenneropenaeus chinensis)是我国黄、渤海的重要经济种类,也是重要的出口水产品。为预防和治疗细菌性疾病,各类抗菌药在对虾养殖中广泛应用,但在起到积极作用的同时,也可能导致动物的急性毒性效应,影响养殖对虾正常的生理机能。有关抗菌药物与免疫调节相关的研究在人、哺乳动物、鸟类、鱼类、虾类已经有所报道(Guardiola et al, 2012),这些结果的差异可能与研究开展条件的不同有关。生物的种类、温度、抗菌药物剂量及给药方式等对于药物的吸收及消除具有很大的影响(Sun et al, 2014、2015; 孙铭等, 2011)。
与其他无脊椎动物一样,对虾缺乏特异性免疫系统而主要依赖非特异免疫系统(Hoffmann et al, 1999)。其中,非特异性免疫因子包括超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、溶菌酶(LZM)和酚氧化酶(PO)等具有免疫活性的酶类,在甲壳动物机体的免疫反应中发挥着十分重要的作用,其变化常被用来衡量对虾免疫活性的大小(董晓慧等, 2009)。
有关抗菌药物对对虾非特异性免疫机能影响的报道较少,张喆等(2011)研究了不同给药浓度下诺氟沙星对中国明对虾非特异性免疫的影响,发现非特异性免疫酶活性在不同组织中的变化趋势不同。Ren等(2014)报道了氟苯尼考对凡纳滨对虾免疫的影响,结果发现其对凡纳滨对虾血淋巴总抗氧化能力(T-AOC)、SOD活力、GSH/GSSG产生显著影响。
磺胺二甲嘧啶具有广谱抑菌作用,对水产动物的细菌性红腿病、烂鳃病、竖鳞病、弧菌病及肠炎等具有较好的防治效果,该类药物一般采用口服给药方式,在水产养殖中广泛使用(巢磊, 2002)。由于细菌的消除取决于抗菌药物抗菌特性及对虾机体的防御机能,因此,有必要研究抗菌药物对对虾非特异性免疫调节的影响。本研究通过向对虾配合饲料中添加不同浓度磺胺二甲嘧啶,于给药期间及给药结束后的不同时间点采集对虾血样,探讨磺胺二甲嘧啶对中国明对虾非特异性免疫的影响。
1 材料与方法 1.1 试剂左旋多巴(L-DOPA)购自Sigma公司;超氧化物歧化酶(SOD)测试盒、溶菌酶(LZM)活性测试盒、碱性磷酸酶测试盒(AKP)均购自南京建成生物工程研究所;磺胺二甲嘧啶原粉购自德邦制药公司(含量98%)。
1.2 实验动物健康中国明对虾,购于山东省昌邑市海丰水产养殖责任有限公司,平均体重为8–10 g。
养殖实验在山东昌邑海丰水产养殖有限公司的12个长方形养殖池塘进行,每个池塘2000尾虾,实验前分别养殖于各个池塘,投喂不含任何药物的基础饲料。虾池长25 m、宽10 m,水深1.5 m,底泥体积275 m3。整个实验期间每天监测水质,水温为(22±2)℃,盐度为23±1,pH为8.0±0.3。
1.3 实验设计磺胺二甲嘧啶药粉分别按照150 mg/kg(高剂量组)、100 mg/kg(中剂量组)和50 mg/kg(低剂量组)添加,即高剂量组按照7.5 g磺胺二甲嘧啶药粉配制1000 g饲料;中剂量组按照5 g磺胺二甲嘧啶药粉配制1000 g饲料;低剂量组按照2.5 g磺胺二甲嘧啶药粉配制1000 g饲料。基础饲料配方如下:鱼粉(45%)、花生粉(25%)、豆粕(10%)、面粉(7%)、鱼油(5%)、玉米粉(5%)、鱼膏(2%)。饲料直径约2 mm。
实验分为1个空白组和3个处理组,每组3个池塘。
投喂及取样:实验前1 d,实验组停止投喂基础饲料,实验开始后,试验组分别投喂含不同浓度磺胺二甲嘧啶的基础饲料,对照组投喂不含磺胺二甲嘧啶药粉的基础饲料,每天早晚各投喂1次,每次投喂量为对虾体重的2%(农业部编委会,2005),连续投喂5 d,后投喂基础饲料。分别于给药期间的1、2、3、4、5 d (1DW、2DW、3DW、4DW、5DW)及最后一次给药后的1、2、3、4、5、7、10 d (1DPW、2DPW、3DPW、4DPW、5DPW、7DPW、10DPW)取中国明对虾血淋巴。每个时间点随机取对虾8尾,全部样品保存于–20℃待测。
1.4 样品处理血样抽取及处理:使用2 ml一次性注射器,先抽取1 ml抗凝剂后,于对虾围心腔取血样1 ml,置于3 ml无菌离心管中,–80℃保存备用。酶活测定前将血样解冻,4℃ 5000 r/min离心10 min分离血清,取上清液,用PBS缓冲液稀释10倍后用于非特异性免疫酶活性的测定。
1.5 SOD、AKP、LZM和PO活性的测定采用南京建成生物工程研究所研制的试剂盒测定SOD、AKP和LZM活性,PO活性用改进的Ashida等(1983)方法,组织蛋白含量采用南京建成生物工程研究所研制的考马斯亮蓝试剂盒测定。
1.6 统计分析实验数据以平均值±标准差(Mean±SD)表示,实验所得数据用SPSS 11.5软件、样品T检验来分析酶活数据。P < 0.05为具有显著性差异,P < 0.01为具有极显著性差异。
2 结果 2.1 血清中SOD活性由图 1可知,不同浓度磺胺二甲嘧啶对中国明对虾血清SOD活性表现出不同的作用。低浓度组SOD活性整体呈现出先升高后降低的趋势,且整个投药期间SOD活性极显著高于对照组(P < 0.01),停止投喂药物后前3 d显著高于对照组(P < 0.05),随后恢复至对照组水平。中浓度组SOD活性在投药期间的前2 d (1DW和2DW)显著高于对照组(P < 0.05),投药第3、4天(3DW和4DW)显著低于对照组(P < 0.05),投药第5天及停止投药后SOD活性与对照组无显著性差异(P > 0.05)。高浓度组SOD活性在投药期间及停止投药后2 d显著低于对照组(P < 0.05),停止投药后第3天开始恢复至对照组水平。
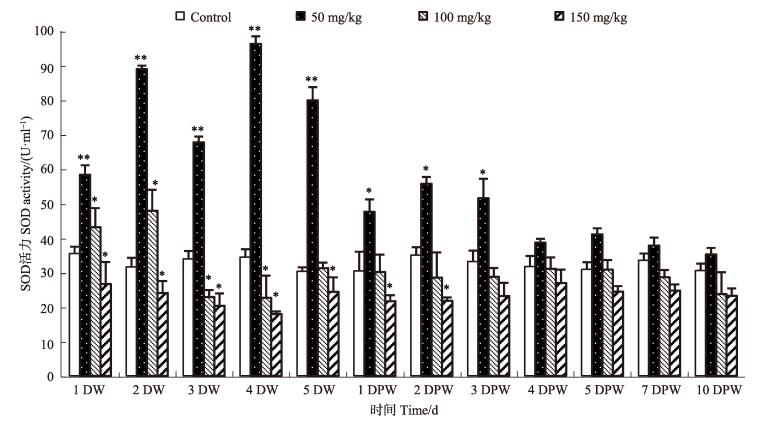
|
图 1 不同浓度磺胺二甲嘧啶对中国明对虾血清SOD活性的影响 Figure 1 Effects of sulfamethazine at different concentrations on the activity of SOD in serum of F. chinensis *表示与对照组相比差异显著(P < 0.05),**表示与对照组相比差异显著(P < 0.01)。下同 Asterisks indicated the significant differences between the sulfamethazine treatment and control (P < 0.05); double asterisks indicated the highly significant differences between the sulfamethazine treatments and control (P < 0.01). The same as below |
图 2显示,低浓度组磺胺二甲嘧啶作用于中国明对虾后,血清AKP活性呈现先降低后升高再降低的趋势,投药第2、3天(2DW和3DW)极显著低于对照组(P < 0.01),随后活性逐渐升高,于5DW和1DPW显著高于对照组(P < 0.05),于2DPW后恢复至对照组水平。中浓度组血清AKP活性整体呈先升高后降低的趋势,于5 DW活性最高,为对照组的1.14倍,于2DPW恢复至对照组水平。高浓度组,血清AKP活性先升高后降低,于2DW极显著高于对照组(P < 0.01),于3DPW恢复至对照组水平,与对照组比无显著性差异(P > 0.05)。
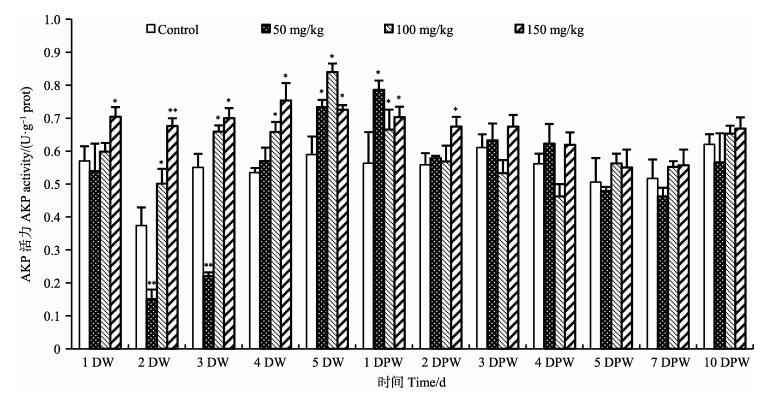
|
图 2 不同浓度磺胺二甲嘧啶对中国明对虾血清AKP活性的影响 Figure 2 Effects of sulfamethazine at different concentrations on the activity of AKP in serum of F. chinensis |
3个浓度组,磺胺二甲嘧啶对LZM活性均具有抑制作用,且呈现一定的剂量-效应关系(图 3)。低浓度组给药后,LZM活性于3DW、4DW显著低于对照组水平(P < 0.05),于5DW极显著低于对照组水平(P < 0.01),其他时间点均与对照组无显著差异(P > 0.05)。中浓度组对虾血清LZM活性在3DW、4DW、5DW显著低于对照组(P < 0.05),其余各时间点与对照组相比均无显著性差异(P > 0.05)。高浓度组与中浓度组LZM活性变化趋势相似,整体低于对照组水平,于5DW和1DPW极显著低于对照组水平(P < 0.01),于5DPW恢复至对照组水平。
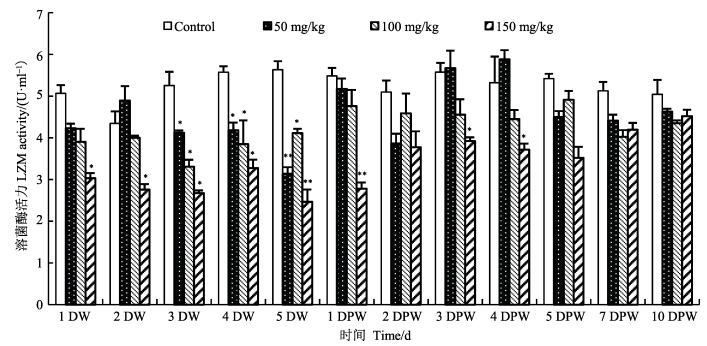
|
图 3 不同浓度磺胺二甲嘧啶对中国明对虾血清LZM活性的影响 Figure 3 Effects of sulfamethazine at different concentrations on the activity of LZM in serum of F. chinensis |
由图 4可知,3个给药剂量下磺胺二甲嘧啶对中国对虾血清PO活性均呈现出先促进后抑制作用。低浓度下,PO活性于1DW至4DW极显著高于对照组(P < 0.01),于3DPW后恢复至对照组水平。中浓度下,PO活性在投喂药物前期呈上升趋势,在1–3DW极显著高于对照组(P < 0.01),于3DW达到最高值,约为对照组的2.75倍,随后呈下降趋势。高浓度下,PO活性于1DW、2DW极显著高于对照组(P < 0.01),随后逐渐下降,于3DPW后恢复至对照组水平(P > 0.05)。
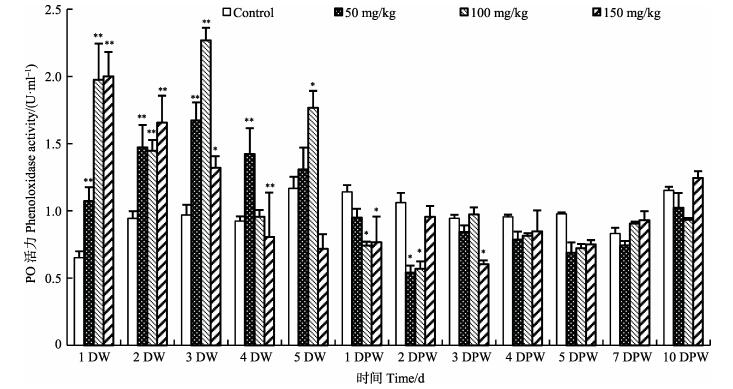
|
图 4 不同浓度磺胺二甲嘧啶对中国明对虾血清PO活性的影响 Figure 4 Effects of sulfamethazine at different concentrations on the activity of PO in serum of F. chinensis |
目前,有关抗菌药物对水产动物免疫系统的影响已有一些报道。对于水产动物免疫机能的研究,主要集中于血淋巴。因为血淋巴既包含体液免疫因子,又包含细胞免疫因子。对虾的免疫系统对外源性应力非常脆弱,有证据表明,外源物质可以对凡纳滨对虾免疫功能产生影响(Tumburu et al, 2012)。对虾生物体的增长、疾病的发生和存活都是由其免疫系统机能决定的,因此,免疫功能是评价外源物质对生物体生理健康影响的重要指标(Blaise et al, 2002; Luengen et al, 2004)。Rijkers等(1981)报道,黄霉素能够降低鲤鱼血清中免疫球蛋白含量,对其免疫系统具有抑制作用。孙智武等(2013)研究表明,饲料中添加240 mg/kg硫酸安普霉素不会对凡纳滨对虾非特异性免疫造成明显的负面影响。由此可见,关于抗菌药物对水产动物免疫系统的影响存在着不同的观念,其原因可能与试验所用抗菌药物种类、剂量和试验动物种类不同有关。张喆等(2011)研究表明,药物对机体免疫的影响与药物的剂量密切相关。
3.2 不同浓度磺胺二甲嘧啶对中国明对虾血清SOD活性的影响活性氧如超氧阴离子、羟基自由基和过氧化氢一直被认为是脊椎动物和无脊椎动物防御系统的细胞毒性成分,是机体在新陈代谢过程中、杀伤异源物质以及机体抗应激时产生的一类重要物质,机体本身在正常状态下清除过剩的氧自由基的能力是评价机体健康的重要指标。
已有研究报道SOD活性与生物体的免疫水平密切相关。水生生物体内的SOD活性受到多种因素的影响,包括重金属污染、药物及环境有毒物质等。对抗菌药物而言,由于其结构的特殊性,抗菌药物的使用可能是导致生物体内活性氧含量上升的原因之一。外源性增强氧自由基的生成是污染毒性的可能机制之一(Gómez-Mendikute et al, 2003)。Monari (2009)发现氯霉素可以显著增加双壳贝类SOD含量。
本研究结果发现,低浓度磺胺二甲嘧啶对SOD活性具有诱导作用,且此诱导作用呈先增强后减弱趋势。中浓度和高浓度磺胺二甲嘧啶对SOD活性具有抑制作用。本研究与张喆等(2011)发现低浓度组诺氟沙星对中国明对虾血清SOD活性有一定的促进作用,而高浓度组呈现抑制作用的结果相一致。Cabell等(1999)研究表明,当生物体受到轻度逆境胁迫时,SOD活性往往升高,表现为抗应激反应;当受到重度逆境胁迫时,SOD活性通常降低,使机体累积过量的活性氧,导致生物体的损伤。本研究中,低浓度作用下,SOD活性显著上升可能是磺胺二甲嘧啶在中国明对虾体内的代谢过程中出现过多自由基,对虾血清反馈性增强抗氧化系统酶活性,以清除多余的自由基。当酶系统遭到破坏,SOD活性下降。中浓度和高浓度作用下,SOD活性被抑制,间接反映了机体清除自由基的能力下降,能清除活性氧的抗氧化系统功能下降,导致机体内活性氧迅速累积。
3.3 不同浓度磺胺二甲嘧啶对中国明对虾血清LZM活性的影响LZM广泛存在于各种动物的血细胞和血清中,在免疫活性中发挥重要作用。溶菌活性是甲壳动物常用的免疫指标,可以作为检测对虾机体免疫机能的一个有价值的参考。LZM是吞噬细胞杀菌的物质基础,它是一种碱性蛋白质,可以水解革兰氏阳性菌细胞壁中黏肽的乙酰氨基多糖,并使之裂解被释放出来,形成水解酶体系,破坏和消除侵入体中的异物。本研究中,3个剂量组的LZM活性总体趋势受到抑制,且呈现剂量–效应关系,说明抗菌药物进入对虾体内,可能对机体造成一定的胁迫,抑制了LZM的合成或分泌,或者直接作用于LZM的活性中心,使其活性降低(张旭东, 2008)1)。LZM活性降低可能在一定程度上抑制血细胞的吞噬活性。Ren等(2014)报道凡纳滨对虾连续投喂氟苯尼考,其血细胞吞噬活性下降;王永胜等(2008)研究发现氯霉素作用于凡纳滨对虾可以显著降低血清、肌肉和肝胰腺LZM活性,均与本研究的结果具有一定的相似性。因动物LZM活性可以受到季节、栖息地、食物、温度和pH等多种因素的影响,有一些研究与本研究结果有所不同,如张喆等(2011)研究发现,诺氟沙星对中国明对虾血清LZM活性呈现先促进后抑制的作用,对肝胰腺、肌肉和鳃LZM活性存在显著的剂量效应,整体呈现低浓度抑制、高浓度促进的作用。Chang等(2000)认为,在持续投喂免疫增强剂的情况下,对虾免疫指标由上升至高峰再转为下降的现象,是由于长期投喂免疫增强剂而导致的“免疫疲劳”的结果,张喆等(2011)认为药物可能存在同样的作用效果。可见,水产药物对LZM活性的影响受到实验条件、药物种类及实验物种等因素的影响而呈现不同的作用效果。
1)张旭东.单诺沙星对鲤鱼(Cyprinus carpio L.)抗氧化和非特异性免疫功能的影响.中国海洋大学硕士研究生学位论文, 2008, 44
3.4 不同浓度磺胺二甲嘧啶对中国明对虾血清AKP活性的影响AKP是生物体内重要的代谢调控酶,直接参与磷酸的转移和代谢,且与膜的物质运输有关,具有重要的生理功能,是生物体内的解毒酶系,直接参与磷酸代谢,对钙质吸收、骨骼形成、磷酸钙沉积及甲壳素分泌与合成有重要作用。对虾生长过程中要经历换壳过程,因此,AKP对于虾的生存有特别重要的意义。AKP含量与多种因素有关,有研究报道Ca2+浓度、盐度和pH可影响日本沼虾肝胰腺AKP的活性,且不同外源物质作用于同一养殖种类或同一物质作用于不同种类,其对机体AKP的活性影响并不相同,认为可能是外源物质本身特性和不同机体组织AKP含量有关。有一些研究发现,外源药物对机体AKP活力具有抑制作用,如王永胜等(2008)研究发现,氯霉素作用于凡纳滨对虾可以显著降低血清、肌肉和肝胰腺AKP活性。张喆等(2011)研究发现,不同浓度诺氟沙星对中国明对虾肝胰腺、肌肉和鳃AKP活性均呈现显著抑制作用,而对血清AKP活性影响没有明显规律。另有研究表明机体的健康状况也对AKP含量有影响,AKP活性的升高是一种病理上的反应(张辉等, 2003)。例如,张丽敏等(2007)研究发现,向红笛鲷腹腔注射10 mg/kg氟苯尼考可以显著增加AKP活性;余东游等(2000)也发现金霉素可以显著提高AKP活性。
本研究结果显示,低浓度组磺胺二甲嘧啶作用于中国明对虾后,血清AKP活性呈现先下降后上升再下降的趋势;中、高浓度组AKP活性整体先升高后降低。说明低剂量的磺胺二甲嘧啶对对虾机体的免疫出现抑制作用,AKP活性下降,随着药物在体内的蓄积,对虾机体对高浓度的药物作用表现出病理反应,从而AKP活性上升,当停止投喂药物后,药物在机体逐渐被代谢,药物浓度的降低使AKP活性表现出下降的趋势。而中高剂量组的给药浓度可以达到引起病理反应的浓度,所以AKP直接表现出先上升后下降的趋势。
3.5 不同浓度磺胺二甲嘧啶对中国明对虾血清PO活性的影响PO参与无脊椎动物的免疫防御反应,在甲壳动物的防卫中发挥极为重要的作用,其在一定程度上反应出甲壳动物的健康状况及免疫灵敏性。甲壳动物的PO也因其所处的环境条件、生理状态和营养水平的不同而不同。不同蜕皮阶段、温度、盐度、pH、氨氮及有机污染源都会对其产生影响(Le Moullac et al, 2000; 潘鲁青等, 2002)。如在一些有机化合物(如多氯联苯PCB,多核的芳香族碳氢化合物PAH)的污染的水体中,褐虾(Crangon crangon)的血细胞PO活性降低,同时其死亡率增加。
另有一些学者研究了抗菌药物对PO活性的影响。刘立鹤等(2006)研究表明,向饲料中添加4 mg/kg黄霉素可以显著提高凡纳滨对虾血清PO活性,而添加12 mg/kg黄霉素,PO活性则呈下降趋势;黄辉等(2008)分别向饲料中添加50、100和150 mg/kg的左旋咪唑(LMS),发现3个处理组罗氏沼虾血清PO活性均显著高于对照组;王永胜等(2008)发现,氯霉素作用下,凡纳滨对虾血清PO活性呈现先下降后上升的趋势,肌肉和肝胰腺PO活性则显著低于对照组。张喆等(2011)研究发现,肌肉和鳃PO活性在诺氟沙星作用下显著高于对照组,说明proPO可能被诺氟沙星激活,不同浓度诺氟沙星对血清和肝胰腺PO活性影响则不同,整体呈现低浓度抑制、高浓度促进的作用。
本研究中3个给药浓度下磺胺二甲嘧啶均对PO活性呈现先诱导后抑制作用,本研究与徐连伟等(2007)报道不同浓度的达氟沙星对施氏鲟肝脏和血清LZM含量有抑制作用,低剂量达氟沙星对血清PO活性呈现先诱导后抑制的结果相似。说明低浓度的药物作用使对虾机体PO原被激活进行防卫作用,PO活力逐渐升高,而随着药物蓄积浓度的增大,酶系统遭到破坏,导致PO活性下降。
4 结论研究结果表明,投喂抗菌药物对中国明对虾的免疫机能具有一定的影响,高浓度磺胺二甲嘧啶对中国明对虾的免疫机能具有明显的抑制作用。在使用抗菌药物进行抑菌或杀菌的同时,要综合考虑所选择给药剂量对对虾生理机能的影响,遵从健康养殖的理念,保证养殖对象的健康生长。
王永胜, 钱鲁闽, 陈昌生, 等. 抗生素和有益微生物对凡纳滨对虾非特异性免疫效应的研究.
台湾海峡 , 2008, 27 (2) : 161-167 ( 0) 0)
|
|
孙铭, 李健, 张喆, 等. 诺氟沙星2种不同给药方式在中国对虾体内的残留及消除规律.
中国海洋大学学报(自然科学版) , 2011, 41 (5) : 43-48 ( 0) 0)
|
|
孙智武, 黄燕华, 王国霞, 等. 硫酸安普霉素对凡纳滨对虾生长、血清生化指标的影响及在组织内的残留.
水产科学 , 2013, 32 (3) : 136-141 ( 0) 0)
|
|
农业部编委会.
渔药手册. 北京: 中国农业出版社, 2005 : 196 .
( 0) 0)
|
|
刘立鹤, 刘辉宇, 董爱华, 等. 饲料中添加黄霉素对凡纳滨对虾生长和非特异性免疫力的影响.
淡水渔业 , 2006, 36 (6) : 25-28 ( 0) 0)
|
|
余东游, 邹晓庭. 杆菌肽锌和金霉素对蛋鸡产蛋性能和蛋品质的影响机理.
浙江大学学报(农业与生命科学版) , 2000, 26 (2) : 169-172 ( 0) 0)
|
|
张喆, 李健, 冯伟, 等. 不同浓度诺氟沙星对中国对虾非特异性免疫酶活的影响.
渔业科学进展 , 2011, 32 (2) : 53-59 ( 0) 0)
|
|
张辉, 张海莲. 碱性磷酸酶在水产动物中的作用.
河北渔业 , 2003 (5) : 12-13 ( 0) 0)
|
|
张丽敏, 吴灶和, 简纪常, 等. 注射氟苯尼考对红笛鲷免疫指标的影响.
广东海洋大学学报 , 2007, 27 (3) : 50-54 ( 0) 0)
|
|
徐连伟, 卢彤岩. 达氟沙星对施氏鲟非特异性免疫功能的影响.
福建农林大学学报(自然科学版) , 2007, 36 (3) : 297-301 ( 0) 0)
|
|
黄辉, 李义, 郝向举. 左旋咪唑对罗氏沼虾免疫功能及抗病力的影响.
淡水渔业 , 2008, 38 (4) : 36-39 ( 0) 0)
|
|
巢磊. 磺胺类药物在水产养殖中的应用.
水利渔业 , 2002, 22 (3) : 50-51 ( 0) 0)
|
|
董晓慧, 李明, 叶继丹. 复方中草药对凡纳滨对虾生长性能和血清非特异免疫因子的影响.
大连水产学院学报 , 2009, 24 (2) : 162-165 ( 0) 0)
|
|
潘鲁青, 姜令绪. 盐度、pH突变对2种养殖对虾免疫力的影响.
青岛海洋大学学报(自然科学版) , 2002, 32 (6) : 903-910 ( 0) 0)
|
|
Ashida M, Ishizaki Y, Iwahana H. Activation of pro-phenoloxidase by bacterial cell walls or β-1, 3-glucans in plasma of the silkworm, Bombyx mori.
Biochem Biophys Res Commun , 1983, 113 (2) : 562-568 DOI:10.1016/0006-291X(83)91762-X ( 0) 0)
|
|
Blaise C, Trottier S, Gagné F, et al. Immunocompetence of bivalve hemocytes as evaluated by a miniaturized phagocytosis assay.
Environ Toxicol , 2002, 17 (3) : 160-169 DOI:10.1002/tox.v17:3 ( 0) 0)
|
|
Cabell LA, Monahan MK, Anslyn EV. A competition assay for determining glucose-6-phosphate concentration with a tris-boronic acid receptor.
Tetrahedron Lett , 1999, 40 (44) : 7753-7756 DOI:10.1016/S0040-4039(99)01651-2 ( 0) 0)
|
|
Chang CF, Chen HY, Su MS, et al. Immunomodulation by dietary beta-1, 3-glucan in the brooders of the black tiger shrimp Penaeus monodon.
Fish Shellfish Immun , 2000, 10 (6) : 505-514 DOI:10.1006/fsim.2000.0266 ( 0) 0)
|
|
Gómez-Mendikute A, Cajaraville MP. Comparative effects of cadmium, copper, paraquat and benzo[a] pyrene on the actin cytoskeleton and production of reactive oxygen species (ROS) in mussel haemocytes.
Toxicol in vitro , 2003, 17 (5-6) : 539-546 DOI:10.1016/S0887-2333(03)00093-6 ( 0) 0)
|
|
Guardiola FA, Cerezuela R, Meseguer J, et al. Modulation of the immune parameters and expression of genes of gilthead seabream (Sparus aurata L.) by dietary administration of oxytetracycline.
Aquaculture , 2012, 334-337 : 51-57 DOI:10.1016/j.aquaculture.2012.01.003 ( 0) 0)
|
|
Hoffmann JA, Kafatos FC, Janeway CA, et al. Phylogenetic perspectives in innate immunity.
Science , 1999, 284 (5418) : 1313-1318 DOI:10.1126/science.284.5418.1313 ( 0) 0)
|
|
Le Moullac G, Haffner P. Environmental factors affecting immune responses in Crustacea.
Aquaculture , 2000, 191 (1-3) : 121-131 DOI:10.1016/S0044-8486(00)00422-1 ( 0) 0)
|
|
Luengen AC, Friedman CS, Raimondi PT, et al. Evaluation of mussel immune responses as indicators of contamination in San Francisco Bay.
Mar Environ Res , 2004, 57 (3) : 197-212 DOI:10.1016/S0141-1136(03)00070-9 ( 0) 0)
|
|
Monari S. Phylogeny and biogeography of pholadid bivalvebarnea (Anchomasa) with considerations on the phylogeny of Pholadoidea.
Acta Palaeontol Pol , 2009, 54 (2) : 315-335 DOI:10.4202/app.2008.0068 ( 0) 0)
|
|
Ren XY, Pan LQ, Wang L. Effect of florfenicol on selected parameters of immune and antioxidant systems, and damage indexes of juvenile Litopenaeus vannamei following oral administration.
Aquaculture , 2014, 432 (34) : 106-113 ( 0) 0)
|
|
Rijkers GT, Van Oosterom R, Van Muiswinkel WB. The immune system of cyprinid fish. Oxytetracycline and the regulation of humoral immunity in carp (Cyprinus carpio).
Vet Immunol Immunopathol , 1981, 2 (3) : 281-290 DOI:10.1016/0165-2427(81)90029-5 ( 0) 0)
|
|
Sun M, Li J, Gai CL, et al. Pharmacokinetics of difloxacin in olive flounder Paralichthys olivaceus at two water temperatures.
J Vet Pharmacol Ther , 2014, 37 (2) : 186-191 DOI:10.1111/jvp.2014.37.issue-2 ( 0) 0)
|
|
Sun M, Li J, Zhai QQ, et al. Environmental fate and pharmacokinetics of sulphamethazine in Fenneropenaeus chinensis shrimp production systems after oral administration.
Aquaculture , 2015, 7 (5) : 1973-1977 ( 0) 0)
|
|
Tumburu L, Shepard EF, Strand AE, et al. Effects of endosulfan exposure and Taura Syndrome Virus infection on the survival and molting of the marine penaeid shrimp, Litopenaeus vannamei.
Chemosphere , 2012, 86 (9) : 912-918 DOI:10.1016/j.chemosphere.2011.10.057 ( 0) 0)
|



