2. 山东省海洋资源与环境研究院 烟台 264006;
3. 山东华春渔业有限公司 东营 257236;
4. 海阳富瀚海洋科技有限公司 海阳 265116
2. Shandong Marine Resource and Environment Research Institute, Yantai 264006 ;
3. Shandong Huachun Fisheries Co., Ltd., Dongying 257236 ;
4. Haiyang Fuhan Ocean Sci-Tech Co., Ltd., Haiyang 265116
刺参(Apostichopus japonicus)又称仿刺参,属棘皮动物门(Echinodermata)、海参纲(Holothurioidea)、刺参科(Stichopodidae)、仿刺参属(Apostichopus),典型的温带种类,主要分布在35°–44°N的广大西北太平洋沿岸,包括中国黄渤海海域、俄罗斯东部沿岸、日本和韩国沿岸(廖玉麟, 1997)。刺参养殖是我国北方沿海水产养殖的重要新兴产业之一,近几年海参养殖业发展迅猛,成为具有北方地方特色的养殖产业和新的海洋经济增长点(杜佳垠, 2005)。夏季是刺参养殖管理的关键期,高温会造成海水中溶解氧下降,尤其是池塘刺参养殖方式,可降低至2 mg/L以下(刘国山等, 2014),对刺参正常生理活动和生长产生严重影响,甚至导致刺参规模性病害暴发或死亡。2013年夏季,山东沿海养殖刺参普遍遭受持续高温灾害,高温水体、低溶氧环境造成东营、烟台、威海等地池塘养殖刺参的大面积死亡,给养殖户带来巨大经济损失,严重影响刺参养殖业的健康发展。
溶解氧是溶解在水体中的分子态的氧,是水生生物赖以生存的必要条件,直接关系到水生生物的生存生长、酶活性以及代谢水平(区又君等, 2014)。水生生物大都有觉察和主动躲避低氧环境的能力,鱼类或甲壳动物等通过游到近水面或浅水区等方式逃离低氧环境。此外,生物可以通过生理生化反应的改变,如渗透调节、血蓝蛋白含量、呼吸代谢、免疫反应、抗氧化能力、能量代谢等的变化,来适应、忍耐低氧胁迫(李利, 2010)1)。对于营底栖生活且活动能力较弱的刺参来说,其养殖水体的溶解氧一般保持在5 mg/L以上(杨秀兰等, 2005)。养殖水体中适宜的溶解氧含量是刺参获得最佳生长状态的必需环境条件,缺氧会影响刺参的行为、代谢能力等(钱圆, 2011)2),低氧状态下刺参的生理生态反应对其生长和存活具有重要意义。有关低溶解氧对虾蟹(Jiang et al, 2005; 管越强等, 2010)、软体动物(Bussell et al, 2008; Cheng et al, 2004)和鱼类(沈凡等, 2010)等水生生物的影响已有很多研究报道,但刺参在养殖水体中低溶解氧环境条件下的生理生化反应及其低氧反应机制仍需进一步探索研究。
本研究以乳酸(LD)、丙二醛(MDA)和抗氧化酶系作为指标,研究低溶氧对刺参肌肉、呼吸树和消化道组织氧化应激参数的影响,探讨刺参对低氧环境的生理响应机制,为低氧环境胁迫的研究提供理论依据,为实际养殖生产中的溶氧调控和低氧应对提供指导,对保障刺参健康养殖具有重要意义。
1 材料与方法 1.1 实验材料来源与驯化实验用刺参购自山东省蓬莱安源水产有限公司。选择体长为(15.6±0.9) cm,体重为(59.0±2.8) g,活动正常的刺参,于实验室养殖水槽中暂养7 d。水温为13–15℃,DO > 7.0 mg/L,盐度为2.6,日换水1次,每天换水量为1/3–1/2,连续充气。每日投喂饵料1次,及时清理粪便。实验前禁食24 h。
1.2 实验设计选择6个规格相同的水槽(50 cm×45 cm×30 cm),实验组和对照组分别设置3个平行,加入等体积的海水,保鲜膜封闭处理。通过充入空气或N2将水体中的溶解氧调节至实验设置水平(2.0±0.2) mg/L。每隔20–30 min用YSI55型溶氧仪检测溶解氧。待溶解氧稳定后,将刺参放入准备好的水槽中,在低氧[(2.0±0.2) mg/L]条件下的0、2、4、6、8 h各取5头刺参取样保存。然后,将水槽中的海水迅速恢复至常氧[(7.0±0.2) mg/L],并在8.5、9.5、10.5 h各取5头刺参取样保存。
1) 李利.低氧胁迫对日本沼虾呼吸代谢、能量代谢和抗氧化能力的影响.河北大学硕士研究生学位论文, 2010, 2–6
2) 钱圆.刺参对不同溶氧水平和干露的生理生态学响应及其机理研究.中国海洋大学硕士研究生学位论文, 2011, 18–20
1.3 样品采集与制备分别取刺参的肌肉、呼吸树、消化道组织各0.5 g,置于2 ml冻存管中,立即放入液氮中保存,然后于–80℃冰箱冷冻保存。取0.2 g组织,按照1︰4 (肌肉)和1︰9 (呼吸树和消化道)的比例加入0.75%的生理盐水,剪碎,冰浴匀浆。将制备好的组织匀浆液离心(4℃, 12000 r/min, 10 min),取上清液,置于–80℃保存,用于测定酶活力。
1.4 检测指标和检测方法LD含量(mmol/g):乳酸脱氢酶法;MDA含量(nmol/mg):TBA法;总抗氧化能力(T-AOC; U/mg):Fe还原法;过氧化氢酶(CAT; U/mg):钼酸铵比色法测定;谷胱甘肽-S-转移酶(GST; U/mg):CDNB底物比色法;超氧化物歧化酶(SOD; U/mg):黄嘌呤氧化酶法;组织蛋白含量(mg/ml):考马斯亮蓝法测定。以上测试指标所用试剂盒均购自南京建成工程研究所。
1.5 数据统计分析所有实验数据采用SPSS19.0软件进行单因素方差分析(One-way ANOVA)。采用LSD检验方法对不同实验时间条件下的酶活力各均值进行多重比较,以P < 0.05作为差异显著的标准。
2 结果实验发现,低氧胁迫过程中,初期刺参贴壁生活,附着在水槽侧壁或底部;随着时间延长,刺参舒展、触手张开、逐渐脱离水槽侧壁;8 h后,大部分刺参停止活动,在吸管触碰其体壁时无反应,逐渐出现化皮死亡现象。
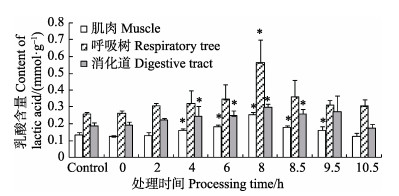
2.1 低氧胁迫对刺参各组织中LD含量的影响在低氧胁迫8 h内,随着低氧时间的延长,刺参肌肉、呼吸树和消化道组织中的LD含量均逐渐增加(图 1)。从图 1可以看出,低氧暴露4、6、8 h时,肌肉和消化道组织中的LD含量显著高于对照组(P < 0.05),且暴露至8 h时,LD含量达到最大值。呼吸树中的LD含量变化最明显,在低氧暴露达到8 h时,其LD含量(0.562 mmol/g)显著高于对照组(0.262 mmol/g)(P < 0.05),为对照组的两倍。复氧阶段,各组织中的LD含量均呈下降状态,肌肉和消化道中的LD在8.5、9.5 h时与对照组仍存在显著差异(P < 0.05),10.5 h时其LD含量与对照组无显著差异(P > 0.05)。呼吸树中的LD含量恢复较快,8.5 h时的LD含量与对照组无显著差异(P > 0.05)。
|
图 1 低氧胁迫及复氧过程中刺参不同组织中的LD含量的变化(平均值±标准误) Figure 1 Changes in the lactic acid content in different tissues of A. japonicus under hypoxia stress and during reoxygenation (Mean±SE) *表示同组织之间,与对照组相比差异显著(P < 0.05)。下同 *denoted significant differences compared with the control group within one tissue (P < 0.05). The same as below |
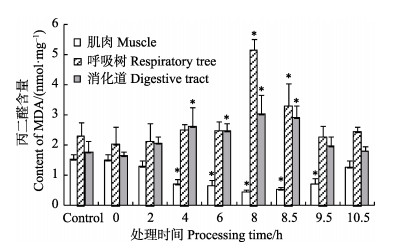
在低溶氧胁迫的8 h内,各组织中的MDA含量变化趋势并不一致(图 2)。由图 2可知,刺参呼吸树和消化道中的MDA含量均逐渐增加,而肌肉中的MDA含量则逐渐降低。消化道中的MDA含量在低氧暴露4 h后显著高于对照组(P < 0.05),而肌肉中的MDA含量显著低于对照组(P < 0.05)。低氧暴露8 h后,呼吸树中的MDA含量迅速增高至5.175 nmol/mg,显著高于对照组和其他组织(P < 0.05)。肌肉中的MDA含量在低氧暴露8 h后降低至0.538 nmol/mg,约为对照组(1.508 nmol/mg)的1/3。复氧阶段,呼吸树和消化道中MDA含量均降低,但8.5 h时仍显著高于对照组(P < 0.05),9.5 h后恢复至对照组水平(P > 0.05);肌肉中的MDA含量增加,但8.5、9.5 h时仍显著低于对照组(P < 0.05),10.5 h时,恢复至对照组水平(P > 0.05)。
|
图 2 低氧胁迫及复氧过程中刺参不同组织中的MDA含量的变化(平均值±标准误) Figure 2 Changes in the MDA content in different tissues of A. japonicus under hypoxia stress and during reoxygenation (Mean±SE) |
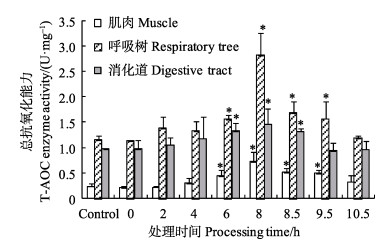
在低溶氧胁迫的8 h内,随着缺氧时间的延长,刺参各组织中的T-AOC酶活力均逐渐增加(图 3)。从图 3可以看出,低氧暴露6 h后,肌肉、呼吸树和消化道中的T-AOC酶活力均显著高于对照组(P < 0.05)。暴露至8 h时,各组织中的T-AOC酶活力达到最大值。呼吸树中的T-AOC酶活力(2.814 U/mg)变化最为明显,约为对照组(1.128 U/mg)的3倍。复氧阶段,肌肉和呼吸树中的T-AOC酶活力降低,但8.5、9.5 h时与对照组仍存在显著差异(P < 0.05),10.5 h时肌肉和呼吸树中的T-AOC酶活力恢复至对照组水平(P > 0.05);消化道中的T-AOC酶活力降低,但8.5 h时与对照组存在显著差异(P < 0.05),9.5 h后消化道中的T-AOC酶活力恢复至对照组水平(P > 0.05)。
|
图 3 低氧胁迫及复氧过程中刺参不同组织中的T-AOC酶活力的变化(平均值±标准误) Figure 3 Changes in the T-AOC activity in different tissues of A. japonicus under hypoxia stress and during reoxygenation (Mean±SE) |
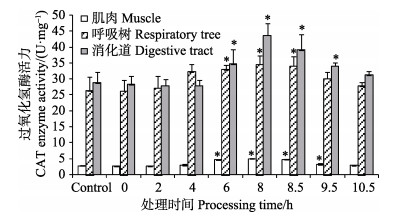
随着低溶氧胁迫时间的延长,刺参组织中的CAT酶活力逐渐增加(图 4)。由图 4可知,低氧暴露6 h后,肌肉、呼吸树和消化道组织中的CAT酶活力均显著高于对照组(P < 0.05),三者均在8 h时达到最大值。其中,肌肉中的酶活力较低,消化道中的CAT酶活力变化最明显,达到43.711 U/mg。复氧阶段,8.5、9.5 h时肌肉和消化道中的CAT酶活力降低,但与对照组仍存在显著差异(P < 0.05),10.5 h时恢复至对照组水平(P > 0.05);8.5 h时呼吸树中的CAT酶活力与对照组具有显著差异(P < 0.05),9.5 h后呼吸树中的CAT酶活力恢复至对照组水平(P > 0.05)。
|
图 4 低氧胁迫及复氧过程中刺参不同组织中的CAT酶活力的变化(平均值±标准误) Figure 4 Changes in the CAT activity in different tissues of A. japonicus under hypoxia stress and during reoxygenation (Mean±SE) |
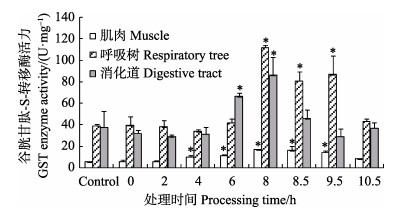
刺参呼吸树和消化道组织的GST酶活力(图 5)在低氧胁迫的前4 h变化不明显,6 h后活力迅速增高,消化道中的GST酶活力显著高于对照组(P < 0.05),呼吸树中的GST酶活力在低氧暴露8 h后显著高于对照组(P < 0.05)。肌肉组织中的GST酶活力低于其他2个组织,在低氧阶段亦呈现增加趋势,低氧暴露4 h时显著高于对照组(P < 0.05)。复氧阶段,肌肉和呼吸树中的GST酶活力降低,但8.5、9.5 h时与对照组仍存在显著差异(P < 0.05);10.5 h时肌肉、呼吸树和消化道中的GST酶活力均恢复至对照组水平(P > 0.05)。
|
图 5 低氧胁迫及复氧过程中刺参不同组织中的GST酶活力的变化(平均值±标准误) Figure 5 Changes in the GST activity in different tissues of A. japonicus under hypoxia stress and during reoxygenation (Mean±SE) |
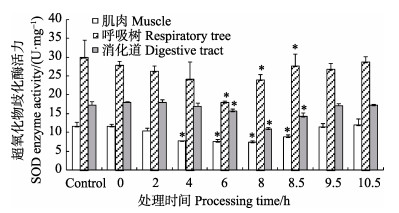
不同于T-AOC酶、CAT酶和GST酶,刺参组织中的SOD酶活力随着低氧胁迫的时间延长逐渐降低(图 6)。如图 6所示,低氧暴露4 h后,肌肉中的SOD酶活力显著低于对照组(P < 0.05),在8 h时为最小值。低氧暴露6 h后,呼吸树和消化道中的SOD酶活力显著低于对照组(P < 0.05)。复氧阶段,肌肉、呼吸树和消化道中的SOD酶活力增加,8.5 h时仍显著低于对照组(P < 0.05),9.5 h后,3个组织中的SOD酶活力恢复至对照组水平(P > 0.05)。
|
图 6 低氧胁迫及复氧过程中刺参不同组织中的SOD酶活力的变化(平均值±标准误) Figure 6 Changes in the SOD activity in different tissues of A. japonicus under hypoxia stress and during reoxygenation (Mean±SE) |
LD是在无氧或缺氧的情况下机体发生糖酵解产生的代谢产物。LD的含量可以较灵敏反应机体组织的氧供应量和代谢状态。在急性缺氧24 h过程中,凡纳滨对虾(Litopenaeus vannamei)各组织中的LD含量显著增加,恢复溶氧后LD含量回落(Zenteno-Savín et al, 2006);同样,在缺氧条件下中国明对虾(Fenneropenaeus chinensis)各组织中的LD含量增加,然而在缺氧24 h时LD含量降低,且恢复溶氧后LD含量又升高至对照组的2.3倍(韦柳枝, 2010)1)。本研究中,在低氧胁迫下刺参各组织中的LD含量增加,这是因为刺参通过厌氧代谢(糖酵解)产生能量,造成LD含量增加,恢复溶氧后,LD含量逐渐回落。不同组织的LD含量及变化幅度有所不同,肌肉和消化道在缺氧4 h时的LD含量与对照组差异显著,而呼吸树在8 h后的LD含量与对照组差异显著。对照组和低氧胁迫组刺参的不同组织中的LD含量依次为呼吸树>消化道>肌肉,呼吸树组织中LD含量在低氧胁迫8 h后达0.562 mmol/g。缺氧胁迫条件下,中国明对虾肌肉中的LD含量为(1.316±0.152) mg/g(韦柳枝, 2010)1),Mercier等(2006)报道的低氧胁迫影响下凡纳滨对虾肌肉组织中的LD含量最高,为(0.760±0.086) mg/g,且均高于本研究中刺参的测定值。一般来说,动物通过厌氧代谢产生能量来维持自身代谢以适应缺氧环境(Guppy et al, 1994),LD含量的差异可能与物种、饲养环境、驯化条件以及生长习性有关。刺参喜欢附着贴壁生活,运动范围小,肌肉产生的LD含量比其他水产动物要少,而呼吸树是刺参活动最为活跃组织,其LD含量相对较高。
1) 贾旭颖.淡水养殖凡纳滨对虾(Litopenaeus vannamei)对环境胁迫的生理生态响应.中国海洋大学博士研究生学位论文, 2014, 62–78
3.2 低氧胁迫对刺参各组织中MDA含量的影响MDA属于脂质过氧化物,是机体通过自身酶系统和非酶系统产生的氧自由基作用于生物膜产生的(贾旭颖, 2014)1),它能够引起机体组织细胞功能受损,用于指示机体脂质过氧化作用以及细胞功能受损情况(Cossu et al, 2000)。研究表明,生物在逆境条件下,其体内的MDA含量有所升高。低氧胁迫对苹果砧木幼苗影响的研究发现,低氧胁迫使叶片和根中的MDA含量增加,且在胁迫期呈现先升后降再升趋势(李翠英等, 2008);重金属污染物如Cr、Hg和Cu等胁迫对鱼影响中发现,随着浓度的升高和暴露时间的延长,鱼肝和卵巢内MDA含量逐渐升高(Berntssen et al, 2003; Roméo et al, 2000; 王学锋等, 2010);低盐度胁迫对鲻鱼(Mugil cephalus)幼鱼各组织影响的研究表明,低盐度水体中各组织的MDA含量增加,盐度越低,MDA含量越高,随着时间的延长,各组织的MDA含量逐渐降低至趋于稳定(吴庆元, 2014)2);在刺参逆境胁迫响应的研究中发现,刺参组织中的MDA含量随着亚硝酸氮胁迫浓度的增加而增加,并且随着时间的延长,MDA含量也在增加(陈芸燕, 2013)3)。本研究中,随着低氧胁迫时间的延长,刺参呼吸树和消化道中的MDA含量升高,这是因为低氧环境使机体内的抗超氧阴离子活力减弱,导致超氧阴离子攻击呼吸树和消化道的生物膜磷脂中不饱和脂肪酸双键而导致脂质发生过氧化反应,使其脂质过氧化物(MDA)升高。而肌肉中的MDA含量降低可能是因为肌肉内抗氧化酶(SOD、T-AOC和CAT等)活性较高,机体内较多的超氧阴离子被T-AOC、SOD和CAT清除,还原成H2O2,机体内积聚少量的氧自由基,因此,肌肉内产生的脂质过氧化物较少。
2) 吴庆元.低盐胁迫对鲻鱼(Mugil cephalus)幼鱼生理生化的影响.上海海洋大学硕士研究生学位论文, 2014, 25–31
3) 陈芸燕.刺参(Apostichopus japonicus Selenka)对亚硝酸氮胁迫的生理生态学响应及其机制研究.中国海洋大学硕士研究生学位论文, 2013, 24–44
3.3 低氧胁迫对刺参各组织中抗氧化酶系的影响在正常的生理条件下,生物体通过不断地消除和产生自由基和活性氧,分解氧化物,防止机体受到氧化损害。该过程主要依赖机体的抗氧化防御体系,主要包括CAT、T-AOC、SOD及GST等抗氧化酶(王宏伟等, 2008)。本研究中,低溶氧胁迫8 h内,随着低氧胁迫时间的延长,T-AOC、GST和CAT活力逐渐增加;SOD活力逐渐降低,恢复溶氧后逐渐恢复至正常水平。这种变化可能是因为,低氧胁迫环境中过多的超氧阴离子被SOD还原生成了H2O2,低氧环境中超氧阴离子的减少导致刺参组织中的SOD活力降低,而H2O2的增多引起了体内过氧化物增加,从而引起机体内抗氧化防御体系产生作用。复氧初期,刺参各组织的CAT、T-AOC及GST活力较8 h时降低,但仍显著高于对照组;SOD活力与8 h时相比有所升高,但仍显著低于对照组。本研究中的T-AOC、CAT、SOD和GST活力结果显示,低氧阶段和复氧初期的实验刺参发生了抗氧化防御反应。这与管越强等(2010)报道的低溶氧对日本沼虾(Macrobrachium nipponense)呼吸代谢和抗氧化能力的影响以及Zenteno-Savín等(2006)报道的缺氧环境对虾的抗氧化能力的影响的结果一致。证明了在低氧胁迫和复氧初期阶段机体发生了显著的抗氧化防御现象,这可能是机体面对低氧环境胁迫所作出的一种自我保护。郑慧等(2014)发现缺氧暴露时,刺参的SOD活力降低,恢复溶氧后SOD恢复至正常水平。此外,相同处理条件下刺参各组织间抗氧化酶系存在一定的差异,这说明不同的组织对低氧胁迫的敏感程度不同。
4 结论本研究立足于低氧和复氧阶段刺参的生理响应,从代谢物和抗氧化能力方面探讨了低氧胁迫对刺参的生理生化指标的影响及作用机理。对刺参养殖实践中水质调控、维持适宜的溶氧以促进刺参健康养殖具有指导意义。在此研究基础上,随着生物逆境响应研究和分子生物学技术的发展,可进一步对温度因子和低溶氧的协同胁迫作用以及刺参逆境响应的内在分子机制进行探索,以更深入的揭示刺参低氧逆境胁迫下的响应机制。
王宏伟, 曹向可, 钱庆增, 等. 饲料中锰对日本沼虾抗氧化酶活性的影响.
河北大学学报(自然科学版) , 2008, 28 (3) : 300-304 ( 0) 0)
|
|
王学锋, 陈海刚, 蔡文贵, 等. 汞离子胁迫对红鳍笛鲷抗氧化酶及乙酰胆碱酯酶活性的影响.
水产学报 , 2010, 34 (12) : 1829-1836 ( 0) 0)
|
|
区又君, 范春燕, 李加儿, 等. 急性低氧胁迫对卵形鲳鲹选育群体血液生化指标的影响.
海洋学报 , 2014, 36 (4) : 126-131 ( 0) 0)
|
|
代国杰, 朱建津, 高琳琳, 等. 褪黑素对小鼠抗氧化作用的影响.
食品工业科技 , 2010, 31 (3) : 347-350 ( 0) 0)
|
|
刘国山, 蔡星媛, 佟飞, 等. 威海双岛湾人工鱼礁区刺参大面积死亡原因初探.
渔业信息与战略 , 2014, 29 (2) : 122-129 ( 0) 0)
|
|
杜佳垠. 刺参分布·品系与引种问题.
北京水产 , 2005 (2) : 55-57 ( 0) 0)
|
|
李桂峰, 康裕财, 孙际佳, 等. 酵母多糖对赤眼鳟非特异性免疫机能的影响.
中山大学学报(自然科学版) , 2003, 42 (4) : 55-58 ( 0) 0)
|
|
李翠英, 马锋旺, 白团辉, 等. 低氧胁迫对苹果砧木幼苗生长与生理特性的影响.
西北植物学报 , 2008, 28 (5) : 1001-1006 ( 0) 0)
|
|
杨秀兰, 王鹏飞, 焦玉龙, 等. 刺参中间培育及生长特性的研究.
齐鲁渔业 , 2005, 22 (10) : 1-4 ( 0) 0)
|
|
沈凡, 樊启学, 杨凯, 等. 不同溶氧条件下黄颡鱼免疫机能及抗病力的研究.
淡水渔业 , 2010, 40 (4) : 44-49, 55 ( 0) 0)
|
|
郑慧, 李彬, 荣小军, 等. 盐度和溶解氧对刺参非特异性免疫酶活性的影响.
渔业科学进展 , 2014, 35 (1) : 118-124 ( 0) 0)
|
|
管越强, 李利, 王慧春, 等. 低氧胁迫对日本沼虾呼吸代谢和抗氧化能力的影响.
河北大学学报(自然科学版) , 2010, 30 (3) : 301-306 ( 0) 0)
|
|
廖玉麟.
中国动物志棘皮动物门海参纲. 北京: 科学出版社, 1997 .
( 0) 0)
|
|
Berntssen MH, Aatland A, Handy RD. Chronic dietary mercury exposure causes oxidative stress, brain lesions, and altered behaviour in Atlantic salmon (Salmo salar) parr.
Aquat Toxicol , 2003, 65 (1) : 55-72 DOI:10.1016/S0166-445X(03)00104-8 ( 0) 0)
|
|
Bussell JA, Gidman EA, Causton DR, et al. Changes in the immune response and metabolic fingerprint of the mussel, Mytilus edulis (Linnaeus) in response to lowered salinity and physical stress.
J Exp Mar Biol Ecol , 2008, 358 (1) : 78-85 DOI:10.1016/j.jembe.2008.01.018 ( 0) 0)
|
|
Cheng W, Liu CH, Cheng SY, et al. Effect of dissolved oxygen on the acid-base balance and ion concentration of Taiwan abalone Haliotis diversicolor supertexta.
Aquaculture , 2004, 231 (1) : 573-586 ( 0) 0)
|
|
Cossu C, Doyotte A, Babut M, et al. Antioxidant biomarkers in freshwater bivalves, Unio tumidus, in response to different contamination profiles of aquatic sediments.
Ecotoxicol Environ Saf , 2000, 45 (2) : 106-121 DOI:10.1006/eesa.1999.1842 ( 0) 0)
|
|
Guppy M, Fuery CJ, Flanigan JE. Biochemical principles of metabolic depression.
Comp Biochem Physiol Part B Biochem Mol Biol , 1994, 109 (2-3) : 175-189 DOI:10.1016/0305-0491(94)90001-9 ( 0) 0)
|
|
Jiang LX, Pan LQ, Fang B. Effect of dissolved oxygen on immune parameters of the white shrimp Litopenaeus vannamei.
Fish Shellfish Immunol , 2005, 18 (2) : 185-188 DOI:10.1016/j.fsi.2004.07.001 ( 0) 0)
|
|
Mercier L, Palacios E, Campa-Córdova áI, et al. Metabolic and immune responses in Pacific whiteleg shrimp Litopenaeus vannamei exposed to a repeated handling stress.
Aquaculture , 2006, 258 : 633-640 DOI:10.1016/j.aquaculture.2006.04.036 ( 0) 0)
|
|
Roméo M, Bennani N, Gnassia-Barelli M, et al. Cadmium and copper display different responses towards oxidative stress in the kidney of the sea bass Dicentrarchus labrax.
Aquat Toxicol , 2000, 48 (2-3) : 185-194 DOI:10.1016/S0166-445X(99)00039-9 ( 0) 0)
|
|
Zenteno-Savín T, Saldierna R, Ahuejote-Sandoval M. Superoxide radical production in response to environmental hypoxia in cultured shrimp.
Comp Biochem Physiol C Toxicol Pharmacol , 2006, 142 (3-4) : 301-308 DOI:10.1016/j.cbpc.2005.11.001 ( 0) 0)
|



