2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 大连海洋大学水产与生命学院 大连 116023
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071 ;
3. College of Fisheries and Life Sciences, Dalian Ocean University, Dalian 116023
中国明对虾(Fenneropenaeus chinensis)是我国重要的海水养殖种类,具有较高的经济价值。在中国明对虾养殖中,由于过量投饵、施肥以及排泄物的积累,尤其是温度和pH值上升致使水体中氨氮升高,中国明对虾长期生活在高NH3浓度的水体中,影响体内氮废物的排泄及氨代谢。若NH3从水体渗入组织液内,就会形成血氨中毒(乔顺风等, 2006)。作为水产养殖环境中普遍存在的一种有毒物质,氨氮是重要的环境胁迫因子,影响对虾的呼吸(Chen et al, 1993)、代谢(Chen et al, 1994)、免疫(Cheng et al, 2002)、渗透调节(Chen et al, 2000)、排泄(Chen et al, 1992)及蜕皮和生长(Koo et al, 2005),甚至会导致死亡(王娟等, 2007)。
谷氨酸脱氢酶(Glutamate dehydrogenase, GDH)是一种利用NAD或NADP辅助因子,催化谷氨酸氧化脱氨基转变成α-同戊二酸的线粒体酶(Nisman, 1954; Frieden, 1963; Pahlich et al, 1971; Smith et al, 1975),产物为氨,该反应为可逆反应,在动态反应中,谷氨酸的形成超过氨的形成(即在上述反应式中ΔG0≈ 30 kJ/mol),氨的浓度越高,毒性越大,因此,这个平衡点在生理学上至关重要。
微生物和动植物对氨的同化作用主要是依靠GDH和谷氨酰胺合成酶(GS)的联合作用,20世纪70年代,学者们先后发现细菌(Tempest et al, 1970)和植物(Lea et al, 1974)可分别利用GDH或GS来完成氨氮的代谢。动物中,GDH将氨氮转化成谷氨酸加以储存是氨氮解毒的一种重要途径。此外,Pennington等(2003)在埃及按蚊体内发现一种脯氨酸循环,能够短暂地将氨基酸脱氨基产生的氨氮衍生物转化为无毒物质加以储存。Scaraffia等(2005)研究指出,GDH催化形成谷氨酸反应(去氨化方向)在合成脯氨酸、维持脯氨酸循环方面十分重要。Iwata等(1981)在研究弹涂鱼的氨氮解毒途径时发现,GDH(去氨氮方向)在硬骨鱼类尿素合成中起着关键作用,且去氨氮方向的酶活显著高于哺乳类的(Wilson, 1973; Walton et al, 1977)。甲壳动物中关于GDH基因的全长克隆较少,Li等(2009)对凡纳滨对虾的GDH基因的克隆发现,凡纳滨对虾体内存在2种GDH基因,GDH A和GDH B,二者前462个氨基酸序列完全相同;Wang等(2012)对中华绒螯蟹的GDH基因进行了克隆,该基因开放阅读框长度为1695 bp,编码564氨基酸。此外,熊泽泉(2010)1)还对5种十足目甲壳动物的GDH序列进行了部分克隆,发现GDH氨基酸序列十分保守,在真核生物中均存在一段氨基酸序列-GGVTVs。
1) 熊泽泉.十足目(Crustacea: Deeapoda)经济甲壳动物谷氨酸脱氢酶基因的研究.华东师范大学硕士研究生学位论文, 2009, 13–30
本研究利用本实验室中国明对虾转录组测序所得的GDH基因片段,采用RACE技术,克隆获得该基因的cDNA全长序列,并对其在氨氮浓度胁迫下的组织表达规律进行初步研究,探究其在氨氮代谢过程中的作用,为中国明对虾健康养殖提供参考。
1 材料与方法 1.1 材料采用中国水产科学研究院黄海水产研究所培育的中国明对虾“黄海3号”,体长为(9.27±0.37) cm,体重为(10.48±1.40) g。实验前7 d将中国明对虾“黄海3号”放入200 L的PVC桶中暂养,每桶20尾。暂养期间,养殖水温控制在(25.0±1.0)℃,盐度为28,pH为8.5±0.2,持续充气,每天换水1/3,投喂配合饲料。TRIzol Reagent购自Invitrogen公司;SMARTTM RACE Amplification Kit和Advantage 2 PCR Kit购于Clontech公司;DNA胶回收试剂盒购自生工生物工程(上海)股份有限公司;反转录试剂和pMD18-T载体以及大肠杆菌TOP 10感受态细胞均购自TaKaRa公司。
1.2 氨氮胁迫实验氨氮胁迫实验共设2组,氨氮浓度设置参照王娟等(2007),分别为对照组(养殖池塘海水)和氨氮胁迫组(16 mg/L)。采用奈氏试剂法测定氨氮浓度,实测值分别为(1.147±0.123) mg/L和(16.651±0.546) mg/L。实验组采用浓度为1 g/L的NH4Cl溶液进行调整。将暂养的健康中国明对虾随机移入各实验组中,每组3个平行,每个平行20尾对虾,实验期间每天换水1次,换水量在2/3以上,换水后重新胁迫。每天早、中、晚各投喂颗粒饲料1次。各组分别于胁迫后的1、3、6、12、24、48、72 h取肌肉和鳃组织,每个时间点取6尾,液氮保存,用于RNA提取。
1.3 cDNA全长的克隆及测序根据本实验室454转录组测序所得的GDH基因片段,利用Primer Premier 5.0软件设计3'RACE和5'RACE特异性引物,所有引物均由生工生物工程(上海)股份有限公司合成。
提取健康中国明对虾肌肉组织的RNA,使用SMARTTM RACE Amplification Kit制备RACE cDNA模板。3'和5'末端扩增使用Advantage 2 PCR Kit进行。3'RACE使用引物GDH3'-1(表 1)和通用引物UPM配对进行3'端扩增;5'RACE使用引物GDH5'-3(表 1)和通用引物UPM进行5'端扩增。反应程序:94℃ 3 min;94℃ 30 s,72℃ 3 min,5个循环;94℃ 30 s,70℃ 30 s,72℃ 3 min,5个循环;94℃ 30 s,68℃ 30 s,72℃ 3 min,30个循环;72℃ 10 min,4℃保存。3'和5'RACE扩增产物经1.5%琼脂糖凝胶电泳检测,用胶回收试剂盒回收目的片段,与pMD18-T载体连接,重组质粒转化到大肠杆菌Top10感受态细胞,阳性克隆经菌落PCR鉴定后,送上海桑尼生物科技有限公司测序。
|
|
表 1 本研究所用引物序列 Table 1 Sequences of the primers used in this study |
中国明对虾各组织总RNA提取利用TRIzol试剂,方法参照Invitrogen说明书;核酸定量仪(Thermo, NanoDrop 2000)和1.0%琼脂糖凝胶电泳检测RNA的质量及完整性。使用DNaseⅠRNase-free (Fermentas)试剂盒处理提取的总RNA,以去除DNA污染。
cDNA合成体系(20 μl):10 μl总RNA,2 μl Oligo DT(50 μmol/L),72℃水浴5 min,冰浴2 min,离心数秒使溶液聚集于底部。之后向管中依次加入1.0 μl dNTP Mixture(each 10 mmol/L)、5×M-MLV Buffer 4.0 μl、0.5 μl RNase Inhibitor(40 μl/ml, TaKaRa)和1.0 μl M-MLV反转录酶(TaKaRa),用DEPC补足体积;42℃孵育l h;72℃孵育15 min;4℃孵育20 min。合成的cDNA用于中国明对虾GDH基因的Real-time PCR检测。
1.5 序列分析利用DNAStar软件中的SeqMan程序对测序所得结果进行载体序列去除,然后用EditSeq程序进行开放阅读框的预测并翻译氨基酸。中国明对虾谷氨酸脱氢酶(FcGDH)基因的核苷酸序列和推导氨基酸序列使用BLAST(http://www.blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对。利用Protparam(http://web.expasy.org/protparam/)进行蛋白质理化性质预测。利用SignalP3.0(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽的预测。利用NCBI的保守结构域(CDD)数据库(http://www.blast.ncbi.nlm.nih.gov/Blast.cgi)进行保守结构域和特殊位点的预测。利用NetNGlyc 1.0 Serve (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行N-糖基化位点的预测。运用DNAMAN进行多重序列比对。利用MEGA 4.0软件,以邻接法(Neighbor-joining)构建系统进化树。
1.6 FcGDH组织分布特征的分析分别根据中国明对虾18S rRNA和FcGDH基因,设计正反引物(18S-F/R及GDH-Primer F/R) (表 1),用于Real-time PCR检测。按照前述选择6尾健康的中国明对虾,取其肌肉、鳃、肝胰腺、胃、肠、淋巴及血淋巴保存于液氮,用于各组织RNA的提取并反转录合成cDNA。取不同组织cDNA各1 μl,利用Real-time PCR对不同组织中FcGDH的表达情况进行检测。以18S rRNA作为内参基因,反应体系为20 μl:10 μl SYBR® Premix ExTaqTMⅡ(×2),0.8 μl 10 μmol/L引物GDH Primer F,0.8 μl 10 μmol/L引物GDH Primer R,0.4 μl ROX Reference DyeⅡ(×50),2.0 μl cDNA,6.0 μl dH2O。反应程序:95℃ 30 s;95℃ 5 s, 60℃ 34 s, 40个循环;95℃ 15 s, 60℃ 1 min, 95℃ 15 s。采用2-DDCt法计算FcGDH基因的相对表达量,用SPSS 11.0软件进行分析。
1.7 氨氮胁迫下FcGDH基因的表达变化分析分别提取胁迫后各实验组不同时间中国明对虾肌肉和鳃的总RNA,逆转录合成cDNA。取各个稀释后的cDNA样品1 μl,18S rRNA基因作为内参,以40个循环扩增目的基因和内标基因片段,检测不同浓度氨氮胁迫下中国明对虾鳃和肌肉中FcGDH基因的表达量。反应体系、反应程序、数据处理及分析同上所述。
2 结果 2.1 FcGDH基因cDNA的克隆与序列分析采用RACE方法扩增获得FcGDH基因全长cDNA,GenBank登录号:KF781120。GDH基因全长1779 bp,包括1个1659 bp的开放阅读框(ORF)、40 bp的5'端非编码区(UTP)和80 bp的3'非编码区,其中包括1个终止密码子(TAA)和PolyA尾。
氨基酸序列分析(图 1)显示,FcGDH编码1个由552个氨基酸组成的蛋白质,分子量为61.3 kDa,理论等电点为6.54。该序列包含2个超家族结构,分别为ELFV dehydrog N和NAD bind amino acid DH,含10个NAD(P)结合位点、4个GDP结合位点和14个GLFV脱氢酶活性位点;同时,SignalP3.0预测显示,此氨基酸序列N端前29个氨基酸组成信号肽,信号肽的断裂点位于第29–30之间。

|
图 1 FcGDH基因的核苷酸序列及其推导的氨基酸序列 Figure 1 Nucleotide sequence and deduced amino acid sequence of FcGDH gene 粗方框中ATG为起始密码子;*为终止密码子;↑为信号肽切割位点;虚线为GLFV脱氢酶活性位点;下划线为NAD(P)结合位点;椭圆为GDP结合位点;阴影为ATP结合位点;2个大框中分别为ELFV dehydrog N super family和NAD bind amino acid DH super family Start codon (ATG) was marked with thick box. The asterisk indicated the stop codon. The cleavage site of the mitochondrial signal peptide was indicated with an arrow. The GLFV dehydrogenases active sites, NAD(P) binding sites, GDP binding sites were annotated with dotted line, underline and ellipses, respectively. The completed ELFV dehydrog N super family and NAD bind amino acid DH super family domain were boxed |
使用在线软件BLAST对FcGDH基因编码的氨基酸序列与其他物种的GDH氨基酸序列进行同源性比较,结果显示,与甲壳类的凡纳滨对虾(Litopenaeus vannamei)、中华绒螯蟹(Eriocheir sinensis)最为相似,同源性分别为98%和89%。与节肢动物黑腹果蝇(Drosophila melanogaster)和埃及按蚊(Aedes aegypti)的同源性分别为78%和74%。与脊椎动物GDH氨基酸序列的同源性也很高,如与泥鳅(Misgurnus anguillicaudatus)、小家鼠(Mus musculus)和斑马鱼(Danio rerio)的同源性分别为75%、74%和70%。
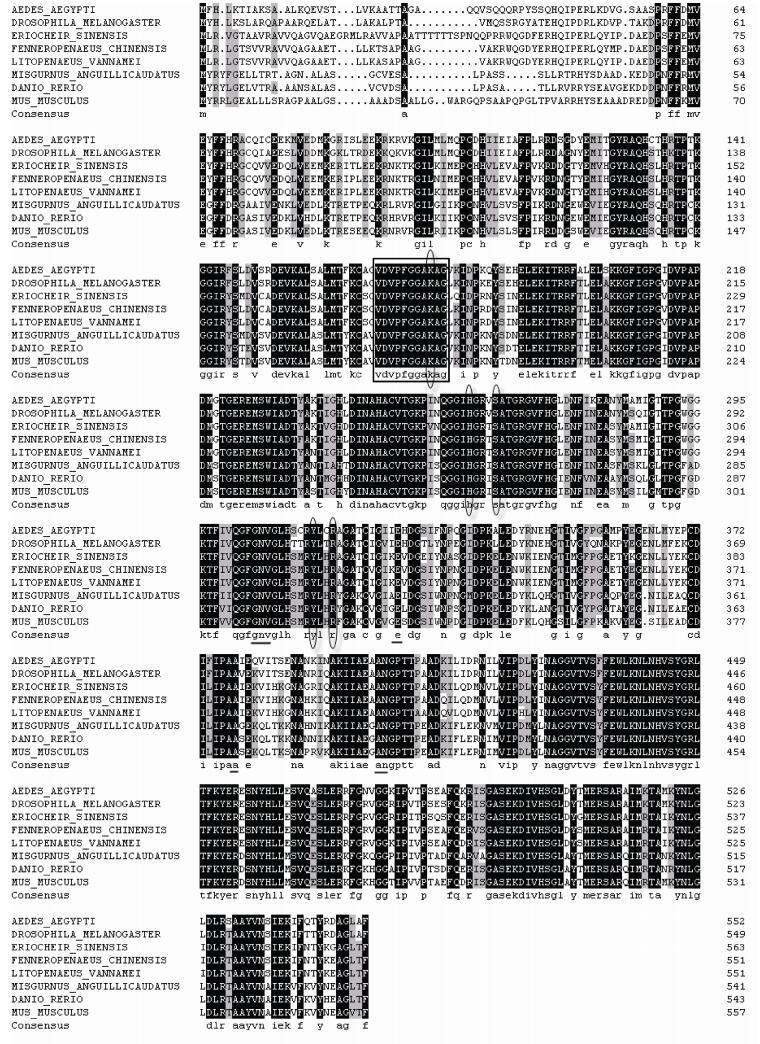
利用DNAMAN软件将FcGDH氨基酸序列与其他物种的氨基酸序列比对发现,FcGDH氨基酸具有9个GLFV脱氢酶家族保守活性位点,NAD(P)结合位点和GDP结合位点也显示出极高的保守性(图 2)。
|
图 2 中国明对虾FcGDH氨基酸与其他物种GDH氨基酸序列的比较 Figure 2 Alignment of F. chinensis GDH amino acid sequence with those of other species 方框中为GLFV脱氢酶活性位点;下划线为NAD(P)结合位点;椭圆为GDP结合位点 Box: GLFV dehydrogenases active site; Underline: NAD(P) binding site; Oval: GDP binding site |
通过MEGA 4.0软件Neighbor-Joining法构建NJ系统进化树(图 3),进化分析显示,节肢动物门GDH聚类亲缘关系较近,而与脊椎动物的鱼类、爬行以及哺乳类的亲缘关系较远。不同物种GDH氨基酸序列比较发现,FcGDH与甲壳纲的GDH最为相似(89%–98%)。与其他节肢动物的相似性(74%–82%)高于脊椎动物(70%–76%)。FcGDH氨基酸序列与凡纳滨对虾GDH聚为一支,之后的聚类次序依次为中华绒螯蟹、黑腹果蝇、埃及按蚊。

|
图 3 利用MEGA 4.0软件构建的基于GDH氨基酸序列的NJ系统进化树 Figure 3 NJ phylogenetic tree based on GDH amino acid sequences by MEGA 4.0 |
利用RT-PCR分析FcGDH基因在不同组织中的表达水平,结果显示,FcGDH基因在中国明对虾肌肉、鳃、肝胰腺、胃、肠、淋巴和血淋巴中均有表达,其中,肌肉中表达量最高,其次为鳃和肝胰腺,在淋巴和血淋巴中表达量最低(图 4)。

|
图 4 FcGDH基因在不同组织中的表达 Figure 4 FcGDH gene expression in different tissues |
氨氮胁迫后中国明对虾肌肉中FcGDH基因的相对表达量变化见图 5。结果显示,与对照组相比,胁迫过程中FcGDH基因上调,随时间变化呈上升–下降–上升的趋势,于48 h达到最大值,并极显著高于对照组(P < 0.01)。

|
图 5 FcGDH基因在肌肉组织中的表达水平随氨氮胁迫时间的变化 Figure 5 Expression profiles of FcGDH gene in muscle after ambient ammonia stress **代表同一时间实验组与对照组差异极显著(P < 0.01) ** indicated highly significant differences (P < 0.01) at the same time point |
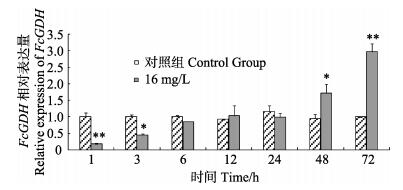
氨氮胁迫后中国明对虾肝胰腺组织中FcGDH基因的表达变化见图 6。3 h之前,FcGDH基因表达被抑制,表达量下调,显著低于对照组(P < 0.05);6–24 h逐渐恢复;48–72 h基因表达量上调,并于72 h达到极值,并极显著高于对照组(P < 0.01);整个胁迫过程中呈现上升的趋势。
|
图 6 FcGDH基因肝胰腺组织中表达水平随氨氮胁迫时间的变化 Figure 6 Expression profiles of FcGDH gene in hepatopancreas after ambient ammonia stress **代表同一时间实验组与对照组差异极显著(P < 0.01),*代表实验组与对照组差异显著(P < 0.05) ** indicated highly significant differences (P < 0.01), * indicated significant differences (P < 0.05), at the same time point |
GDH是水生动物氨基酸代谢的关键酶(Willett et al, 2003),在无脊椎甲壳动物中,仅Li等(2009)和Wang等(2012)对凡纳滨对虾和中华绒螯蟹GDH cDNA全长进行了克隆。本研究通过对中国明对虾转各物种GOT序列登录号:凡纳滨对虾L. vannamei (ACC95446.1)、中华绒螯蟹E. sinensis (AEO72077.1)、黑腹果蝇D. melanogaster (CAA82304.1)、埃及按蚊A. aegypti (XP_001660861.1)、小家鼠M. musculus (NP_032159.1)、斑马鱼D. rerio (NP_997741.1)、泥鳅M. anguillicaudatus (AEX31556.1)、家蚕Bombyx mori (NP_001040245.1)、佛罗里达弓背蚁Camponotus floridanus (EFN70808.1)、印度跳蚁Harpegnathos saltator (EFN77465.1)、玉带凤蝶Papilio polytes (BAM20330.1)、非洲爪蟾蜍Xenopus laevis (NP_001087023.1)、野猪Sus scrofa (NP_001231430.1)、裸鼹鼠Heterocephalus glaber (EHB00320.1)录组序列查找,获得GDH基因的部分片段序列,首次克隆获取该基因全长,命名为FcGDH。该基因全长1779 bp,包括1个1659 bp的ORF,编码552个氨基酸,经多重序列比对发现,该氨基酸序列高度保守,N端具有一段信号肽序列,这一点与Li等(2009)克隆的凡纳滨对虾2种GDH序列和Wang等(2012)克隆的中华绒螯蟹GDH序列相一致。FcGDH基因属于ELFV脱氢酶家族,具有一段多种脱氢酶活性位点(Glu/Leu/Phe/Val),与熊泽泉(2010)1)对十足目5种甲壳动物的GDH基因部分克隆得到的结果相一致。多重比对发现,这段氨基酸序列与其他物种同样十分相似,只有脊椎动物和埃及按蚊在该活性位点的第10位由亮氨酸变为缬氨酸,埃及按蚊和中华绒螯蟹在第13位天冬酰胺变为天冬氨酸。此外,在谷氨酸丰富的区域还存在1个保守的赖氨酸活性位点(Nagata et al, 1988; Takada et al, 1991; Britton et al, 1992; Benachenhou-Lahfa et al, 1993; Tang et al, 1993)。一般认为,GDH可分为4种:GDH-1和GDH-2是一种小型六聚体酶,广泛分布于动植物组织中,在氨同化作用中十分重要(Miñambres et al, 2000; Brown et al, 1997);GDH-3是一类分子较大的GDH,作用于谷氨酸盐的分解代谢过程,只在真菌和原生生物中有所发现(Andersson et al, 2003);GDH-4仅发现于真菌中(Miñambres et al, 2000)。
1) 熊泽泉.十足目(Crustacea: Deeapoda)经济甲壳动物谷氨酸脱氢酶基因的研究.华东师范大学硕士研究生学位论文, 2009, 13–30
3.2 FcGDH基因组织表达分析本研究利用RT-PCR技术对FcGDH基因在不同组织中的表达量进行了测定,发现FcGDH基因在各组织中广泛表达,但各组织中的表达量差异很大,FcGDH基因在肌肉中表达量最高,这与Li等(2009)和Wang等(2012)中凡纳滨对虾和中华绒螯蟹GDH基因组织表达结果一致。这种组织特异性可能与GDH参与谷氨酸、丙氨酸和脯氨酸循环有关(Willett et al, 2003; Plaitakis et al, 2001)。肌肉是蛋白质沉积的主要组织,也可能是氨基酸储存的主要组织,大部分的氨基酸代谢发生在肌肉中,因此,在氨基酸分解代谢过程中的GDH主要在肌肉中表达。
3.3 FcGDH基因在氨氮胁迫下的表达规律分析通常情况下,GDH可催化机体中各组织(包括脑)(Cooper et al, 1987)氨基酸代谢产生的氨与α-酮戊二酸反应,生成谷氨酸,这是消耗体内氨的主要方式(Jürss et al, 1995)。在排尿素动物体内,GDH和GS联系紧密,并称为“氨清除体系”(王镜岩等, 2002),GDH(去氨氮方向)催化形成谷氨酸,随后GS催化谷氨酸反应形成无毒的谷氨酰胺加以储存,在排尿素动物体内尿素循环欠缺情况时,这一“氨清除体系”起到降低生物体内氨氮的作用。正常情况下,甲壳动物体内氮的主要代谢产物是氨态氮,体内60%–70%的氮是以氨态氮的形式由鳃排出体外(Regnault et al, 1987),当甲壳动物受到氨氮胁迫,体内氨氮浓度过高时,甲壳动物的氨氮解毒代谢途径主要包括:1) 降低鳃组织对NH3的通透性,增加对NH4+的排出;2) 减少体内蛋白质和氨基酸的分解,降低内生性氨氮;3) 合成谷氨酰胺、谷氨酸、丙氨酸、脯氨酸等无毒害作用的氨基酸;4) 加强尿素循环,增加尿素氮的排泄(岳峰, 2010)2)。
2)岳峰.三疣梭子蟹在氨氮胁迫下免疫应答与解毒代谢机制的研究.中国海洋大学硕士研究生学位论文, 2010
为了研究FcGDH基因在氨氮代谢中的作用,本研究测定了FcGDH基因在2种不同组织中的变化规律。肌肉组织中,胁迫组FcGDH基因的表达量上调并于48 h达到极值,说明FcGDH基因对氨氮胁迫具有积极的应答反应,这可能是GDH参与氨基酸(包括谷氨酸、脯氨酸和谷氨酰胺)合成以减少体内氨氮含量的缘故。Chen等(2000)对不同浓度NH4Cl胁迫下斑节对虾体内的氨基酸含量进行了研究,发现肌肉组织中谷氨酸的含量随NH4Cl浓度的增大而减少,谷氨酰胺的含量随NH4Cl浓度的升高而增加,而GDH活力在氨氮胁迫下升高已在青蟹和黄道蟹中被证实(King et al, 1985),这可能是GDH催化合成的谷氨酸又作为底物参与了谷氨酰胺的合成。Scaraffia等(2005)研究表明,在对埃及按蚊饲喂血粉后(增加蛋白含量,使体内氨氮含量增大),AaGDH在脂肪体(具有解毒和排泄作用)和中肠(消化吸收作用)的表达量急剧上调,并认为这是因为GDH基因参与了机体的谷氨酸和脯氨酸合成,加以储存以降低氨氮毒性。Srivastava等(1987)研究表明,植物在高温、干旱、高盐以及病原菌侵染等逆境条件下,GDH的活性均会升高,其原因可能是:在逆境中容易造成植物体蛋白质降解,释放出大量的铵引起植物中毒,此时GS/GOGAT(谷氨酰胺合成酶/谷氨酸合成酶)途径受到限制,GDH在缓解植物铵中毒的过程中发挥主要作用。
肝胰腺是甲壳动物解毒的重要组织,FcGDH基因在肝胰腺中的表达规律与肌肉中完全不同,胁迫初期FcGDH基因被抑制,随后呈逐渐上升的趋势,并于72 h达到极值。这种现象可能是由16 mg/L组的高氨氮浓度引起的,从1 h FcGDH基因的表达量也可看出16 mg/L组的表达量极显著低于对照组。张克俭(1993)指出,当氮浓度高于10.44 mg/L时,中国明对虾肝胰腺遭到破坏,吸收细胞转化为分泌细胞,并逐渐解体。而随着胁迫时间的延长,对虾对高氨氮环境逐渐适应,FcGDH基因表达量逐渐上升并于48 h上调,加速体内氨氮的转化及谷氨酸的合成。但Chen等(2000)的研究表明,NH4Cl胁迫后肝胰腺中的游离氨基酸含量下降,其中,谷氨酸含量降低了27%,这有可能是氨基酸分解代谢产能的缘故。在胁迫后期,胁迫组FcGDH基因表达量上调,且显著高于对照组(P < 0.05),说明FcGDH基因在氨氮解毒代谢过程中发挥了重要作用。
本实验针对GDH在中国明对虾氨氮代谢过程中的作用进行了研究,对FcGDH基因进行了cDNA全长的克隆,并研究了其在氨氮胁迫下肌肉和肝胰腺组织内的表达规律,发现其在不同组织中表达模式有所差异,但胁迫组基因表达量较对照组有所上调,进一步证明了FcGDH在降低中国明对虾体内氨氮方面具有重要作用,为深入研究中国明对虾氨氮代谢途径提供了依据。
王娟, 曲克明, 刘海英, 等. 不同溶氧条件下亚硝酸盐和氨氮对中国对虾的急性毒性效应.
海洋水产研究 , 2007, 28 (6) : 1-6 ( 0) 0)
|
|
王镜岩, 朱胜庚, 徐长法.
生物化学. 北京: 高等教育出版社, 2002 : 306 -308.
( 0) 0)
|
|
乔顺风, 刘恒义, 谨秀云. 养殖水体氨氮积累危害与生物利用.
河北渔业 , 2006 (1) : 20-22 ( 0) 0)
|
|
张克俭. 锌和氨氮对对虾肝胰脏的毒性作用.
水产学报 , 1993, 17 (1) : 52-59 ( 0) 0)
|
|
Andersson JO, Roger AJ. Evolution of glutamate dehydrogenase genes: evidence for lateral gene transfer within and between prokaryotes and eukaryotes.
BMC Evol Biol , 2003, 3 (1) : 14 DOI:10.1186/1471-2148-3-14 ( 0) 0)
|
|
Benachenhou-Lahfa N, Forterre P, Labedan B. Evolution of glutamate dehydrogenase genes: evidence for two paralogous protein families and unusual branching patterns of the archaebacteria in the universal tree of life.
J Mol Evol , 1993, 36 (4) : 335-346 ( 0) 0)
|
|
Brown JR, Doolittle WF. Archaea and the prokaryote-to-eukaryote transition.
Microbiol Mol Biol Rev , 1997, 61 (4) : 456-502 ( 0) 0)
|
|
Britton KL, Baker PJ, Rice DW, et al. Structural relationship between the hexameric and tetrameric family of glutamate dehydrogenases.
Eur J Biochem , 1992, 209 (3) : 851-859 DOI:10.1111/ejb.1992.209.issue-3 ( 0) 0)
|
|
Chen JC, Nan FH. Effects of ammonia on oxygen consumption and ammonia-N excretion of Penaeus chinensis after prolonged exposure to ammonia.
Bull Environ Contam Toxicol , 1993, 51 (1) : 122-129 ( 0) 0)
|
|
Chen JC, Cheng SY, Chen CT. Changes of haemocyanin, protein and free amino Acid levels in the haemolymph of Penaeus japonicus exposed to ambient ammonia.
Comp Biochem Physiol A: Mol Integr Physiol , 1994, 109 (2) : 339-347 DOI:10.1016/0300-9629(94)90137-6 ( 0) 0)
|
|
Chen JC, Lin JN. Oxygen consumption and ammonia-N excretion of Penaeus chinensis juveniles exposed to ambient ammonia at different salinity levels.
Comp Biochem Physiol C: Toxicol Pharmacol , 1992, 102 (2) : 287-291 DOI:10.1016/0742-8413(92)90113-L ( 0) 0)
|
|
Chen JM, Chen JC. Study on the free amino acid levels in the hemolymph, gill, hepatopancreas and muscle of Penaeus monodon exposed to elevated ambient ammonia.
Aquat Toxicol , 2000, 50 (1) : 27-37 ( 0) 0)
|
|
Cheng W, Chen JC. The virulence of Enterococcus to freshwater prawn Macrobrachium rosenbergii and its immune resistance under ammonia stress.
Fish Shellfish Immunol , 2002, 12 (2) : 97-109 DOI:10.1006/fsim.2001.0363 ( 0) 0)
|
|
Cooper AJ, Plum F. Biochemistry and physiology of brain ammonia.
Physiol Rev , 1987, 67 (2) : 440-519 ( 0) 0)
|
|
Frieden C. L-Glutamate dehydrogenase. In: Boyer PD, Lardy H and Myrback K (Eds.), The Enzymes, 2nd Ed. Vol. 7, Academic Press, New York, 1963, 3–24
( 0) 0)
|
|
Iwata K, Kakuta I, Ikeda M, et al. Nitrogen metabolism in the mudskipper, Periophthalmus cantonensis: a role of free amino acids in detoxification of ammonia produced during its terrestrial life.
Comp Biochem Physiol A: Mol Integr Physiol , 1981, 68 (4) : 589-596 DOI:10.1016/0300-9629(81)90365-0 ( 0) 0)
|
|
Jürss K, Bastrop R. Amino acid metabolism in fish.
Biochem Mol Biol Fish , 1995, 4 (6) : 159-189 ( 0) 0)
|
|
King FD, Cucci TL, Bidigare RR. A pathway of nitrogen metabolism in marine decapod crabs.
Comp Biochem Physiol B: Comp Biochem , 1985, 80 (3) : 401-403 DOI:10.1016/0305-0491(85)90262-7 ( 0) 0)
|
|
Koo JG, Kim SG, Jee JH. Effects of ammonia and nitrite on survival, growth and moulting in juvenile tiger crab, Orithyia sinica (Linnaeus).
Aquacult Res , 2005, 36 (1) : 79-85 DOI:10.1111/are.2005.36.issue-1 ( 0) 0)
|
|
Lea PJ, Miflin BJ. Alternative route for nitrogen assimilation in higher plants.
Nature , 1974, 251 (5476) : 614-616 DOI:10.1038/251614a0 ( 0) 0)
|
|
Li EC, Arena L, Chen LQ, et al. Characterization and tissue-specific expression of the two glutamate dehydrogenase cDNAs in Pacific white shrimp, Litopenaeus vannamei.
J Crustacean Biol , 2009, 29 (3) : 379-386 DOI:10.1651/08-3104.1 ( 0) 0)
|
|
Miñambres B, Olivera ER, Jensen RA, et al. A new class of glutamate dehydrogenases (GDH) biochemical and genetic characterization of the first member, the AMP-requiring NAD-specific GDH of Streptomyces clavuligerus.
J Biol Chem , 2000, 275 (50) : 39529-39542 DOI:10.1074/jbc.M005136200 ( 0) 0)
|
|
Nagata S, Tanizawa K, Esaki N, et al. Gene cloning and sequence determination of leucine dehydrogenase from Bacillus stearothermophilus and structural comparison with other NAD(P)+-dependent dehydrogenases.
Biochemistry , 1988, 27 (25) : 9056-9062 DOI:10.1021/bi00425a026 ( 0) 0)
|
|
Nisman B. The stickland reaction.
Bacteriol Rev , 1954, 18 (1) : 16 ( 0) 0)
|
|
Pahlich E, Joy KW. Glutamate dehydrogenase from pea roots: Purification and properties of the enzyme.
Can J Biochem , 1971, 49 (1) : 127-138 DOI:10.1139/o71-018 ( 0) 0)
|
|
Pennington JE, Goldstrohm DA, Wells MA. The role of hemolymph proline as a nitrogen sink during blood meal digestion by the Mosquito Aedes aegypti.
J Insect Physiol , 2003, 49 (2) : 115-121 DOI:10.1016/S0022-1910(02)00267-6 ( 0) 0)
|
|
Plaitakis A, Zaganas I. Regulation of human glutamate dehydrogenases: implications for glutamate, ammonia and energy metabolism in brain.
J Neurosci Res , 2001, 66 (5) : 899-908 DOI:10.1002/(ISSN)1097-4547 ( 0) 0)
|
|
Regnault M, Egnault M. Nitrogen excretion in marine and fresh-water crustacea.
Biol Rev , 1987, 62 (1) : 1-24 ( 0) 0)
|
|
Scaraffia PY, Isoe J, Murillo A, et al. Ammonia metabolism in Aedes aegypti.
Insect Biochem Mol Biol , 2005, 35 (5) : 491-503 DOI:10.1016/j.ibmb.2005.01.012 ( 0) 0)
|
|
Smith EL, Austen BM, Blumenthal KM, et al. Glutamate dehydrogenases In: Boyer PD (Ed.), The Enzymes, 3rd Ed., Vol. 11, Academic Press, New York, 1975, 293–367
( 0) 0)
|
|
Srivastava HS, Singh RP. Role and regulation of L-glutamate dehydrogenase activity in higher plants.
Phytochemistry , 1987, 26 (3) : 597-610 DOI:10.1016/S0031-9422(00)84749-4 ( 0) 0)
|
|
Takada H, Yoshimura T, Ohshima T, et al. Thermostable phenylalanine dehydrogenase of Thermoactinomyces intermedius: cloning, expression, and sequencing of its genes.
Biochemistry , 1991, 109 (3) : 371-376 ( 0) 0)
|
|
Tang L, Hutchinson CR. Sequence, transcriptional, and functional analyses of the valine (branched-chain amino acid) dehydrogenase gene of Streptomyces coelicolor.
Bacteriology , 1993, 175 (13) : 4176-4185 ( 0) 0)
|
|
Tempest DW, Meers JL, Brown CM. Synthesis of glutamate in Aerobacter aerogenes by a hitherto unknown route.
Biochemical Journal , 1970, 117 (2) : 405 DOI:10.1042/bj1170405 ( 0) 0)
|
|
Walton MJ, Cowey CB. Aspects of ammoniogenesis in rainbow trout, Salmo gairdneri.
Comp Biochem Physiol B: Comp Biochem , 1977, 57 (2) : 143-149 ( 0) 0)
|
|
Willett CS, Burton RS. Characterization of the glutamate dehydrogenase gene and its regulation in a euryhaline copepod.
Comp Biochem Physiol B: Biochem Mol Biol , 2003, 135 (4) : 639-646 DOI:10.1016/S1096-4959(03)00145-3 ( 0) 0)
|
|
Wilson RP. Nitrogen metabolism in channel catfish, Ictalurus punctatus. II: evidence for an apparent incomplete ornithine-urea cycle.
Comp Biochem Physiol , 1973, 64B : 625-634 ( 0) 0)
|
|
Wang YR, Li EC, Yu N. Characterization and expression of glutamate dehydrogenase in response to acute salinity stress in the Chinese mitten crab, Eriocheir sinensis.
PLoS One , 2012, 7 (5) : 1-10 ( 0) 0)
|



