2. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006
2. Shandong Provincial Key Laboratory of Marine Ecology Restoration, Shandong Marine Resource and Environment Research Institute, Yantai 264006
皱纹盘鲍(Haliotis discus hannai)隶属于腹足纲、原始腹足目、鲍科、鲍属,主要分布在我国辽宁、山东北部沿海以及日本、朝鲜半岛沿海,是我国最具经济价值的鲍品种之一,也是我国鲍养殖的主要种类(齐钟彦,1998)。在皱纹盘鲍养殖业迅速发展的过程中,大规模死亡事件不断发生,给养殖产业造成了巨大损失,不利于该产业的可持续发展(徐艳虹,2007)1)。加强皱纹盘鲍的免疫学研究,深入分析其死亡原因,寻找疾病防治的有效方法成为亟待解决的问题。鲍主要依靠非特异性免疫来抵御病原微生物的入侵,免疫能力相对较弱(Zhang et al,2004)。关于鲍的免疫能力及其机制的研究已有一些报道,如万敏(2003)2)研究了维生素A、维生素D、维生素E和Se对皱纹盘鲍免疫能力的影响;Chen等(2005)研究了不同摄入量的吡哆醇对皱纹盘鲍免疫应答的影响;Wu等(2011)、Park等(2015)分别研究了不同浓度Zn与持续热激条件下,皱纹盘鲍体内热激蛋白和抗氧化酶基因表达的变化等,但对鲍的免疫机制尚需深入了解。
1) 徐艳虹. 皱纹盘鲍遗传多样性的研究及遗传图谱构建. 中国海洋大学硕士研究生学位论文, 2007, 1-54
2) 万敏. 皱纹盘鲍营养免疫学初步研究. 中国海洋大学硕士研究生学位论文, 2003, 15-23
卵色研究一直是国内外学者关注的焦点。Pellew(1925)就对家蚕(Bombyx mori L.)卵色的母性遗传进行了论述,并纠正了其他学者在家蚕卵色母性遗传研究中存在的问题。近年来,家蚕限性卵色基因定位及克隆方面的研究也相继开展(张静静,2012)3)。Castilla等(2007)通过对白色、白色斑点、棕色、棕色斑点4种颜色的红腿鹌鹑(Alectoris chukar)卵进行比较,发现颜色鲜艳的卵更易遭受敌害。钟明超等(1993)对鲶鱼(Silurus asptisl)绿黄色卵和草绿色卵进行观察比较,发现绿黄色卵与草绿色卵具有完全相同的发育潜能。孙莉等(2009)对大猿叶虫(Colaphellus bozoringi Baly)浅黄色和深红色2种卵色个体后代滞育率进行了比较,发现在光照周期为L14 h:D10 h时,浅黄色卵的后代滞育率显著高于深色卵的后代。关于皱纹盘鲍卵色方面的研究迄今尚未见报道。
3) 张静静. 家蚕限性卵色系卵色基因的定位与克隆及突变位点分析. 浙江师范大学硕士研究生学位论文, 2012, 45-50
本研究对不同卵色皱纹盘鲍幼鲍体液中5种重要免疫酶超氧化物歧化酶(Superoxide dismutase,SOD)、碱性磷酸酶(Alkaline phosphatase,AKP)、酸性磷酸酶(Acid phosphatase,ACP)、过氧化氢酶(Catalase from Micrococcus lysodeikticus,CAT)和溶菌酶(Lysozyme,LZM)的活力进行了测定,并与其生长性状进行了比较分析,旨在探讨不同卵色幼鲍在非特异性免疫方面的差异,为皱纹盘鲍新品系选育提供一定参考。
1 材料与方法 1.1 实验材料2013年4月在山东寻山渔业集团养殖场按常规工艺进行亲鲍促熟、催产,以3个产绿色卵子的皱纹盘鲍为母本,分别与10个父本两两交配,构建了30个绿卵全同胞家系。受精期间,所有操作注意隔离,避免交叉混杂。为保持相同养殖环境,养殖过程采用家系混养的方式。养成阶段稚鲍挂养于山东省荣成桑沟湾养殖浮筏上,定期清理养殖笼并投喂海带(Saccharina japonica)、江蓠(Gracilaria sp.)等饵料。
1.2 样品采集与处理 1.2.1 样品采集与指标测量从采苗后经过480 d养殖的30个绿卵全同胞家系中随机抽取幼鲍100只,用干净纱布吸干表面水分后逐个称重。用游标卡尺测量并记录幼鲍的壳长、壳宽等参数,然后解剖性腺,分辨雌、雄,与标准色图进行对比,观察并记录雌性幼鲍的卵色。
1.2.2 生化样品采集与处理将所取样品分别置于培养皿中,用解剖刀在腹足上划“井”字,待血液流出,用注射器吸取置于1.5 ml离心管中,加入0.175倍体积的1.32%柠檬酸钠抗凝剂,放入液氮速冻后置于-80℃超低温冰箱中保存待测。
用一次性无菌注射器抽取1 ml皱纹盘鲍血液样本,4℃下5000 r/min离心10 min,取上清液作为粗酶液用于测定SOD、AKP、ACP、CAT和LZM的活力。测定中,每个样品设立3个平行组。
1.3 酶活性测定皱纹盘鲍血液上清液中SOD、AKP、ACP、CAT和LZM的活力均采用南京建成生物工程研究所的试剂盒进行测定。
SOD酶活性单位定义:每毫升反应液中,每分钟抑制邻苯三酚自氧化速率达50%时的酶量。
AKP、ACP酶活性单位定义:以100 ml体液在37℃与底物作用30 min产生1 mg酚为1个单位。
CAT酶活性单位定义:以每分钟内A240 nm减少0.1为1个酶量单位。
LZM酶活性单位定义:在 25℃、pH为6.2条件下,于450 nm处每分钟使吸光度值降低0.001为1个酶活力单位。
1.4 数据处理实验所得数据采用SPSS19.0软件进行单因素方差分析(One-way ANOVA),以P<0.05作为差异显著水平。统计数据以平均值±标准差(Mean ± SD)表示。
2 结果 2.1 雌雄及不同卵色比例通过对皱纹盘鲍样品的性腺进行观察,结果显示,在随机取的100只幼鲍中,雌鲍占94%,雄鲍占6%,雌雄比例为15.7:1。在雌鲍中,棕卵个体占61.71%,绿卵个体占28.72%,棕绿卵个体占6.38%,棕红卵个体占3.19%。
2.2 不同卵色幼鲍的生长差异种不同卵色皱纹盘鲍总重、壳长、壳宽等生长指标见表 1。从表 1可以看出,在3个不同的生长指标中,4种不同卵色的皱纹盘鲍并无显著差异(P>0.05)。但在各个指标的比较中,绿卵皱纹盘鲍的平均值都高于其他3种卵色;棕红卵皱纹盘鲍均值都略低于其他 3种卵色。
|
|
表 1 不同卵色皱纹盘鲍生长指标分析 Table 1 Growth performance of H. discus hannai with different egg color |
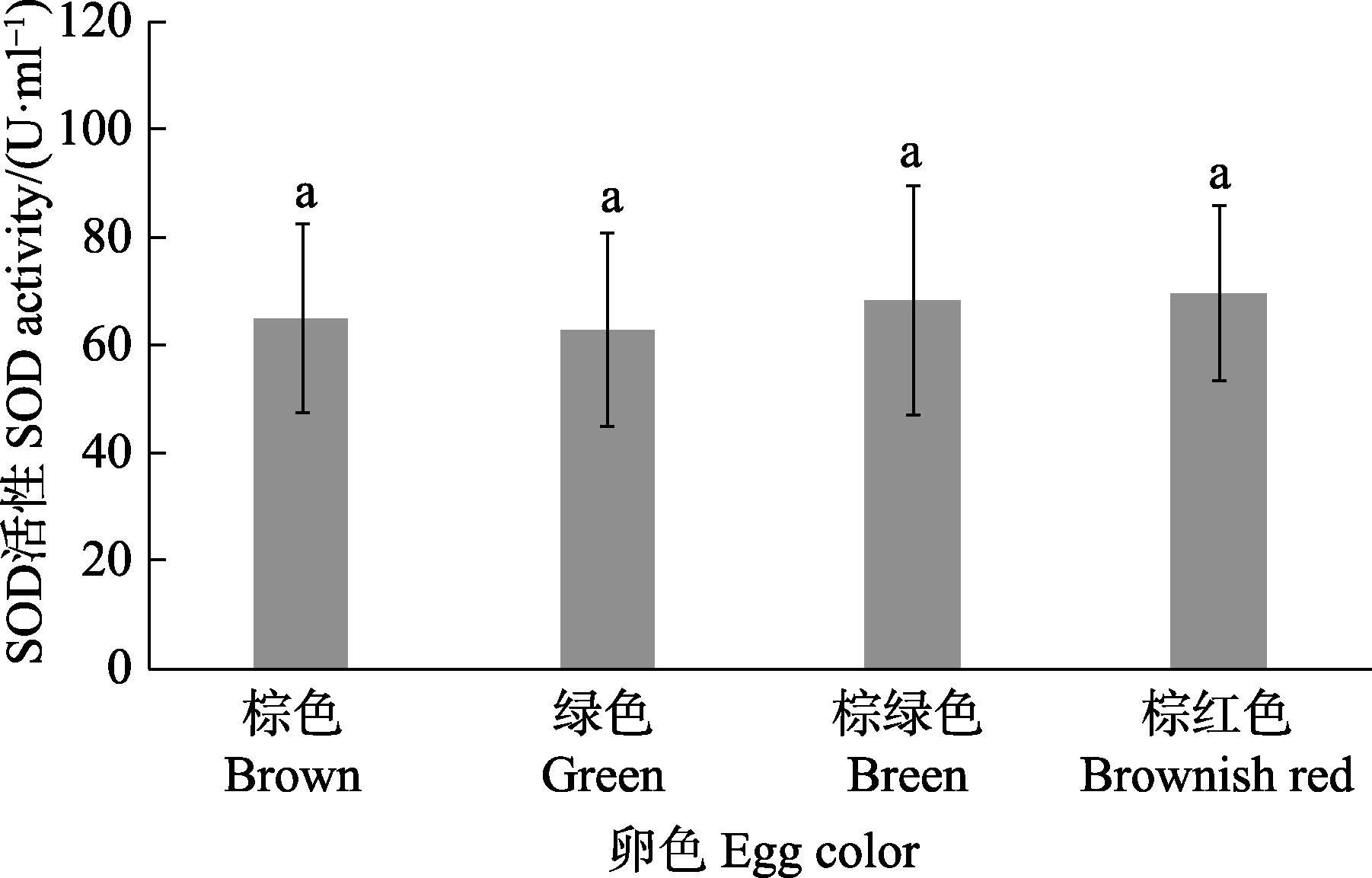
4种不同卵色皱纹盘鲍个体SOD活性差异见图 1。从图 1可以看出,棕色、绿色、棕绿色和棕红色皱纹盘鲍SOD活性均稳定在正常值,4种卵色间无显著差异(P>0.05)。
|
图 1 不同卵色皱纹盘鲍SOD活性比较 Figure 1 Comparison of SOD activities in H. discus hannai with different egg colors 注:标有相同字母表示各组间无显著性差异(P>0.05) Note: Values marked with the same letter were not significant different(P>0.05)the same as below |
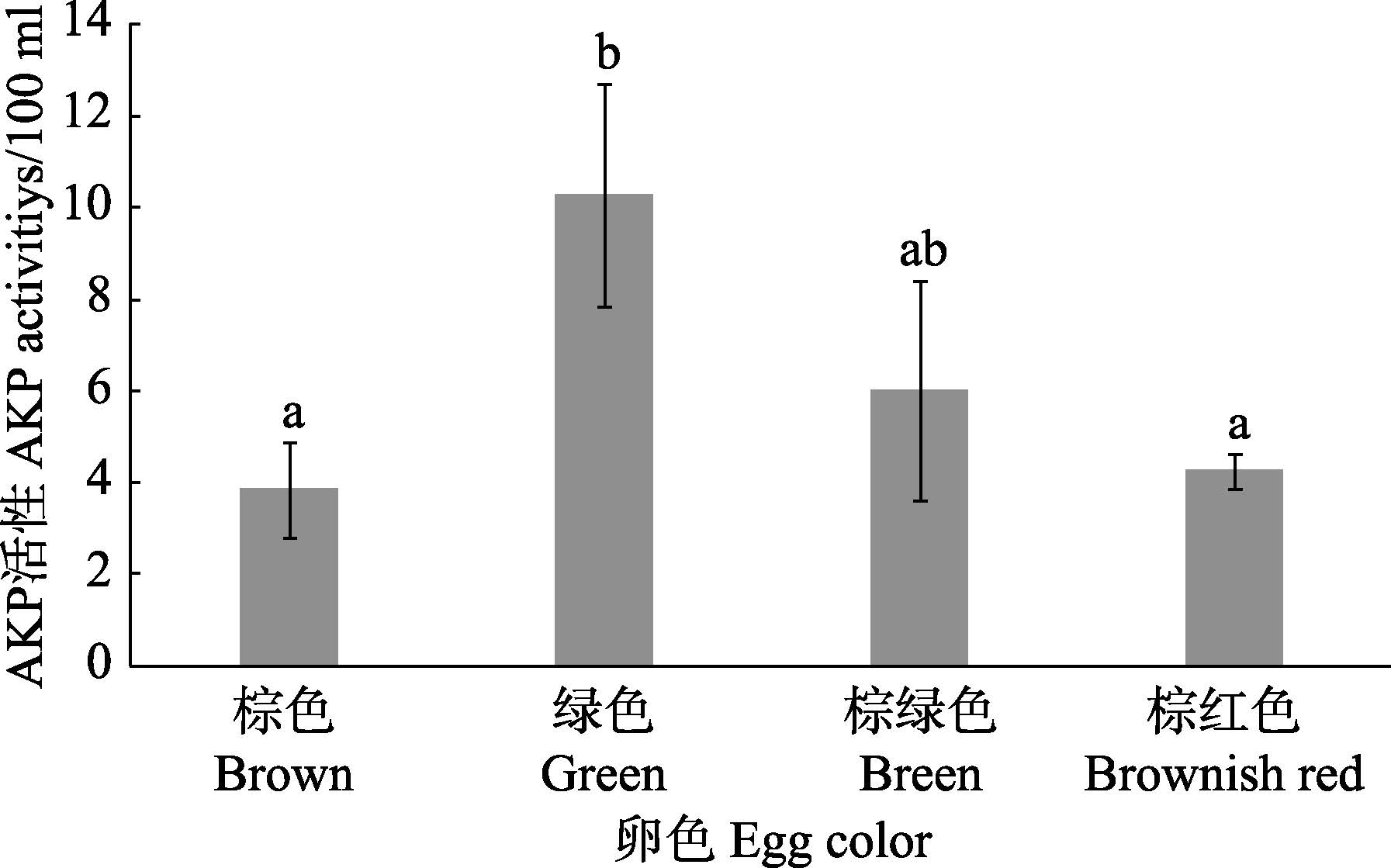
从图 2可以看出,绿卵皱纹盘鲍AKP活性维持在较高水平,且与棕色和棕红色卵皱纹盘鲍存在显著差异(P < 0.05)。棕色和棕红色卵皱纹盘鲍之间无显著差异(P>0.05)。棕绿色卵皱纹盘鲍与其他3种卵色皱纹盘鲍均无显著差异(P>0.05)。
|
图 2 不同卵色皱纹盘鲍AKP 活性比较 Figure 2 Comparison of AKP activities H. discus hannai with in different egg colors 注:标有不同字母各组间存在显著性差异(P<0.05) Note: Values marked with different letters were significantly, different in different groups (P<0.05) the same as below |
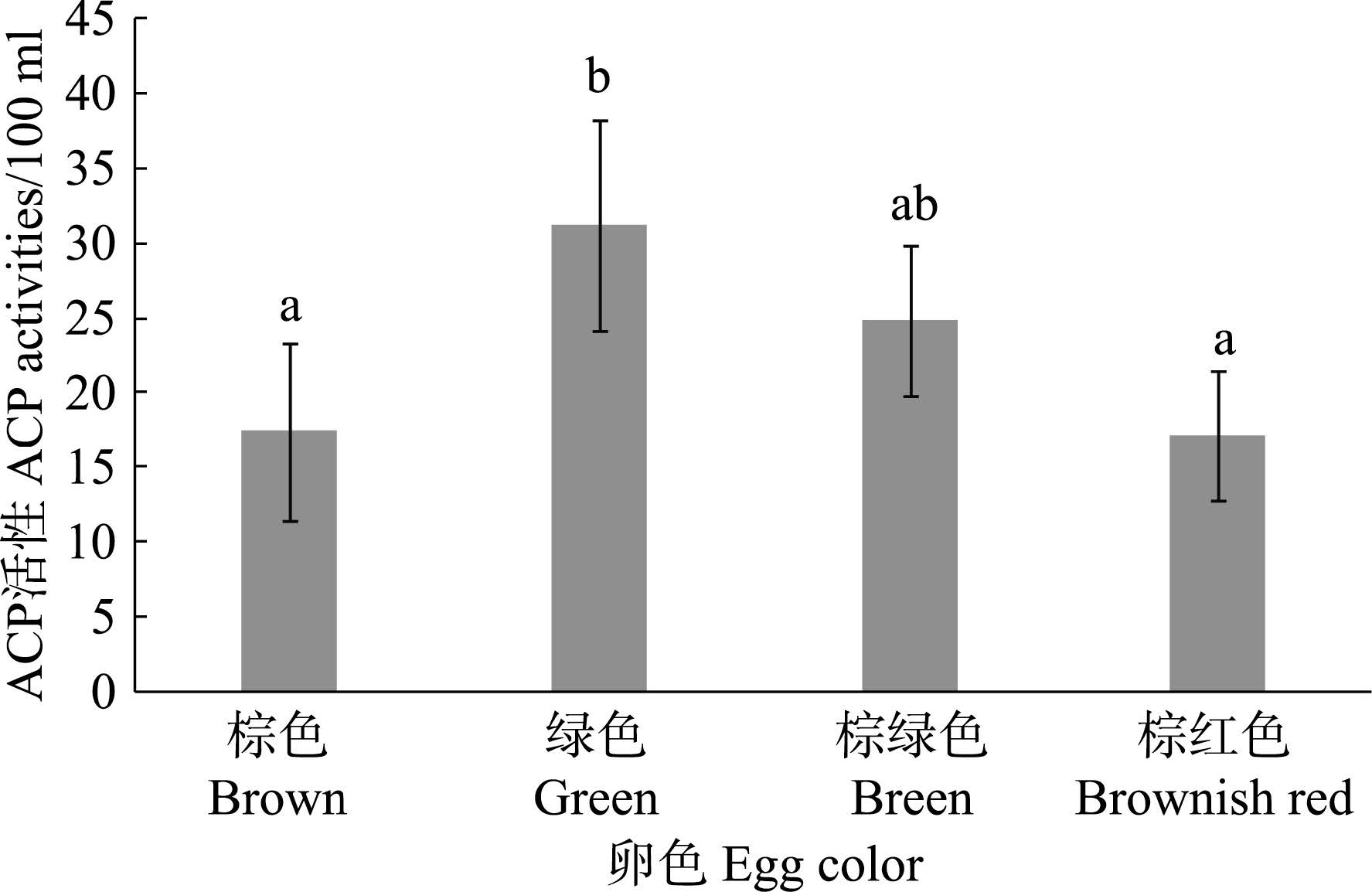
4种不同卵色皱纹盘鲍ACP活性差异见图 3。从图 3可以看出,此结果与AKP活性类似,绿卵皱纹盘鲍ACP活性维持在较高水平,且与棕色和棕红色卵皱纹盘鲍存在显著差异(P < 0.05)。棕色和棕红色卵皱纹盘鲍之间无显著差异(P>0.05)。棕绿色卵皱纹盘鲍与其他3种卵色皱纹盘鲍均无显著差异(P>0.05)。
|
图 3 不同卵色皱纹盘鲍ACP 活性比较 Figure 3 Comparison of ACP activities in H. discus hannai with different egg colors |
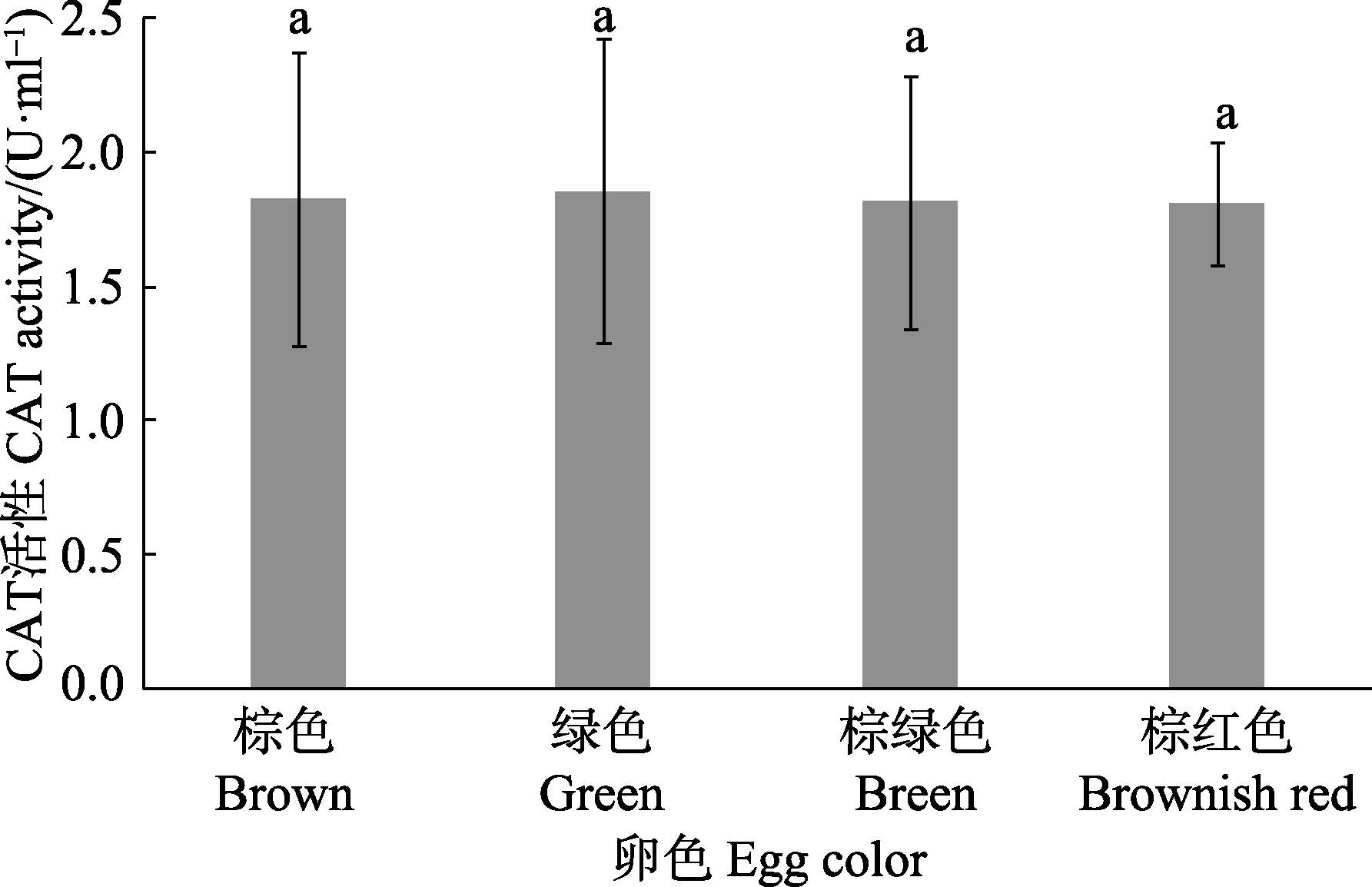
4种不同卵色皱纹盘鲍CAT活性差异见图 4。从图 4可以看出,4种卵色皱纹盘鲍CAT活性均维持在正常水平,四者之间无显著差异。
|
图 4 不同卵色皱纹盘鲍CAT 活性比较 Figure 4 Comparison of CAT activities in H. discus hannai with differrnt egg colors |
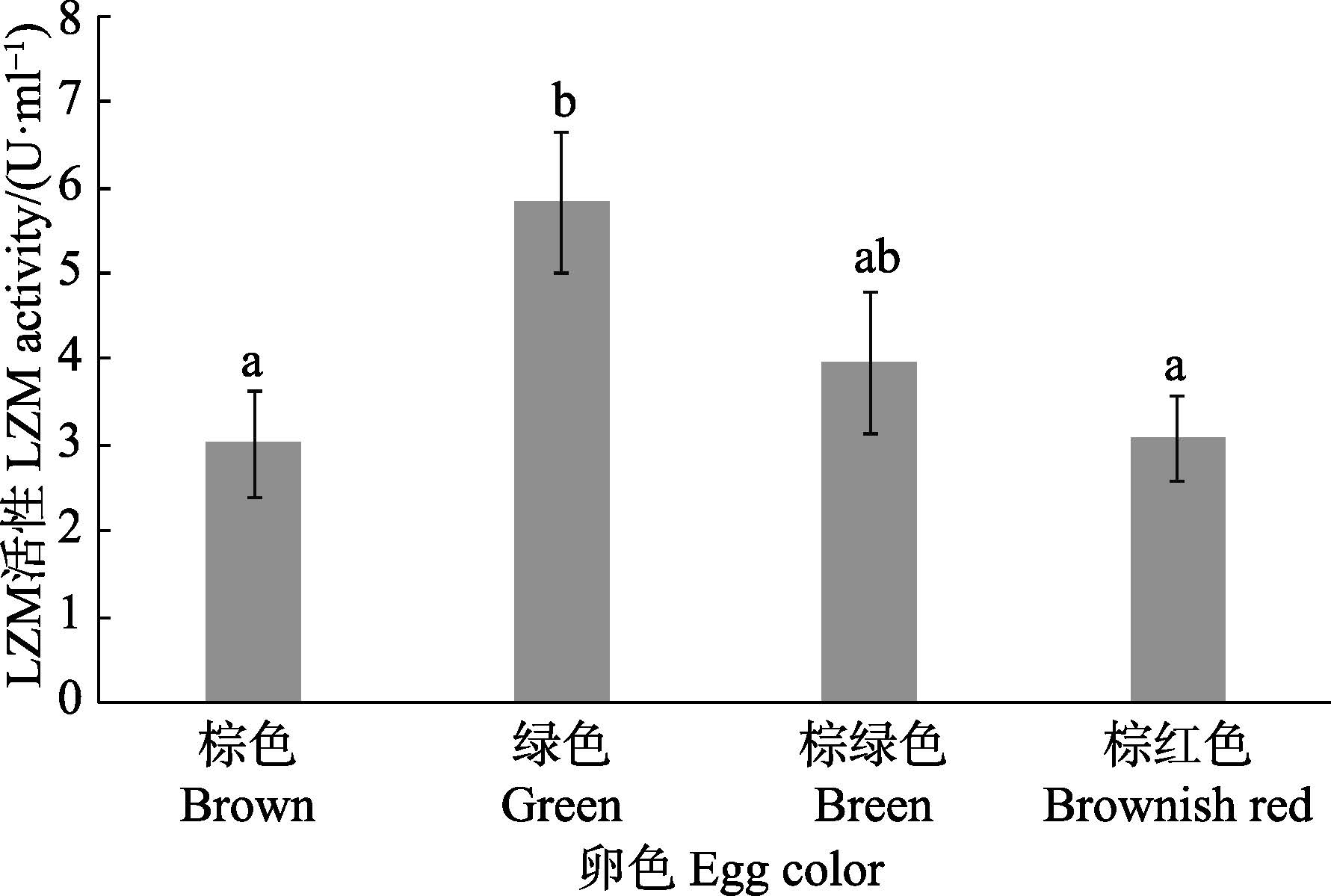
从图 5可以看出,不同卵色皱纹盘鲍LZM活性差异结果与AKP、ACP活性类似,绿卵皱纹盘鲍酶活性维持在较高水平,且与棕色和棕红色卵皱纹盘鲍存在显著差异(P<0.05)。棕绿色卵皱纹盘鲍与其他3种卵色皱纹盘鲍均无显著差异(P>0.05)。
|
图 5 不同卵色皱纹盘鲍LZM活性比较 Figure 5 Comparison of LZM activities in H. discus hannai with differrnt egg colors |
皱纹盘鲍的免疫防御机制主要是非特异性免疫,体内分布的大量免疫相关酶发挥着十分重要的作用(丁鉴锋,2011)1)。免疫相关酶主要分为氧化酶、抗氧化酶类和水解酶类2种。氧化酶和抗氧化酶类主要包括SOD和CAT,二者都能够清除机体内氧自由基来防止生物分子对机体造成损伤(Cheng et al,2004; 张璐等,2008)。水解酶类主要包括ACP、AKP和LZM,主要在清除异物及病原过程中发挥着重要的作用,水解酶活性是衡量鲍免疫能力的重要指标(Chen et al,2005; Jia et al,2009)。本研究测定SOD、CAT、ACP、ATP、LZM 5种酶的活力,有助于深入了解皱纹盘鲍的免疫防御能力。
1) 丁鉴锋. 皱纹盘鲍溶菌酶及两种蛋白酶抑制因子的克隆与表达. 中国科学院研究生院(海洋研究所)博士研究生学位论文, 2011, 1-32
在检测的5种酶活性中,ACP、ATP、LZM在部分卵色个体间存在显著差异(P<0.05),SOD和CAT活性在4种卵色个体间无显著差异(P>0.05)。存在显著差异的3种酶中,酶活性高低根据卵色排序依次是绿色、棕绿色、棕色和棕红色。绿卵皱纹盘鲍在这3种酶的活性上存在显著优势,维持较高水平,具有较高的非特异性免疫能力。分析这4种卵色皱纹盘鲍生长指标发现,4种卵色各生长指标均无显著差异(P>0.05),但绿卵个体的总重、壳长和壳宽均值都高于其他卵色个体,与免疫酶活性检测结果相符。总之,绿卵幼鲍相比于其他卵色在免疫酶活性与生长上存在一定优势。关于绿卵幼鲍在群体中比例低(28.72%)的原因可能是由于绿卵性状是由隐性基因决定的,卵色的遗传模式有待进一步研究。本研究结果为皱纹盘鲍的选育提供了新的思路,但尚需深入探讨不同卵色皱纹盘鲍的繁殖能力及其后代的特性。
3.2 皱纹盘鲍性比失调原因分析本研究对随机抽取的皱纹盘鲍样品进行分类统计后,得出雌雄比为15.7:1,性比例明显失调。Fisher法则认为,雌雄异体生物理论性比为1:1,但大量研究表明,自然界雌雄异体生物性比常常偏离1:1,呈现偏雌或偏雄的现象(费世民等,2011)。
导致性比例失调的因素主要有遗传因素和环境因素,2种因素相互或是单独作用导致了性比的异质性或者变异性(Schmidt,2008)。生物在减数分裂过程中发生基因重组,此过程的差异最终导致遗传性比的差异(徐艳虹,2007)2)。Hamilton(1933)认为,近亲交配将会导致物种的偏雌性演化。尹春英等(2007)认为,雌雄异体生物的性别比例会随温度、光照和干扰水平等环境因素的不同呈现出性比失调的环境调控现象。基于环境的影响,不同性别的生物体往往在胚胎死亡率、幼体死亡率以及成体死亡率上有所不同,从而导致性比失调现象的发生。
2) 徐艳虹. 皱纹盘鲍遗传多样性的研究及遗传图谱构建. 中国海洋大学硕士研究生学位论文, 2007, 1-54
本研究中,3♀×10♂绿卵全同胞家系亲本并未进行亲缘关系鉴定,要确定近亲交配是否会造成性比失调,需利用多种分子标记对亲本进行亲缘关系鉴定,这将是下一步要开展的工作。关于皱纹盘鲍性比失调的确切原因,还有待进一步研究。
| 尹春英, 李春阳. 雌雄异株植物与性别比例有关的性别差异研究现状与展望. 应用与环境生物学报 , 2007, 13 (3) : 419-425 | |
| 孙莉, 肖海军, 赖锡婷, 等. 大猿叶虫卵的颜色与其后代滞育率和繁殖力的关系. 昆虫知识 , 2009, 46 (2) : 304-306 | |
| 齐钟彦. 中国经济软体动物. 北京: 中国农业出版社, 1998 . | |
| 张璐, 艾庆辉, 麦康森, 等. 肽聚糖对鲈鱼生长和非特异性免疫力的影响. 中国海洋大学学报(自然科学版) , 2008, 38 (4) : 551-554 | |
| 钟明超, 黄浙. 关于鲶的卵色. 水产学报 , 1993, 17 (3) : 262-263 | |
| 费世民, 何亚平, 何飞, 等. 雌雄异体生物种群的性比失调及其调控研究现状. 四川林业科技 , 2011, 32 (2) : 23-37 | |
| Castilla AM, Dhondt AA, Diza-Uriarte R, et al. Predation in ground-nesting birds: an experimental study using natural egg-color variation. Avian Conserv Ecol , 2007, 2 (1) : 145-153 | |
| Chen H, Mai KS, Zhang WB, et al. Effects of dietary pyridoxine on immune responses in abalone, Haliotis discus hannai Ino. Fish Shellfish Immun , 2005, 19 (3) : 241-252 DOI:10.1016/j.fsi.2004.12.006 | |
| Cheng WT, Hsiao IS, Hsu CH, et al. Change in water temperature on the immune response of Taiwan abalone Haliotis diversicolor supertexta and its susceptibility to Vibrio parahaemolyticus. Fish Shellfish Immun , 2004, 17 (3) : 235-243 DOI:10.1016/j.fsi.2004.03.007 | |
| Hamilton WJ. The weasels of New York. Am Midl Nat , 1933, 14 (4) : 289-344 DOI:10.2307/2420251 | |
| Jia XW, Zhang ZP, Wang SH, et al. Effects of tributyltin (TBT) on enzyme activity and oxidative stress in hepatopancreas and hemolymph of small abalone, Haliotis diversicolor supertexta. Chin J Oceanol Limnol , 2009, 27 (4) : 816-824 DOI:10.1007/s00343-009-9222-z | |
| Park KY, Lee JS, Kang JC, et al. Cascading effects from survival to physiological activities and gene expression of heat shock protein 90 on the abalone Haliotis discus hannai responding to continuous thermal stress. Fish Shellfish Immun , 2015, 42 (3) : 233-240 | |
| Pellew C. A note on the inheritance of egg-color in the silkworm. J Genet , 1925, 15 (2) : 233-235 DOI:10.1007/BF02983108 | |
| Schmidt JP. Sex ratio and spatial pattern of males and females in the dioecious sandhill shrub, Ceratiola ericoides ericoides (Empetraceae) Michx. Plant Ecol , 2008, 196 (2) : 281-288 DOI:10.1007/s11258-007-9353-2 | |
| Wu CL, Zhang WB, Mai KS, et al. Effects of dietary zinc on gene expression of antioxidant enzymes and heat shock proteins in hepatopancreas of abalone Haliotis discus hannai. Comp Biochem Phys C: Toxicl pharmaco , 2011, 154 (1) : 1-6 DOI:10.1016/j.cbpc.2011.03.003 | |
| Zhang WB, Mai KS, Xu W, et al. Effects of vitamins A and D onshell biomineralization of abalone Haliotis discus hannai Ino. J Shellfish Res , 2004, 23 (4) : 1065-1072 |



