作为海水养殖新品种,金乌贼(Sepia esculenta)具有生命周期短(通常1年)、生长速度快、个体大(均重700 g)、营养丰富、可食率高等特点,消费市场需求旺盛,增养殖前景广阔。目前,我国已攻克了金乌贼苗种繁育技术,但苗种培育成活率相对较低,大规格苗种的缺乏成为产业化推广养殖的一大限制瓶颈。
消化酶是一种主要由消化腺和消化系统分泌的营消化作用的酶类,其活性的大小反映了动物的消化能力和营养需求(Lemieux et al,1999),开展水产动物早期发育阶段消化酶活性变化的研究可用于幼体的营养需求分析,还可通过建立和优化投喂方式来提高苗种的成活率(Diaz et al,1997)。近年来,有关早期发育阶段消化酶活性变化的研究已经在甲壳类(田华梅等,2003)、鱼类(何滔,20111); 孙敏等,2012; Ribeiro et al,2008)和贝类(孙虎山等,2008)中展开。在乌贼科种类消化酶研究方面,目前仅见少量报道(Perrin et al,2004; 郝振林,20102); 陆伟进,20123)),且局限在幼体和成体,未见早期发育阶段消化酶活力变化的报道。
1) 何滔. 条石鲷早期发育及相关酶活性的研究. 中国科学院研究生院博士研究生学位论文, 2011
2) 郝振林. 金乌贼繁殖、发育及荧光标志技术的研究. 中国海洋大学博士研究生学位论文, 2010
3) 陆伟进. 曼氏无针乌贼消化系统组织细胞学和酶化学的研究. 宁波大学硕士研究生学位论文, 2012
本研究对金乌贼早期发育阶段消化酶及与消化相关的谷丙转氨酶的活力进行测定,以期解析消化酶活力的变化与营养物质利用及发育进程的关系,进而为提高初孵幼体的质量及优化开口饵料供给提供理论指导。
1 材料与方法 1.1 材料实验用金乌贼受精卵和幼体于2014年6-7月取自青岛金沙滩水产开发有限公司。受精卵由野生金乌贼亲体自然产卵获得,孵化水温为18-25℃。仔金乌贼孵化后第2天开始投喂糠虾,每天投喂2次,投喂量为仔乌贼幼体体重的2%-3%。取样时,先在同一批次受精卵中随机取3-5粒,剥离三级卵膜后在解剖镜下观察,参考陈四清等(2010)的方法,确定胚胎发育时期。对金乌贼早期发育阶段卵裂期(Ⅰ)、囊胚期和原肠期(Ⅱ)、外部器官形成期(Ⅲ)、红珠期和黑珠期(Ⅳ)、心跳期(Ⅴ)、出膜期(Ⅵ)的受精卵及初孵幼体(Ⅶ)、5日龄幼体(Ⅷ)、10日龄幼体(Ⅸ)进行取样,其中,仔乌贼孵出后,每天上午于投饵前随机取样。每个阶段取样20-30 g(受精卵约20粒,幼体约100个),放入-80℃超低温冰箱中保存备用。
1.2 方法 1.2.1 酶液的制备金乌贼胚胎发育各时期及幼体各阶段分别取1-2 g样品,加入4倍体积(W/V)预冷生理盐水,在电动匀浆机中匀浆,然后用TGL-16 G型冷冻离心机离心10 min(4℃、2500 r/min),取上清液,置于4℃冰箱保存备用。
1.2.2 酶活性的测定胰蛋白酶(Trypsin)测定参照Erlanger(1961),胃蛋白酶(Pepsin)、碱性磷酸酶(AKP)、脂肪酶(Lipase)和谷丙转氨酶(ALT)活性均采用南京建成生物工程公司生产的试剂盒测定。可溶性蛋白含量用考马斯亮蓝-蛋白测定试剂盒测定,用于计算消化酶的相对活性。酶的活力单位(U)除以相应酶液中可溶性蛋白含量即为酶的比活力。每组实验设3个平行样,结果用平均值±标准差(Mean±SD)表示。
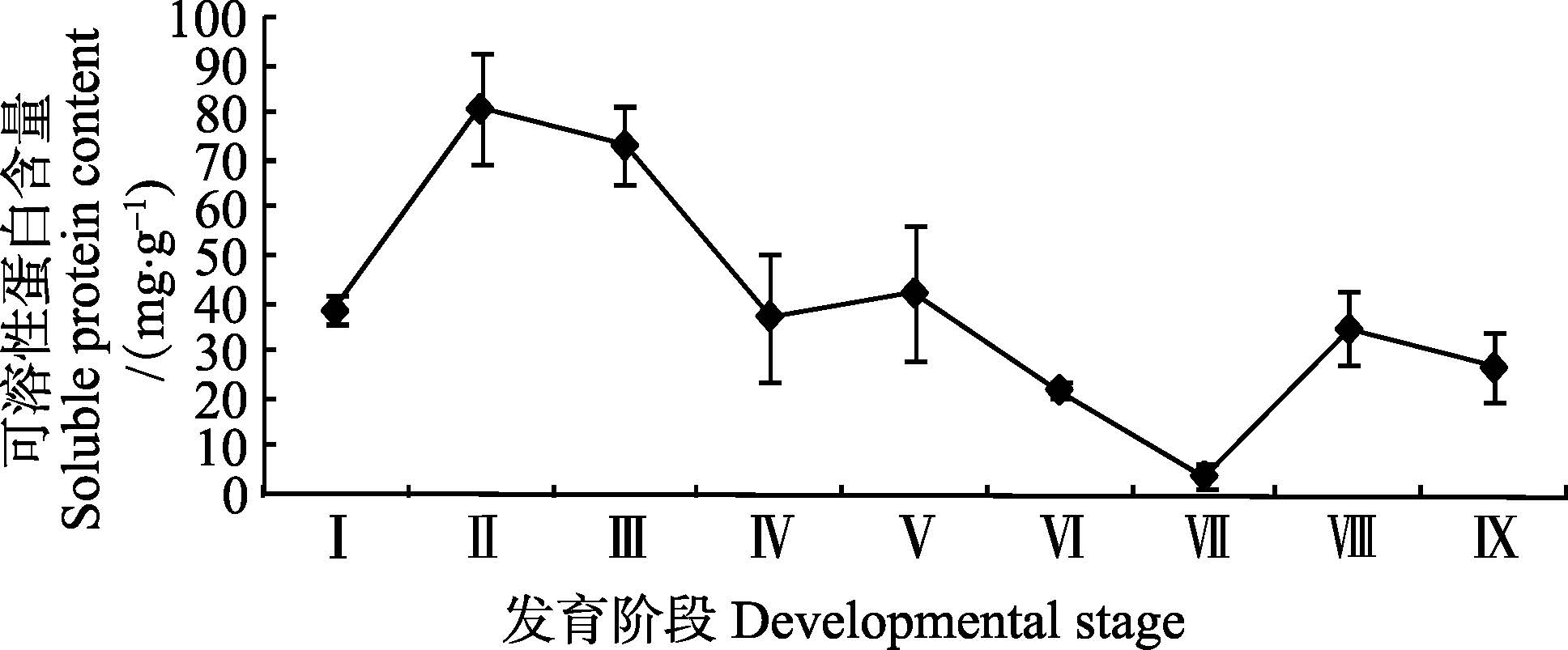
2 结果 2.1 可溶性蛋白浓度的变化由图 1可知,在金乌贼胚胎发育阶段可溶性蛋白含量处于较高水平,且波动较大,呈现先升后降的趋势,其中,在囊胚和原肠期最高,达到(81.50±11.70)mg/g,后逐渐下降。仔金乌贼孵化出膜后,蛋白含量急剧下降至(4.24±2.73)mg/g。随后,其含量又逐渐上升,但到10日龄,蛋白浓度略有降低。
|
图 1 金乌贼早期发育阶段可溶性蛋白含量变化 Figure 1 Variation of soluble protein contents in early developmental stages of S. esculenta |
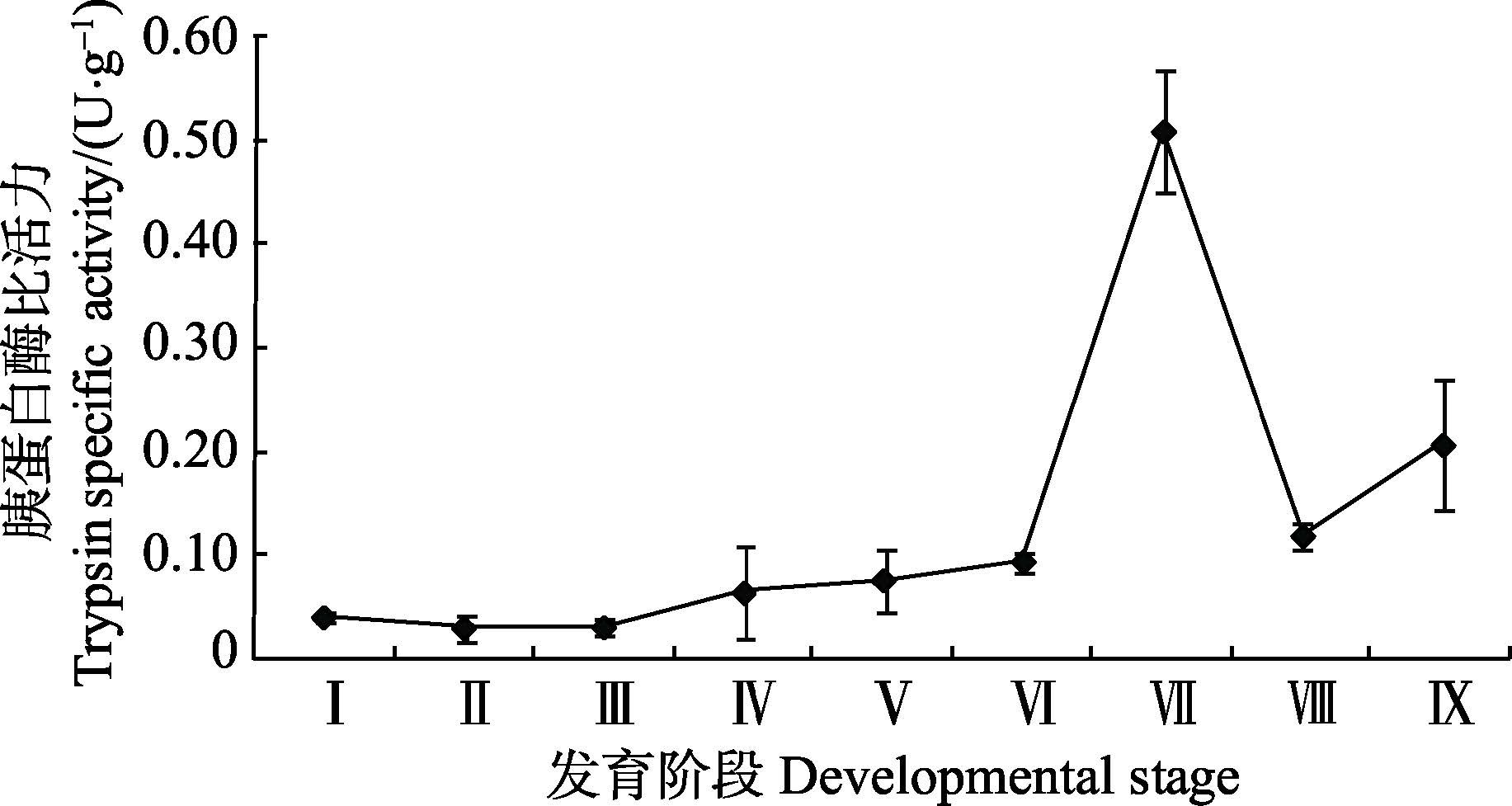
由图 2可知,在金乌贼胚胎发育阶段胰蛋白酶比活力处于较低水平,总体呈上升的趋势。仔金乌贼孵化出膜后,胰蛋白酶比活力急剧增加至(0.51±0.06)U/g。随后,其活性开始下降,5日龄幼体酶比活力降至(0.12±0.01)U/g,但仍高于胚胎发育期,10日龄幼体的酶比活力又逐渐上升。
|
图 2 金乌贼早期发育阶段胰蛋白酶比活力的变化 Figure 2 Variation of the trypsin specific activity in early developmental stages of S. esculenta |
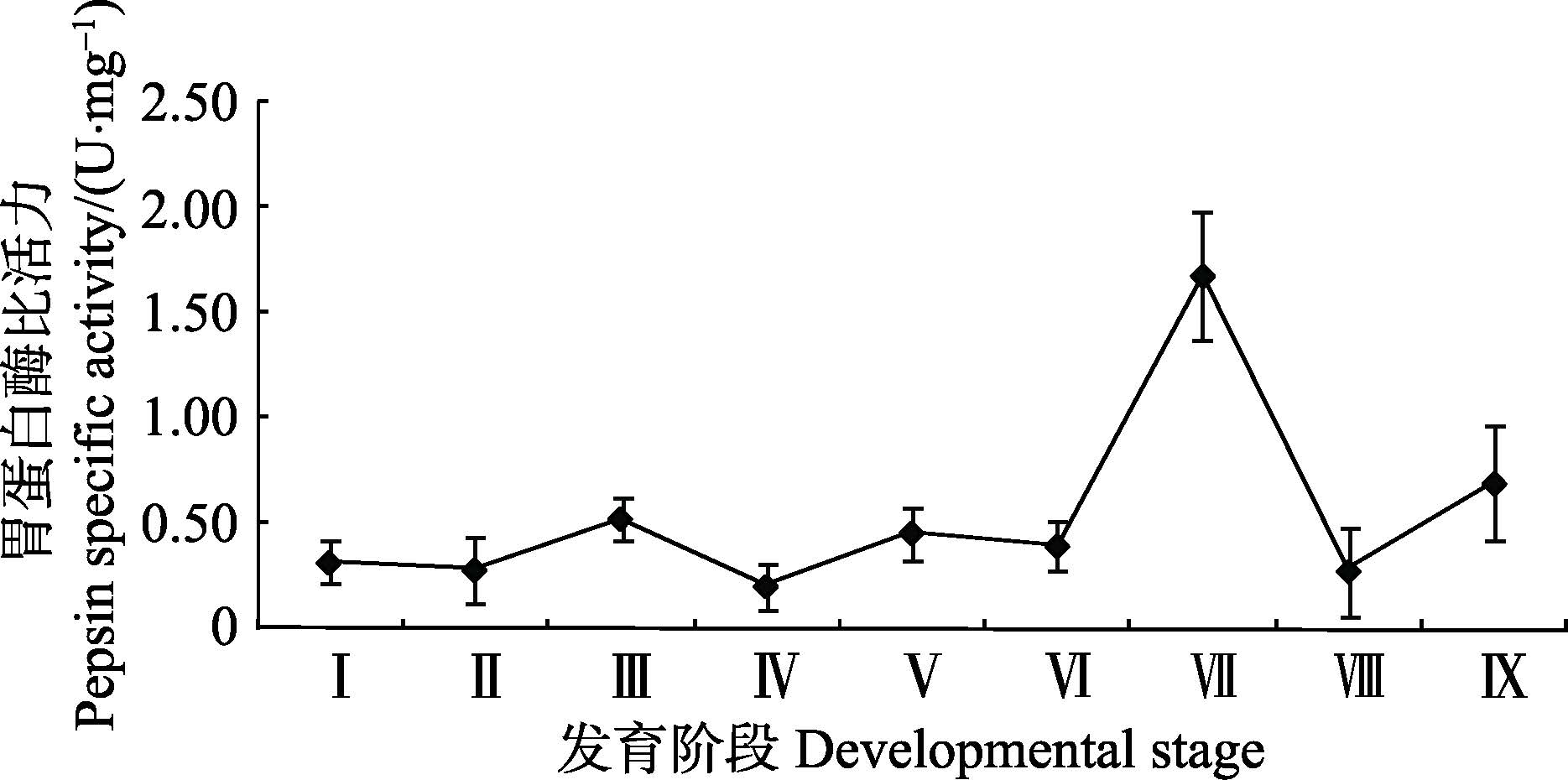
由图 3可知,在金乌贼胚胎发育阶段,胃蛋白酶相对活性相对较低,且波动幅度不大,范围在0.2-0.5 U/mg,其中,外部器官形成期胚胎的比活力最高。仔金乌贼孵化出膜后胃蛋白酶比活力急剧上升至(1.68±0.30)U/mg,随后,其活力开始下降,5日龄幼体的酶比活力降至(0.28±0.21)U/mg,10日龄又上升至(0.69±0.27)U/mg。
|
图 3 金乌贼早期发育阶段胃蛋白酶比活力的变化 Figure 3 Variation of the pepsin activity in early developmental stages of S. esculenta |
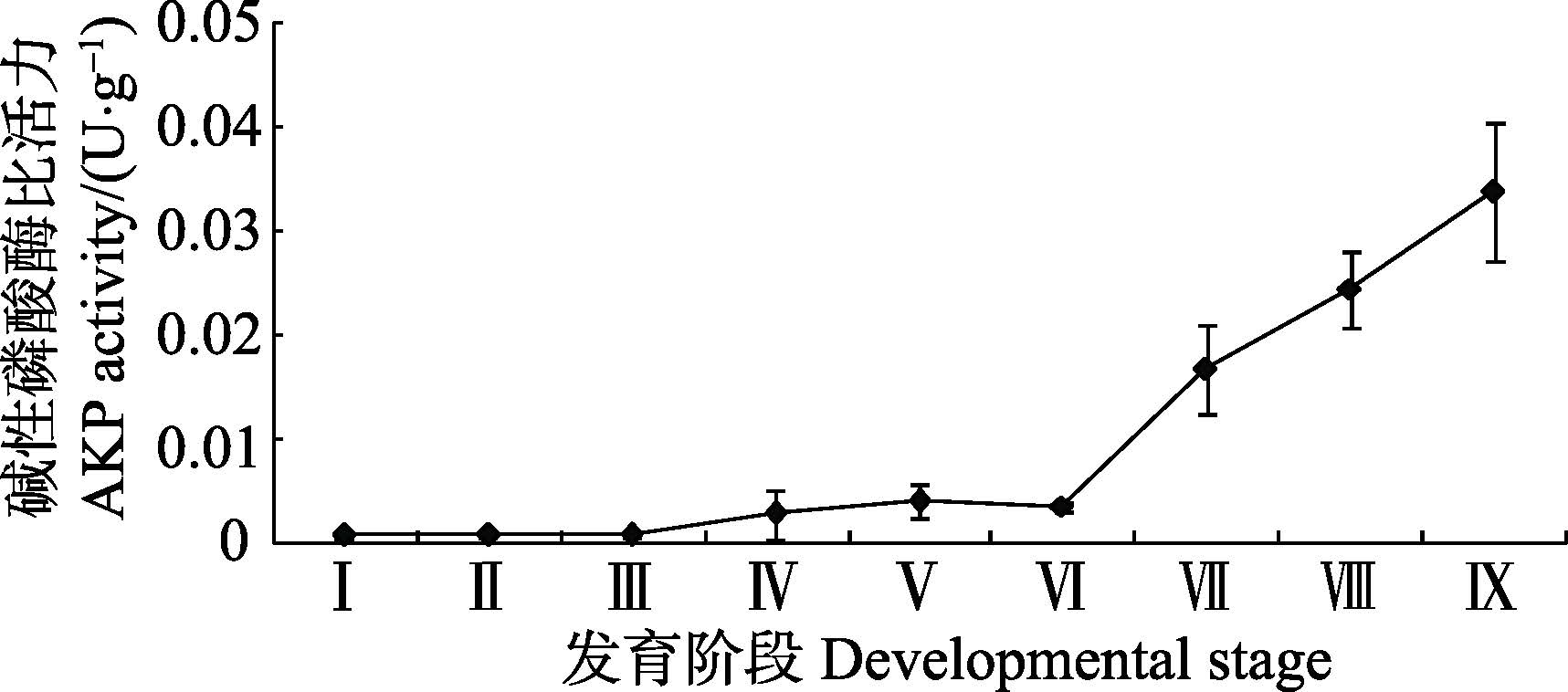
由图 4可知,在金乌贼早期发育阶段,碱性磷酸酶比活力总体呈上升趋势,且在胚胎发育阶段碱性磷酸酶比活力极低,至仔金乌贼孵化出膜后急剧上升,其中,初孵幼体的酶比活力为(0.02±0.01)U/g,10日龄幼体为(0.03±0.01)U/g。
|
图 4 金乌贼早期发育阶段碱性磷酸酶比活力的变化 Figure 4 Variation of the AKP activity in early developmental stages of S. esculenta |
由图 5可知,在金乌贼早期发育阶段,脂肪酶比活力总体呈上升趋势。在胚胎发育阶段,脂肪酶比活力极低,上升趋势不明显。仔金乌贼孵化出膜后,脂肪酶比活力急剧上升至(34.39±3.72)U/g,5日龄幼体略有上升,10日龄幼体迅速升高至(75.00±8.40)U/g。
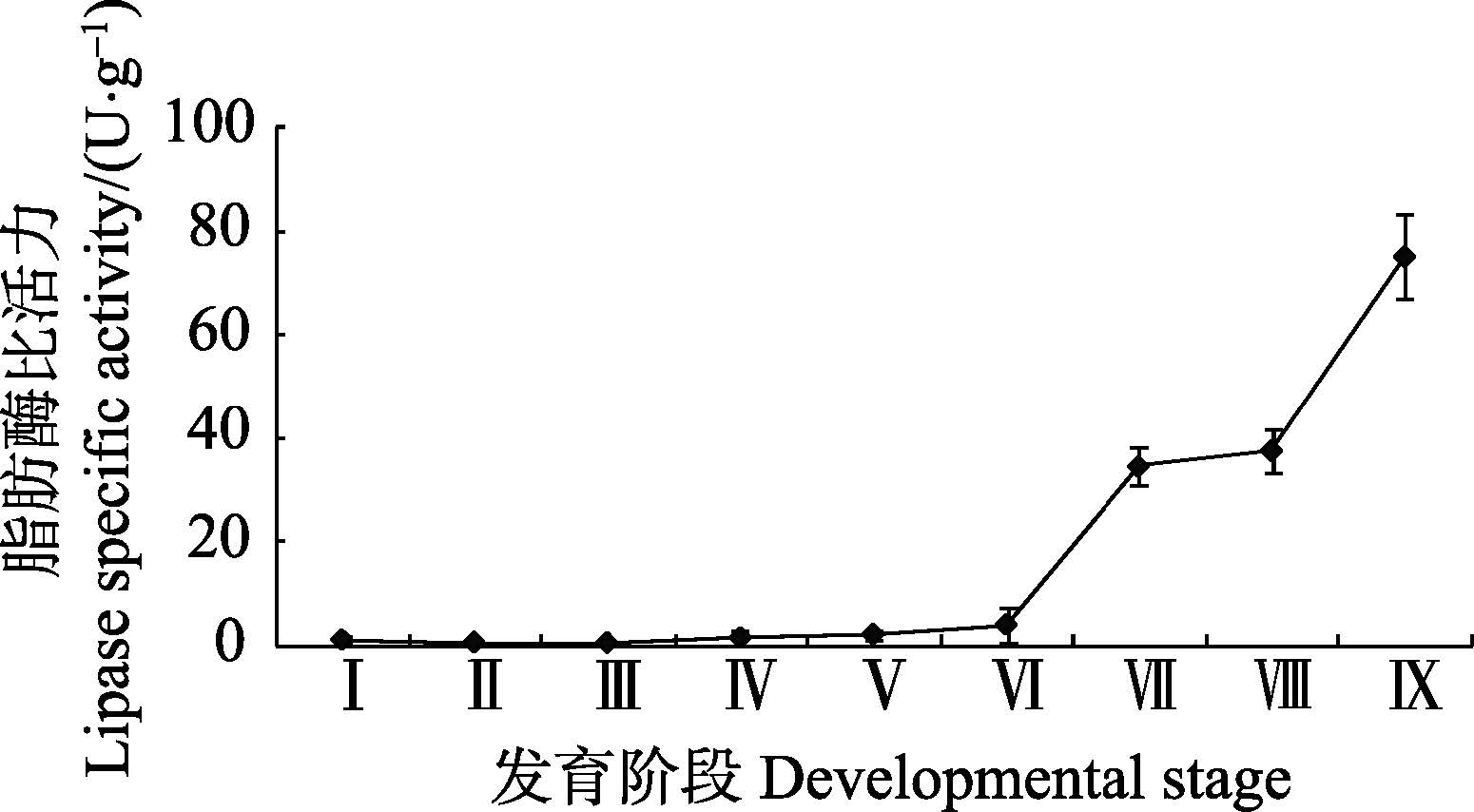
|
图 5 金乌贼早期发育阶段脂肪酶比活力的变化 Figure 5 Variation of the lipasespecific activity in early developmental stages of S. esculenta |
由图 6可知,在金乌贼胚胎发育阶段,谷丙转氨酶比活力呈上升趋势,但处于较低水平。仔金乌贼孵化出膜后,初孵幼体的谷丙转氨酶比活力急剧增加至(37.84±6.79)U/g,随后金乌贼幼体的谷丙转氨酶比活力急剧下降至低于出膜前水平。
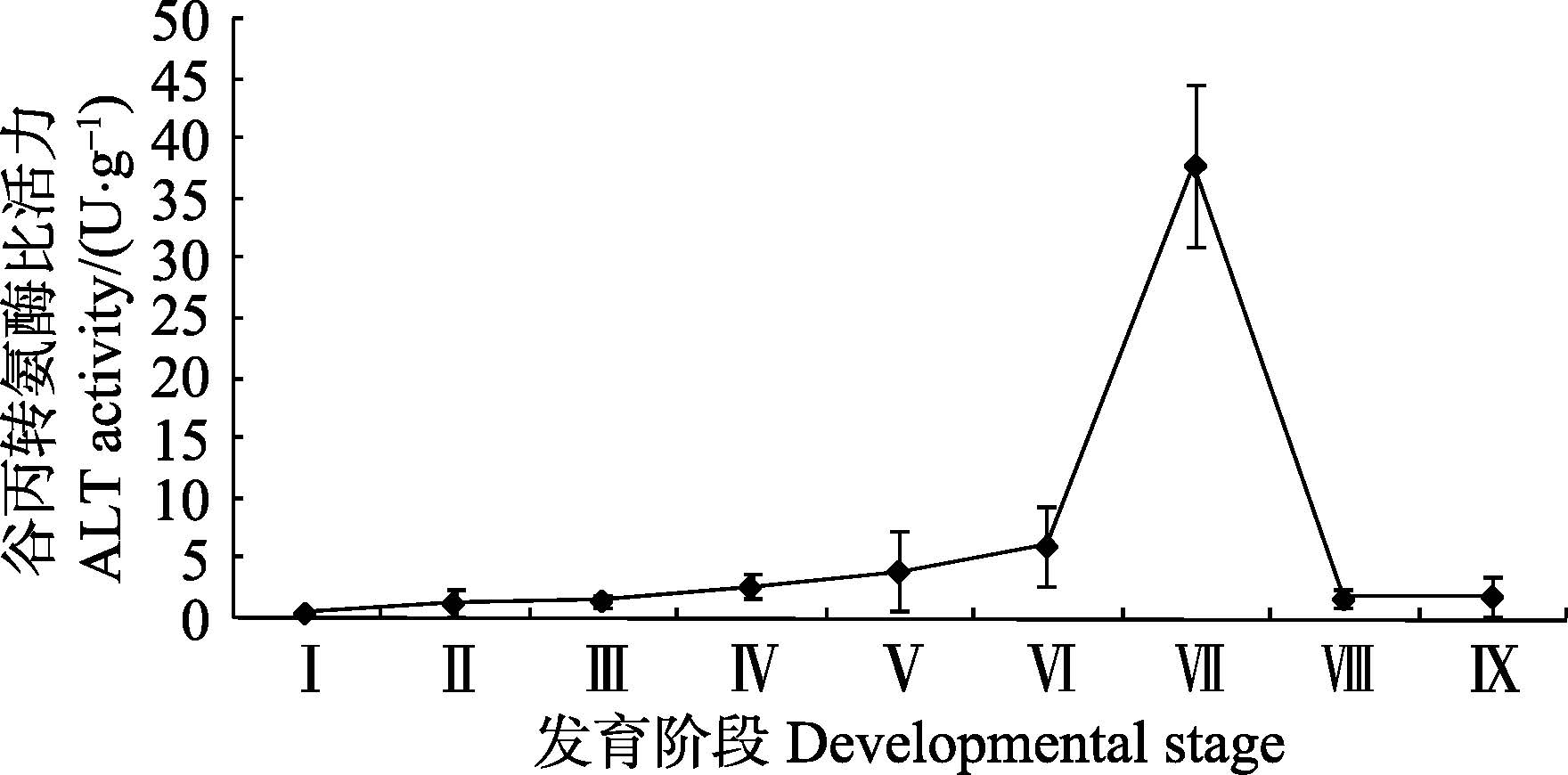
|
图 6 金乌贼早期发育阶段谷丙转氨酶比活力的变化 Figure 6 Variation of the ALT activity in early developmental stages of S. esculenta |
可溶性蛋白是动物胚胎发育时期的主要营养来源,也以酶的形式存在,可以分解卵黄物质(Srivastava et al,1995; Gunasekera et al,1999)。金乌贼在胚胎发育阶段可溶性蛋白浓度处于较高水平,且波动较大,呈先升后降的趋势,其中,囊胚和原肠期最高,后逐渐下降,与长蛸(Octopus variabilis)胚胎发育过程中可溶性蛋白的变化趋势一致(詹萍萍等,2010)。田华梅等(2003)认为,在胚胎发育早期自母体提供的相关酶类不断分解卵黄物质,以提供组织或器官构建所需的物质和能量,但由于头足类卵裂为不完全的盘状卵裂,盘状卵裂只发生在卵黄表面(詹萍萍等,2010),利用和消耗的营养物质较少,可溶性蛋白浓度上升,为后期的胚胎发育积累能量。金乌贼胚胎发育进入器官形成期后,细胞分裂、组织分化及器官形成处于快速发展阶段(陈四清等,2010),需要消耗大量的蛋白为胚胎的代谢提供营养,此时可溶性蛋白的消耗量大于酶水解量,其浓度开始逐渐降低,至幼体孵出后绝大部分卵黄蛋白被消耗,含量达到最低。金乌贼幼体孵出后,幼体主要消化器官的功能逐步完善,合成新蛋白质的速度高于蛋白质的消耗速度,使可溶性蛋白的浓度有所升高。
3.2 消化酶比活力胰蛋白酶、胃蛋白酶和碱性磷酸酶是关系到仔鱼蛋白消化吸收最主要的消化酶,也是肝胰脏、胃、肠等主要消化器官开始功能化的标志性酶(Zambonino et al,2001)。在金乌贼胚胎发育阶段就能检测到胰蛋白酶和胃蛋白酶,不仅说明这两种消化酶主要是由受精卵自母体获得,还说明金乌贼在胚胎发育阶段已经能够进行蛋白质消化利用,因此,蛋白质是胚胎期所需能量主要来源,这与头足类成体能量主要来源于蛋白质的研究结论一致(Lee,1994; García et al,2002)。在金乌贼幼体孵出后,胰蛋白酶和胃蛋白酶比活力急剧升高,其原因主要表现在两个方面:第一,初孵幼体的能量主要由卵黄提供,仔金乌贼孵化出膜后更多的母源胰蛋白酶和胃蛋白酶被激活,用于更多卵黄蛋白的消化,在条石鲷(Oplegnathus fasciatus)(何滔,20111))和军曹鱼(Rachycentron canadum)(Faulk et al,2007)中也有类似的情况;第二,可能与取样方式有关,在胚胎发育阶段采用的是受精卵整体匀浆,样品中包括厚厚的三级卵膜以及体积不断增加的卵周液(陈四清等,2010),而幼体孵出后采用的仅是幼体整体匀浆,造成活性急剧升高。金乌贼幼体孵出后,残留卵黄逐渐被吸收掉,并开口摄食糠虾,此时,由于母源蛋白酶量的不断消耗以及内源性营养向外源性营养转换期间幼体对饵料转变的不适应(Ribeiro et al,1999),导致胰蛋白酶和胃蛋白酶相对活性逐渐下降,到5日龄降到最低,此后,随着胰腺和胃腺的逐渐发育完善,其活性开始上升,说明金乌贼开始摄食后已具有充分的消化饵料的能力。
1) 何滔. 条石鲷早期发育及相关酶活性的研究. 中国科学院研究生院(海洋研究所)博士研究生学位论文, 2011
碱性磷酸酶(AKP)主要存在于鱼类前肠上皮细胞的浅部和纹状缘上,是一种可帮助肠上皮细胞吸收的金属酶,与脂类、葡萄糖、钙和无机磷的吸收存在正相关性(Tengjaroenkul et al,2000; 冯晓燕等,2003)。Zamani等(2009)认为,AKP活性的增加标志肠细胞的持续发育,Beedham(1958)认为可能与贝类幼虫变态及胚壳的形成有关。金乌贼胚胎发育至外部器官形成期时AKP比活力极低,发育至红珠和黑珠期时活力逐渐上升,由此推测,金乌贼在红珠和黑珠期时已经开始了肠细胞的增殖与分化,内壳也逐渐开始形成。金乌贼幼体孵出后,AKP活性显著升高,说明肠的功能逐渐发育完善,且对脂类、葡萄糖、钙和无机磷的吸收能力逐渐增强。此外,孙虎山等(2008)认为,贝类原肠胚之前的各个发育阶段无吞噬细胞的分化,只能依靠分子防御系统抵抗外来生物侵蚀,AKP可能在其早期发育阶段对抵抗病原生物侵染发挥重要作用。金乌贼早期发育阶段AKP是否具有抵御病原生物侵染作用,还需要结合免疫学研究进行进一步验证。
Oozeki等(1995)认为,鱼类个体发育早期存在两种类型的脂肪酶,一种用于卵黄的吸收,而另一种用于外源性脂肪的消化。金乌贼胚胎发育阶段脂肪酶相对活性极低,说明内源性营养阶段用于卵黄吸收的脂肪酶含量极低,表明脂肪不是胚胎发育能量的主要来源,这与欧洲乌贼(Sepia officinalis)的研究结果一致(Sykes et al,2009)。由于能量主要来源于脂类的海洋鱼类都具有富含脂类的油球(Love,1980),而乌贼类受精卵不含油球,推测脂肪不是其胚胎发育能量的主要来源的原因可能与受精卵不含油球有关。金乌贼孵化出膜后,脂肪酶相对活性逐渐上升,直至50日龄活力才趋于平缓(郝振林,20102)),推测金乌贼孵化后脂肪酶活性上升主要是用于外源性脂肪的消化,其相对活性的增加反映出仔金乌贼胰腺的发育、脂肪代谢系统的完善和对食物脂质利用能力的增加,以利于仔金乌贼开口摄食后外源性脂肪的消化。
2) 郝振林. 金乌贼繁殖、发育及荧光标志技术的研究. 中国海洋大学博士研究生学位论文, 2010
谷丙转氨酶(ALT)是氨基酸代谢过程中重要的氨基转移酶,主要在催化α-酮戊二酸与天冬氨酸生成谷氨酸与草酰乙酸的反应过程中起氨基转移作用,通常根据血清中转氨酶活性的变化判断肝脏等组织器官的功能状况(陈晨等,2010)。目前,关于水产动物ALT活性研究主要集中在化学物质对其活性的影响(陈晨等,2010; 王媛等,2005; 谭娟等,2001),迄今为止,未见关于早期发育阶段ALT活力变化的研究报道。在金乌贼胚胎发育阶段ALT就具有一定的活性,说明ALT主要从母体获得。初孵幼体的ALT相对活性急剧增加,其原因可能是由于幼体孵出后失去了卵膜的保护,受环境突变胁迫所致,此后,随着幼体对环境的适应性增强,环境胁迫的影响逐渐消失,使得ALT活性逐渐降低至出膜前水平且逐步趋于稳定。
| 王媛, 杨康健, 吴中, 等. 氯氰菊酯对鲫鱼血清中谷丙转氨酶及谷草转氨酶活力的影响. 水产科学 , 2005, 24 (9) : 8-10 | |
| 田华梅, 王群, 赵云龙, 等. 中华绒螯蟹胚胎发育过程中的消化酶活力及氨基酸组成. 中国水产科学 , 2003, 10 (5) : 404-408 | |
| 冯晓燕, 郑家声, 王梅林. 许氏平鲇消化道的组织化学研究. 青岛海洋大学学报 , 2003, 33 (3) : 399-404 | |
| 孙虎山, 王宜艳, 梁建光, 等. 贻贝(Mytilus edulis)发育早期酸性和碱性磷酸酶活性. 海洋与湖沼 , 2008, 39 (1) : 42-48 | |
| 孙敏, 柴学军, 许源剑, 等. 日本黄姑鱼早期发育过程中消化酶活性变化研究. 上海海洋大学学报 , 2012, 21 (6) : 965-970 | |
| 陈四清, 刘长琳, 庄志猛, 等. 金乌贼(Sepia esculenta)胚胎发育的研究. 渔业科学进展 , 2010, 31 (5) : 1-7 | |
| 陈晨, 黄峰, 舒秋艳, 等. 共轭亚油酸对草鱼生长、肌肉成分、谷草转氨酶及谷丙转氨酶活性的影响. 水生生物学报 , 2010, 34 (3) : 647-651 | |
| 詹萍萍, 王春琳, 张晓梅, 等. 长蛸胚胎发育过程中可溶性蛋白含量及组成变化. 海洋学研究 , 2010, 28 (4) : 65-69 | |
| 谭娟, 尚蕾, 肖雅元. 甲氰菊酯对尼罗罗非鱼组织乙酰胆碱酯酶、谷丙转氨酶和谷胱甘肽活性的影响. 淡水渔业 , 2001, 41 (3) : 39-42 | |
| Beedham GE. Observation on the mantle of the lamellibranchia. Quart J Microscop Sci , 1958, 99 (2) : 181-197 | |
| Diaz M, Moyano FJ, Garcia-Carreno FL, et al. Substrate- SDS-PAGE determination of protease activity through larval development in sea bream. Aquacult Int , 1997, 5 (5) : 461-471 DOI:10.1023/A:1018340929705 | |
| Erlanger B, Kokowsky N, Cohen W. The preparation and properties of two new chromogenic substrates of trypsin. Arch Biochem Biophy , 1961, 95 (2) : 271-278 DOI:10.1016/0003-9861(61)90145-X | |
| Faulk CK, Benninghoff AD, Holt GJ. Ontogeny of the gastrointestinal tract and selected digestive enzymes in cobia Rachycentron canadum (L.). J Fish Biol , 2007, 70 (2) : 567-583 DOI:10.1111/jfb.2007.70.issue-2 | |
| García BG, Giménez FA. Influence of diet on ongrowing and nutrient utilization in the common octopus (Octopus vulgaris). Aquaculture , 2002, 211 (1-4) : 171-182 DOI:10.1016/S0044-8486(01)00788-8 | |
| Gunasekera RM, Silva SSD, Ingram BA. The amino acid profiles in developing eggs and larvae of the freshwater Percichthyid fishes, trout cod, Maccullochella macquariensis and Murray cod, Maccullochella peelii peelii. Aquat Living Res , 1999, 12 (4) : 255-261 DOI:10.1016/S0990-7440(00)86636-X | |
| Lee PG. Nutrition of cephalopods: fueling the system. Mar Freshwater Behav Physiol , 1994, 25 (1) : 35-51 | |
| Lemieux H, Blier P, Dutil JD. Do digestive enzymes set a physiological limit on growth rate and food conversion efficiency in the Atlantic cod (Gadus morhua). Fish Physiol Biochem , 1999, 20 (4) : 293-303 DOI:10.1023/A:1007791019523 | |
| Love RM. Chemical Biology of Fishes. London: Academic Press, 1980 : 1968 -1977. | |
| Oozeki Y, Bailey KM. Ontogenetic development of digestive enzyme activities in larval walleye pollock, Theragra chalcogramma. Mar Biol , 1995, 122 (2) : 177-186 | |
| Perrin A, Bihan EL, Koueta N. Experimental study of enriched frozen diet on digestive enzymes and growth of juvenile cuttlefish Sepia officinalis L. J Exp Mar Biol Ecol , 2004, 311 (2) : 267-285 DOI:10.1016/j.jembe.2004.05.012 | |
| Ribeiro L, Couto A, Olmedo M, et al. Digestive enzyme activity at different developmental stages of blackspot seabream, Pagellus bogaraveo (Brunnich 1768). Aquacult Res , 2008, 39 (4) : 339-346 DOI:10.1111/j.1365-2109.2007.01684.x | |
| Ribeiro L, Zambonino-Infante JL, Cahu CL, et al. Development of digestive enzymes in larvae of Solea senegalensis, Kaup 1858. Aquaculture , 1999, 179 (1) : 465-473 | |
| Srivastava RK, Brown JA, Shahidi F. Changes in the amino acid pool during embryonic development of cultured and wild Atlantic salmon (Salmo salar). Aquaculture , 1995, 131 (1) : 115-124 | |
| Sykes AV, Almansa E, Lorenzo A, et al. Lipid characterization of both wild and cultured eggs of cuttlefish (Sepia officinalis L.) throughout the embryonic development. Aquacult Nutr , 2009, 15 (1) : 38-53 DOI:10.1111/anu.2008.15.issue-1 | |
| Tengjaroenkul B, Smith BJ, Caceci T, et al. Distribution of intestinal enzyme activities along the intestinal tract of cultured Nile tilapia, Oreochromis niloticus L. Aquaculture , 2000, 182 (3) : 317-327 | |
| Zamani A, Hajimoradloo A, Madani R, et al. Assessment of digestive enzymes activity during the fry development of the endangered Caspian brown trout Salmo caspius. J Fish Biol , 2009, 75 (4) : 932-937 DOI:10.1111/jfb.2009.75.issue-4 |



