2. 上海海洋大学食品学院 上海 201306;
3. 荣成泰祥食品股份有限公司 荣成 264300;
4. 威海时进食品检测服务有限公司 荣成 264300;
5. 青岛华测检测技术有限公司 青岛 266101
2. College of Food Science & Technology, Shanghai Ocean University, Shanghai 201306 ;
3. Rongcheng Taixiang Food Products Co., Ltd., Rongcheng 264300 ;
4. Weihai Shijin Food Inspection Service Co., Ltd., Rongcheng 264300 ;
5. Qingdao Centre Testing International Co., Ltd., Qingdao 266101
近年来,受人类活动的影响,有害赤潮现象在我国频繁发生,伴随赤潮而来的产毒藻类产生的海洋生物毒素,不仅恶化海洋环境、严重影响海洋渔业资源和水产养殖,而且还可以通过食物链,危害人体健康,甚至致人死亡(周秀锦等,2012)。腹泻性贝类毒素(Diarrhetic shellfish poisons,DSP)是其中一类常见的危害严重的海洋毒素,它是由海洋中藻类或微生物产生的一类脂溶性次生代谢产物,主要来自于鳍藻属和原甲藻(马荣桧等,2013)。常见腹泻性贝类毒素主要有以下4种:聚醚类毒素的大田软海绵酸(Okadaic acid,OA)和鳍藻类毒素(Dinophysistoxin-1,DTX-1和Dinophysistoxin-2,DTX-2)以及米氏螺环毒素(Gymnodimine toxins,GYM)(母清林等,2013),以OA最为常见。人体DSP中毒的症状表现为消化功能紊乱,出现腹泻、呕吐、腹痛的同时,并伴有恶心和肠胃绞痛等类似急性肠胃炎的症状(张锐等,2013)1)。每年由贝类毒素引起的人体中毒事件屡见不鲜,给水产品加工业及进出口贸易造成了巨大的经济损失(黄翔等,2013; 李兆新等,2016)。
1) 张锐, 兰文开, 欧小雷, 等. 腹泻性贝毒(DSP)研究进展. 中国环境科学学会学术年会论文集, 2013, 65-68
固相吸附毒素跟踪技术(Solid phase adsorbent and toxin tracking,SPATT)由荷兰学者MacKenzie等(2004)提出,该技术利用吸附树脂主动吸附的原理直接从海水中富集毒素。结合毒素检测技术,能从时间和空间两方面反应整个水体中毒素变化情况,能全方位实时监控水体环境,建立海水中毒素提前预警方法(Caillaud et al,2011)。SPATT技术在麻痹性贝毒与腹泻性贝毒的富集与检测方面的应用已有报道。Fux等(2010)经过长时间实验,应用HP20树脂成功吸附OA和DTX-2毒素,在实验室中证明该种树脂能有效吸附这两种常见的贝类毒素。Rodriguez等(2011)证明该技术可用于麻痹性贝毒预警体系的建立。荷兰学者McCarthy等(2008)在Longh Hyne海洋自然保护区内,比较了HP20大孔型吸附树脂与SP700型树脂对腹泻性贝毒的吸附能力,建立了水体环境中两种腹泻性贝类毒素的时间和空间变化的全方位检测。在国内,杨守国(2010)1)在胶州湾海域进行相关实验,研究了OA与百日咳毒素(Pertussis toxin,PTX)2种毒素随时间的变化趋势,但未建立整个水体环境内的毒素空间变化规律。上述研究表明,以HP20为代表的树脂能吸附海水中的贝类毒素,SPATT技术可用于监控水体中贝类毒素的时空变化。但关于树脂对不同贝类毒素的吸附效果(赵慧,2012)2),以及树脂吸附贝类毒素的含量同养殖区生物样品中毒素含量之间关系的研究较少(Rodriguez et al,2011)。本研究在前人研究的基础上,系统研究了HP20树脂对4种常见腹泻贝类毒素的吸附效果,在黄海某牡蛎养殖区进行了实验,调查了海水中4种常见的腹泻性贝类毒素,分析了4种毒素在水体环境和牡蛎体内的时间与空间的变化规律,为我国今后贝类毒素监控体系的建立提供了方法和数据支持。
1) 杨守国. 黄海胶州湾海区腹泻性贝毒的特征和时间变化规律研究. 上海海洋大学硕士研究生学位论文, 2010, 1-10
2) 赵慧. 微囊藻毒素的树脂吸附于原位检测方法研究. 中国海洋大学硕士研究生学位论文, 2012, 12-15
1 材料与方法 1.1 实验材料实验所用毒素标准品购于加拿大海洋生物科学研究所;甲醇、乙酸乙酯、甲酸、乙腈、异丙醇(色谱纯)为德国默克公司生产,氨水,乙酸铵(色谱纯)购于天津科密欧化学试剂公司。
1.2 仪器设备液相色谱串联四级杆质谱联用仪(Thermo TSQ Quantum Access,美国),配电喷雾离子源(ESI);N- EVAP112型氮吹仪(Organomation Associates,美国);KQ-600DE型超声清洗器(KQ-300VDV,昆山超声仪器有限公司,上海);旋转蒸发仪(R-3,BUCHI,瑞士);分析天平,精确度0.0001 g(XS10SDU,Mettler Toledo,瑞士);HP20大孔吸附树脂(DIAION,三菱,日本);48 μm聚酯网布;砂芯滤柱(30 cm × 2 cm),可调节流速。
1.3 实验方法 1.3.1 树脂吸附效率实验验证选用HP20型大孔吸附树脂,用孔径为48 μm的聚酯网布缝制成边长为6 cm × 6 cm的正方形布袋,装入20 g DIAION HP20大孔吸附树脂之后密封,在正方形布袋的一角固定尼龙挂扣。吸附袋在甲醇中浸泡24 h,然后用蒸馏水浸泡2 h,取出,换新蒸馏水重复3次,放入密封的塑料袋中,在4℃条件下短时间保存,待用。
选用本底不含4种贝类毒素的海水,分别放置于 5个相同的容器中,每个容器放置约5 L海水,并加入200 μl浓度为500 μg/kg的含有4种毒素的混合标准溶液,分别放置已活化的树脂吸附袋,进行主动吸附,第1、3、5、7、9天取出,进行样品处理,设3组平行,取平均值。
1.3.2 海水中贝类毒素富集根据统计学原理,在整个养殖区的4个角和对角线的交点位置设置5个采样点,7 d采样1次。将吸附袋系于长绳上,分上、中、下3层,层间隔2 m,每层一次固定2个吸附袋,将绳系于固定位置的漂浮杆上,每间隔7 d将吸附袋取出,再放入新的吸附袋,提取的吸附袋用蒸馏水冲洗,放入预先编号的样品袋中,冰盒保存直至实验室4℃条件下暂存。
将树脂填料转入砂芯滤柱中,用50 ml去离子水洗去盐分,把柱子中水分正压吹干,加入20 ml甲醇,滤入蒸发瓶中,再加入20 ml甲醇重复提取1次。提取液在40℃蒸去甲醇,残余1-2 ml水,用5 ml二氯甲烷萃取后离心,取出二氯甲烷层,重复萃取1次,合并2次二氯甲烷萃取液后氮气吹干,用1.0 ml甲醇定容,以0.22 μm的聚四氟乙烯滤膜过滤,供LC-MS/MS检测。
1.3.3 牡蛎中贝类毒素样品的制备、净化准确称取均质后的样品2.00 g于25 ml离心管中,加入10 ml 80%甲醇水溶液,旋涡振荡1 min,超声提取10min,4000r/min离心6 min,将上清液转移至25 ml容量瓶中。重复上述操作并合并上清液,40℃条件下旋蒸(加异丙醇作消泡剂),旋蒸至小于5 ml,在水相中加入10 ml乙酸乙酯,旋涡1 min,萃取,4000 r/min离心6 min。重复上述操作,合并乙酸乙酯层,40℃旋蒸蒸干,加800 μl甲醇复溶,后加入5 ml水稀释混匀,待净化。
MAX固相萃取柱依次用6 ml甲醇、6 ml水活化处理,加入上样液,依次用6 ml 5%氨水、6 ml 10%甲醇水溶液淋洗,最后用6 ml甲酸/甲醇(2/98,v/v)洗脱。接收洗脱液,在40℃条件氮气吹干,准确加入1 ml甲醇定容,旋涡1 min后过孔径为0.22 μm聚四氟乙烯有机滤膜,滤液供LC-MS/MS分析。
1.3.4 贝类毒素的检测色谱柱:MGII C18(2.0 mm i.d.×100 mm,5 μm);柱温:35℃;样品室温度:4℃;进样量:10 μl;流动相分为A、B两部分,其中,A为乙腈(含1‰甲酸和2 mmol/L乙酸铵),B为100%水(含1‰甲酸和2 mmol/L乙酸铵),采用梯度洗脱方式,具体参数见表 1。
|
|
表 1 腹泻性贝类毒素梯度洗脱方式 Table 1 Gradient elution method of DSP |
离子源:电喷雾离子源ESI;检测方式为选择反应监测(Selected Reaction Monitoring,SRM);电喷雾电压:3500 V;毛细管温度:350℃;辅助气压力:10 psi;鞘气压力:30 psi。扫描宽度(m/z):0.01;扫描时间:0.1 s。经测试,GYM毒素在ESI+源条件下有较高响应,OA、DTX-1、DTX-2在ESI-条件下有较高响应,具体参数见表 2。
|
|
表 2 4种毒素质谱分析参数 Table 2 Parameters of mass spectrometry for four toxins |
比较了HP20树脂对4种常见腹泻性贝类毒素的吸附效率,分别检测吸附第1、3、5、7、9天树脂内吸附毒素的含量,结果取3组平行实验的平均值,见表 3。结果显示,HP20树脂对腹泻性贝毒OA、DTX-1、DTX-2三种毒素的吸附效率较好,随着时间的延长,树脂对3种毒素的吸附量逐渐增加,在第7天接近饱和状态,吸附效率在92.1%以上,随着时间继续延长,第9天的吸附量同第7天相比变化不大;HP20对腹泻性贝毒GYM的吸附效率较低,在第7天达到峰值,为76.6%,第9天的吸附量同第7天相比变化不大。表明HP20树脂可以很好地吸附上述4种毒素,树脂在海水中放置7 d即达到较好的吸附效果,可用于后续富集海水中的4种毒素。
|
|
表 3 吸附时间对树脂吸附毒素量的影响 Table 3 The effect of residence time on quantities of toxins in the resin |
本研究比较了D101、SP700两种树脂对4种毒素的吸附效率,结果显示,D101型树脂只对OA有微量吸附,SP700型树脂对OA和DTX-1有少量吸附,这与李鑫(2013)1)的研究结果相似。而HP20大孔型吸附树脂,能很好地吸附海水中常见的4种腹泻性贝类毒素,但相比较OA、DTX-1、DTX-2三种毒素来讲,对GYM的吸收效率偏低,这是因为GYM含有螺环和亚胺结构,致使GYM偏弱碱性(MacKenzie et al,2002)。HP20大孔型吸附树脂是一类非极性树脂,主要为苯乙烯聚合物,又称为芳香族吸附树脂,其吸附力主要为范德华力与氢键,而含有亚胺结构的GYM形成氢键的能力较弱,故而HP20型树脂对GYM的吸附率小于其他3种毒素(赵慧,2012)1)。
1) 李鑫. 液相色谱质谱联用技术筛查及测定海水和藻体中脂溶性藻毒素. 国家海洋局第一海洋研究所硕士研究生学位论文, 2013
1) 赵慧. 微囊藻毒素的树脂吸附与原位监测方法研究. 中国海洋大学硕士研究生学位论文, 2012, 55-59
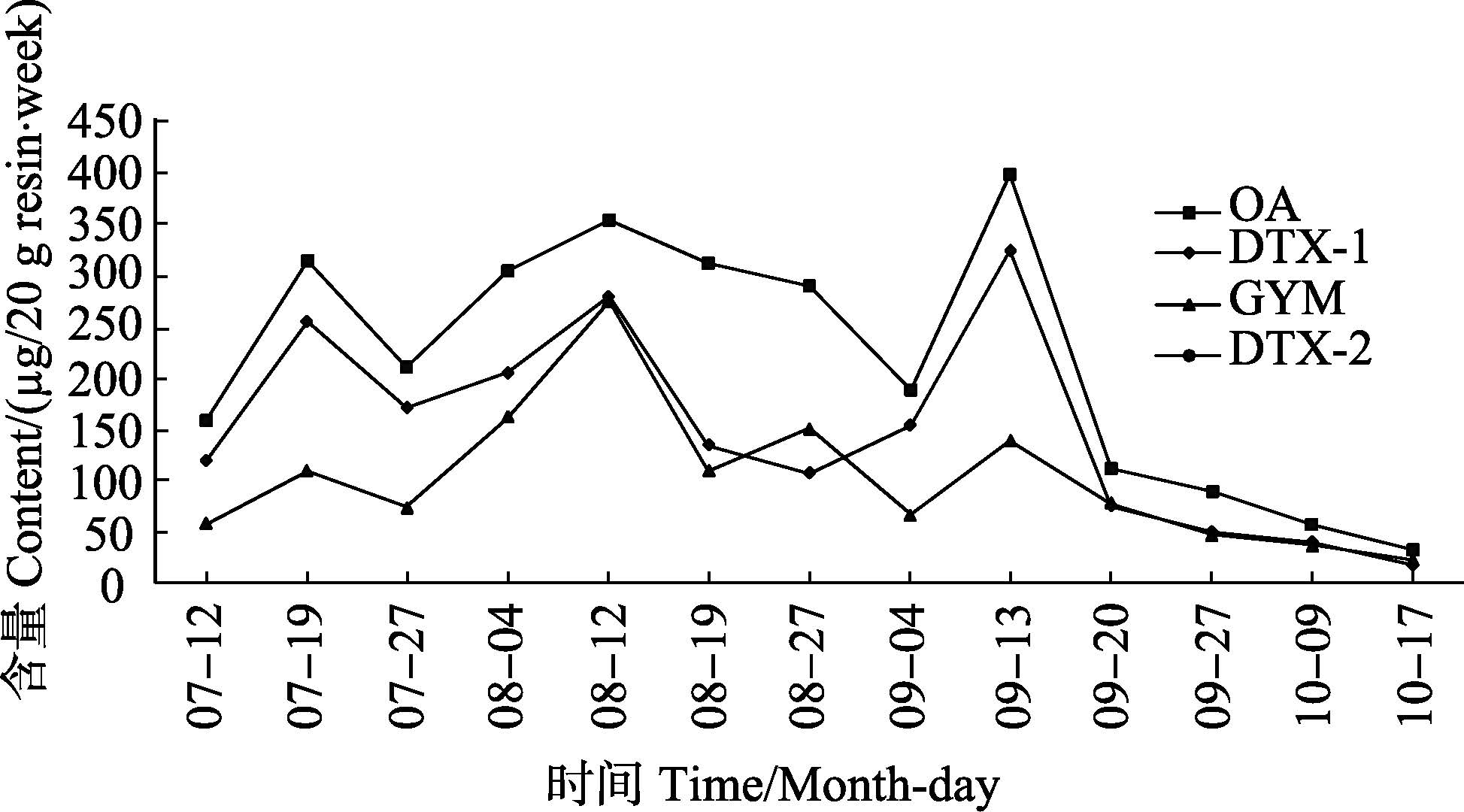
2.2 养殖海域中4种毒素含量的分布特征在整个监测期间,海水中4种毒素含量的分布情况见图 1。对监控点的上、中、下3层海水中的毒素取平均值,发现在监控期间内,OA的含量相对较高,其次为DTX-1,GYM含量在4种毒素中相对较低,DTX-2未检测出。
|
图 1 养殖区内4种腹泻性贝类毒素含量的变化 Figure 1 The variation of four DSPs in the oyster farming area |
在中国,目前公认腹泻性贝类毒素中最大的威胁为OA,日本也将OA作为LC-MS/MS检测方法的定量物质,其他毒素可依据危害转化因子转换为OA来定量。本研究发现,在整个监控期内,OA的含量均处于较高水平,而在整个海域内未检测到DTX-2。DTXs是一类由鳍藻类产生的腹泻性贝类毒素,除此之外,该种藻类还产生OA及其衍生物和PTX,鳍藻产毒状况存在很大的种间差异,产生DTX-2毒素的藻类主要为D. acuta(尖锐鳍藻)类,该种藻类主要分布在爱尔兰、西班牙、斯堪的纳维亚半岛、葡萄牙地域,它们的产毒能力也随地理分布的差异而有所 不同(罗璇,2011)2)。
2) 罗璇. 青岛近海鳍藻种群动态与产毒特征研究. 中国科学院博士研究生学位论文, 2011, 32-40
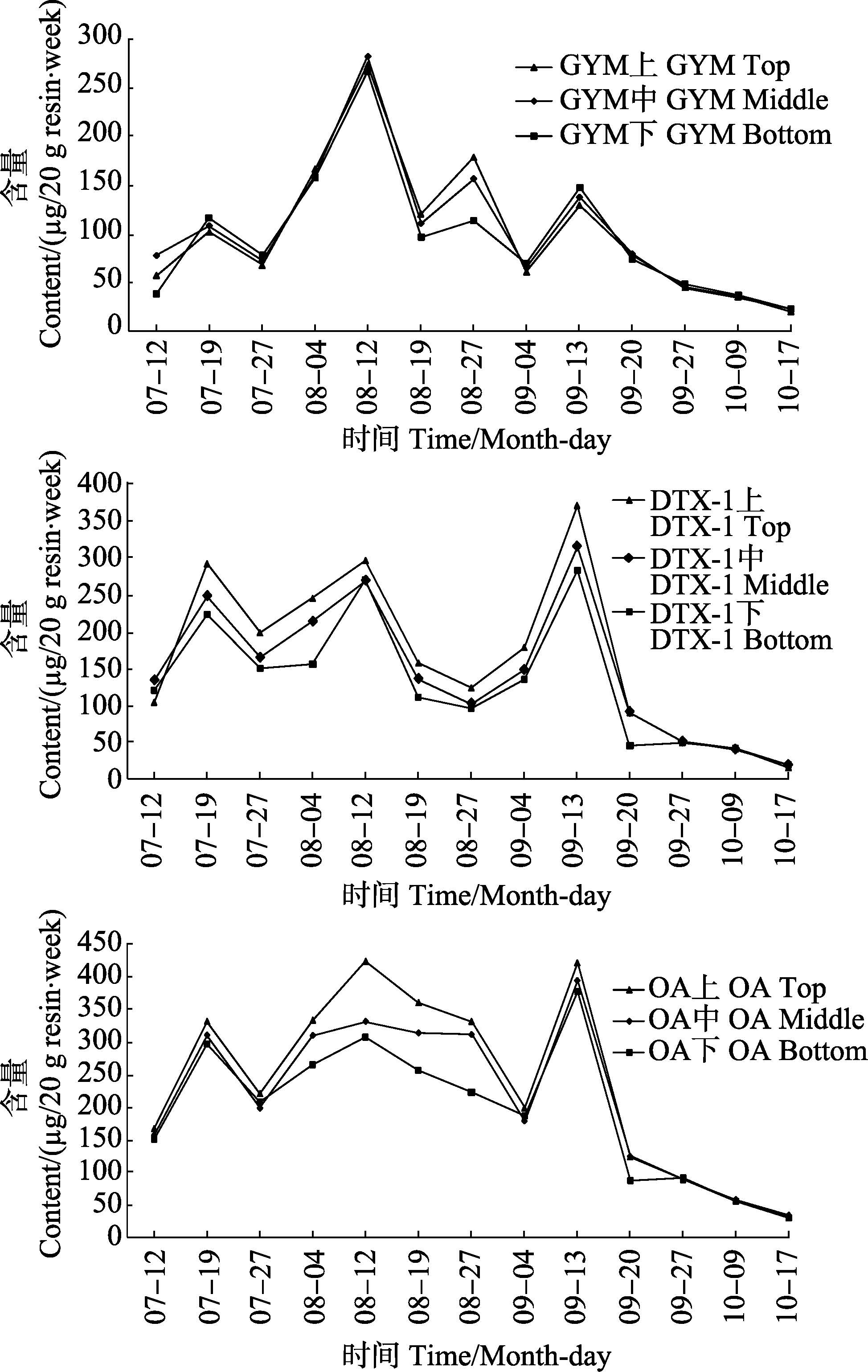
2.3 养殖海域内腹泻性贝类毒素含量的变化规律从2014年7月12日-10月17日对养殖区海水中的腹泻性贝类毒素进行了监测(图 2)。在整个监控期内,3种腹泻性贝类毒素整体含量呈先递增后下降的趋势,OA含量在8月12日检测点含量最高,为422.352 μg /20 g resin∙week,DTX-1毒素在9月13日最高,为368.678 μg/20 g resin∙week。GYM毒素含量在8月 12日检测点最高,为282.231 μg/20 g resin∙week。在整个监测过程中,养殖海域内未发现DTX-2。3种毒素的峰值均出现在8-9月,其中,GYM与OA的峰值出现在8月12日,DTX-1峰值出现在9月13日。分析原因为海域水体温度偏高引起,据当地海洋局水文资料显示,8月中旬-9月中旬之间,该海域内平均水温在23.5℃以上,7月之前和10月之后,水温一般在15.3℃以下,在较高水体温度下,产毒藻类生长旺盛,新陈代谢活动产生大量毒素,导致水体中毒素含量增高。
|
图 2 3种腹泻性贝类毒素的分布与变化规律 Figure 2 The distribution and variation of three DSPs |
在不同水层放置HP20树脂吸附袋,结果显示,在9月20日前,悬挂在上层的树脂中吸附3种毒素含量明显高于中、下层,并且呈现上层>中层>下层的变化特征。说明腹泻性贝类毒素表层水中含有大量毒素,随深度增加,毒素呈现递减趋势。9月20日之后,上、中、下3层水层内毒素含量基本相等,海水中毒素整体含量已处于很低的水平。在8-9月间不同水层水体中3种毒素的含量呈现较大差异,这是因为腹泻性贝类毒素主要是藻类的代谢产生,其含量受到藻类新陈代谢活动的影响,而藻类新陈代谢活动受阳光、温度等影响(赵洪,2014)1),在8-9月期间,上层水温温度高,藻类新陈代谢活动旺盛,产生毒素含量也相对较高,随水深深度的加深,水温及光照强度都呈现递减趋势,故而不同水层水体中毒素含量呈现该分布规律。8月之前与9月之后,不同水层水体中温度都处于较低水平,藻类新陈代谢活动弱,故呈现上、中、下层含量差异不明显。
1) 赵洪. 周村水库藻类特征及其在混合胁迫条件下的生长衰亡规律. 扬州大学硕士研究生学位论文, 2014, 76-80
此外,产毒藻类繁殖和新陈代谢的强弱还受到海水中营养盐和养料的影响,在8月12日和9月13日,受今年第8号和14号台风的影响,台风导致大洋中的营养盐迁移至近海养殖区,为藻类提供丰富的营养物质,此外,台风带来大量降水,淡水经地表流入近海养殖区,淡水中含有大量的营养成分,加剧了海水的富营养化,导致产毒藻活动旺盛,海水中毒素含量激增。国内也有不少文献报道关于天气原因,如台风、持续低压等天气或气候原因引起赤潮的发生(任湘湘等,2007),这也解释了在8月12日和9月13日3种毒素含量呈现2个峰值。
2.4 海水中与牡蛎体内贝类毒素之间的相关性本研究同步测定了生物体牡蛎内的4种毒素的含量,并与树脂吸附海水中的毒素进行比较,探究二者之间的相关关系。
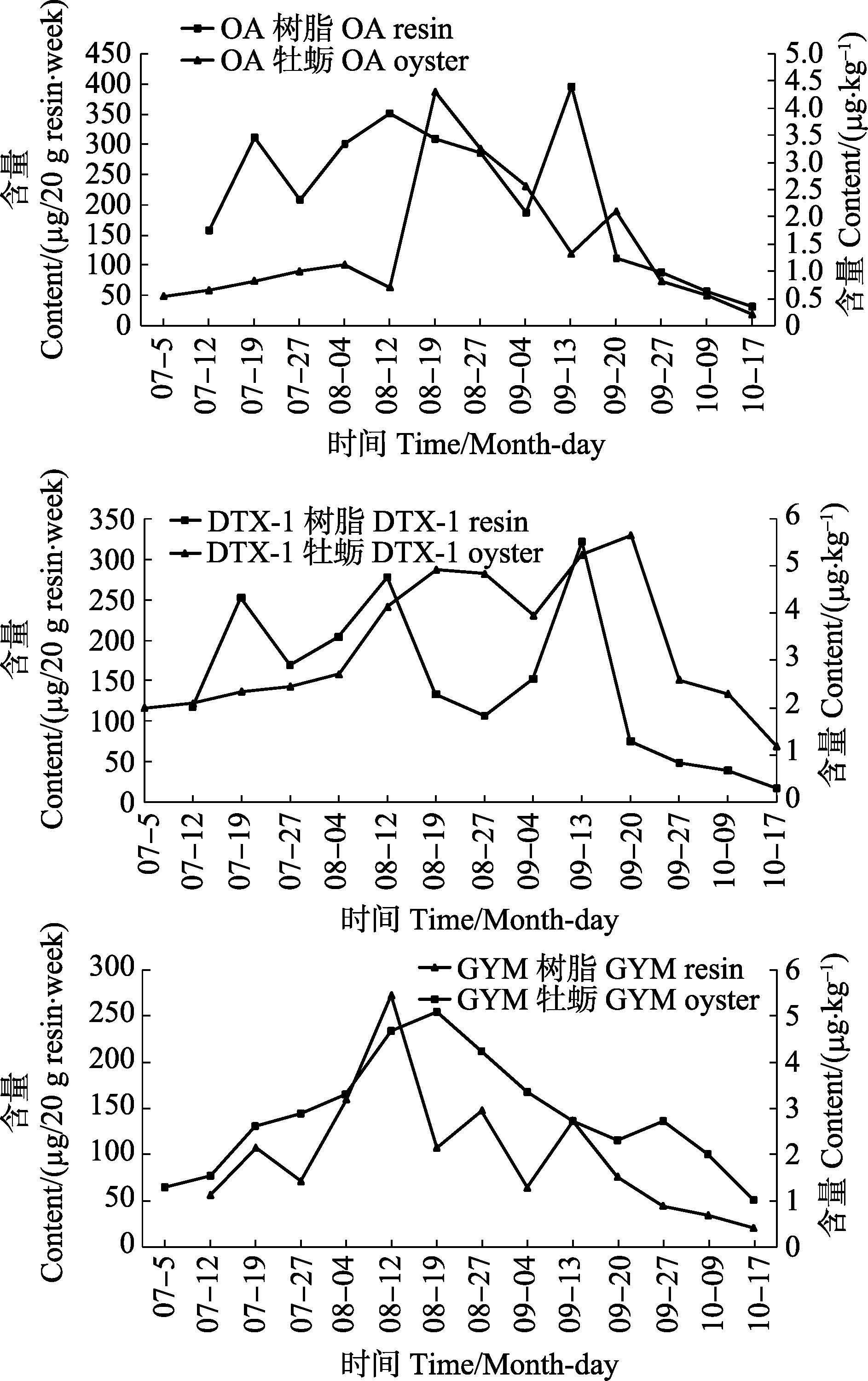
实验结果显示,海水中与牡蛎体内贝类毒素的含量呈现正相关关系(图 3),当海水中贝类毒素含量相对高时,牡蛎体内毒素含量也相对较高,每年10月至次年6月期间,牡蛎体内毒素含量相对较低,这是由于随着气温降低,产毒藻生长繁殖减速,赤潮发生概率低,海洋水体相对安全。
|
图 3 海水中与牡蛎体内贝类毒素之间的相关性 Figure 3 The correlation between toxins in oysters and those in the seawater |
此外,实验结果显示,牡蛎体内3种毒素与海水中毒素的含量峰值上出现延后现象,整个监控期内,在8月12日,海水中这3种贝类毒素的含量达到峰值,而牡蛎体内这3种腹泻性毒素在8月19日含量达到峰值,延后约1个采样周期的时间,而后呈现下降趋势;在9月13日,受台风影响,海水中DTX-1毒素含量出现急剧增长,此时牡蛎体内毒素含量也呈现急剧增长,而其他2种毒素未出现该现象,主要是因为台风带来大量营养物质,致使鳍藻属藻类迅速增长,新陈代谢旺盛,产生大量腹泻性贝类毒素DTX-1,海水中毒素含量出现增高,而牡蛎主要滤食该种藻类,该种毒素在牡蛎体内迅速富集,从而致使在9月20日检测到牡蛎体内DTX-1毒素含量增高。随着环境中毒素含量逐渐下降,牡蛎体内毒素含量也随之下降,在整个监控期间内,在牡蛎内未检测到DTX-2。
牡蛎体内与海水中毒素含量峰值上存在延后现象的原因,主要是牡蛎体内毒素富集与净化需要一定时间,这与Seubert等(2012)的研究结果有相似性,海水中出现的鳍藻类毒素达到最大浓度的时间与贻贝中富集DSP最高浓度之间有一定的时间差,即为富集时间。曹际娟等(1998)研究发现,牡蛎的富集时间比贻贝稍慢一些;当海水中毒素含量下降时,牡蛎体内毒素出现净化现象,其净化速度也受到环境水温的影响,在双壳贝类中,净化腹泻性贝毒时间一般为10 d左右。此外,还有一部分原因是牡蛎内脏团中的藻类被代谢出体外,这也导致牡蛎体内毒素含量出现降低。
3 结论本研究表明,HP20 大孔吸附树脂能有效富集海水中常见的腹泻性贝类毒素,能够全方位检测海水中贝类毒素的含量。本研究建立了海水中与牡蛎体内贝类毒素含量之间的变化关系,二者之间存在一个采样周期的时间差,这为贝类毒素预警体系的建立提供了数据支持。
| 马荣桧, 高彦, 万进, 等. 贝类毒素及检测技术的研究现状. 食品研究与开发 , 2013, 34 (22) : 104-108 | |
| 母清林, 方杰, 王晓华, 等. 液相色谱?串联质谱法检测贝类产品中麻痹性贝类毒素. 中国环境监测 , 2013, 39 (2) : 111-114 | |
| 任湘湘, 何恩业, 李海, 等. 珠江口赤潮生成的天气分型研究. 海洋预报 , 2007, 24 (3) : 46-58 | |
| 李兆新, 张婷婷, 郭萌萌, 等. 贝类毒素固相吸附示踪监测技术研究进展. 渔业科学进展 , 2016, 37 (5) : 162-166 | |
| 周秀锦, 周向阳, 周斌, 等. HPLC检测记忆缺失性贝毒软骨甲藻酸. 浙江海洋学院学报(自然科学版) , 2012, 31 (3) : 211-214 | |
| 黄翔, 雷芳, 江天久, 等. 我国东海和南海近岸海域腹泻性贝毒污染现状. 暨南大学学报(自然科学与医学版) , 2013, 34 (1) : 101-105 | |
| 曹际娟, 唐守亭. 试探应用贻贝进行海洋生物毒素跟踪监测的可行性. 卫生研究 , 1998 (s1) : 105-108 | |
| Caillaud A, Iglesia PDL, Barber E, et al. Monitoring of dissolved ciguatoxin and maitotoxin using solid-phase adsorption toxin tracking devices: application to Gambierdiscus pacificus in culture. Harmful Algae , 2011, 10 (5) : 433-446 DOI:10.1016/j.hal.2011.02.004 | |
| Seubert EL, Trussell S, Eagleton J. Algal toxins and reverse osmosis desalination operations: Laboratory bench testing and field monitoring of domoic acid, saxtioxin, brevetoxin and okadiaic acid. Water Research , 2012, 46 (19) : 6563-6573 DOI:10.1016/j.watres.2012.09.042 | |
| Fux E, Gonzalez-Gil S, Lunven M, et al. Production of diarrhetic shellfish poisoning toxins and pectenotoxins at depths within and below the euphotic zone. Toxicon , 2010, 56 (8) : 1478-1496 | |
| MacKenzie L, Beuzenberg V, Holland P, et al. Solid phase adsorption toxin tracking (SPATT): a new monitoring tool that simulates the biotoxin contamination of filter feeding bivalves. Toxicon , 2004, 44 (8) : 901-918 DOI:10.1016/j.toxicon.2004.08.020 | |
| MacKenzie AL, Holland P, McNabb P, et al. Complex toxin profiles in phytoplankton and Greenshell mussels (Perna canaliculus), revealed by LC-MS/MS analysis. Toxicon , 2002, 40 (9) : 1321-1330 DOI:10.1016/S0041-0101(02)00143-5 | |
| McCarthy M, van Pelt FNAM, Bane V, et al. Application of passive(SPATT) and active sampling methods in the profiling and monitoring of marine biotoxins. Toxicon , 2014, 89 (9) : 77-86 | |
| Rodriguez P, Alfonso A, Turrell E, et al. Study of solid phase adsorption of paralytic shellfish poisoning toxins (PSP) onto different resins. Harmful Algae , 2011, 10 (5) : 447-455 DOI:10.1016/j.hal.2011.02.005 |



