2. 江苏省宿迁旭邦水产科技有限公司 泗洪 223900;
3. 上海海洋大学 上海市教委水产动物遗传育种协同创新中心 上海 201306
2. Jiangsu Suqian Xubang Fisheries Science and Technology Ltd. Co., Sihong 223900 ;
3. Collaborative Innovation Center of Aquatic Animal Breeding Center Certificated by Shanghai Municipal Education Commission, Shanghai Ocean University, Shanghai 201306
中华绒螯蟹(Eriocheir sinensis),简称河蟹,是我国最重要的养殖蟹类之一。2014年,我国成蟹养殖产量高达79.65万t(农业部渔业渔政管理局,2015)。尽管河蟹池塘养殖遍及我国绝大多数省份,但长江流域蟹养殖产量占全国总产量的90%以上(王武等,2013)。由于在人工育苗过程中采用小规格亲本近亲繁殖和不同水系间的盲目引种,长江水系主要池塘养殖群体种质退化严重,表现为早熟率越来越高,商品蟹的规格越来越小(He et al,2014; 何杰等,2015b、c)。目前,我国已经开始对河蟹进行遗传选育,选育了多个良种(邓燕飞等,2013; 全国水产技术推广总站,2014)。He等(2014)研究表明,与长江水系养殖群体相比,在池塘养殖条件下,长江野生扣蟹蟹种具有成蟹规格大、性腺成熟晚等更为优良的养殖性能。但野生扣蟹数量较少、捕捞难度较大,价格较高。
养殖性能和抗病力是评价水产动物苗种质量的重要指标(Racotta et al,2003),成活率、增重率和蜕壳间隔时间则是评价蟹类养殖性能的重要指标(Wu et al,2010; 何杰等,2015a)。He等(2014)研究表明,野生扣蟹在成蟹养殖阶段具有一定的生长优势,但尚不清楚野生和养殖群体在扣蟹阶段的养殖性能和免疫性能,这非常不利于野生扣蟹的种质资源评价和优势种质发掘利用。本研究较为系统地比较了长江野生和池塘养殖河蟹扣蟹的早期养殖性能、攻毒成活率和非特异性免疫指标,旨在较全面评价长江野生扣蟹的蟹种质量,为长江水系河蟹优良性状的发掘利用、良种培育及野生扣蟹资源的合理利用提供基础资料。
1 材料与方法 1.1 蟹种来源和养殖管理本研究所用河蟹野生扣蟹于2015年1月下旬捕自江苏镇江江段(32°11N,119°27E),渔民通过小型拖网捕捞而得;养殖群体扣蟹同期采自上海海洋大学崇明河蟹养殖基地的养殖池塘,养殖过程中全程投喂0-3#扣蟹配合饲料(蛋白含量分别为41%、38%、35%和32%),养殖群体大眼幼体于2014年5月中旬购自光合蟹业公司如东土池育苗基地,为露天土池培育。2个种群扣蟹在室内暂养7 d后,分别随机选取规格相近、肢体健全的个体进行实验。实验用野生群体扣蟹雌雄平均体重分别为(7.23±1.62)g和(8.70±0.58)g,养殖群体扣蟹雌雄平均体重分别为(6.89±1.15)g和(7.81±1.07)g,两种来源扣蟹的初始体重无显著差异。
1.2 攻毒实验2015年1月底,分别取附肢健全、活力较好的野生和池塘养殖扣蟹各240只用于攻毒实验,体重均为6-10 g。每种来源的扣蟹攻毒实验各设3个平行组,每个重复有40只扣蟹(雌雄各半),养殖于体积为150 L(75 cm×45 cm×55 cm)的循环水族箱中。攻毒菌株为毒力较强的嗜水气单胞菌(Aeromonas hydrophilia)Y-2-L-1株,由上海海洋大学水产动物医学系张庆华副教授提供。攻毒前,所有实验用蟹在循环系统中暂养7 d,暂养期间如有死亡则补充对应性别和体重的个体。养殖环境条件为:日光灯光照,光照强度约为800 lx,光照:黑暗=12 h:12 h,循环水养殖,水温为(28±1)℃,pH值为7.5-8.5、DO>5 mg/L、NH3-N<0.5 mg/L、亚硝酸盐<0.05 mg/L,投喂扣蟹3#配合饲料。根据预实验结果确定嗜水气单胞菌注射量为2.5×106 CFU/g蟹体重,合适的注射剂量为2.0 μl/g。采用微量注射器从扣蟹第三步足基部进行注射;采用相等数量的扣蟹注射等剂量生理盐水作为阴性对照,同时设未注射组为空白对照组。注射后每日正常投喂,观察和记录各组扣蟹死亡情况,及时取出死亡个体。在无菌条件下,分离并辨别死亡个体肝胰腺和头胸部肌肉中感染的病原菌是否为本实验注射的嗜水气单胞菌。持续观察7 d,直到连续3 d内基本无死亡个体便停止实验(陈彦良等,2014; Wang et al,2014)。攻毒实验结束后,分别统计每个水族箱各个时间段的累计死亡率。
1.3 非特异性免疫指标测定每组分别取雌雄扣蟹各10只,采集血淋巴和肝胰腺,用于非特异性免疫指标测定。扣蟹的选择要求同1.2。采用1 ml无菌注射器,从第三步足基部抽取0.4 ml血淋巴样品于1.5 ml离心管中。解剖扣蟹,取出整个肝胰腺,装在冻存管中。肝胰腺和血淋巴样品于-80℃超低温冰箱中保存备用。称取0.2 g肝胰腺,加入1 ml(W/V=1:5)预冷的生理盐水,用微型匀浆器(T10B,德国IKA)匀浆30 s,在4℃,12000 r/min条件下离心20 min。取中间清液,再次离心,取中间清液用于后续分析。血淋巴解冻后用微型匀浆器匀浆30 s后,在4℃、12000 r/min条件下离心20 min,取出上清液(血清)待测。采用南京建成生物工程研究所生产的试剂盒测定超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、过氧化物酶(POD)、丙二醛(MDA)、酸性磷酸酶(ACP)活性;使用迈瑞全自动生化分析仪及其配套试剂盒测定碱性磷酸酶(ALP)活性;采用苏州科铭生物科技有限公司生产的试剂盒测定γ-谷氨酰转肽酶(γ-GT)活性;血蓝蛋白(Hc)测定参考Nickerson等(1971)的方法,用Tris-Ca缓冲液(50 mmol/L Tris-HCl + 10 mmol/L CaCl2,pH=8.0)将血清稀释70倍后,在335 nm波长下比色测定OD值,Hc含量(mg/ml)= 3.717 × OD335nm×稀释倍数。
1.4 早期养殖性能比较2015年3月底,分别取越冬后的扣蟹各60只(雌雄各半)进行养殖性能比较实验。每种来源的扣蟹雌雄各设3个重复,每个重复10只。为防止河蟹蜕壳过程中相互蚕食,本实验采用单个体养殖方法评价其早期养殖性能(赵亚婷等,2013)。所有实验用蟹分别单独养殖于小型循环水族箱中(水体体积18.4 L,48 cm× 32 cm×27 cm,水深12 cm),每箱放置1段PVC管作为隐蔽物。实验期间光暗周期为12 h︰12 h,光照强度约为800 lx,日光灯光源;养殖用水为过滤、沉淀和消毒曝气后的河道淡水。每天16:00投喂,按照蟹体重的1%-5%投喂成蟹1#配合饲料(浙江欣欣饲料有限公司生产,蛋白含量为40%,脂肪为10%),具体根据水温和摄食情况确定。正式实验后,每日08:00开始,观察和记录每个水族箱中的蜕壳和死亡情况,同时采用虹吸法去除残饵和粪便;扣蟹蜕壳后5-6 d,用游标卡尺测定甲壳长和甲壳宽,用电子天平测量体重(精确到0.01 g);采用温度自动记录仪记录每日平均水温,实验期间水温为13-19℃;每日测定水体溶氧和pH值,每3 d测定、记录1次亚硝酸和氨氮,根据水质情况每3-5 d换水20%-30%。实验期间水质指标要求:pH为7.5-9.0、溶氧>5 mg/L、氨氮< 0.3 mg/L、亚硝酸盐<0.10 mg/L。正式实验共持续70 d左右,待所有实验用蟹完成第1次蜕壳或者死亡后便结束养殖实验,统计各实验组的成活率、增重率、特定生长率和第1次蜕壳间隔时间,计算公式为:
成活率(Survival rate,SR,%)=100×终末实验蟹数量/初始实验蟹数量;
增重率(Weight gain rate,WGR,%)=100×(终末体重-初始体重)/初始体重;
特定生长率(Specific growth rate,SGR,%/d)= 100×(ln终末体重-ln初始体重)/实验天数。
1.5 数据处理所有数据采用平均值±标准误(Mean±SE)表示。采用SPSS 17.0软件对实验数据进行统计分析。用Levene法进行方差齐性检验。当数据不满足齐性方差时,对百分比数据进行反正弦或平方根处理。采用双尾t-test(Independent samples t-test)分析野生和池塘养殖扣蟹各个指标的差异。当数据转换后仍不满足齐性方差时,采用Mann-Whiteny U-test进行非参数检验。P<0.05为差异显著,利用Excel和Sigma plot软件绘制图表。
2 结果与分析 2.1 早期养殖性能比较长江野生和池塘养殖扣蟹的早期养殖性能参数见表 1。由表 1可以看出,野生扣蟹SR整体高于养殖扣蟹,但各组SR差异不显著(P>0.05);无论雌蟹还是雄蟹,养殖扣蟹的蜕壳间隔时间均显著短于野生扣蟹(P<0.05);野生和养殖扣蟹的第1次蜕壳WGR差异较小。其中,雄性野生扣蟹WGR略高于养殖扣蟹,而雌性野生扣蟹WGR高于养殖扣蟹,但差异不显著;不同种群对扣蟹体重SGR的影响较明显,养殖扣蟹雄体和雌体体重SGR分别比野生扣蟹高70.13%和69.23%,并显著高于野生扣蟹。
|
|
表 1 长江野生和池塘养殖扣蟹的早期养殖性能比较 Table 1 Comparison of early culture performance between wild-caught and pond-reared juvenile E. sinensis |
开始攻毒实验后,各实验组的阴性对照组和空白对照组均无死亡个体。无论雌雄,扣蟹攻毒后的死亡主要发生在12-48 h,96 h后基本无死亡发生。2种扣蟹攻毒后12-96 h的累计死亡率变化情况见图 1。由图 1可以看出,野生扣蟹在攻毒后的累计死亡率一直低于养殖扣蟹。攻毒24 h后,野生扣蟹的死亡率低于20%,而养殖扣蟹的死亡率高达33-43%;攻毒96 h后,野生扣蟹累计死亡率为28.3%,明显低于养殖扣蟹(50%),此后2组扣蟹均无发现死亡个体。
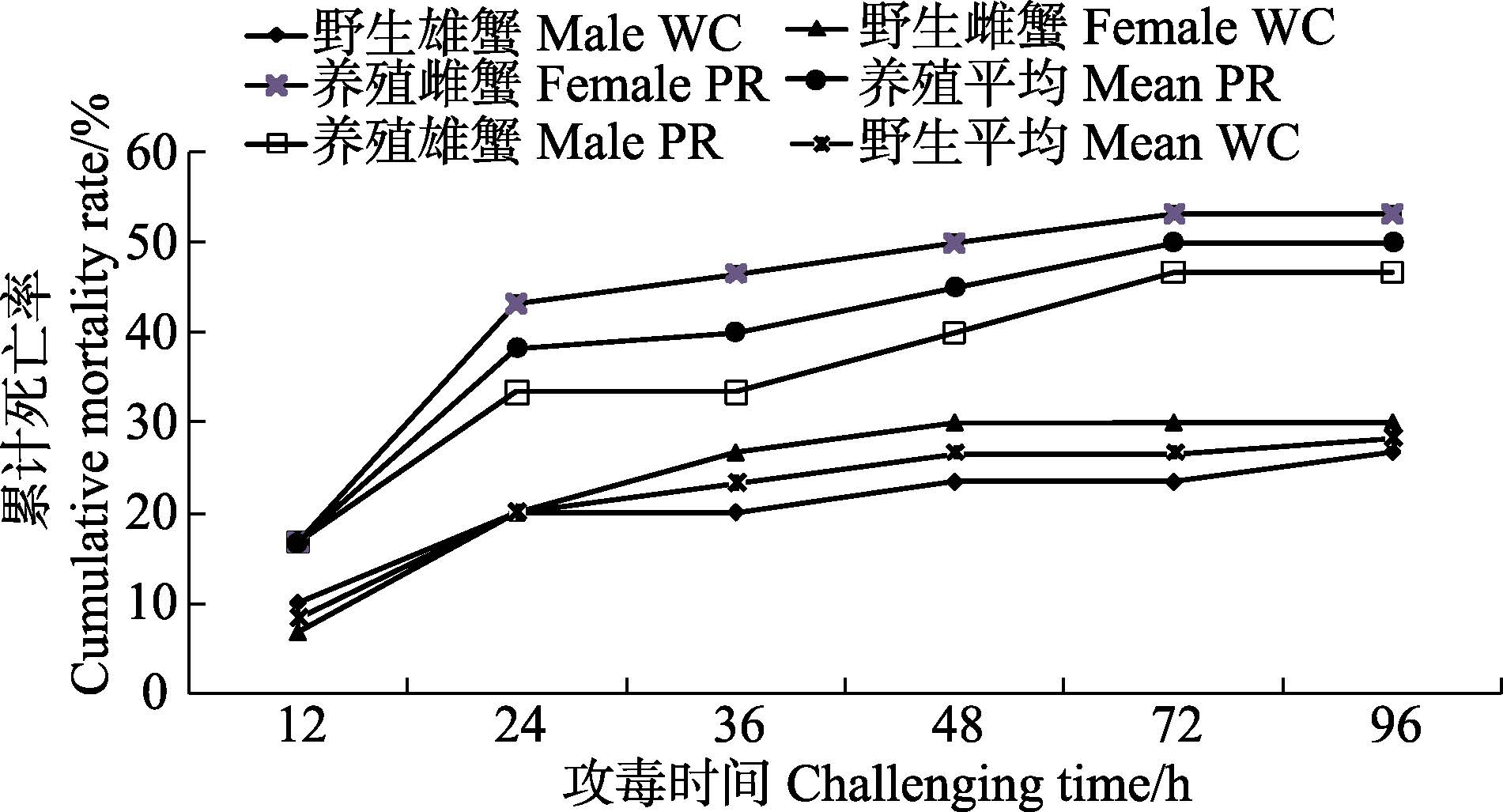
|
图 1 长江野生和池塘养殖扣蟹攻毒后的累计死亡率比较 Figure 1 Comparison of mortality rate during the pathogen challenge test between wild-caught and pond-reared juvenile E. sinensis |
长江野生和池塘养殖扣蟹肝胰腺中的非特异性免疫指标和抗氧化能力差异如表 2所示。就雄体而言,养殖扣蟹的ALP活性显著高于野生扣蟹,而野生扣蟹的γ-GT、T-AOC、POD、NO等指标均高于养殖扣蟹(P<0.05);野生扣蟹的ACP活性高于养殖扣蟹,而养殖扣蟹的SOD、MDA、GSH-Px等活性低于野生扣蟹,但差异不显著(P>0.05)。
|
|
表 2 长江野生和池塘养殖扣蟹肝胰腺中的非特异性免疫指标和抗氧化能力比较 Table 2 Comparison of immune indices and antioxidant ability in the hepatopancreas of wild-caught and pond-reared juvenile E. sinensis |
就雌蟹而言,野生扣蟹的γ-GT、T-AOC、POD、ACP、NO等指标均高于养殖扣蟹,而养殖扣蟹的SOD、GSH-Px活性均高于野生扣蟹,但差异不显著(P>0.05)。2个群体扣蟹之间的ALP和MDA含量差异明显,表现为野生扣蟹的ALP活性显著高于养殖扣蟹,养殖扣蟹的MDA含量显著高于野生扣蟹(P<0.05)。
2.3.2 血清中的非特异性免疫指标长江野生和池塘养殖扣蟹血清中的非特异性免疫指标和抗氧化能力差异如表 3所示。就雄蟹而言,野生扣蟹的T-AOC、Hc、PO等指标高于养殖扣蟹,而养殖扣蟹的ALP、γ-GT、SOD、MDA、GSH-Px、GR等指标均高于野生扣蟹,但差异不显著(P>0.05)。野生扣蟹的NO含量高于养殖扣蟹,而养殖扣蟹的ACP活性高于野生扣蟹,且差异显著(P<0.05)。
|
|
表 3 长江野生和池塘养殖扣蟹血淋巴中非特异性免疫指标和抗氧化能力比较 Table 3 Comparison of immune indices and antioxidant ability in the hemolymph of wild-caught and pond-reared juvenile E. Sinensis |
就雌蟹而言,野生扣蟹血清内的MDA含量高于养殖扣蟹,而养殖扣蟹的ACP活性高于野生扣蟹,但各组之间差异不显著(P>0.05)。野生扣蟹的T-AOC、Hc、NO、Gr等活性显著高于养殖扣蟹,而养殖扣蟹的ACP、T-AOC、ACP、GSH-Px等活性显著高于野生扣蟹(P<0.05)。
3 讨论 3.1 早期生长性能差异本研究表明,在相同的养殖条件下(饵料和养殖环境一致),长江野生和池塘养殖扣蟹在成蟹阶段早期养殖性能差异较大,主要表现为养殖扣蟹蜕壳周期短和生长速度快等特点,这可能与2个群体蟹种在扣蟹阶段的生长环境差异较大有关。水体积温是影响甲壳动物蜕壳的重要因素之一,通常积温越高,蜕壳周期越短(陈再忠,20021); Verhoef et al,1998; Daoud et al,2010)。野生蟹种在扣蟹阶段的水体积温低于养殖扣蟹,主要因为:一方面,长江水体5-12月的平均水温要低于长江流域的养殖池塘水体温度(何杰等,2015b);另一方面,长江水系野生大眼幼体出现时间通常晚于池塘养殖群体的土池培育大眼幼体近 1个月,野生大眼幼体出现时间为6月初,池塘培育大眼幼体在5月上中旬出现(张列士等,2002)。这可能是造成野生扣蟹蜕皮周期较长的重要原因之一。其次,由于长江野生扣蟹的活动空间较大、食性较杂,而池塘养殖群体扣蟹经过多世代人工繁殖和养殖,已经适应人工养殖环境和配合饲料,长江野生扣蟹对人工养殖环境和配合饲料不适应可能也是其蜕壳周期较长的重要原因。有关2种来源扣蟹的活动规律和摄食行为差异有待今后进一步深入研究。
1) 陈再忠. 中华绒螯蟹性早熟及其机理的研究. 上海海洋大学博士研究生学位论文, 2002
此外,由于长江水体深度(6-11 m)远大于池塘(0.6-1.2 m),且水体体积也远大于养殖池塘,故每年1-3月初长江底部平均水温应高于池塘水温(何杰等,2015b)。将野生和养殖扣蟹同时转移到水温为13-19℃的室内养殖系统,池塘养殖群体的升温幅度远大于野生群体。短期内较高幅度的升温可以提高甲壳动物体内酶活力,加快新陈代谢,从而促进其蜕壳频率(Hartnoll,1982)。因此,养殖群体扣蟹升温幅度较大,也可能是其蜕皮较快的原因之一。养殖群体扣蟹的SGR显著高于野生扣蟹,这是其蜕皮周期较短造成的。
3.2 非特异性免疫指标和攻毒成活率差异研究结果显示,长江野生扣蟹攻毒死亡率明显低于池塘养殖扣蟹,表明长江野生扣蟹具有较强的免疫性能和抗病力。非特异性免疫指标分析也表明,无论雌雄,野生扣蟹肝胰腺和血淋巴中的T-AOC、NO显著高于养殖群体。此外,野生扣蟹血淋巴中的Hc含量也显著高于养殖扣蟹,这也暗示野生扣蟹具有较强的免疫性能和抗氧化能力。Hc是甲壳动物血淋巴的主要蛋白,具有载氧、转运金属离子、储存蛋白质、调节渗透压、参与蜕壳后新表皮组织的形成和固化、抗细菌和抗病毒等多种生理功能(潘鲁青等,2008)。张秀丽等(2008)研究表明,Hc免疫裂解后形成的多肽具有较强的抗菌作用。血淋巴中的Hc含量及其基因表达水平与甲壳动物免疫性能有关,通常Hc含量越高,其免疫性能越强(Qiu et al,2011; Sun et al,2013)。长江野生和池塘养殖扣蟹免疫性能及抗病力差异的形成原因较为复杂,可能与如下几个因素有关:(1)野生扣蟹冬季的营养状况优于池塘养殖扣蟹。由于长江流域的池塘养殖扣蟹在越冬期间(12月-翌年3月)水温较低,扣蟹很少摄食(张列士等,2002),而长江底部的冬季水温相对较高,长江中的野生扣蟹在越冬期间可能仍然有摄食活动。因此,野生扣蟹的肝胰腺指数和总脂含量高于池塘养殖扣蟹(何杰等,2015b),二者的脂肪酸组成存在较大差异,生化组成差异可能会影响其免疫性能(赵亚婷等,2013)。(2)野生扣蟹的种质状况优于池塘养殖扣蟹。最近的研究表明,长江野生扣蟹仍具有较好的养殖性能和较高的遗传多样性(何杰等,2015a;刘青等,2015),而养殖群体扣蟹经过多代人工繁育,由于小规格亲本、近亲繁殖和种质混杂等原因,种质退化严重,免疫性能和养殖性能下降严重(He et al,2014)。中国明对虾(Fenneropenaeus chinensis)经过多代近交后,养殖性能和抗病力显著下降(刘萍等,2004; Luo et al,2014),类似现象可能也存在于河蟹养殖群体中。(3)长江及长江口区水体中含有大量细菌等病原生物(刘子琳等,2001),野生扣蟹长期生活在这种环境中,其机体抗菌能力也得到相应提升。而扣蟹养殖的池塘水体由于定期消毒和种植水草等措施(何杰等,2015a、b),水体中含有的病原菌相对较少,故其免疫抗病力相对较差。(4)野生扣蟹的生长速度慢于养殖群体。生长和免疫抗病通常是两个相互矛盾的生理过程,通常生长较快的水生动物,其抗病力和免疫性能低于生长较慢的个体(Moss et al,2005)。
综上所述,池塘养殖扣蟹在成蟹养殖早期的养殖性能优于长江野生扣蟹,这可能与其蟹种阶段的积温和环境适应性有关;长江野生扣蟹比池塘养殖扣蟹具有更强的抗氧化能力、免疫性能及抗病能力,可能与其遗传特性、越冬期的营养状况和生长较慢有关。野生和池塘养殖河蟹扣蟹2种蟹种各有优缺点,本研究可为河蟹蟹种质量评价和来源辨别提供基础资料。
致谢: 上海海洋大学水产与生命学院季策、黄根勇等同学参与攻毒实验,潘杰同学参与部分免疫指标的测定,在此表示感谢。| 王武, 王成辉, 马旭洲. 河蟹生态养殖. 北京: 中国农业出版社, 2013 : 59 -84. | |
| 邓燕飞, 夏爱军, 潘建林, 等. 中华绒螯蟹“长江1号”的选育. 水产养殖 , 2013, 34 (4) : 43-47 | |
| 全国水产技术推广总站. 产新品种推广指南. 北京: 中国农业出版社, 2014 . | |
| 刘子琳, 越川海, 宁修仁, 等. 长江冲淡水区细菌生产力研究. 海洋学报 , 2001, 23 (4) : 93-99 | |
| 刘青, 刘皓, 吴旭干, 等. 长江-黄河和辽河水系中华绒螯蟹野生和养殖群体遗传变异的微卫星分析. 海洋与湖沼 , 2015, 46 (4) : 958-968 | |
| 刘萍, 李健, 何玉英, 等. 中国明对虾种质资源研究现状与保护策略. 海洋水产研究 , 2004, 25 (5) : 80-85 | |
| 农业部渔业渔政管理局. 2015年中国渔业统计年鉴. 北京: 中国农业出版社, 2015 . | |
| 何杰, 吴旭干, 龙晓文, 等. 长江水系中华绒螯蟹野生和养殖群体选育子一代养殖性能和性腺发育的比较. 海洋与湖沼 , 2015a, 46 (4) : 808-818 | |
| 何杰, 吴旭干, 龙晓文, 等. 池塘养殖和野生长江水系中华绒螯蟹扣蟹形态学及生化组成的比较研究. 水产学报 , 2015b, 39 (11) : 1665-1678 | |
| 何杰, 吴旭干, 姜晓东, 等. 野生和人工繁育大眼幼体在成蟹阶段的养殖性能比较. 上海海洋大学学报 , 2015c, 24 (1) : 66-67 | |
| 张列士, 李军. 河蟹增养殖技术. 北京: 金盾出版社, 2002 : 5 -248. | |
| 张秀丽, 刘庆慧, 程江峰, 等. 血蓝蛋白研究进展. 动物医学进展 , 2008, 29 (7) : 86-89 | |
| 陈彦良, 李二超, 禹娜, 等. 豆油替代鱼油对中华绒螯蟹幼蟹生长、非特异性免疫和抗病力的影响. 中国水产科学 , 2014, 21 (3) : 511-521 | |
| 赵亚婷, 吴旭干, 常国亮, 等. 饲料中DHA含量对中华绒螯蟹幼蟹生长、脂类组成和低氧胁迫的影响. 水生生物学报 , 2013, 37 (6) : 1133-1144 | |
| 潘鲁青, 金彩霞. 甲壳动物血蓝蛋白研究进展. 水产学报 , 2008, 32 (3) : 484-491 | |
| Daoud D, Lambert Y, Audet C, et al. Size and temperature- dependent variations in intermolt duration and size increment at molt of Northern Shrimp, Pandalus borealis. Mar Biol , 2010, 157 (12) : 2655-2666 DOI:10.1007/s00227-010-1526-1 | |
| Hartnoll RG. Growth. In: Abele LG (ed). The Biology of Crustacea. New York: Academic Press, 1982 : 11 -96. | |
| He J, Wu X, Li J, et al. Comparison of the culture performance and profitability of wild-caught and captive pond-reared Chinese mitten crab (Eriocheir sinensis) juveniles reared in grow-out ponds: Implications for seed selection and genetic selection programs. Aquaculture , 2014, 434 : 48-56 DOI:10.1016/j.aquaculture.2014.07.022 | |
| Luo K, Kong J, Luan S, et al. Effect of inbreeding on survival, WSSV tolerance and growth at the postlarval stage of experimental full-sibling inbred populations of the Chinese shrimp Fenneropenaeus chinensis. Aquaculture , 2014, 420-421 : 32-37 DOI:10.1016/j.aquaculture.2013.10.030 | |
| Moss SM, Doyle RW, Lightner DV. Breeding shrimp for disease resistance: challenges and opportunities for improvement. Diseases in Asian Aquaculture V , 2005 : 379-393 | |
| Nickerson KW, van Holde KE. A comparison of molluscan and arthropod hemocyanin-I. Circular dichroism and absorption spectra. Comp Biochem Phys B Comp Biochem , 1971, 39 (4) : 855-872 | |
| Qiu R, Cheng Y, Huang X, et al. Effect of hypoxia on immunological, physiological response, and hepatopancreatic metabolism of juvenile Chinese mitten crab Eriocheir sinensis. Aquacult Int , 2011, 19 (2) : 283-299 DOI:10.1007/s10499-010-9390-z | |
| Racotta IS, Palacios E, Ibarra AM. Shrimp larval quality in relation to broodstock condition. Aquaculture , 2003, 227 (1-4) : 107-130 DOI:10.1016/S0044-8486(03)00498-8 | |
| Sun S, Qin J, Yu N, et al. Effect of dietary copper on the growth performance, non-specific immunity and resistance to Aeromonas hydrophila of juvenile Chinese mitten crab, Eriocheir sinensis. Fish , 2013, 34 (5) : 1195-1201 | |
| Verhoef GD, Austin CM, Jones PL, et al. Effect of temperature on molt increment and intermolt period of a juvenile Australian fresh-water crayfish, Cherax destructor. J Crustacean Biol , 1998, 18 (4) : 673-679 DOI:10.1163/193724098X00539 | |
| Wang L, Chen L, Qin J, et al. Effect of dietary lipids and vitamin E on growth performance, body composition, anti-oxidative ability and resistance to Aeromonas hydrophila challenge of juvenile Chinese mitten crab Eriocheir sinensis. Aquac Res , 2014, 46 (10) : 2544-2558 | |
| Wu X, Cheng Y, Zeng C, et al. Reproductive performance and offspring quality of wild-caught and pond-reared swimming crab, Portunus trituberculatus broodstock. Aquaculture , 2010, 301 (1-4) : 78-64 DOI:10.1016/j.aquaculture.2010.01.016 |



