草鱼(Ctenopharyngodon idellus)是中国重要的草食性淡水养殖鱼类,已经有1700多年的养殖历史,经过几十年的人工养殖,目前,草鱼的产量在世界淡水养殖鱼类中排名第一(沈玉帮等,2011)。
20世纪50年代以后,在中国草鱼养殖中暴发了一种严重的传染性疾病——草鱼出血病(Hemorrhage disease of grass carp),引起草鱼大量死亡。在对该病病原学、流行病学和防控技术进行研究的过程中,研究人员建立了多株草鱼细胞系,如草鱼吻端细胞系、草鱼肾细胞系和草鱼性腺细胞系(GCO)(张念慈等,1981; 左文功等,1986; 陈燕燊,1978)等。其中,陈燕燊(1978)建立的GCO细胞系已稳定传至300多代,在淡水鱼类病毒,如草鱼出血病病毒、胭脂鱼(Myxocyprinus asiaticus)弹状病毒、淋巴囊肿病毒等(陈立祥等,1998; 张奇亚,2002)的研究中发挥了重要作用。
在检测和诊断工作中,研究人员发现GCO细胞系对鲤春病毒血症病毒(SVCV)表现出非常稳定的敏感性,并在SVCV检测的国家标准和行业标准中使用,但一直未对GCO细胞系的特性及其对SVCV的敏感性进行系统的研究和比较。本研究对GCO的生长特性、SVCV在该细胞中的增殖特性等进行了研究,以期为GCO细胞系的使用、维护和应用提供基础数据。
1 材料与方法 1.1 病毒、细胞、试剂和仪器 1.1.1 细胞系本研究使用的4种鱼类细胞系:GCO细胞系、鲤(Cyprinus carpio)上皮瘤细胞 系(EPC)、肥头鲤(Pimephales promelas)细胞系(FHM)、大鳞大麻哈鱼(Oncorhynchus tshawytscha)胚胎细胞 系(CHSE-214),均为中国科学院水生生物研究所赠。
1.1.2 病毒SVCV 10/3株为英国环境、渔业及水产科学研究中心(The Centre for Environment,Fisheries and Aquaculture Science,CEFAS)实验室赠送;使用前测定病毒滴度,并将病毒悬液稀释至103 TCID50/50 μl待用。
1.1.3 试剂CELL LAB ApoScreenTM Annexin V-FITC Apoptosis Kit及DNA Prep Reagent kit购自美国Beckman公司。细胞培养液均购自GIBCO(美国),戊二醛、秋水仙素、卡诺固定液、四氧化锇、树脂包被购自美国Sigma公司。
1.2 GCO 细胞系生物学特性 1.2.1 GCO细胞生长特性分析将初始浓度为104 cell/ml的GCO细胞悬液加入到6个12孔板中,分别置于15℃、20℃、25℃、30℃的培养箱中培养。在培养至第1、2、3、4、5、6、7天时,每个温度培养的细胞分别取3孔进行消化,测定细胞数量,绘制细胞生长曲线。
1.2.2 GCO细胞周期分析对第345代GCO细胞系进行细胞周期研究。将细胞转至6孔板后,约35 h后细胞处于指数生长期,形成70%-80%的汇合层。用胰蛋白酶消化法收集细胞,做成单细胞悬液,室温下1000 r/min离心5 min,收集沉淀,用磷酸盐缓冲液(PBS)清洗2次,1000 r/min离心5 min,收集沉淀。先用20-50 μl/ml的杜氏磷酸盐缓冲液(D-PBS)将细胞沉淀充分打散成单个细胞,用4℃预冷的70%冰乙醇1 ml重悬,4℃过夜。采用流式细胞仪(Cytomics FC 500 Beckman Coulter)进行细胞周期检测。
1.2.3 GCO细胞核型分析采用Ye等(2006)的方法制备第345代GCO细胞染色体,进行核型分析。待细胞贴壁稳定生长36 h后,在培养基中加入0.8 μg/ml秋水仙素,孵育4 h。吸去培养基,PBS清洗,用胰蛋白酶消化,收集细胞,1500 r/min离心5 min。去上清液,加入5 ml 0.075 mol/L的KCl,低渗25 min。缓慢加入1 ml新配的预冷卡诺固定液,固定15 min。 1500 r/min离心5 min,弃上清液,重复此步骤3次。冷滴片法滴片(Freshney,2010),待载玻片干燥后,用5%吉姆萨染液染色25 min,干燥镜检,随机统计 100个细胞分裂相的染色体数目(Levan et al,1964)。
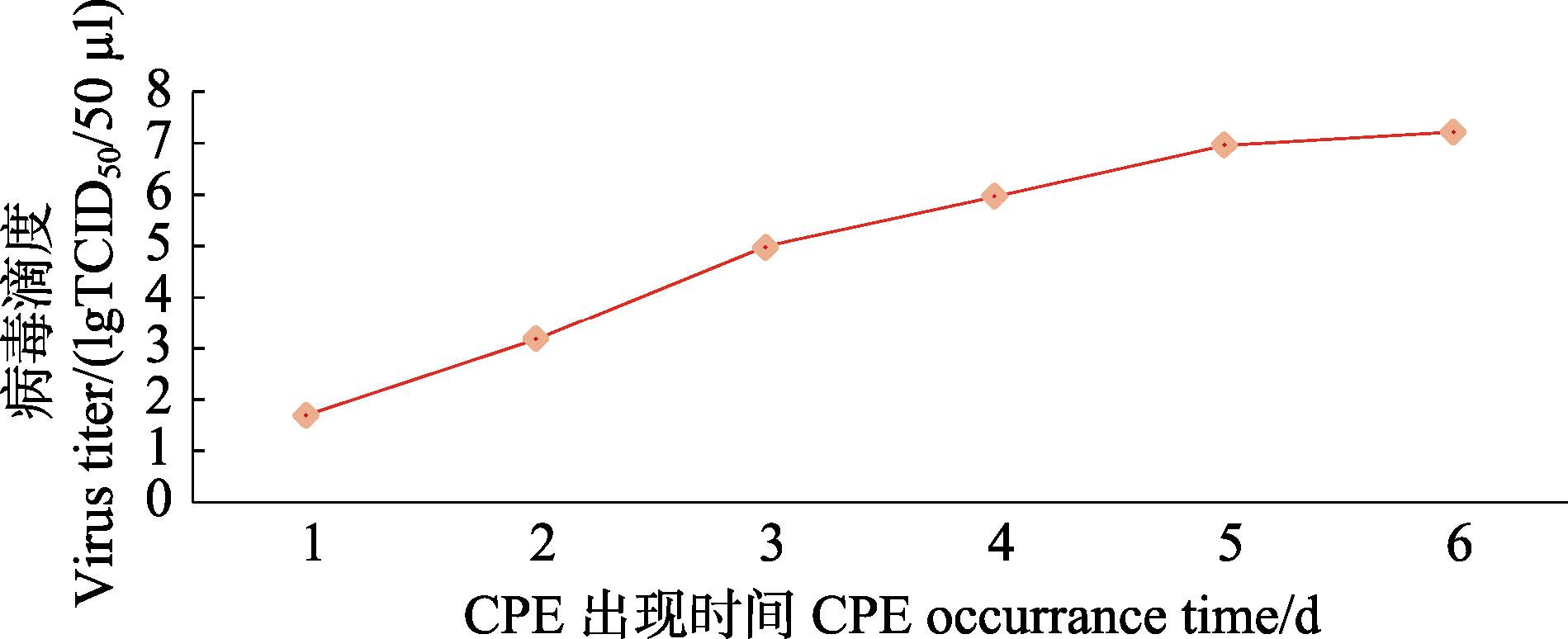
1.2.4 GCO细胞系对SVCV的敏感性分析 1.2.4.1 病毒生长曲线准备足够的GCO细胞,用胰蛋白酶消化后,加入新鲜的细胞培养液。测定细胞浓度,稀释至105 cell/ml。在9个12.5 cm2的细胞瓶中,接入3 ml GCO细胞悬液。24 h后接种300 μl滴度为103 TCID50/50 μl的SVCV悬液,置于20℃下培养。每隔24 h,取3瓶,反复冻融3次,用细胞培养液进行10倍系列稀释,待用。在96孔板中,接种新鲜的GCO细胞,测定每瓶细胞中SVCV的滴度。根据Yan等(2011)的方法,绘制20℃时SVCV在GCO细胞中的生长曲线。
1.2.4.2 GCO细胞系和其他常用鱼类细胞系对SVCV易感性的比较SVCV在不同细胞内滴度测定:在4个25 cm2的细胞瓶中,分别准备GCO、EPC、FHM和CHSE-214细胞系。在各细胞系最适培养温度下培养24 h后,接种500 μl滴度为103 TCID50/50 μl的SVCV悬液,置于20℃培养,每天观察是否出现细胞病变效应(CPE)。待CPE完全后,反复冻融3次。准备新鲜的EPC细胞用于病毒滴度的测定。
SVCV诱导不同细胞凋亡情况分析:根据Riccardi等(2006)的方法,分别将GCO、CHSE-214、EPC和FHM细胞转至6孔板中。24 h后,每孔接种100 μl滴度为103 TCID50/50 μl的SVCV悬液,并设置空白对照,置于20℃培养箱中培养48 h。用胰蛋白酶消化细胞,制成细胞悬液,用冰PBS洗涤细胞2次,弃上清液。用试剂盒中的1×结合缓冲液重悬细胞,细胞浓度达到1×106-1×107 cell/ml。每个实验管中加入10 μl Annexin V-FIT,轻柔涡旋震荡,避光冰置15 min,然后加入380 μl冰冷的1×结合缓冲液,再加入10 μl碘化丙啶(PI),用于之后仪器分析。
1.2.4.3 电镜观察SVCV感染GCO细胞用SVCV病毒感染单层GCO细胞,在CPE出现明显时,收集细胞。1500 r/min离心10 min,用PBS洗涤2次后,用含2.5%戊二醛的PBS(0.1 mol/L,pH为7.2)固定过夜。再用PBS洗涤细胞,用1%四氧化锇固定90 min后,最后用PBS洗涤2次。用梯度浓度的乙醇脱水,树脂包被,超微切片机(Reichert-Jung)超薄切片,用透射电镜(JEOL JEM-1000CX II,日本)观察(100 kV)。
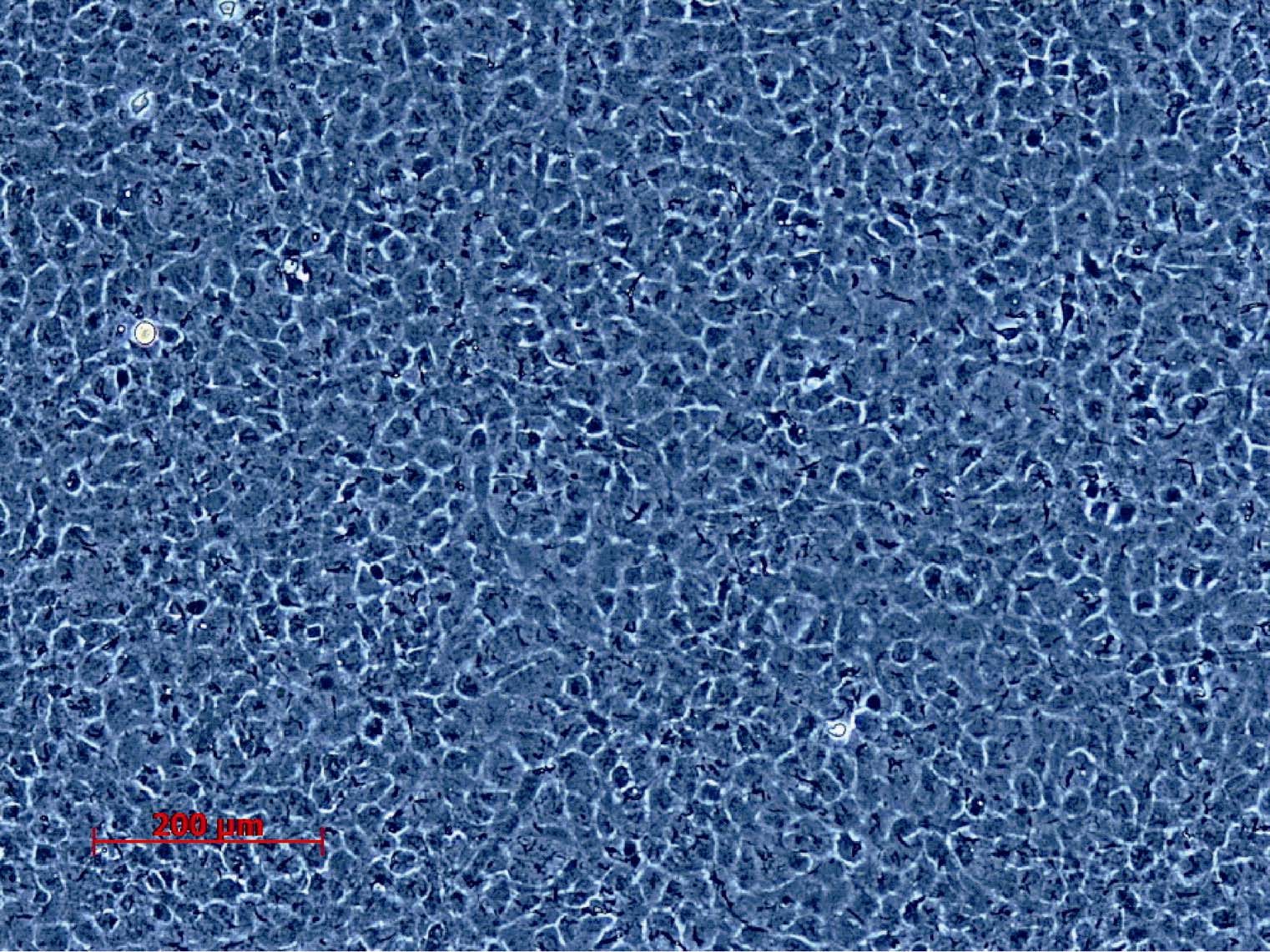
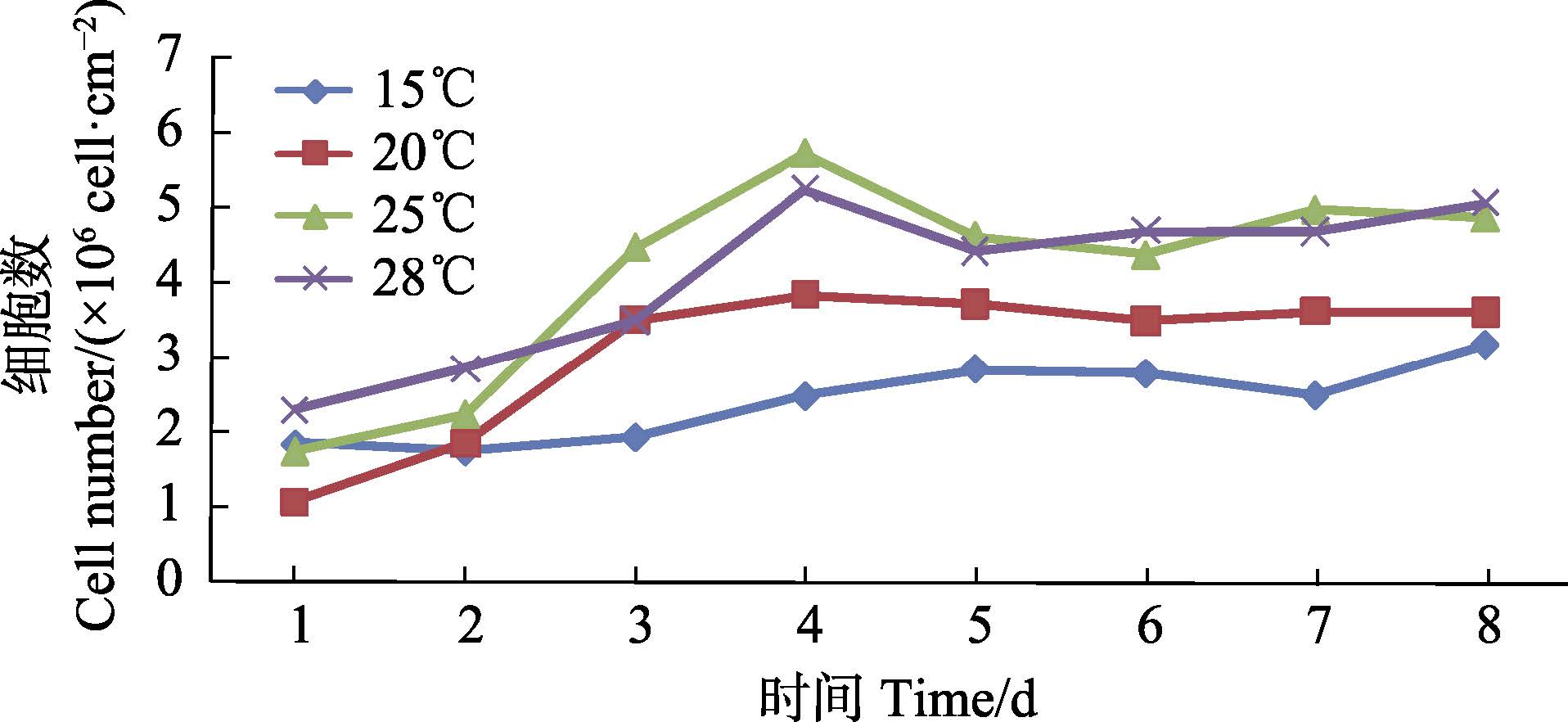
2 结果与分析 2.1 GCO细胞系特性 2.1.1 生长特性GCO细胞系是从草鱼性腺组织分离建立的连续细胞系,呈上皮样形态,细胞间存在接触抑制,无重叠生长(图 1)。从GCO细胞的生长曲线(图 2)可以看出,25℃最适宜GCO的生长。GCO在贴壁生长后,第1天生长较慢,第2天生长开始加快,进入对数生长期,持续3 d左右后进入平台期。
|
图 1 培养3 d的GCO(100×) Figure 1 GCO cultured for three days(100×) |
|
图 2 GCO在不同温度下的生长曲 Figure 2 Growth curve of GCO at different temperatures |
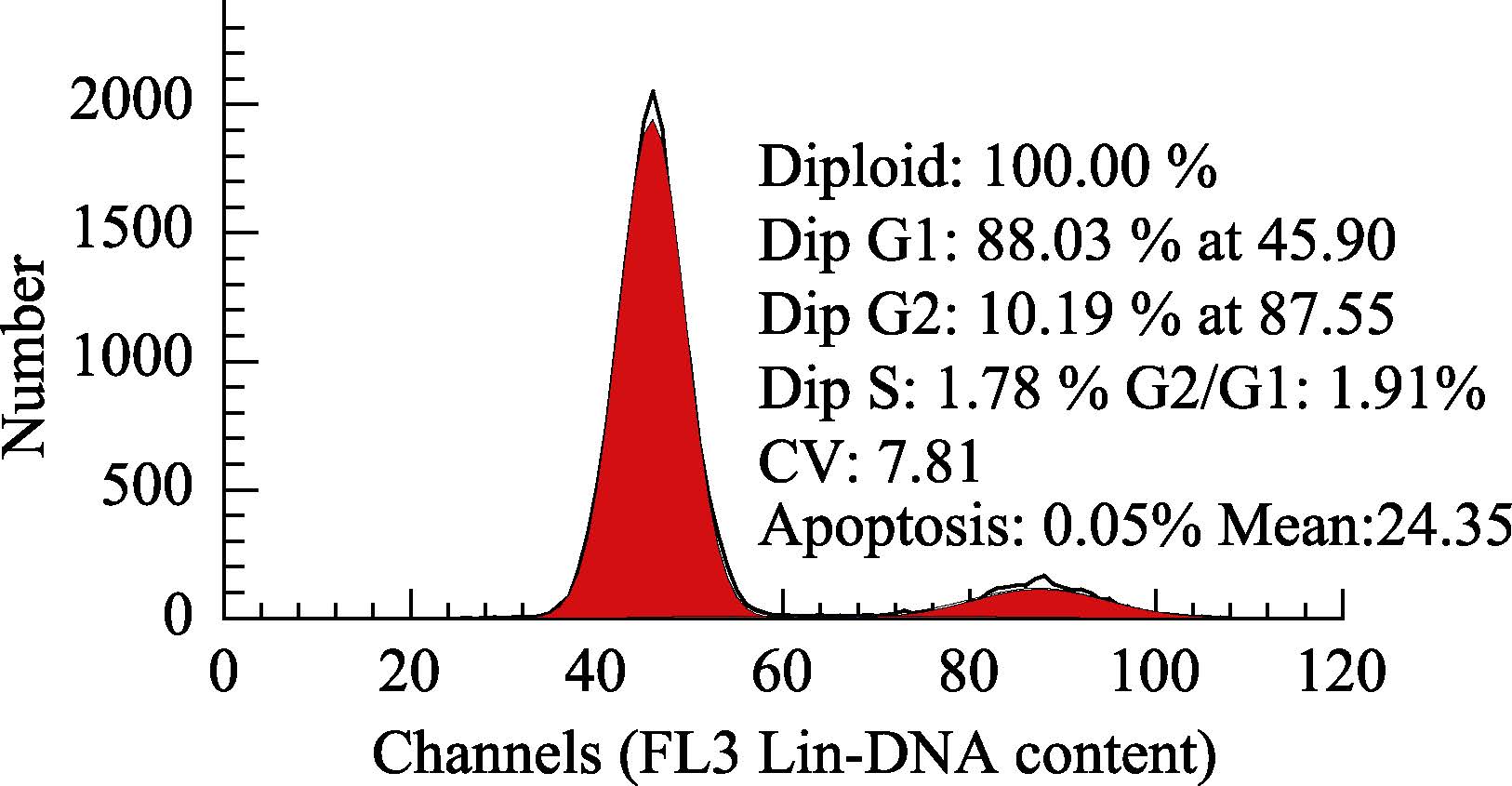
应用流式细胞仪对第345代的GCO细胞进行细胞周期检测,发现GCO核型正常,为二倍体(图 3)。GCO在G1期的DNA含量占88.03%,在S期的DNA含量占1.78%,表明GCO增殖活力旺盛。
|
图 3 第345代GCO细胞生长周期 Figure 3 Cell cycle of GCO of the 345th generation |
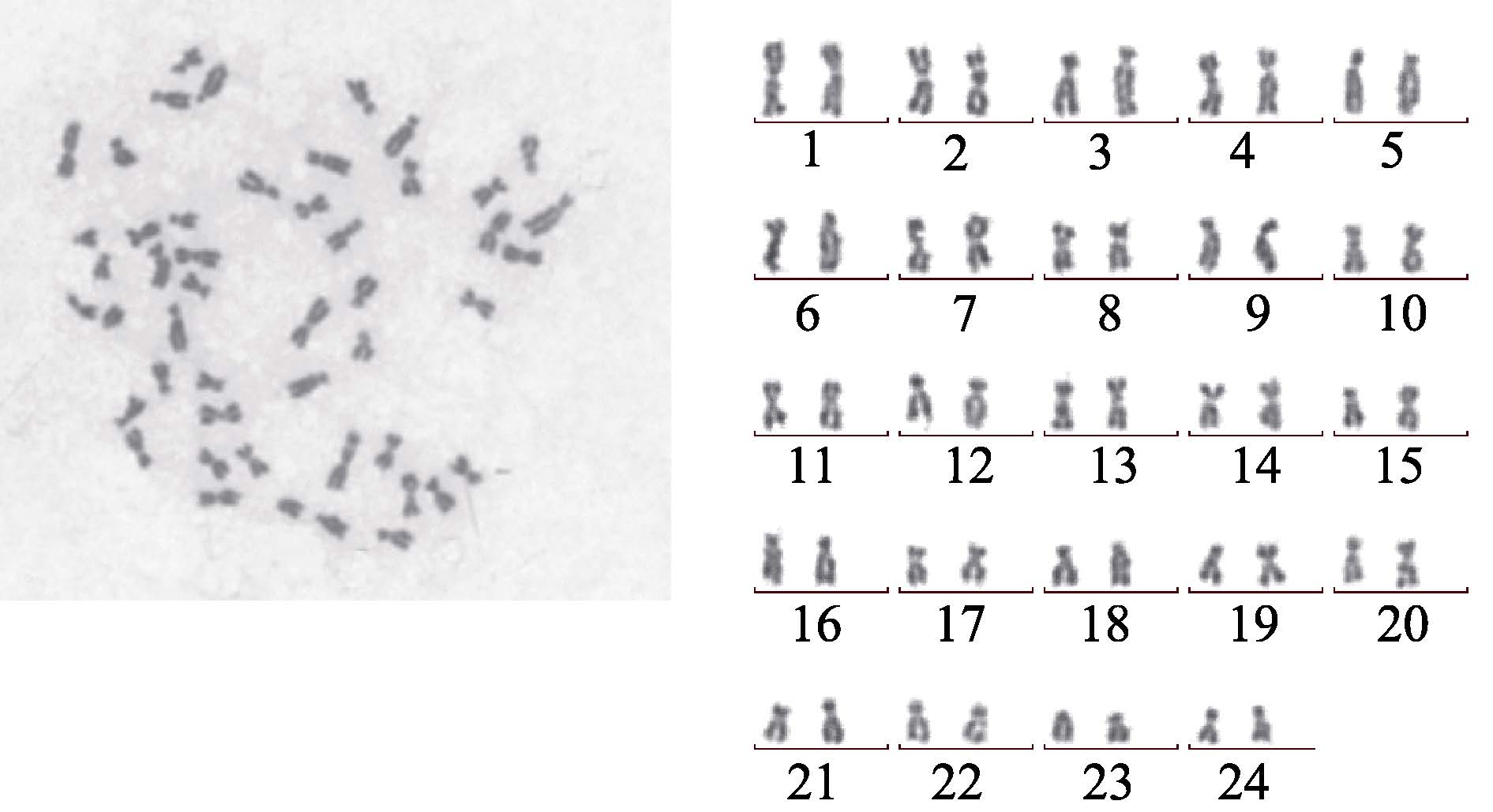
对100个分裂中期的细胞进行染色体数目统计分析。结果显示,在GCO细胞系染色体中,2n=48的分裂相占(98%)(图 4),二倍体染色体数目出现频率非常高,其他非整数倍体只占了很小的比例。
|
图 4 GCO染色体核型 Figure 4 Chromosome karyotype of GCO |
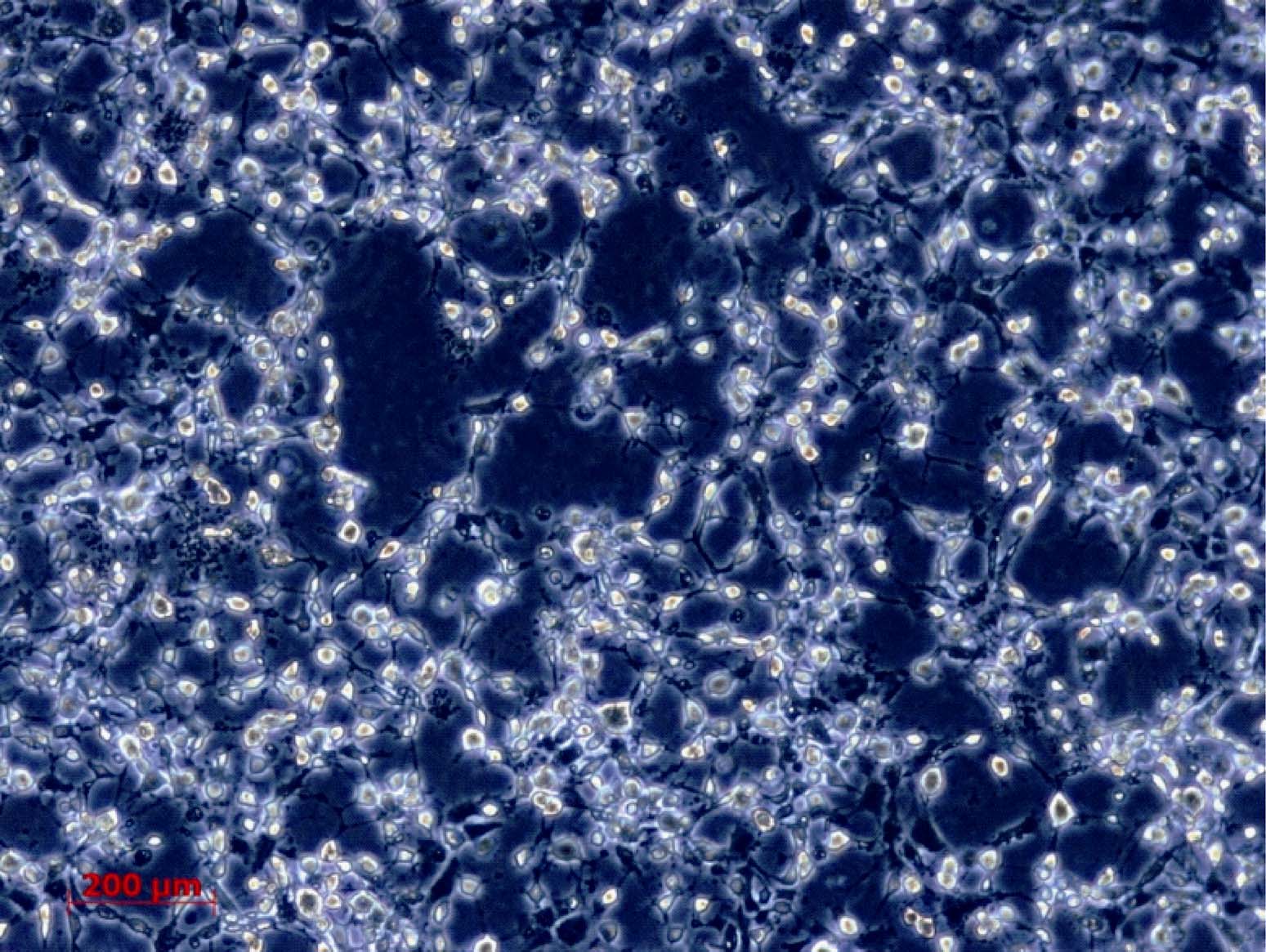
SVCV接种GCO细胞出现典型CPE(图 5)后,检测SVCV的滴度,并绘制病毒的生长曲线(图 6)。
|
图 5 SVCV-10/3在GCO中的CPE Figure 5 The CPE of SVCV-10/3 in GCO cells |
|
图 6 SVCV-10/3在GCO中的生长曲线 Figure 6 The growth curve of SVCV-10/3 in GCO cells |
SVCV分别接种GCO、EPC、FHM和CHSE-214。出现CPE后,根据殷震等(1997)的方法测定TCID50(表 1)。从表 1可以看出,SVCV在GCO和EPC的滴度明显高于FHM和CHSE-214。
|
|
表 1 不同细胞感染SVCV毒株的病变和病毒滴度 Table 1 CPE and titers of SVCV in different cell lines |
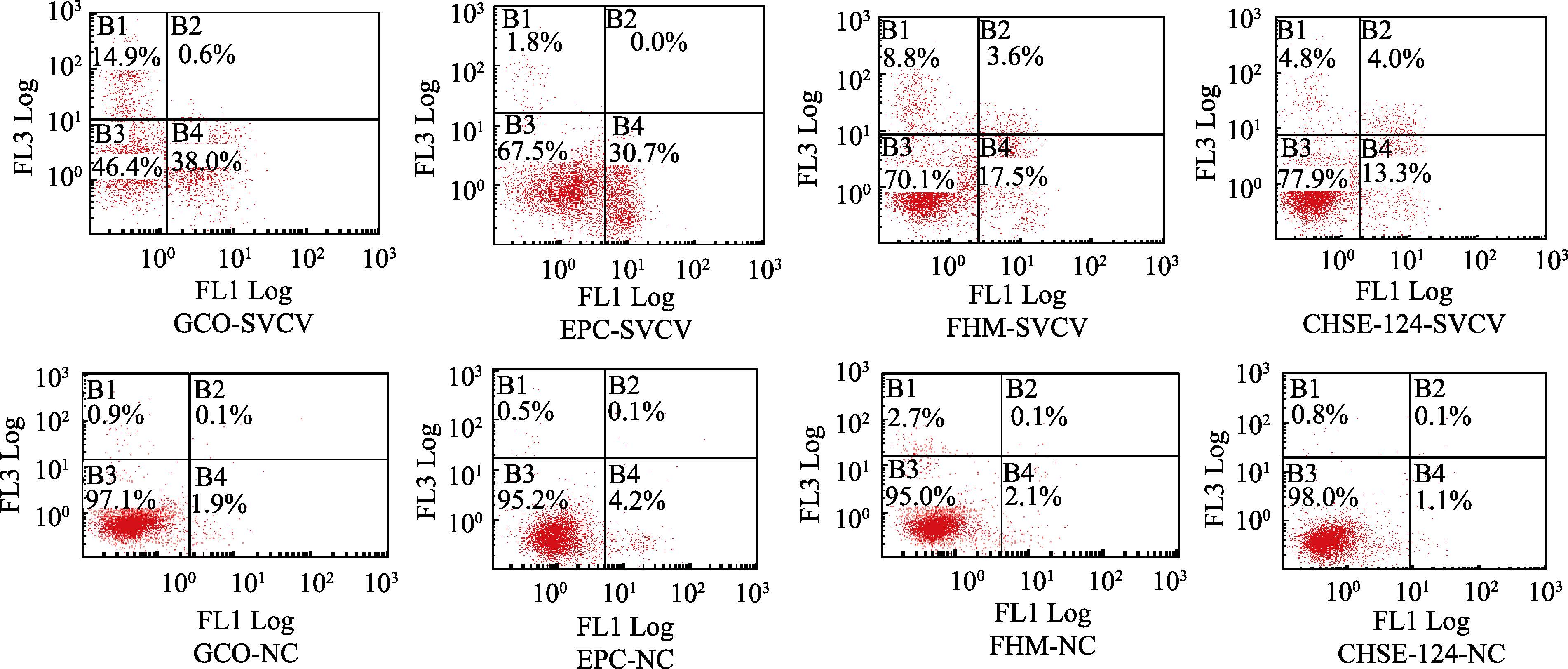
通过流式细胞仪检测SVCV诱导的GCO、EPC、FHM和CHSE-214。发现SVCV引起GCO的凋亡率为38.0%,EPC为30.7%,FHM为17.5%,CHSE-214为13.3%(图 7)。
|
图 7 流式细胞仪检测SVCV诱导不同细胞凋亡 Figure 7 Apoptosis in different cell lines caused by SVCV by using flow cytometry |
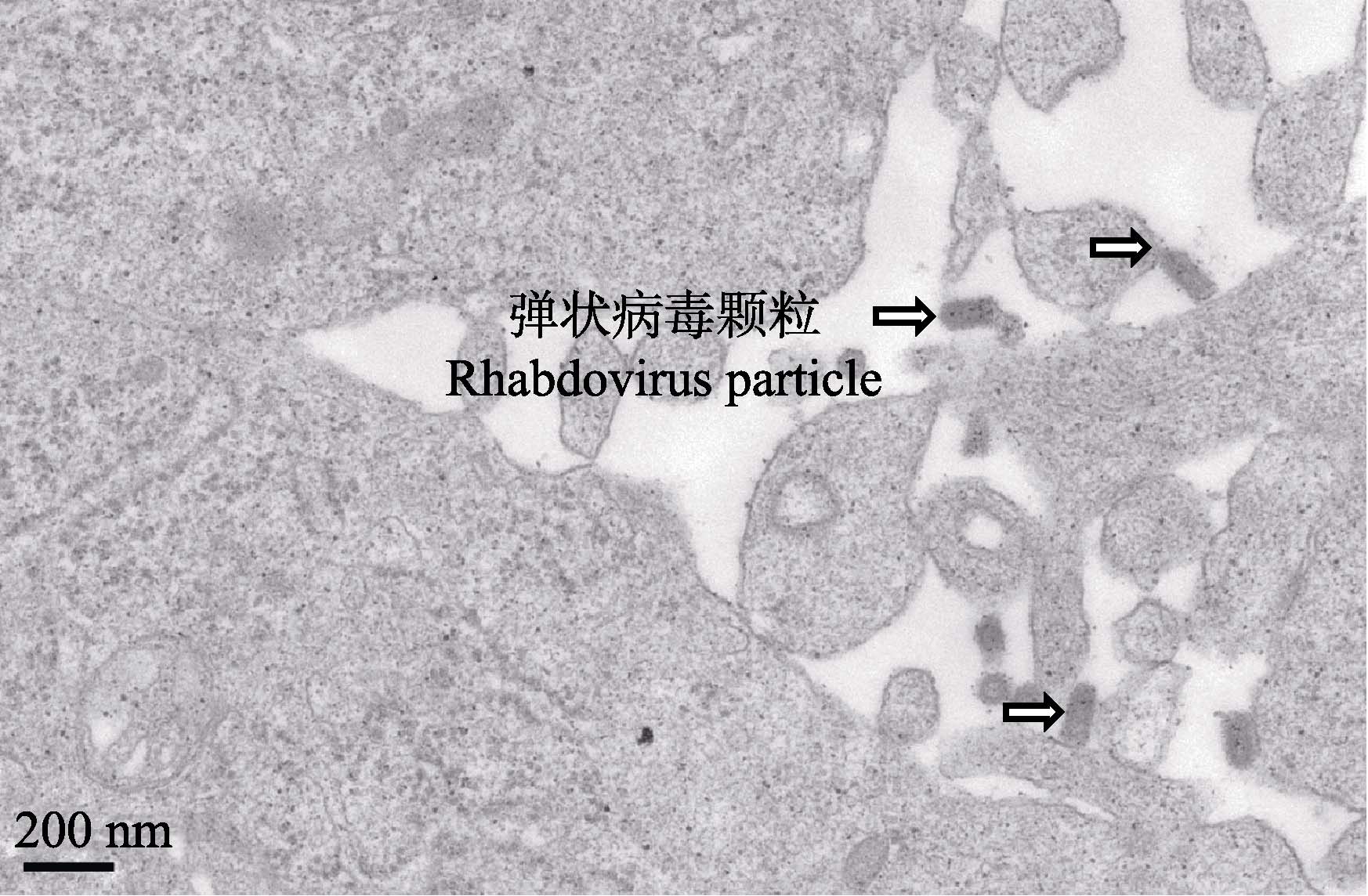
将SVCV接种GCO细胞后,电镜观察可见,在GCO细胞质内有典型弹状病毒颗粒(约为140 nm,图 8)。
|
图 8 GCO感染SVCV后电镜照片 Figure 8 Electron micrograph of GCO cells infected with SVCV |
本研究通过对GCO细胞生长曲线绘制和形态学观察等发现,GCO细胞的适宜生长温度为15-28℃,最适生长温度为25℃。一种细胞系的生长温度在一个宽泛的范围,使该细胞系具备了可以分离淡水鱼病毒和冷水鱼病毒的潜力(Nicholson et al,1987)。GCO细胞系的这一特点使得它未来可以广泛地用于水生动物病毒的分离。通过对GCO细胞系细胞周期、染色体核型的分析发现,GCO细胞系呈典型的二倍体特征,染色体数为2n=48,这与舒琥等(2014)和Beck等(1984)描述的草鱼的染色体特征相符,说明GCO细胞系保持着稳定而正常的草鱼生理学特征,未发生变异,是可靠的病毒分离与检测的工具。
目前,SVCV病毒已经在世界范围内广泛存在,可以感染鲤鱼(肖克宇等,2004)、鲫鱼(Carassius auratus)(Rougée et al,2007)等多种鲤科鱼类,造成鱼类多器官感染。SVCV存在多种分离株,如欧洲株、亚洲株等。世界动物卫生组织(OIE)推荐使用EPC分离SVCV病毒,但就目前的现状,EPC不足以全面地对进出口鲤科鱼类SVCV感染情况进行监测,这就需要寻找更多的SVCV敏感细胞。
本研究通过接种SVCV病毒,检测细胞凋亡、CPE观察、病毒粒子观察,发现SVCV能够很好地在GCO细胞内增殖,出现明显的病变。与其他已知的SVCV易感细胞相比,GCO细胞对SVCV更加易感,可以快速出现CPE,病毒滴度更高。研究结果显示,GCO细胞可以作为分离SVCV病毒的可靠实验工具。
研究表明,GCO对多种水生动物病毒有敏感性。张奇亚等(2012)用草鱼呼肠孤病毒(Grass carp reovirus,GCRV,也称为草鱼出血病病毒Grass carp hemorrhage virus,GCHV)感染GCO细胞,通过电镜在GCO细胞内观察到病毒粒子,诱导GCO细胞形成含多个细胞核的合胞体,细胞变大并发生崩解。这一现象说明,GCO细胞可以用来分离GCHV病毒,但敏感性不如草鱼肾脏细胞(CIK)(肖雪,2007)1)。江育林等(1999)用GCO细胞从甲鱼(Amyda sinensis)中分离到甲鱼虹彩病毒(STIV),孙颖杰等(2009)用GCO细胞从石鲽鱼(Platichthys bicoloratus)中分离到牙鲆(Paralichthys olivaceus)弹状病毒。GCO细胞具有生长活力强、细胞纯度高、细胞形态典型以及对病毒的特异性高等优点,是一个具有广阔应用前景的生物模型。
1) 肖雪. 草鱼呼肠孤病毒人工感草鱼的条件筛选和病理学研究. 四川农业大学硕士研究生学位论文, 2007, 2–3
| 左文功, 钱华鑫, 许映芳, 等. 草鱼肾组织细胞系CIK的建立及其生物学特性. 水产学报 , 1986, 10 (1) : 11-17 | |
| 江育林, 陈在贤, 郑坚川. 甲鱼虹彩病毒的分离和鉴定. 深圳特区科技 , 1999 (5) : 62 | |
| 孙颖杰, 江育林, 刘荭, 等. 石鲽鱼鱼苗中一种弹状病毒的分离与鉴定. 中国兽医学报 , 2009, 29 (3) : 277-282 | |
| 肖克宇, 陈昌福. 水产微生物学. 北京: 中国农业出版社, 2004 : 256 -257. | |
| 沈玉帮, 张俊彬, 李家乐. 草鱼种质资源研究进展. 中国农学通报 , 2011, 27 (7) : 369-373 | |
| 张奇亚, 桂建芳. 水生病毒及病毒病图鉴. 北京: 科学出版社, 2012 : 317 -322. | |
| 张奇亚. 我国水生动物病毒病研究概况. 水生动物学报 , 2002, 26 (1) : 89-101 | |
| 张念慈, 杨广智. 草鱼吻端组织细胞株ZC-7901及其亚株ZC-7901S1的建立和特性观察. 水产学报 , 1981, 5 (2) : 111-120 | |
| 陈立祥, 符少辉, 汪冬庚, 等. 草鱼出血病毒H962毒株的生物学特性研究. 湖南农业大学学报 , 1998, 24 (6) : 468-470 | |
| 陈燕燊. 草鱼出血病病原的研究. 水生生物学集刊 , 1978, 6 (3) : 321-330 | |
| 殷震, 刘景华. 动物病毒学. 北京: 科学出版社, 1997 : 239 -241. | |
| 舒琥, 刘远波, 魏秋兰, 等. 珠江野生草鱼、赤眼鳟的核型、银染和C带比较研究. 广州大学学报(自然科学版) , 2014, 13 (2) : 53-59 | |
| Beck ML, Biggers CJ, Barker CJ. Chromosomal and electrophoretic analyses of hybrids between grass carp and bighead carp (Pisces: Cyprinidae). Copeia , 1984 (2) : 337-342 | |
| Freshney RI. Culture of animal cells: a manual of basic technique and specialized applications. New York: Wiley Blackwell, 2010 : 387 -389. | |
| Levan A, Fredga K, Sandberg AA. Nomenclature for centromeric position on chromosomes. Hereditas , 1964, 52 (2) : 201-220 | |
| Nicholson BL, Danner DJ, Wu JL. Three new continuous cell lines from marine fishes of Asia. In Vitro Cell Dev Biol , 1987, 23 (3) : 199-204 DOI:10.1007/BF02623580 | |
| Riccardi C, Nicoletti I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nat Protoc , 2006, 1 (3) : 1458-1461 DOI:10.1038/nprot.2006.238 | |
| Rougée L, Ostrander GK, Richmond RH, et al. Establishment, characterization, and viral susceptibility of two cell lines derived from goldfish (Carassius auratus) muscle and swim bladder. Dis Aquat Organ , 2007, 77 (2) : 127-135 | |
| Yan W, Nie P, Lu Y. Establishment characterization and viral susceptibility of a new cell line derived from gold fish, Carassius auratus (L. ), tail fin. J Fish Dis , 2011, 34 (10) : 757-768 DOI:10.1111/j.1365-2761.2011.01292.x | |
| Ye HQ, Chen SL, Sha ZX, et al. Development and characterization of cell lines from heart, liver, spleen and head kidney of sea perch Lateolabrax japonicas. J Fish Dis , 2006, 69 (SA) : 115-126 |



