2. 天津市晨辉饲料有限责任公司 天津 301811;
3. 天津农学院农业分析实验教学中心 天津 300384
2. Tianjin Chenhui Feed Limited Company, Tianjin 301811 ;
3. Laboratory of Agricultural Analysis, Tianjin Agricultural College, Tianjin 300384
“津新鲤”是以建鲤(Cyprinus carpio var. Jian)为亲本来源,在天津换新水产良种场以抗寒能力、生长速度、繁殖力等为指标,经过17年连续6代群体选育而获得的新品种。该鱼具有抗旱能力强、繁殖能力高、生长速度快、起捕率高等优点,适宜在我国各地,特别是“三北”(西北、华北和东北)低温地区池塘养殖。
裂壶藻(Schizochytrium)是一类海洋真菌(Nakahara et al,1996),富含油脂、色素、角鳖烯等有益活性物质,其中,二十二碳六烯酸(DHA)含量高达35%-40%(李美玉等,2012),近年来备受关注。与此同时,裂壶藻及其制品作为新型饲料资源,在海水鱼苗种繁育(陈家鑫,2002)、中国对虾生长存活(冯伟,2011)1)和刺参的生长和免疫(黄亮华等,2014)等方面均发挥了积极作用。
1) 冯伟. 维生素C、E和裂壶藻对中国对虾特异性免疫功能影响的研究. 上海海洋大学硕士研究生学位论文,2011,74-78
鉴于此,本研究以津新鲤为研究对象,探究不同水平的裂壶藻对津新鲤生长、血液非特异性免疫指标和抗病力的影响,旨在为开发利用新型饲料资源提供参考。
1 材料与方法 1.1 饲料设计本研究采用单因素梯度配方设计,以鱼粉、豆粕、花生粕、棉粕等为基础原料,配制6组等氮等能的半精制饲料,分别含有0、0.40%、0.80%、1.20%、1.60%和2.00%裂壶藻,用Diet 1-Diet 6表示。裂壶藻购自青岛越洋进出口有限公司,其中,粗蛋白为25.29%,粗脂肪为52.15%,粗灰分为5.31%,DHA为24.26%,二十碳五烯酸(EPA)为2.17%。实验饲料配方和营养组成见表 1。各种原料经粉碎机粉碎后,过60目筛,混匀加水,用制粒机加工成粒径为2 mm的沉性颗粒饲料,置于室温通风处48 h阴干,保存于-20℃的冰箱中待用。
|
|
表 1 实验饲料配方和营养成分组成(风干基础) Table 1 Formulation and nutrient composition of test diets(Air-dry basis)(%) |
津新鲤幼鱼购自天津换新水产良种场,在天津晨辉饲料有限公司室内循环水养殖系统进行养殖,养殖容器为80 cm×60 cm×65 cm的PVC周转箱。驯化14 d后,选择健康、体重、规格基本一致的540尾津新鲤幼鱼,初始体重为(26.77±1.56)g,初始体长为(10.75±1.07)cm。随机分为6个组,每组3个重复,每个重复30尾鱼。实验期间,水温为22-27℃,pH为7.1±0.5,溶解氧>5.0 mg/L;日投饲2次(09:00和15:00),每次投喂持续40 min,投饲率为3%-5%,并根据水温、摄食情况作相应调整。养殖周期为56 d。
1.3 样品采集及处理养殖实验结束后,禁食24 h取样。分别从每箱随机取津新鲤10尾(每组30尾),先测量每条实验鱼的体重、体高、体长及全长,再自尾静脉取血。每5尾鱼的血液采集后,混合均匀,4℃静置1 h,4℃ 4000 r/min离心15 min,制备血清,-80℃冻存待测。
1.4 血液非特异性免疫指标测定血液非特异性免疫指标测定试剂盒均购自南京建成生物工程研究所,具体测定方法参照所附说明书进行。
1.5 血细胞呼吸爆发活性测定养殖实验结束后,分别从每个水箱中随机取5尾鱼(每组15尾),用一次性注射器(用肝素钠润湿)从尾静脉取血,每3尾鱼的血液采集后,混合均匀。将50 μl抗凝血与50 μl NBT(Nitroblue tetrazolium)应用液(0.2% NBT与1 mg/ml葡萄糖溶液等体积混合)混合,28℃水浴30 min,每10 min混匀1次。孵育结束后取75 μl加入到1.5 ml的N,N-二甲基甲酰胺(DMF)中,混合均匀后,4℃离心(1000 r/min,15 min),取上清液,在紫外-可见分光光度计620 nm波长条件下(DMF调零),测定吸光度(OD)值(吴旋等,2011)。
1.6 抗病力测定养殖结束后,选择体重基本一致的津新鲤进行攻毒实验,每箱取10尾鱼,每个处理30尾鱼。病原菌采用天津水产研究所保存的嗜水气单胞菌(Aeromonas hydrophila)。将活化后的嗜水气单胞菌用无菌生理盐水稀释,使终浓度约为1×109 cell/ml,按每100 g鱼2 ml菌液的剂量腹腔注射,保持养殖条件不变,每天定时观察并记录鱼死亡情况,实验周期为10 d,统计各组鱼的累计死亡率和免疫保护率(Bai et al,2012)。
1.7 饲料常规成分测定水分采用常压恒温烘干法,粗蛋白采用杜马斯燃烧法,粗脂肪采用索氏抽提法,粗灰分采用马弗炉550℃灼烧恒重法。
1.8 相关指标计算公式增重率(Weight gain rate,WGR,%)=(Wt-W0)/W0×100
特定生长率(Specific growth rate,SGR,%/d)=100(lnWt - lnW0)/t
肥满度(Condition factor,CF)=Wt/B3×100
成活率(Survival rate,SR,%)=(N2/N1)×100
累计死亡率(Cumulative mortality,%)=N4/N3×100
免疫保护率(Immune protective rate,%)=(1-F2/F1)×100
式中,Wt为终末鱼体重(g);W0为初始鱼体重(g);B为终末鱼体长(cm);t为饲养时间;N1为初始鱼尾数;N2为终末鱼尾数;N3为初受感染鱼尾数,N4为死亡鱼尾数,F1为对照组死亡率,F2为实验组死亡率。
1.9 数据统计与分析采用SPSS 17.0软件对数据进行统计和分析,实验数据用平均值±标准差(Mean±SD)表示,显著性水平用P<0.05表示,先对数据作单因子方差分析(One-way ANOVA),若处理间有显著差异,再进行Duncan’s多重比较。
2 结果与分析 2.1 饲料中不同水平的裂壶藻对津新鲤生长性能的影响饲料中添加裂壶藻可显著影响津新鲤的生长性能。随着裂壶藻添加水平的上升,增重率、特定生长率和肥满度均呈先上升后下降的趋势,最大增重率和特定生长率均出现在Diet 3组(P<0.05);肥满度在Diet 4组达到最大值,显著高于其他组(P<0.05)。各组成活率差异不显著(P>0.05)(表 2)。从生长角度来分析,添加0.80%-1.20%裂壶藻可有效促进津新鲤的生长。
|
|
表 2 不同水平的裂壶藻对津新鲤生长性能的影响 Table 2 Effects of Schizochytrium at different levels on growth performance of C. carpio var. Jian(n=30; Mean±SD) |
在抗氧化指标方面,随着裂壶藻添加水平的逐渐上升,丙二醛含量呈先下降后上升的趋势,在Diet 3组达到最低值(P<0.05)。总超氧化物歧化酶和过氧化氢酶含量则整体呈先上升后下降的趋势,Diet 2组、Diet 3组、Diet 4组组酶活性显著高于其他组(P<0.05)。血清中谷胱甘肽含量整体呈上升趋势,Diet 4组、Diet 6组显著高于其他组(P<0.05)(表 3)。从血清抗氧化指标来分析,裂壶藻适宜的添加水平为0.80%-1.20%。
|
|
表 3 不同水平的裂壶藻对津新鲤血清抗氧化指标的影响 Table 3 Effects of Schizochytrium at different levels on serum antioxidant indices of C. carpio var. Jian(n=6; Mean±SD) |
津新鲤的非特异性免疫水平受饲料中不同水平的裂壶藻影响显著。溶菌酶含量呈先上升后下降的趋势,在Diet 4组达到最大值(P<0.05)。一氧化氮含量呈上升趋势,各添加组均显著高于对照组Diet 1(P<0.05)。谷草转氨酶和谷丙转氨酶含量均呈先上升后下降的趋势,谷草转氨酶/谷丙转氨酶的变化趋势则相反,在Diet 3组达到最小值(P<0.05)(表 4)。从非特异性免疫指标角度来看,裂壶藻适宜添加水平为0.80%-1.20%。
|
|
表 4 不同水平的裂壶藻对津新鲤血清非特异性免疫指标的影响 Table 4 Effects of Schizochytrium at different levels on serum nonspecific immune indices of C. carpio var. Jian(n=6; Mean±SD) |
由图 1可知,饲料中添加裂壶藻不同程度地提高了津新鲤血细胞的呼吸爆发活性,整体呈先上升后下降的趋势。在Diet 3组,血细胞呼吸爆发活性达到峰值,显著高于其他组(P<0.05)。可见,裂壶藻添加水平为0.80%时,能显著提高血细胞呼吸爆发活力。
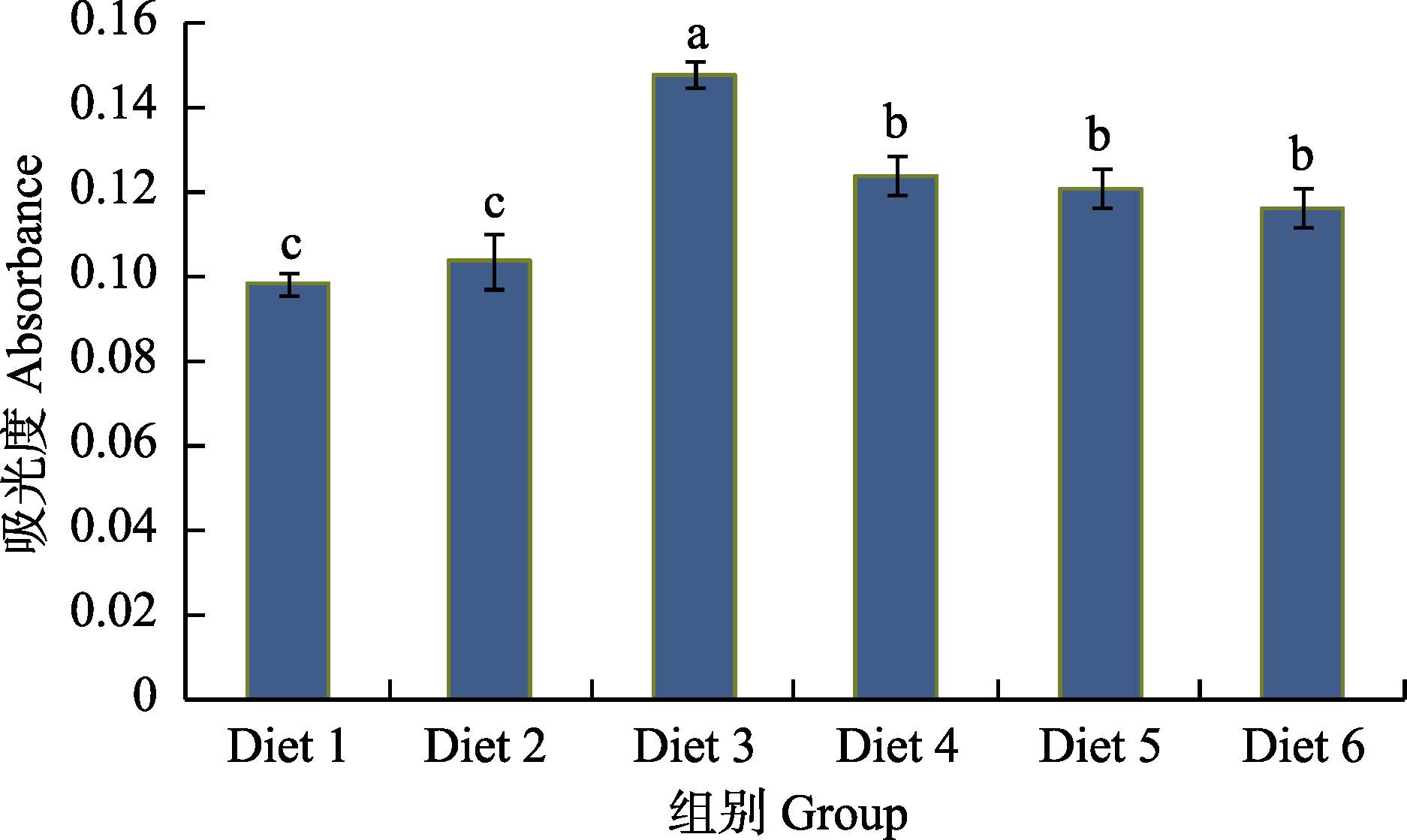
|
图 1 不同水平的裂壶藻对津新鲤血细胞呼吸爆发活性的影响 Figure 1 Effects of Schizochytrium at different levels on respiratory burst activities of blood cell of C. carpio var. Jian(n=5; x±SD) |
对津新鲤投饲含不同水平的裂壶藻的饲料56 d后,用嗜水气单胞菌进行攻毒实验,实验鱼均不同程度地出现了典型出血症状,如腹部、鳍基部、鳃裂后部有充血或出血症状,部分濒死状态的鱼腹部膨大、肛门红肿,解剖后发现肠部充血发炎,计算累计死亡率、免疫保护率(表 5)。经嗜水气单孢菌活菌攻毒10 d后,随着裂壶藻水平的增加,津新鲤累计死亡率整体呈现先下降后上升的趋势,除Diet 6组外,其余各添加组累计死亡率均显著低于对照组Diet 1(P<0.05),且Diet 3组的死亡率达到最小值(25%)(P<0.05)。
|
|
表 5 不同水平的裂壶藻对津新鲤抗病力的影响 Table 5 Effects of Schizochytrium at different levels on disease resistance of C. carpio var. Jian(n=3; Mean±SD)(%) |
通过计算免疫保护率可知,裂壶藻提高了津新鲤的免疫保护率,且随裂壶藻水平的增加呈现先上升后下降的趋势。裂壶藻添加水平为0.40%-1.60%时,对津新鲤起到了免疫保护作用,其中,Diet 3组的免疫保护率达到最大值(44.44%)(P<0.05),因此,选择0.80%裂壶藻水平为津新鲤免疫保护作用的最佳添加水平。
3 讨论 3.1 饲料中不同水平的裂壶藻对津新鲤生长性能的影响海洋微藻细胞中存在着丰富的初级或次级代谢产物,其化学成分非常复杂,且具有各种生理活性。近年来,随着我国饲料工业水平的不断提高,将海洋微藻作为一种功能性的饲料添加剂应用于水产养殖的相关研究日益成为热点。
本研究所选用的裂壶藻中富含大量的有益活性物质,如油脂、色素、角鳖烯等,其中,油脂占细胞干重的70%以上,总脂中DHA含量高达35%-40%(曾娟等,2015)。DHA是许多鱼类幼体、对虾幼体、双壳类幼虫的必需脂肪酸,它直接关系到幼虫和幼体的生长发育和存活(梁英等,2000)。已有研究表明,在对虾基础饲料中,0.5%的裂殖壶藻发酵粉可明显降低饲料系数,促进其生长,同时提高了肌肉中蛋白及DHA的含量(焦建刚等,2014)。在斑点叉尾鮰(Ietalurus pune- taus)饲料中添加裂殖壶藻粉,可增加鱼的体重及饲料转化率,适宜的添加量可显著提高肌肉中DHA和长链多不饱和脂肪酸的水平(Li et al,2009)。在鲤鱼饲料中添加0.5%-1.5%的DHA,能显著促进生长性能(王桂芹等,2010)。在鲤鱼饲料中添加不同脂肪源,显示富含不饱和脂肪酸的鱼油组生长性能最好(潘瑜等,2012)。Ganuza等(2008)指出,裂殖壶藻作为鱼油DHA替代资源,在金头海鲷养殖上具有巨大潜力。陈家鑫(2002)认为,裂壶藻在水产苗种生产中的应用已经引起广泛关注。本研究中,随着裂壶藻添加水平的增加,津新鲤的各项生产性能指标与对照组相比均得到显著提高。本实验结果与上述研究成果基本一致。本研究结果显示,裂壶藻在津新鲤饲料中的适宜添加水平为0.80%-1.20%,与Steffens等(2007)鲤鱼饲料添加较低水平的DHA显著促生长效应的结果相吻合。也有研究表明,淡水鱼类生长发育过程中需要n-3和n-6系列多不饱和脂肪酸适宜的配比(Visentainer et al,2007),但其相关研究尚需深入展开。
3.2 饲料中不同水平的裂壶藻对津新鲤血清抗氧化指标的影响抗氧化酶系统存在于所有需氧生物的组织内,其功能是清除物质代谢过程中所产生的活性中间产物,尤其是清除氧自由基。其中,丙二醛作为脂质氧化的终产物,会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性。总超氧化物歧化酶是一类重要的清除氧自由基的抗氧化酶,它能催化超氧自由基发生歧化反应,生成氧气和过氧化氢;过氧化氢又在过氧化氢酶的作用下,生成无毒的水和氧气。谷胱甘肽能还原H2O2,清除体内的自由基团,对细胞有保护作用。本研究添加0.80%-1.20%的裂壶藻,可显著降低血清中丙二醛的含量,显著提高总超氧化物歧化酶、过氧化氢酶和谷胱甘肽的含量,显示出裂壶藻具有清除体内自由基、改善脂质代谢、减轻脂质过氧化反应的功效。这与DHA、EPA对耐力训练小鼠抗氧化能力的影响(于得庆等,2005)、DHA对鲤抗氧化能力的影响(吉红等,2009)的结论一致。
3.3 饲料中不同水平的裂壶藻对津新鲤血清非特异性免疫指标的影响溶菌酶是广泛存在于生物体液、血清和巨噬细胞中的一种水解酶,是吞噬细胞杀菌的物质基础和重要的非特异性免疫因子,能使吞噬细胞的吞噬活性增强(Amar et al,2004)。一氧化氮是巨噬细胞的效应分子,对T淋巴细胞和巨噬细胞的细胞因子分泌具有调节功能(李万坤等,2007)。本研究中,0.80%-1.20%裂壶藻显著提高了津新鲤血清中溶菌酶活性,这与黄亮华等(2014)在裂壶藻对刺参生长、免疫及消化酶的影响研究中的结论相吻合。杨鸢劼等(2008)在黄鳝(Monopterus alba)基础饲料中添加DHA,也表明实验组血清LSZ活性较对照组显著增大。与对照组相比,各裂壶藻添加组的一氧化氮含量均高于对照组,推测是由于裂壶藻内的有效活性物质能够与巨噬细胞表面受体结合,从而刺激巨噬细胞表面一氧化氮合酶的表达,诱导其产生大量一氧化氮。王媛等(2005)研究表明,鱼类血液中的谷丙转氨酶和谷草转氨酶的含量变化可以作为反映鱼类肝功能的重要指标。本研究中,津新鲤血清谷草转氨酶含量和谷草转氨酶/谷丙转氨酶分别在裂壶藻添加量为1.20%和0.80%时最小,说明适宜的裂壶藻添加水平(0.80%-1.20%)可有效避免对肝的损伤,减轻肝脏的应激反应。该结果与殷海成等(2014)研究鲤幼鱼饲料中DHA的适宜添加量的结果具有相同趋势。血清谷丙转氨酶含量在对照组最小,各添加组均不同程度地高于对照组,推测原因可能是摄入的裂壶藻导致体内脂肪酸不均衡,从而引起脂类代谢紊乱。
3.4 饲料中不同水平的裂壶藻对津新鲤抗病力的影响呼吸爆发活性的高低是反映机体杀菌能力的一个直观指标(Babior et al,1973)。实验结果显示,随着裂壶藻添加水平的升高,与对照组相比,除Diet 2组外,各添加组的呼吸爆发活力均显著提高,且在添加量为0.80%时效果最好。鱼体受到外源性细菌感染之后的死亡率能够非常直观地反映鱼体对疾病的抵抗力(廖英杰等,2014)。本研究中,除Diet 6组外,其余各添加组累计死亡率和免疫保护率均显著优于对照组。该结果与王桂芹等(2010)得出的添加DHA可显著影响鲤鱼的攻毒存活率,并提升鲤鱼的免疫保护力的结论以及投喂缺乏n-3系列多不饱和脂肪酸饲料的鱼更加容易感染病菌的研究结果(Kiron et al,1995)相互印证。
4 结论综上所述,饲料中裂壶藻添加水平在0.80%- 1.20%时,可显著提高津新鲤的生长性能、抗氧化能力、非特异性免疫力及鱼体的抗病力。本研究为裂壶藻作为功能性藻类饲料添加剂的开发和利用提供了理论依据。
| 于得庆, 焦玲霞, 张雪红, 等. DHA、EPA对耐力训练小鼠抗氧化能力影响的实验研究. 河北工业科技 , 2005, 22 (2) : 64-68 | |
| 王桂芹, 牛小天, 闫先春, 等. 饲料中添加维生素E和二十二碳六烯酸对鲤鱼生长和抗病力的影响. 上海交通大学学报(农业科学版) , 2010, 28 (2) : 124-128 | |
| 王媛, 杨康健, 吴中, 等. 氯氰菊酯对鲫鱼血清中谷丙转氨酶及谷草转氨酶活力的影响. 水产科学 , 2005, 24 (9) : 8-10 | |
| 吉红, 周继术, 曹福余, 等. DHA对鲤抗氧化能力影响的初步研究. 上海水产大学学报 , 2009, 18 (2) : 142-149 | |
| 李万坤, 闫鸿斌, 才学鹏, 等. β-葡聚糖的免疫增强作用机理研究进展. 中国畜牧兽医 , 2007, 34 (7) : 151-155 | |
| 李美玉, 李健, 陈萍, 等. 维生素E和裂壶藻对中国对虾生长及TLR/NF-kB表达水平的影响. 中国渔业质量与标准 , 2012, 2 (2) : 37-44 | |
| 杨鸢劼, 邴旭文, 徐增洪. 不饱和脂肪酸对黄鳝部分非特异性免疫和代谢指标的影响. 中国水产科学 , 2008, 15 (4) : 600-605 | |
| 吴旋, 白东清, 朱国霞, 等. 长期投喂黄芪多糖对黄颡鱼免疫细胞活性的影响. 动物营养学报 , 2011, 23 (5) : 887-892 | |
| 陈家鑫. 裂壶藻及其制品在水产苗种培育中的应用. 科学养鱼 , 2002 (6) : 53 | |
| 殷海成, 管军军, 马芳芳. 鲤幼鱼饲料中DHA的适宜添加量研究. 饲料工业 , 2014, 35 (20) : 69-73 | |
| 黄亮华, 李浩洋, 李彬, 等. 裂壶藻对刺参生长、免疫及消化酶的影响. 渔业科学进展 , 2014, 35 (3) : 91-97 | |
| 梁英, 麦康森. 微藻EPA和DHA的研究现状及前景. 水产学报 , 2000, 24 (3) : 289-296 | |
| 焦建刚, YuanK, ClémentineT, 等. 裂殖壶藻发酵粉对南美白对虾生长性能和肌肉营养成分的影响. 上海海洋大学学报 , 2014, 23 (4) : 523-527 | |
| 曾娟, 刘海燕, 顾继锐, 等. 裂殖壶藻在水产养殖中的应用. 中国饲料 , 2015 (13) : 27-28 | |
| 廖英杰, 刘波, 任鸣春, 等. 精氨酸对团头鲂幼鱼生长、血清游离精氨酸和赖氨酸、血液生化及免疫指标的影响. 中国水产科学 , 2014, 21 (3) : 549-559 | |
| 潘瑜, 毛述宏, 关勇, 等. 饲料中不同脂肪源对鲤鱼生长性能、脂质代谢和抗氧化能力的影响. 动物营养学报 , 2012, 24 (7) : 1368-1375 | |
| Amar EC, Kiron V, Satoh S, et al. Enhancement of innate immunity in rainbow trout (Oncorhynchus mykiss Walbaum) associated with dietary intake of carotenoids from natural products. Fish Shellfish Immun , 2004, 16 (4) : 527-537 DOI:10.1016/j.fsi.2003.09.004 | |
| Babior BM, Kipnes RS, Curnutte JT. Biological defense mechanisms: the production by leukocytes of superoxide, a potential bactericidal agent. J Clin Invest , 1973, 52 (3) : 741-744 DOI:10.1172/JCI107236 | |
| Bai DQ, Wu X, Zhu GX, et al. Astragalus polysaccharides enhance cellular immune response and disease resistance in yellow catfish. Isr J Aquacult-Bamid , 2012, 64 : 1-7 | |
| Ganuza E, Benítez-Santana T, Atalah E, et al. Crypthecodinium cohnii and Schizochytrium sp. as potential substitutes to fisheries-derived oils from seabream (Sparus aurata) microdiets. Aquaculture , 2008, 277 (1-2) : 109-116 | |
| Kiron V, Fukuda H, Takeuchi T, et al. Essential fatty acid nutrition and defense mechanisms in rainbow trout Oncorhynchus mukiss. Comp Biochem Physiol , 1995, 111 (3) : 361-367 | |
| Li MH, Robinson EH, Tucker CS, et al. Effects of dried algae Schizochytrium sp. a rich source of docosahexaenoic acid, on growth, fatty acid composition, and sensory quality of channel catfish (Ictalurus punctatus). Aquaculture , 2009, 292 (3) : 232-236 | |
| Nakahara T, Yokochi T. Production of docosahexaenoic and docosapexaenoic acids by Schizochytrium sp. isolated from Yap Islands. J Am Oil Chem Soc , 1996, 73 (11) : 1421-1426 DOI:10.1007/BF02523506 | |
| Steffens W, Wirth M. Influence of nutrition on the lipid quality of pond fish: common carp (Cyprinus carpio) and tench (Tinca tinca). Aquacult Int , 2007, 15 (3) : 313-319 | |
| Visentainer JV, Noffs MD, de Oliveira Carvalho P, et al. Lipid content and fatty acid composition of 15 marine fish species from the southeast coast of Brazil. J Am Oil Chem Soc , 2007, 84 (6) : 543-547 DOI:10.1007/s11746-007-1070-4 |



