2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 中国科学院海洋研究所 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071 ;
3. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071
气候变化已成为当前国际社会公认的全球性问题之一,海洋生态系统在气候变化背景下也正发生着巨大的变化(Belkin,2009),如海水温度升高、溶氧降低、海洋酸化、冰川融化及海平面上升等。作为海洋生态系统生物主体的渔业资源也经历着不可逆转的演替:(1)渔业生物生长、发育、繁殖、死亡等生命过程的改变(Bakun,1990; Nissling et al,1998; Pörtner et al,2007; Cheung et al,2013a);(2)渔业生物多样性演替和生物量分布迁移(MacKenzie et al,2004; Perry et al,2005; Dulvy et al,2008; Cheung et al,2008、2009、2010、2013b);(3)渔业生物栖息环境破坏和饵料基础的转换(Beaugrand et al,2002; Sheppard,2003; Grandcourt et al,2003; Richardson et al,2004)。渔业生物通过这些被动或主动的适应性改变着生态系统的结构和功能,进而对生态系统的食物可持续产出产生影响(Cardinale et al,2006、2012)。研究不同气候变化情景对渔业资源分布的潜在影响,对科学认识气候变化对海洋生态系统的影响及采取正确、及时的应对策略具有重要意义。
目前,关于气候变化对渔业资源影响的研究多注重用实测数据结合环境变量进行探讨,以分析气候变化对渔业资源的影响(刘允芬,2000; Perry et al,2005; Pörtner et al,2007; 李玉尚等,2007; Dulvy et al,2008;李玉尚,2010; 王跃中等,2011、2012)。如利用渔业史资料分析了黄、渤海鲱鱼(Clupea pallasii)数量周期性变动与气候变化产生的海洋水文条件波动的相关性(李玉尚,2010),厄尔尼诺(ENSO)事件与海洋环流对渔业资源量的影响(何发祥等,1995、2003; 洪华生等,1997; Klyashtorin,1998)。Cheung等(2008、2009、2010)研究了全球范围内不同气候变化情景下海洋生物多样性和生物量分布趋势。在中国近海,涉及气候变化的预估分析仅见于苏杭等(2015)关于海水表面温度(SST)升高(SST分别拟定升高0.5℃、1℃、2℃和4℃)对鲐(Scomber japonicus)栖息地分布面积的研究,而针对不同气候变化情景对渔业资源分布潜在影响的评估尚未见报道。
河口生态系统是气候变化和人类活动集中作用的典型区域,同时又是渔业生物生长、繁殖和育幼的重要场所,也是众多洄游性鱼类的必经通道。因此,河口生态系统对渔业资源的可持续补充有重要的意义(罗秉征等,1992; Whitfield et al,2003)。本研究选择长江口作为研究区域,以2012-2013年长江口鱼类资源密度分布为基础,采用动态生物气候分室模型(Dynamic bioclimate envelope model,DBEM)预估了不同气候变化情景下长江口鱼类资源密度增量的分布,以期为气候变化背景下近海渔业生态系统演变及适应性渔业管理的研究提供基础和科学范例。
1 材料与方法 1.1 数据来源数据来源于2012年6月、8月、11月、2013年1月、5月、8月、10月长江口水域6个断面的渔业底拖网调查。调查区域、调查网具、调查取样等见 孙鹏飞等(2015);利用CTD测定每个站位的温度、盐度等环境因子。对渔业种类进行鉴定,记录每种的重量和数量,数据标准化到1 h,以单位面积的渔获量(kg/km2)表示。本研究仅包括鱼类,其中,底层鱼类包括小黄鱼(Larimichthys polyactis)、带鱼(Trichiurus lepturus)、发光鲷(Acropoma japonicum)、白姑鱼(Argyrosomus argentatus)、龙头鱼(Psenopsis anomala)、长吻红舌鳎(Cynoglossus lighti)、棘头梅童鱼(Collichthys lucidus)、红狼牙鰕虎鱼(Odontamblyopus rubicundus)、六丝钝尾鰕虎鱼(Amblychaeturichthys hexanema)、黄鱇 (Lophius litulon)等;中上层鱼类包括黄鲫(Setipinna taty)、凤鲚(Coilia mystus)、赤鼻棱鳀(Thryssa kammalensis)、鳀(Engraulis japonicus)、康氏小公鱼(Stolephorus commersonnii)、竹荚鱼(Trachurus japonicus)、鲐等,以上种类以暖温性和暖水性种类为主。
1.2 鱼类资源密度增量分布预估方法 1.2.1 气候变化情景本研究采用政府间气候变化委员会(Intergovernmental panel on climate change,IPCC)新一代温室气体排放情景(Representative concentration pathways,RCPs),即典型浓度目标分别为RCP2.6、RCP4.5、RCP6.0和RCP8.5(表 1),分别代表最低、较低、中和最高程度的温室气体排放情景。
|
|
表 1 典型浓度目标 Table 1 Representative concentration pathways |
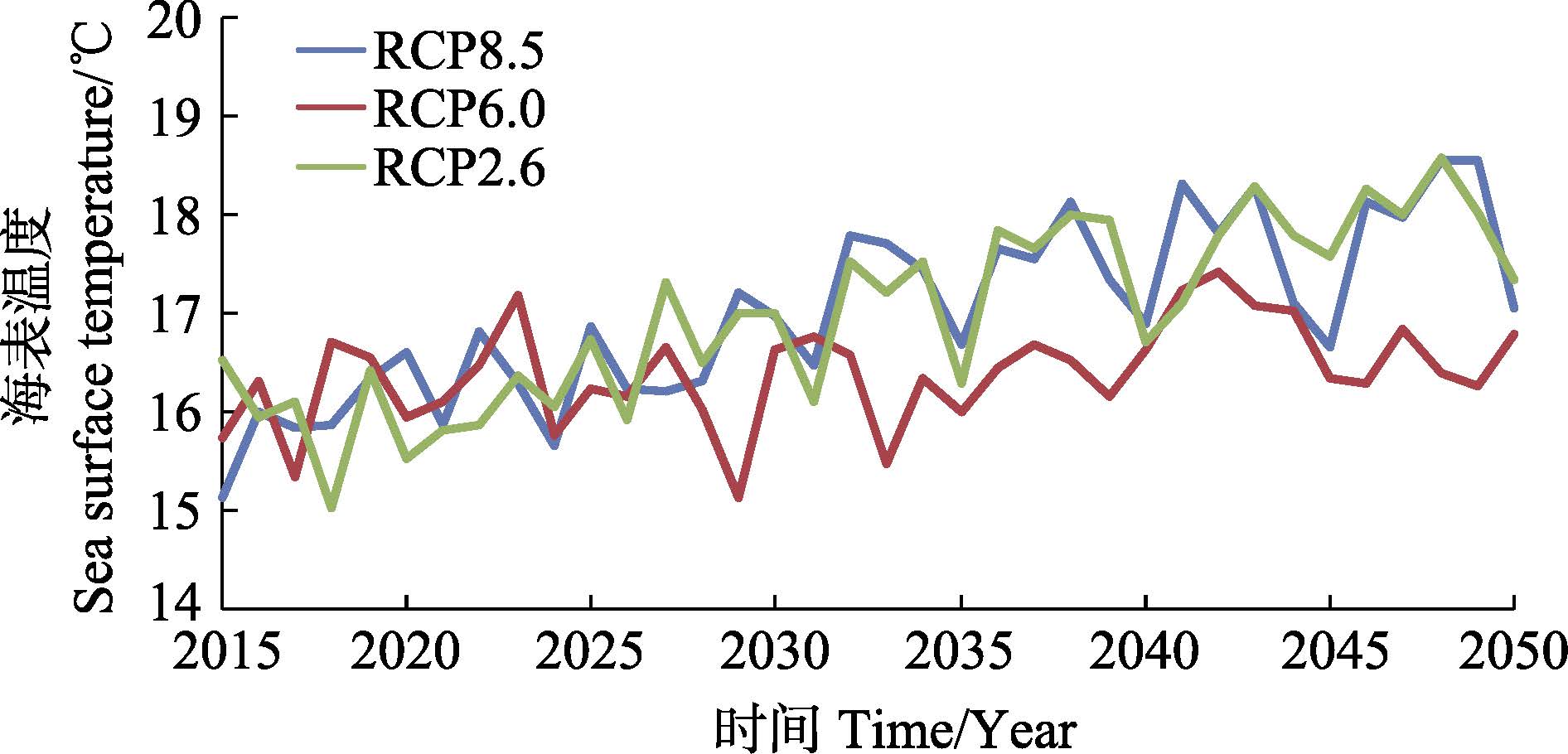
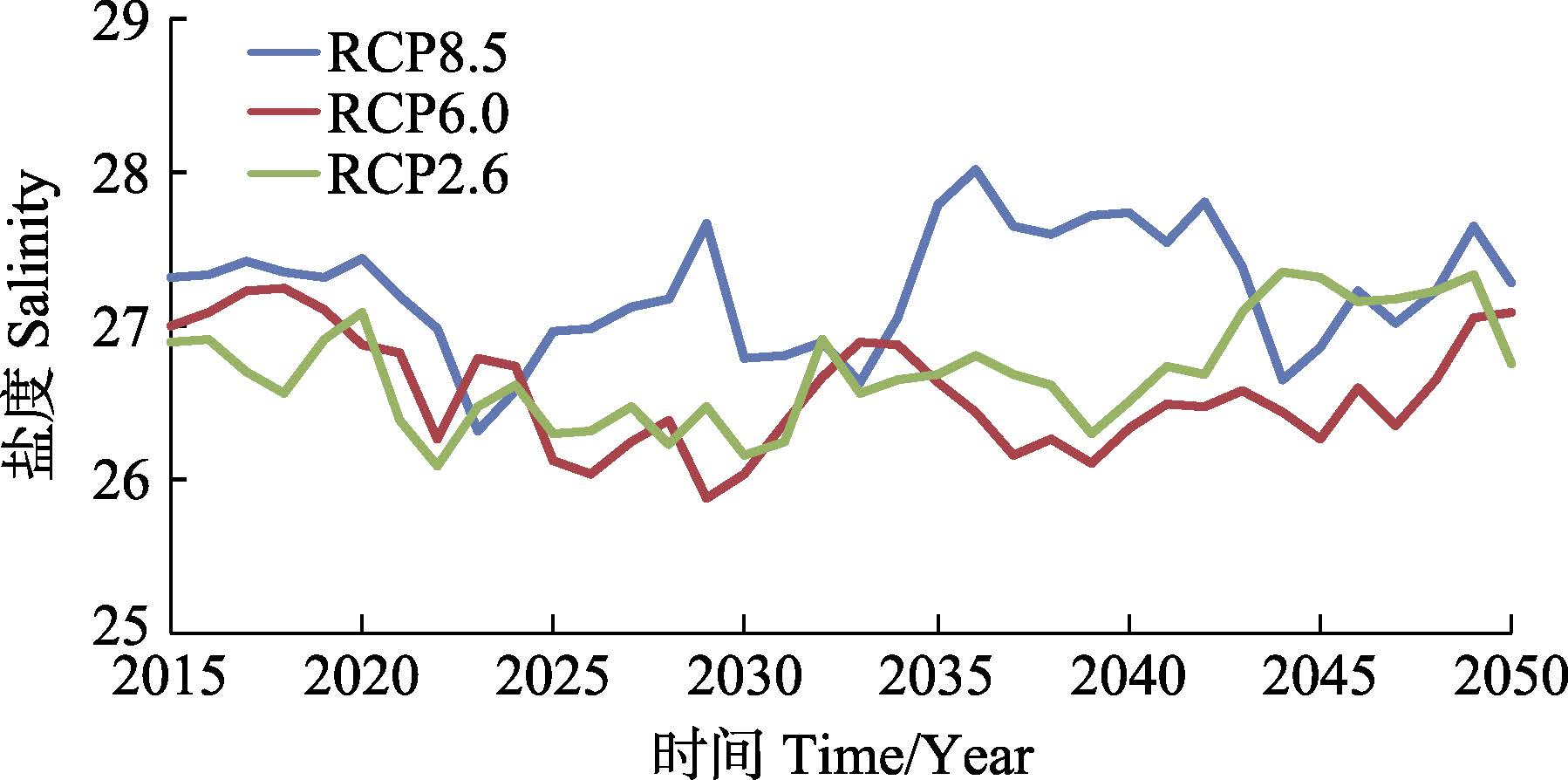
在实际分析中,RCP4.5和RCP6.0情景温度变化不存在显著差异,故本研究只分析RCP2.6、RCP6.0和RCP8.5这3种温室气体排放情景。长江口水域温度和盐度变化预测通过美国国家海洋与大气管理局(NOAA)地球物理流体动力学实验室(The Geophysi- cal Fluid Dynamics Laboratory,GFDL)的物理耦合模型(Coupled physical model,CM3)实现。CM3是GFDL基于耦合模式比较计划第5阶段(CMIP5)的新一代全球气候模式的预估研究和评估,具体见http://www.gfdl.noaa.gov/coupled-physical-model-cm3。长江口水域温度和盐度在不同气候变化情景下的变化预测见图 1和图 2。
|
图 1 不同气候变化情景下长江口水域温度的变化(2015-2050年) Figure 1 Projections of temperature changes in the Yangtze River estuary under different climate change scenarios(2015-2050) |
|
图 2 不同气候变化情景下长江口水域盐度的变化(2015-2050年) Figure 2 Projections of salinity changes in the Yangtze River estuary under different climate change scenarios(2015-2050) |
动态生物气候分室模型已被广泛用于预测陆地和海洋对于气候变化的响应(Berry et al,2002; Peterson et al,2002; Pearson et al,2003; Keith et al,2008; Cheung et al,2009、2010)。本研究的动态生物气候分室模型主要参考Cheung等(2008),并在此基础上,针对长江口水域的环境和鱼类的具体参数作了调整。
该模型中,海区按照经纬度分成0.25°×0.25°的地理单元,每个地理单元对应着相应的鱼类资源密度指数(Resource density index,RDI)。RDI计算公式如下:
| $RDI=\frac{C}{a\cdot q}$ |
式中,C为每个站位的渔获量,单位为kg/km2,a为底拖网扫海面积,q为捕获系数,其值参考 金显仕等(2006)。
本研究用鱼类资源密度重心来描述其空间分布的迁移和变化(牛明香等,2012)。鱼类资源密度重心计算公式如下:
| $X=\frac{\sum\limits_{i}^{n}{{{C}_{i}}\cdot {{X}_{i}}}}{\sum\limits_{i}^{n}{{{C}_{i}}}}$ |
式中,X为鱼类资源密度重心的经纬度,Ci为地理单元i的RDI值,n为鱼类出现的地理单元的总个数。
模型中定义了一个环境适合度函数,用来反映不同环境条件环境变量对鱼类的影响,本研究的环境变量包括海表温度(T)和海表盐度(S)。环境适合度(P)函数公式如下:
| $P=P\left( T \right)\text{ }\times P\left( S \right)$ |
模型中,假定环境容纳量与环境适合度是正相关,这样随着不同地理单元环境适合度的变化,鱼类环境容纳量也随之变化。环境变量的变化导致环境适合度的改变,从而造成环境容纳量的改变,进而对鱼类生存和洄游产生影响。当一个地理单元的环境变量更适合鱼类生存时,其环境容纳量也相应增加。
在预测鱼类资源密度增量分布时,用逻辑斯蒂生长模型来驱动鱼类资源密度增量,具体如下:
| $\frac{d{{A}_{i}}}{dt}=\underset{j=1}{\overset{N}{\mathop \sum }}\,{{G}_{i}}+{{I}_{ji}}+{{L}_{ji}}$ |
式中,Ai为0.25°×0.25°地理单元鱼类资源密度增量,Gi为鱼类种群的内秉增长率,Lji、Iji分别为幼鱼、成鱼从相邻地理单元j的净迁入量。鱼类内秉增长率由其增长率和环境容纳量决定:
| ${{G}_{i}}=r\cdot {{A}_{i}}\cdot [1-\left( {{A}_{i}}/K{{C}_{i}} \right]$ |
式中,r是鱼类内秉增长率,Ai和KCi分别是鱼类所在地理单元i的资源密度增量和环境容纳量。
针对地理单元中成鱼的迁入和迁出问题,应用欧拉空间生态系统模拟模型(Eulerian spatial ecosystem simulation model)中的Ecospace定理,把研究的地理单元分为东-西和南-北两个方向,假定鱼类沿着这两个方向运动,环境适合度越高的地理单元,越容易引起鱼类迁入。
| ${{m}_{i}}=\frac{{{m}_{i(base)}}\cdot k}{k+D}$ |
式中,mi为i地理单元中鱼类的迁移率,mi (base)为相邻地理单元不存在环境适合度梯度时的迁移率,k为尺度因子,用来反映迁移率对环境适合度变化的敏感程度。D为相邻地理单元环境适合度比值,定义如下:
| ${{D}_{ij}}={{P}_{i}}/{{P}_{j}}$ |
式中,Pi和Pj分别为相应地理单元的环境适合度。
同时,新迁入的鱼类还有可能回到原来迁出的地理单元i,这取决于其新迁入地理单元j的资源密度与环境容纳量的比值(KRj)。
| $~K{{R}_{j}}=\frac{{{A}_{j}}}{K{{C}_{j}}}$ |
式中,Aj为地理单元j的鱼类相对丰度,KCj为地理单元j的环境容纳量。
返回原地理单元i的鱼类资源密度(REji):
| $R{{E}_{ji}}=\frac{{{m}_{i}}\cdot {{A}_{i}}\cdot k}{k+\left( 1-K{{R}_{j}} \right)}$ |
式中,mi为鱼类的迁移率,Ai为地理单元i的鱼类相对丰度,k为尺度因子,KRj为地理单元j鱼类相对丰度接近于该单元最大环境容纳量的程度。
因此,从地理单元i净迁出到地理单元j的鱼类资源量(Iij)为迁出到地理单元j的资源量(Eij)减去迁回到地理单元i的资源量(REji):
| ${{I}_{ij}}={{E}_{ij}}-R{{E}_{ji}}$ |
同时,鱼类在时间t时,地理单元i中的总死亡(Mi,t)由捕捞死亡(Mi,f,t)和自然死亡(Mi,m,t)共同作用:
| ${{M}_{i,t}}={{M}_{i,f,t}}+{{M}_{i,m,t}}$ |
且自然死亡(Mi,m)随着地理单元中环境适合度改变等比例的变化。
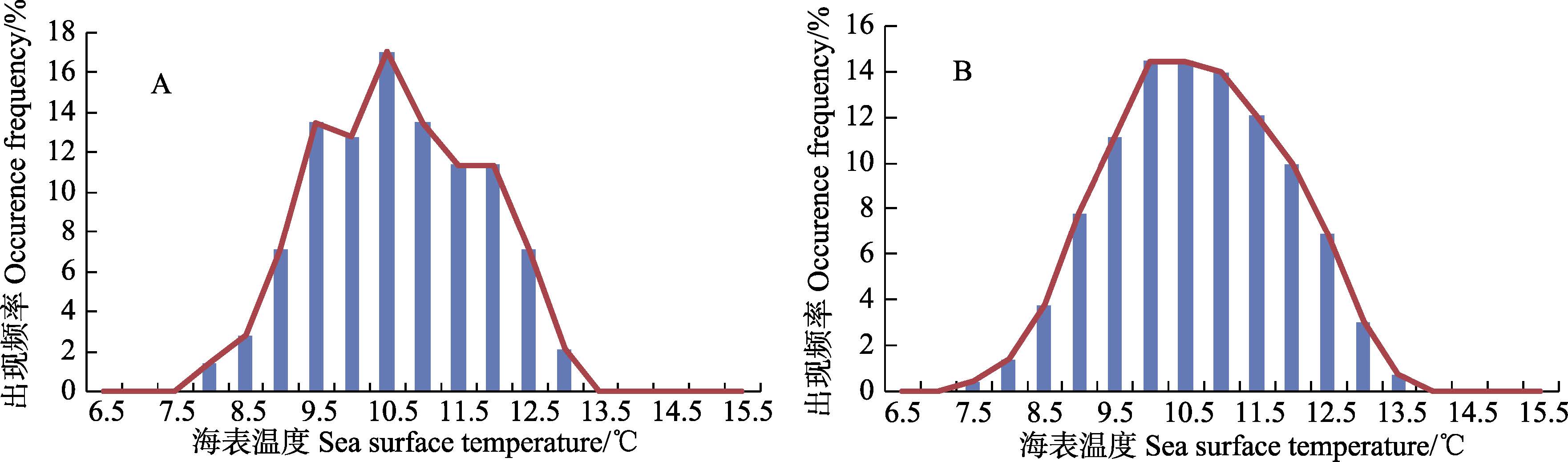
1.2.3 环境适合度函数的构建 1.2.3.1 温度每种鱼类均具有其存活温度范围及最适温度,鱼类温度的适合度函数P(T)定义为鱼类在不同温度的出现频率。为求得P(T),首先对GFDL的海表温度数据进行内插,使其与模型的分辨率相一致,然后对长江口水域2012-2013年调查数据进行分析,得到鱼类温度适合度函数。判断适合度函数是否合理,需要满足两个条件:(1)数据分布应为单峰分布;(2)物种最适温度范围的变异系数要小于50%。如果适合度函数不是单峰分布,需要对其进行相邻单位的平滑处理。为了减小相对于原始数据的误差,平滑处理从相邻两个单位开始,直到获得单峰的函数分布为止。以鳀鱼为例,对由原始数据得到的鱼类温度适合度函数(图 3-A)进行平滑处理,得到其单峰分布图(图 3-B)。
|
图 3 鳀鱼的温度适合度函数 Figure 3 The function of suitable temperature for E. japonicus A:原始;B:平滑后 A: Original; B: After curve fitting |
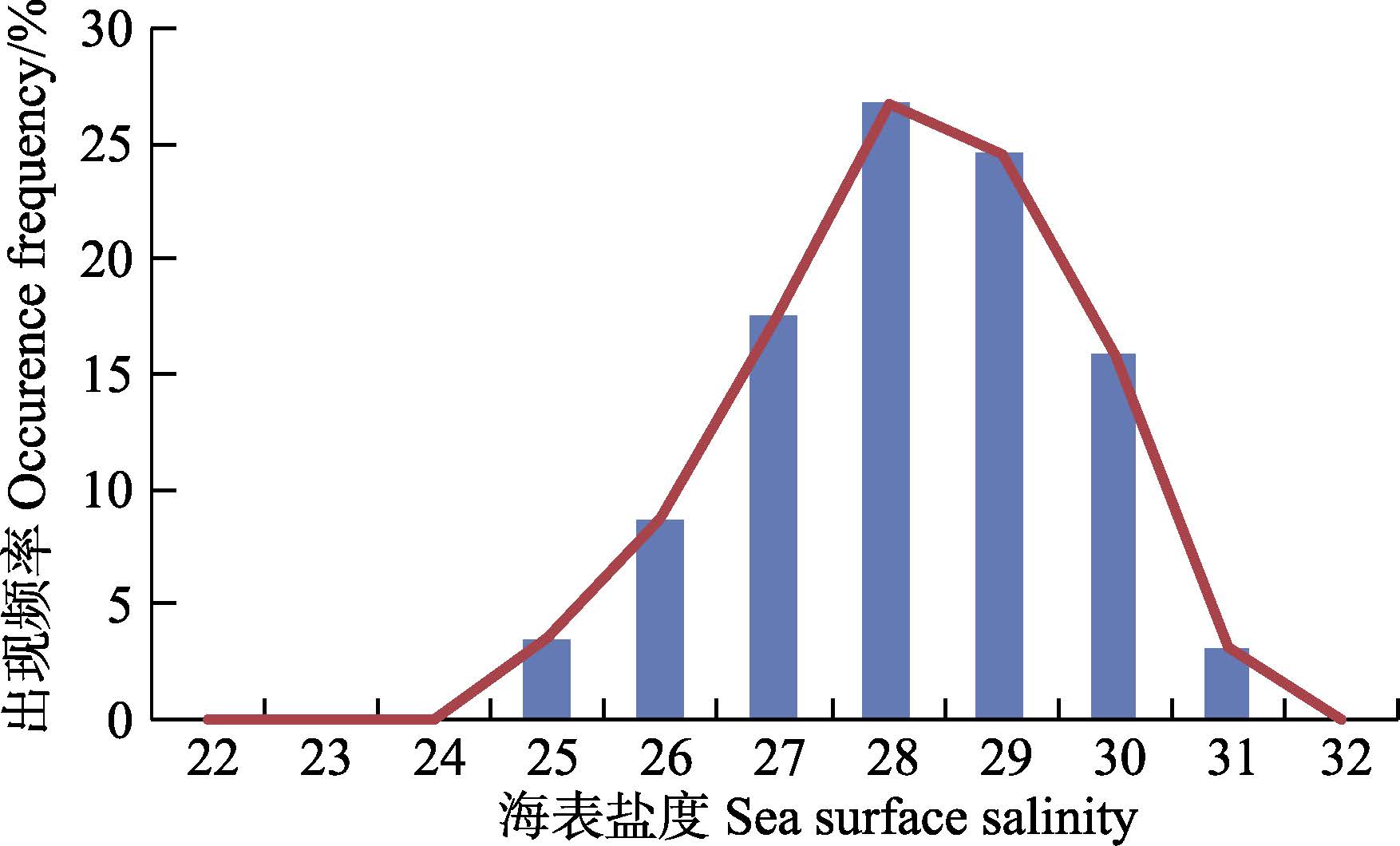
盐度适合度函数P(S)具体方法同1.2.3.1,以鳀鱼为例,根据原始数据得到的盐度适合度函数见图 4 。
|
图 4 鳀鱼的盐度适合度函数 Figure 4 Curve fitting of the function of suitable salinity for E. japonicus |
2013年,底层鱼类资源高密度区主要分布在长江口中部和南部,北部资源密度较低,并在长江口水域内散落着较小面积的低密度区域。2020年,底层鱼类资源密度增量普遍较小,在靠近崇明岛及其外侧水域,资源密度增量相对较高。2030年,底层鱼类资源密度增量增加,长江口北部和外侧资源密度增量较低,资源密度增量重心主要分布在崇明岛外侧水域,并以此为中心呈递减趋势。2050年,底层鱼类资源密度增量显著增加,长江口北部和外侧水域资源密度增量相对较低,崇明岛附近水域资源密度增量较高,并随着向外侧水域扩展呈递减趋势(图 5)。
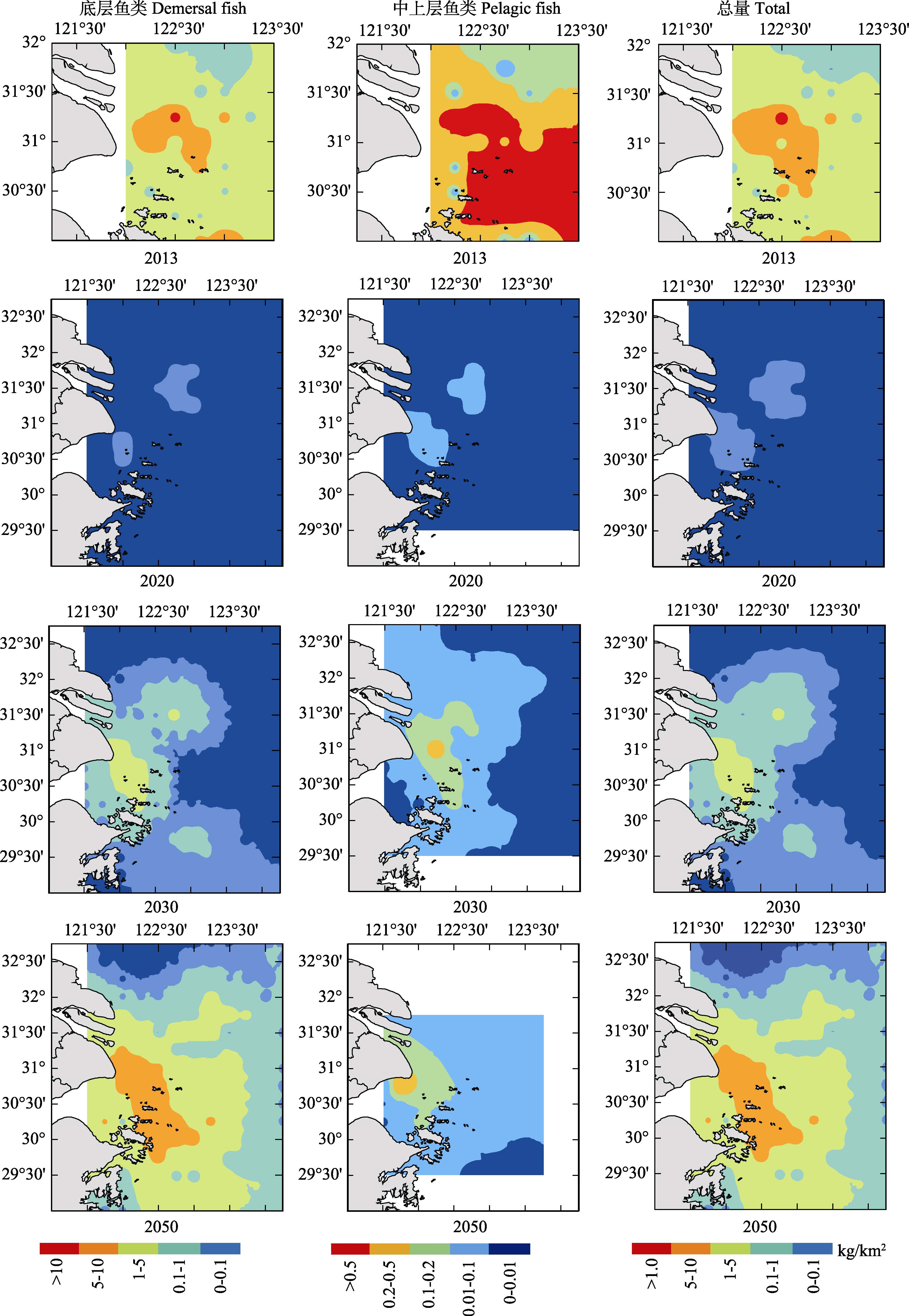
|
图 5 长江口鱼类资源密度分布(2013年)和RCP2.6情景下资源密度增量分布 Figure 5 The distribution of fish biomass in 2013 and projections of its increment in Yangtze River estuary in the RCP2.6 scenario |
2013年,中上层鱼类资源密度聚集区主要分布在长江口中部,在长江口北部和沿岸水域,资源密度较低。2020年,中上层鱼类资源密度增量较低,资源密度增量重心主要分布在崇明岛外侧水域。2030年,资源密度增量升高,但主要分布在沿岸水域,长江口外侧水域资源密度增量较低,在崇明岛外侧水域存在中上层鱼类的资源密度增量重心。2050年,资源密度增量进一步增大,资源密度增量重心进一步向沿岸集中,从沿岸向外侧水域,资源密度增量呈递减趋势,长江口南部水域资源密度增量相对较低(图 5)。
2.1.3 鱼类资源密度总增量分布2013年,鱼类资源密度聚集区主要分布在长江口中部,在长江口北部,鱼类资源密度较低。2020年,鱼类资源密度增量较低,资源密度增量重心主要分布在崇明岛外侧水域。2030年,资源密度增量升高,资源密度增量重心主要分布在崇明岛附近的沿岸水域,长江口外侧和北部水域资源密度增量较低。2050年,资源密度增量进一步增大,资源密度增量重心分布范围扩大,主要分布在长江口崇明岛的外侧水域,长江口北部资源密度增量较低(图 5)。
2.2 RCP6.0 情景下鱼类资源密度增量分布 2.2.1 底层鱼类资源密度增量分布2020年,底层鱼类资源密度增量较低,在长江口沿岸水域,资源密度增量相对较高。2030年,底层鱼类资源密度增量增加,长江口北部和外侧资源密度增量较低,资源密度增量重心主要分布在崇明岛外侧水域,并且以此为中心呈递减趋势,与RCP2.6情景下的分布一致,但资源密度增量重心分布范围扩大。2050年,底层鱼类资源密度增量显著增加,资源密度增量大于RCP2.6情景下资源密度增量,长江口北部和外侧水域资源密度增量相对较低,崇明岛附近水域资源密度增量较高,并向外侧水域扩展呈递减趋势,在崇明岛外侧存在一个资源密度增量重心(图 6)。
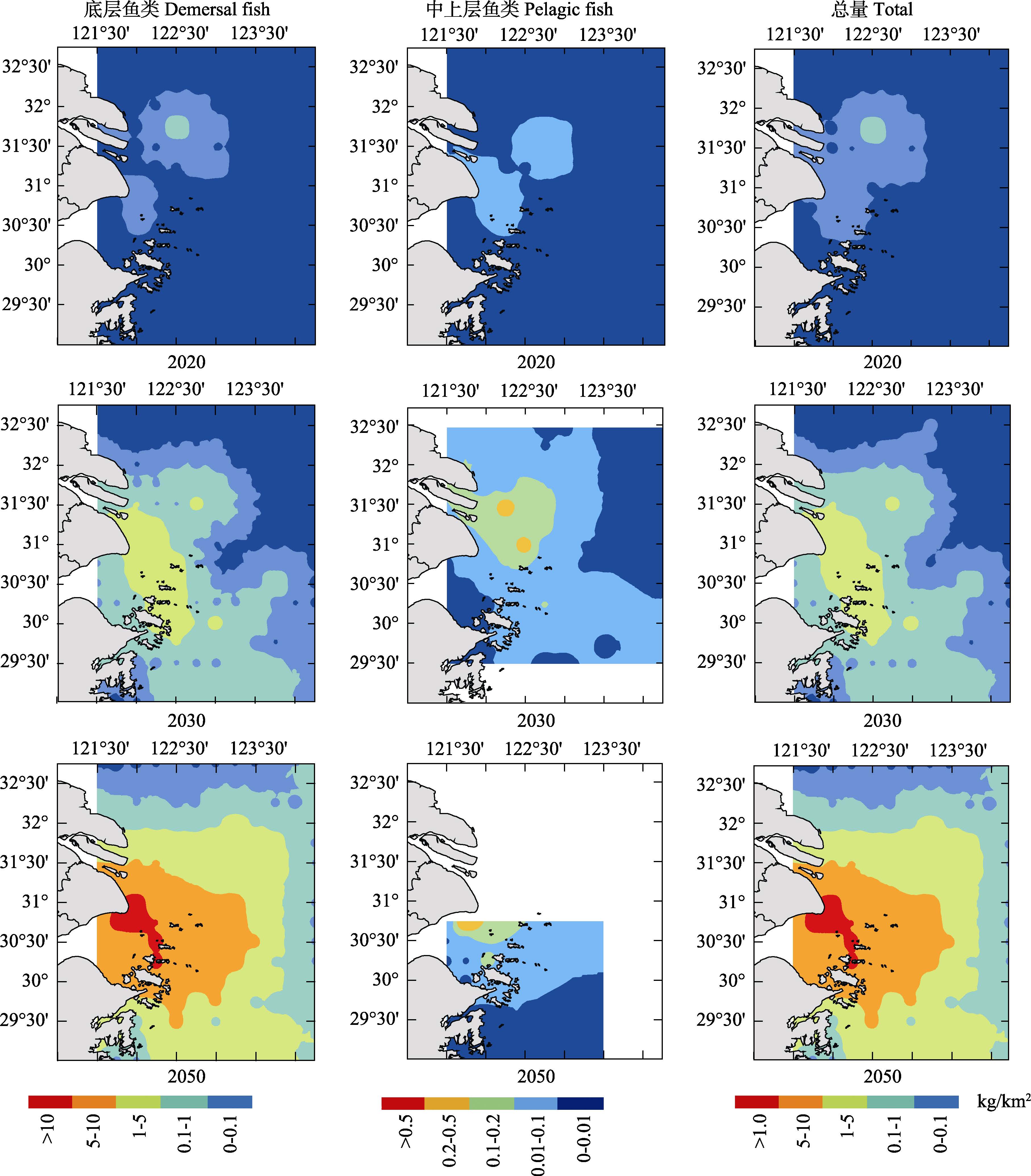
|
图 6 RCP6.0情景下长江口水域鱼类资源密度增量分布 Figure 6 Projections of the distribution of fish biomass increment in the Yangtze River estuary in the RCP6.0 scenario |
2020年,中上层鱼类资源密度增量较低,资源密度增量重心与RCP2.6情景分布一致,主要是在长江口沿岸水域。2030年,资源密度增量升高,主要分布在崇明岛沿岸水域,长江口外侧水域资源密度增量较低,在崇明岛南部沿岸水域存在中上层鱼类的低资源密度增量聚集区。2050年,资源密度增量进一步增大,主要分布在长江口北部,从北向南呈递减趋势,长江口南部资源密度增量最低,长江口北部资源密度增量为0(图 6)。
2.2.3 鱼类资源密度总增量分布2020年,鱼类资源密度增量较低,资源密度增量重心与RCP2.6情景分布一致,但范围有所扩大。2030年,资源密度增量升高,资源密度增量重心分布范围扩大,主要分布在崇明岛附近的沿岸水域,长江口外侧和北部资源密度增量较低。2050年,资源密度增量进一步增大,资源密度增量重心分布范围进一步扩大,主要分布在崇明岛的外侧水域,长江口北部资源密度增量较低(图 6)。
2.3 RCP8.5 情景下鱼类资源密度增量分布 2.3.1 底层鱼类资源密度增量分布2020年,底层鱼类资源密度增量显著降低,资源密度增量重心与RCP2.6、RCP6.0情景下分布一致,但范围有所扩大。2030年,底层鱼类资源密度增量增加,长江口北部和外侧资源密度增量较低,资源密度增量重心主要分布在崇明岛外侧水域,并且以此为中心呈递减趋势,与RCP2.6、RCP6.0情景下的分布一致,但资源密度增量重心分布范围扩大。2050年,底层鱼类资源密度增量显著增加,资源密度增量与RCP2.6、RCP6.0情景下的资源密度增量分布趋势一致,但资源密度增量显著高于RCP2.6、RCP6.0情景下的资源密度增量,长江口北部和外侧水域资源密度增量相对较低,在崇明岛外侧存在一个高密度增量聚集区(图 7)。
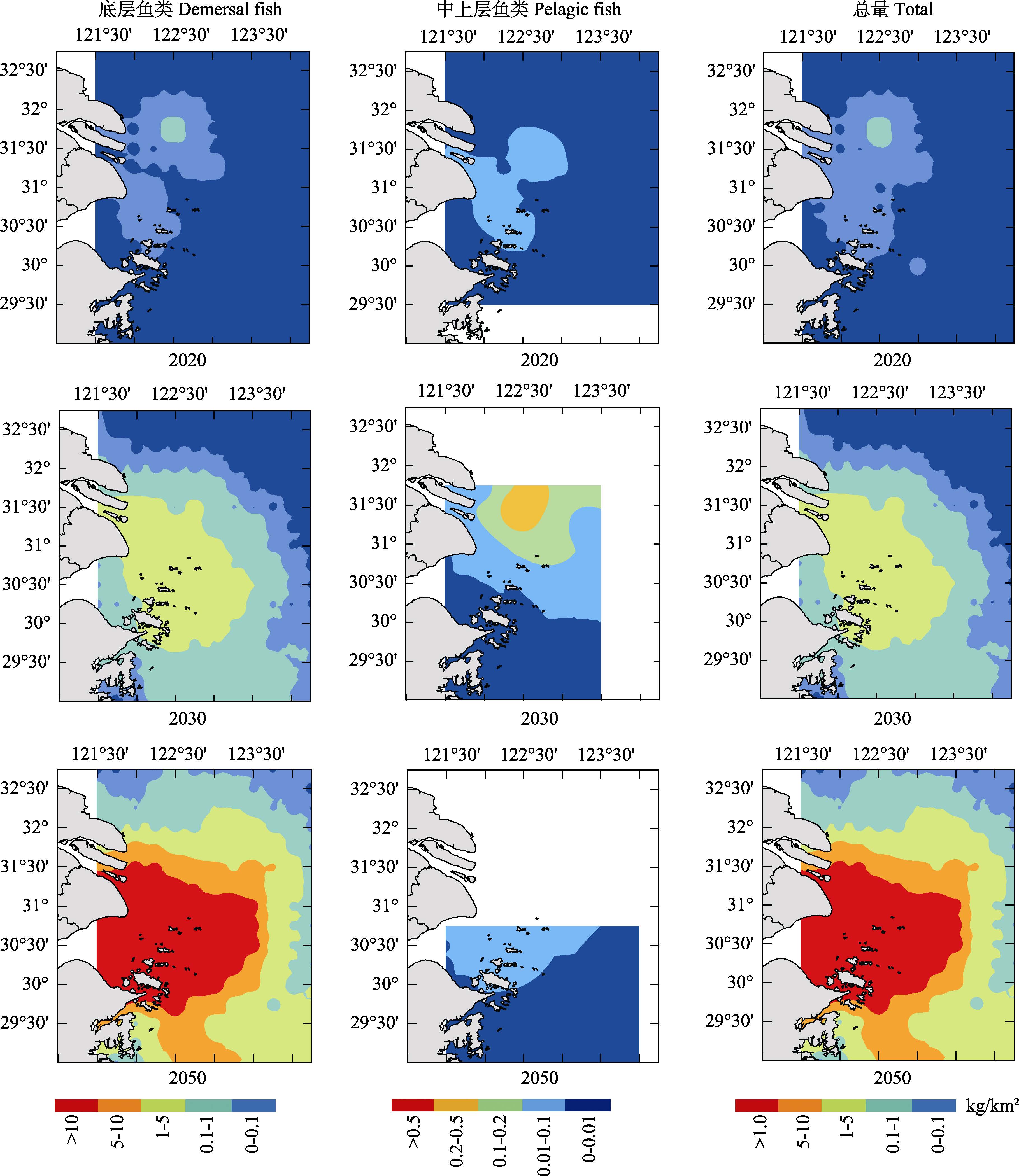
|
图 7 RCP8.5情景下长江口水域鱼类资源密度增量分布 Figure 7 Projections of the distribution of fish biomass increment in the Yangtze River estuary in the RCP8.5 scenario |
2020年,中上层鱼类资源密度较低,资源密度聚集区与RCP2.6、RCP6.0情景分布一致,但范围有所扩大。2030年,资源密度增量升高,从长江口北部到南部资源密度增量呈递增趋势,且崇明岛以北的外侧资源密度增量较高,存在高资源密度增量重心。2050年,资源密度增量较低,显著低于2030年水平,从北向南呈递减趋势,长江口南部资源密度增量最低,并且长江口北部资源密度增量为0(图 7)。
2.3.3 鱼类资源密度总增量分布2020年,鱼类资源密度增量较低,资源密度增量重心与RCP2.6、RCP6.0情景分布一致,但范围有所扩大。2030年,资源密度增量升高,资源密度增量重心进一步扩大,主要分布在崇明岛沿岸水域,长江口北部资源密度增量较低。2050年,资源密度增量进一步增大,资源密度增量重心分布区域进一步扩大,主要分布在崇明岛的外侧水域(图 7)。
3 讨论气候变化是决定生物分布和多样性的重要因子(Root et al,2003; Thomas et al,2004; Rosenzweig et al,2008)。在渔业生态系统中,气候变化引起的海水温度、盐度等变化影响了渔业生物的代谢率,这种影响可通过渔业生物本身的调节和适应引起其纬度(Perry et al,2005; Hiddink et al,2008; 苏杭等,2015)和深度(Dulvy et al,2008)的迁移,部分迁移能力和适应能力上受限制的种类会灭绝,而适应能力强的种类会形成入侵。其中,亚寒带海区、热带海区及陆架边缘海是种类灭绝的高发区,而北冰洋区、南大洋区是种类入侵的高发区(Thomas et al,2004; Cheung et al,2009)。Cheung等(2013b)以平均温度渔获量研究全球渔获量变化时发现,海洋暖化引起热带鱼类向温带迁移,温带鱼类向寒带迁移,导致热带平均温度渔获量降低,鱼类种类减少;在中国的闽南-台湾浅滩渔场和黄海水域也有类似发现(张学敏等,2005; 李忠炉等,2012)。长江口虽是区域性海域,但气候变化对其影响在鱼类资源密度增量分布上也有所体现。不同气候变化情景下,长江口水域鱼类资源密度增量在2020年、2030年主要分布在长江口北部,2050年则转移至崇明岛外侧水域。资源密度增量重心主要分布在崇明岛外侧水域,并且随着时间延长资源密度增量重心南移。在不考虑捕捞、污染等人类活动的影响条件下,不同气候变化情景下鱼类资源密度增量随着温室气体排放的增加而增加,RCP2.6<RCP6.0<RCP8.5,并且RCP8.5情景下鱼类资源密度增量重心的分布范围也最大,这与底层鱼类资源密度增量变化趋势一致。这种变化与底层鱼类和中上层鱼类在本研究中入选种类的适温性有较大关系。在本研究中,中上层鱼类资源密度较高的主要以暖水性种类为主,如鳀、黄鲫、凤鲚、赤鼻棱鳀、康氏小公鱼和鲐等;底层鱼类资源量相对较高的以暖温性种类为主,如小黄鱼、黄鱇、六丝钝尾鰕虎鱼等。暖温性和暖水性鱼类对气候变化的响应不同,暖水性鱼类受影响较大,可引起较大幅度迁移,因本研究区域范围受限,故在资源密度预测中相对较低。另外,本研究中的暖水性鱼类主要是一些小型的短生命周期的鱼类,Perry等(2005)研究证明,这一类型的鱼类在气候变化背景下比大型长生命周期的种类更容易引起迁移,并具有较高的脆弱性,其分布和资源量在气候变化背景下的波动更大。由上可见,气候变化在长江口鱼类资源密度分布重塑中发挥了重要作用,近海渔业资源的适应性管理中气候变化应作为一个重要因子考虑在内。
气候变化严重影响了渔业生物的分布、丰度及多样性,进而改变了生态系统的结构和功能(Cardinale et al,2006、2012; 徐炜等,2016)。气候变化引起的资源量和种类组成的重新分布,不同海域和不同种类的变化有所不同,通常为高纬度区渔获量增加,低纬度区渔获量减少(Cheung et al,2010)。动态生物气候分室模型有效地模拟了这种气候变化引起的鱼类资源密度波动,如随着水温的升高,根据模型模拟结果,崇明岛沿岸水域成为鱼类生长和繁殖更适宜的区域,鱼类资源密度增量相应增大;同时,长江口浮游植物和浮游动物生物量的变化也会引起部分鱼类分布范围的变化。其他研究也有类似发现,如Cheung等(2009)采用该模型发现,高纬度海区的生物多样性对气候变化比较敏感,与在实际观测中鱼类群落多样性变化趋势一致(Hiddink et al,2008),并且模型预测鱼类生理生态学效应,基本与实际效应值一 致(Pörtner et al,2007)。但本研究模型中涉及的鱼类主要是以中上层和底层种类为主,一些底栖性鱼类并未包含在内。Hughes等(2015)研究发现,气候变化对低氧区有一定的调节作用,而低氧对底层和底栖鱼类多样性及育幼场功能具有一定影响,这对长江口鱼类资源密度增量评估会产生一定影响。另外,鱼类资源密度分布与过度捕捞、栖息地破坏、污染等因素也密切相关,并且气候变化会与这些因素协同作用从而影响鱼类的适应性,在以后的研究中会进一步考虑气候变化与其他影响因子的协同作用。
| 王跃中, 孙典荣, 林昭进, 等. 捕捞压力和气候因素对黄渤海带鱼渔获量变化的影响. 中国水产科学 , 2012, 19 (6) : 1043-1050 | |
| 王跃中, 贾晓平, 林昭进, 等. 东海带鱼渔获量对捕捞压力和气候变动的响应. 水产学报 , 2011, 35 (12) : 1881-1889 | |
| 牛明香, 李显森, 赵庚星. 黄海中南部越冬鳀鱼空间分布及其与水温年际变化的关系. 应用生态学报 , 2012, 23 (2) : 552-558 | |
| 刘允芬. 气候变化对我国沿海渔业生产影响的评价. 中国农业气象 , 2000, 21 (4) : 1-5 | |
| 孙鹏飞, 戴芳群, 陈云龙, 等. 长江口及其邻近海域渔业资源结构的季节变化. 渔业科学进展 , 2015, 36 (6) : 8-16 | |
| 苏杭, 陈新军, 汪金涛. 海表水温变动对东、黄海鲐鱼栖息地分布的影响. 海洋学报 , 2015, 37 (6) : 88-96 | |
| 李玉尚, 陈亮. 清代黄渤海鲱鱼资源数量的变动——兼论气候变迁与海洋渔业的关系. 中国农史 , 2007, 26 (1) : 24-32 | |
| 李玉尚. 1600年之后黄海鲱的旺发及其生态影响. 中国农史 , 2010, 29 (2) : 10-21 | |
| 李忠炉, 金显仕, 张波, 等. 黄海大头鳕(Gadus macrocephalus)种群特征的年际变化. 海洋与湖沼 , 2012, 43 (5) : 924-931 | |
| 何发祥, 陈清花, 郑爱荣. 厄尔尼诺与浙江近海冬汛带鱼渔获量关系. 海洋湖沼通报 , 1995 (3) : 17-23 | |
| 何发祥, 洪华生, 陈刚. ENSO现象与台湾海峡西部海区中下层鱼类渔获量关系. 海洋湖沼通报 , 2003 (1) : 27-34 | |
| 张学敏, 商少平, 张彩云, 等. 闽南-台湾浅滩渔场海表温度对鲐鲹鱼类群聚资源年际变动的影响初探. 海洋通报 , 2005, 24 (4) : 91-96 | |
| 罗秉征, 薛频, 卢继武, 等. 三峡工程对河口及邻近海域渔业影响的初步探讨. 海洋科学集刊 , 1992, 33 : 341-352 | |
| 金显仕, 程济生, 邱盛尧, 等. 黄渤海渔业资源综合研究与评价. 北京: 海洋出版社, 2006 . | |
| 洪华生, 何发祥, 杨圣云. 厄尔尼诺现象和浙江近海鲐鲹鱼渔获量变化关系—长江口ENSO渔场学问题之二. 海洋湖沼通报 , 1997 (4) : 8-16 | |
| 徐炜, 马志远, 井新, 等. 生物多样性与生态系统多功能性:进展与展望. 生物多样性 , 2016, 24 (1) : 55-71 | |
| Bakun A. Global climate change and intensification of coastal ocean upwelling. Science , 1990, 247 (4939) : 198-201 DOI:10.1126/science.247.4939.198 | |
| Beaugrand G, Reid PC, Ibaňez F, et al. Reorganization of North Atlantic marine copepod biodiversity and climate. Science , 2002, 296 (5573) : 1692-1694 DOI:10.1126/science.1071329 | |
| Belkin IM. Rapid warming of large marine ecosystems. Prog Oceanogr , 2009, 81 (1-4) : 207-213 DOI:10.1016/j.pocean.2009.04.011 | |
| Berry PM, Dawson TP, Harrison PA, et al. Modelling potential impacts of climate change on the bioclimatic envelope of species in Britain and Ireland. Global Ecol Biogeogr , 2002, 11 (6) : 453-462 DOI:10.1111/geb.2002.11.issue-6 | |
| Cardinale BJ, Duffy JE, Gonzalez A, et al. Biodiversity loss and its impact on humanity. Nature , 2012, 486 (7401) : 59-67 DOI:10.1038/nature11148 | |
| Cardinale BJ, Srivastava DS, Duffy JE, et al. Effects of biodiversity on the functioning of trophic groups and ecosystems. Nature , 2006, 443 (7114) : 989-992 DOI:10.1038/nature05202 | |
| Cheung WWL, Lam VWY, Pauly D. Modelling present and climate-shifted distribution of marine fishes and invertebrates. 2008 . | |
| Cheung WWL, Lam VWY, Sarmiento JL, et al. Large-scale redistribution of maximum fisheries catch potential in the global ocean under climate change. Global Change Biol , 2010, 16 (1) : 24-35 DOI:10.1111/(ISSN)1365-2486 | |
| Cheung WWL, Sarmiento JL, Dunne J, et al. Shrinking of fishes exacerbates impacts of global ocean changes on marine ecosystems. Nat Clim change , 2013a (3) : 254-259 | |
| Cheung WWL, Watson R, Pauly D. Signature of ocean warming in global fisheries catch. Nature , 2013b, 497 (7449) : 365-368 DOI:10.1038/nature12156 | |
| Cheung WWL, Lam VWY, Sarmiento JL, et al. Projecting global marine biodiversity impacts under climate change scenarios. Fish Fish , 2009, 10 (3) : 235-251 DOI:10.1111/faf.2009.10.issue-3 | |
| Dulvy NK, Rogers SI, Jennings S, et al. Climate change and deepening of the North Sea fish assemblage: a biotic indicator of warming seas. J Appl Ecol , 2008, 45 (4) : 1029-1039 DOI:10.1111/jpe.2008.45.issue-4 | |
| Grandcourt EM, Cesar HS. The bio-economic impact of mass coral mortality on the coastal reef fisheries of the Seychelles. Fish Res , 2003, 60 (2) : 539-550 | |
| Hiddink JG, Hofstede RT. Climate induced increases in species richness of marine fishes. Global Change Biol , 2008, 14 : 453-460 DOI:10.1111/gcb.2008.14.issue-3 | |
| Hughes BB, Levey MD, Fountain MC, et al. Climate mediates hypoxic stress on fish diversity and nursery function at the land-sea interface. Proc Natl Acad Sci USA , 2015, 112 (26) : 8025-30 DOI:10.1073/pnas.1505815112 | |
| Keith DA, Akçakaya HR, Thuiller W, et al. Predicting extinction risks under climate change: coupling stochastic population models with dynamic bioclimatic habitat models. Biol Lett , 2008, 4 (5) : 560-563 DOI:10.1098/rsbl.2008.0049 | |
| Klyashtorin LB. Long-term climate change and main commercial fish production in the Atlantic and Pacific. Fish Res , 1998, 37 (1) : 115-125 | |
| MacKenzie BR, Köster FW. Fish production and climate: sprat in the Baltic Sea. Ecology , 2004, 85 (3) : 784-794 DOI:10.1890/02-0780 | |
| Nissling A, Larsson R, Vallin L, et al. Assessment of egg and larval viability in cod, Gadus morhua: methods and results from an experimental study. Fish Res , 1998, 38 (2) : 169-186 DOI:10.1016/S0165-7836(98)00121-0 | |
| Pearson RG, Dawson TP. Predicting the impacts of climate change on the distribution of species: are bioclimate envelope models useful. Global Ecol Biogeogr , 2003, 12 (5) : 361-371 DOI:10.1046/j.1466-822X.2003.00042.x | |
| Perry AL, Low PJ, Ellis JR, et al. Climate change and distribution shifts in marine fishes. Science , 2005, 308 (5730) : 1912-1915 DOI:10.1126/science.1111322 | |
| Peterson AT, Ortega-Huerta MA, Bartley J, et al. Future projections for Mexican faunas under global climate change scenarios. Nature , 2002, 416 (6881) : 626-629 DOI:10.1038/416626a | |
| Pörtner HO, Knust RC. Climate change affects marine fishes through the oxygen limitation of thermal tolerance. Science , 2007, 315 (5808) : 95-97 DOI:10.1126/science.1135471 | |
| Richardson AJ, Schoeman DS. Climate impact on plankton ecosystems in the Northeast Atlantic. Science , 2004, 305 (5690) : 1609-1612 DOI:10.1126/science.1100958 | |
| Root TL, Price JT, Hall KR, et al. Fingerprints of global warming on wild animals and plants. Nature , 2003, 421 (6918) : 57-60 DOI:10.1038/nature01333 | |
| Rosenzweig C, Karoly D, Vicarelli M, et al. Attributing physical and biological impacts to anthropogenic climate change. Nature , 2008, 453 (7193) : 353-357 DOI:10.1038/nature06937 | |
| Sheppard C. Predicted recurrences of mass coral mortality in the Indian Ocean. Nature , 2003, 425 (6955) : 294-297 DOI:10.1038/nature01987 | |
| Thomas CD, Cameron A, Green RE, et al. Extinction risk from climate change. Nature , 2004, 427 (6970) : 145-148 DOI:10.1038/nature02121 | |
| Whitfield AK, Paterson AW. Distribution patterns of fishes in a freshwater deprived Eastern Cape estuary with particular emphasis on the geographical headwater region. Water SA , 2003, 29 (1) : 61-67 |



