2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
锥状斯氏藻(Scrippsiella trochoidea)等有害甲藻是危害池塘养殖动物的主要藻类之一(Rolton et al,2014; 李兰涛等,2011; 陈全震等,2000; 肖咏之等,2001)。甲藻主要通过产生藻毒素毒害养殖动物或通过自身分解过程中大量消耗水中溶氧造成养殖动物缺氧死亡(Linares et al,2009; 张琪等,2012)。优良浮游微藻如绿藻(Chlorophyta sp.)、硅藻(Diatoms sp.)具有调控水体浮游植物群落结构、保持生态系统动态平衡、抑制有害微生物生长、营造适宜对虾生长的水体环境等作用(陆家昌,20101); 刘新宇,20142); 黄翔鹄,20133))。而微藻优势种由于数量和生物量占微藻总量比例较高,对整个虾池微藻群落结构及其水体环境的稳定起主要调控作用(彭聪聪等,2010)。因此,为了营造良好的养殖水体环境,需要去除其中的有害甲藻优势种,并且营造以绿藻、硅藻等优良微藻为优势种的微藻生物群落。
1) 陆家昌. 菌、藻改善水体环境提高凡纳滨对虾幼虾免疫指标和抗逆性的研究. 广东海洋大学硕士研究生学位论文,2010, 32-42
2) 刘新宇. 浮游微藻和细菌代谢抑制剂的筛选及其对虾池溶解态氮吸收的研究. 广东海洋大学硕士研究生学位论文,2014, 43-50
3) 黄翔鹄. 对虾高位池水环境养殖污染和浮游微藻生态调控机制研究. 东华大学博士研究生学位论文, 2013,128-142
相对于传统的物理、化学、生物化感作用等控藻方法(王志富,20141); Bao et al,2013; Accoroni et al,2015),溶藻细菌控藻具有高效、安全、无二次污染等优点,且有些溶藻细菌具有调控水质、降解有害物质、促进优良微藻生长等作用,因而受到广泛关注(陆家昌,2010 2); Jing et al,2014; Hare et al,2005)。目前,利用溶藻细菌调控甲藻的研究主要集中于溶藻细菌对甲藻的作用效果、作用机制等方面(Yang et al,2014),缺乏针对养殖池塘有害甲藻与优良微藻溶藻特性的共同研究。将溶藻细菌应用于养殖水体中,溶藻细菌在有效调控有害甲藻的同时,是否对水体中优良绿藻、硅藻产生影响,迄今为止尚未引起研究者的关注。
1) 王志富. 改性粘土治理藻华对典型底栖生物的影响研究. 中国科学院大学(海洋研究所)硕士研究生学位论文, 2014, 49-68
2) 陆家昌. 菌、藻改善水体环境提高凡纳滨对虾幼虾免疫指标和抗逆性的研究. 广东海洋大学硕士研究生学位论文,2010, 32-42
锥状斯氏藻是养殖池塘的常见有害甲藻优势种(梁伟峰等,2007; 张瑜斌等,2009)。蛋白核小球藻(Chlorella pyrenoidosa)、四尾栅藻(Scendesmus. quadricauda)、条纹小环藻(Cyclotella striata)在养殖池塘分布广,组成群落稳定,具有调控、营造适宜养殖对虾生存的水体环境等作用,进而成为虾池中优良绿藻和硅藻的代表种(刘孝竹等,2011; 赵巧玲,20103))。调查显示,低盐度水体环境中,裸甲藻(Gymnodinium aerucyinosum)等淡水甲藻、四尾栅藻、条纹小环藻等较易形成优势种;高盐度水体中,适应高盐度生长的锥状斯氏藻等甲藻、蛋白核小球藻、条纹小环藻较易形成优势种(陶晶晶,20134); 刘孝竹等,2011)。因此,本研究将锥状斯氏藻作为甲藻代表种,条纹小环藻作为硅藻代表种,蛋白核小球藻作为高盐度水体绿藻代表种,四尾栅藻作为低盐度水体绿藻代表种,从而探究溶藻细菌A3(下文简称菌株A3)对不同盐度水体优势藻种的溶藻特性,为养殖水体有害甲藻的防控提供初步的理论依据。
3) 赵巧玲. 植物浮床对精养池塘水质及浮游藻类群落结构的效应. 华中农业大学硕士研究生学位论文, 2010, 22-42
4) 陶晶晶. 滴水湖及其外围水体浮游植物群落结构与水质评价. 上海师范大学硕士研究生学位论文, 2013, 17-36
1 材料与方法 1.1 实验材料供试藻种为:锥状斯氏藻、条纹小环藻、蛋白核小球藻、四尾栅藻,由中国水产科学研究院南海水产研究所提供。藻种扩大培养基为f/2培养基(张俊,2010)5),光照强度约为70 μmol/m×s,光暗周期为12 h︰12 h,温度为23℃。
5) 张俊. 赤潮藻际细菌溶藻效应研究. 暨南大学硕士研究生学位论文, 2010, 21-75
实验菌株A3从锥状斯氏藻藻液中筛选获得(张俊,2010)5),由暨南大学水生生物研究所提供,经鉴定属于海杆菌属(Marinobacter)。
1.2 菌株A3生长曲线将菌株A3在无菌2216E液体培养基中28℃、250 r/min震荡培养48 h得到种子液,利用平板涂布计数法计算细菌浓度。自接种之时起,每6 h取样,平板涂布测定细菌浓度,实验周期为5 d。以菌浓度的对数为纵坐标、时间为横坐标,绘制生长曲线。
1.3 菌株A3溶藻实验 1.3.1 菌液的制备将菌株A3在2216E液体培养基中28℃、250 r/min培养48 h得到种子液,利用平板涂布计数法计算细菌浓度,用无菌f/2藻培养液将菌液稀释成浓度为108 CFU/ml的菌液。
1.3.2 无菌藻液制备取处于对数生长期的4种藻的藻液,按500 U/ml的浓度加入青霉素、庆大霉素、链霉素、卡那霉素混合抗生素进行无菌处理,处理时间为4-8 h(张俊,2010)5)。将处理后的藻液放入离心管中,1800 g/min离心5 min,去掉上清液,沉淀以无菌f/2培养液洗涤,反复洗涤3次,得到的沉淀藻液用无菌f/2培养液重悬后无菌培养。
1.3.3 菌株A3溶藻实验从表 1可以看出,设置4种微藻的单种培养、2种藻混合培养及3种藻混合培养的实验系统。实验在25 ml的三角瓶中进行,每个三角瓶装有9 ml的无菌藻液,将1 ml浓度为108 CFU/ml 菌株A3菌液分别加入各组藻液,加菌组菌株A3最终浓度为107 CFU/ml,对照组以等体积的无菌f/2培养液代替细菌菌液,各组均设3个平行。将藻液于23℃、光照强度70 μmol/m×s、光暗周期为12 h︰12 h条件下培养。每天定时摇动培养瓶2次,实验周期为10 d。自接种之时起,每48 h取样1次,藻样用5%甲醛固定(梁伟峰等,2007),显微镜下观察藻细胞形态并用血球计数板和浮游生物计数框计数(张俊,2010)5)。
|
|
表 1 实验设计 Table 1 Experimental design |
实验数据采用Excel 2010处理作图,实验结果以平均值±标准差(Mean±SD)表示。统计分析采用SPSS 19.0软件,利用单因素方差分析(One-way ANOVA)进行差异显著性分析,P<0.05为具有显著差异。
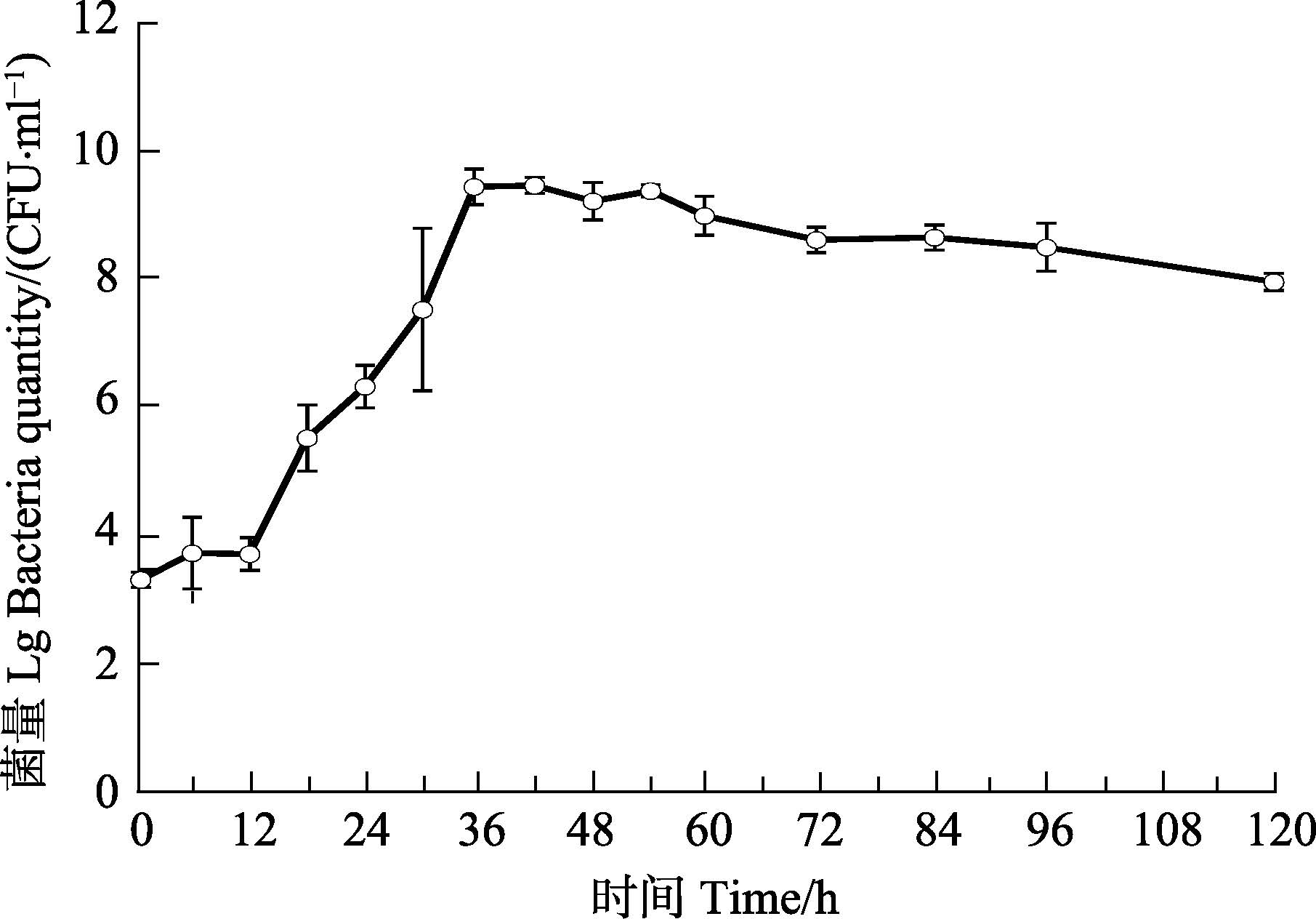
2 结果与分析 2.1 菌株A3生长曲线菌株A3的延滞期为0-12 h,12 h后进入指数生长期,36 h后进入稳定期,54 h后进入衰亡期(图 1)。
|
图 1 菌株A3的生长曲线 Figure 1 The growth curve of Strain A3 |
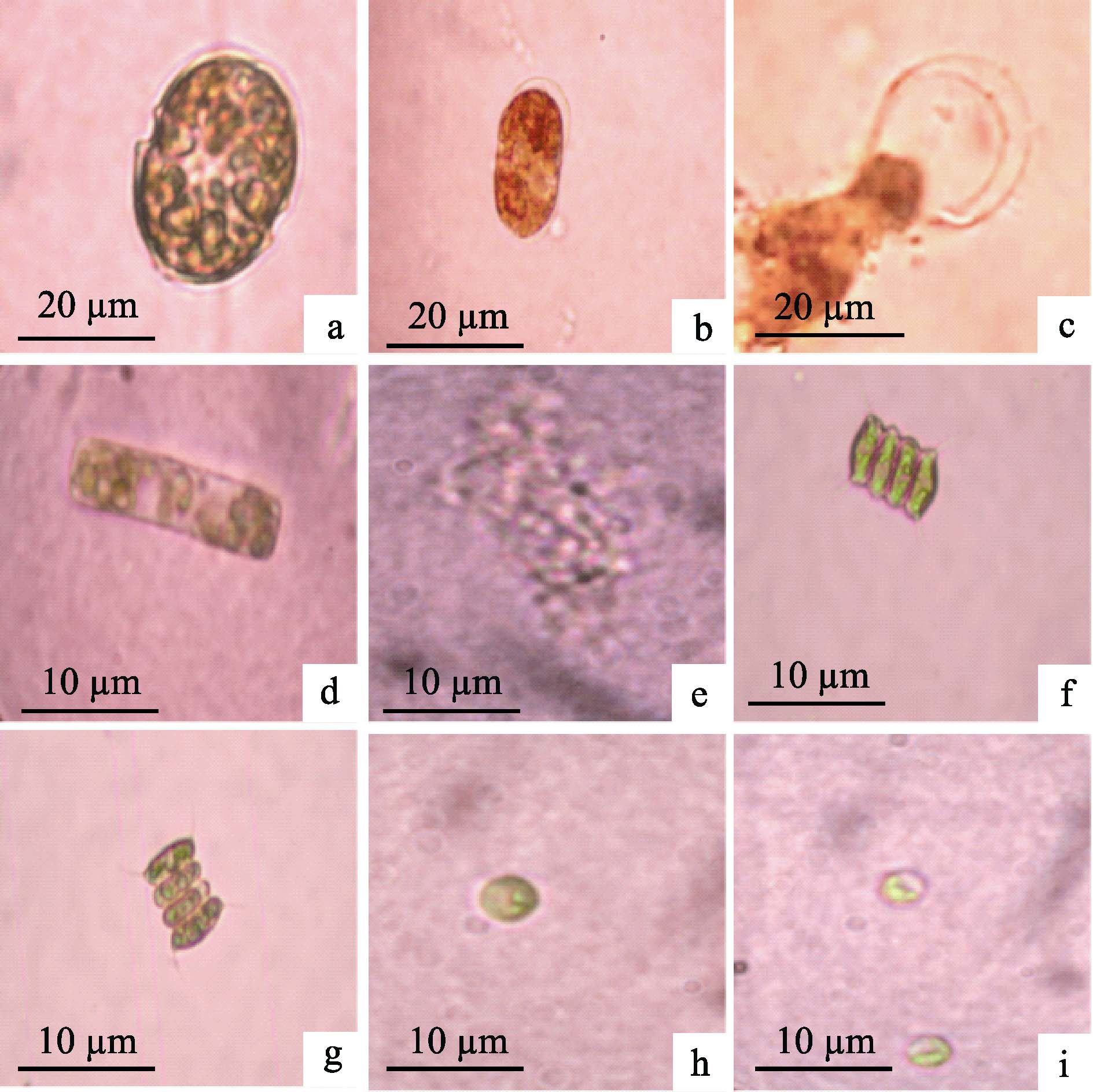
菌株A3作用于各微藻细胞共10 d,显微镜下观察可见,对照组各微藻细胞保持形态完整(图 2-a、图 2-d、图 2-f、图 2-h)。
|
图 2 菌株A3作用下的微藻细胞形态 Figure 2 Morphology of microalgal cells affected by Strain A3 a. 初始锥状斯氏藻细胞;b. 1 d时锥状斯氏藻;c. 5 d时锥状斯氏藻细胞;d. 初始条纹小环藻细胞;e. 8 d时条纹小环藻细胞;f. 初始四尾栅藻细胞;g. 10 d时四尾栅藻细胞;h. 初始蛋白核小球藻细胞;i. 10 d时蛋白核小球藻细胞 a. S. trochoidea at initial phase; b. S. trochoidea at the first day; c. S. trochoidea at the fifth day; d. C.striata at initial phase; e. C. striata at the eighth day; f. S. quadricauda at initial phase; g. S. quadricauda at the tenth day; h. C. pyrenoidosa at initial phase; i. C. pyrenoidosa at the tenth day |
而加菌组锥状斯氏藻细胞于第1天失去运动活性,细胞拉长变形(图 2-b),第5天细胞壁破裂溶解(图 2-c);加菌组条纹小环藻于第8天溶解(图 2-e);加菌组四尾栅藻和蛋白核小球藻细胞形态保持完整,菌株A3对其无溶藻效果(图 2-g-图 2-i)。
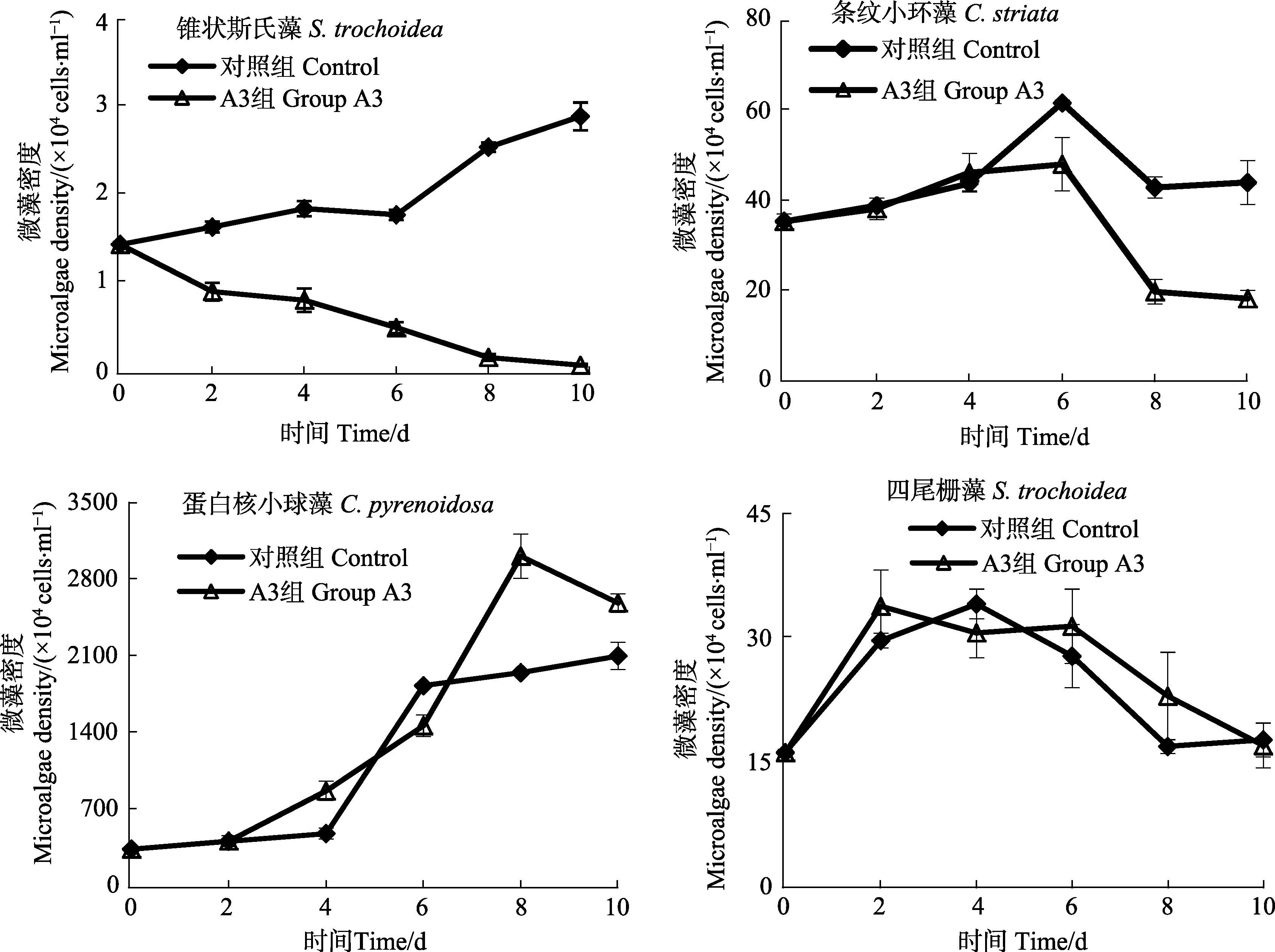
2.2.2 菌株A3对单种培养微藻生长的影响菌株A3对单种培养微藻生长的影响见图 3。从图 3可以看出,对照组锥状斯氏藻细胞密度总体呈升高的趋势,加菌组呈明显的下降趋势,第10天对照组与加菌组锥状斯氏藻细胞密度分别为2.90×104 cells/ml、7.07× 102 cells/ml,加菌组藻细胞密度显著低于对照组(P<0.05),说明菌株A3对锥状斯氏藻具有显著的溶藻作用;对照组与加菌组条纹小环藻细胞密度均呈先升高后降低的趋势,第10天对照组与加菌组条纹小环藻细胞密度分别为4.38×105 cells/ml、1.78×105 cells/ml,加菌组藻细胞密度显著低于对照组(P<0.05),但此时条纹小环藻细胞密度仍然较高,因此,菌株A3对条纹小环藻的溶藻作用较弱;对照组与加菌组蛋白核小球藻细胞密度均呈显著的升高趋势,第10天对照组与加菌组蛋白核小球藻细胞密度分别为2.09×107 cells/ml、2.58×107 cells/ml,因此,菌株A3对蛋白核小球藻无溶藻作用;实验期间,对照组与加菌组四尾栅藻细胞密度均呈先升高后降低的趋势,第10天对照组与加菌组藻细胞密度分别为1.75×104 cells/ml、1.68×104 cells/ml,说明对照组与加菌组藻细胞密度无显著差异(P>0.05),菌株A3对四尾栅藻生长无溶藻作用。结果显示,在4种微藻单独培养条件下,菌株A3对锥状斯氏藻具有显著的溶藻作用,对条纹小环藻生长具有较弱的溶藻作用,对蛋白核小球藻与四尾栅藻无溶藻作用。
|
图 3 菌株A3对单种培养的锥状斯氏藻、条纹小环藻、蛋白核小球藻、四尾栅藻生长的影响 Figure 3 Effects of A3 on the growth of S. trochoidea, C. striata,C. pyrenoidosa and S. quadricauda in the microalgal monoculture system |
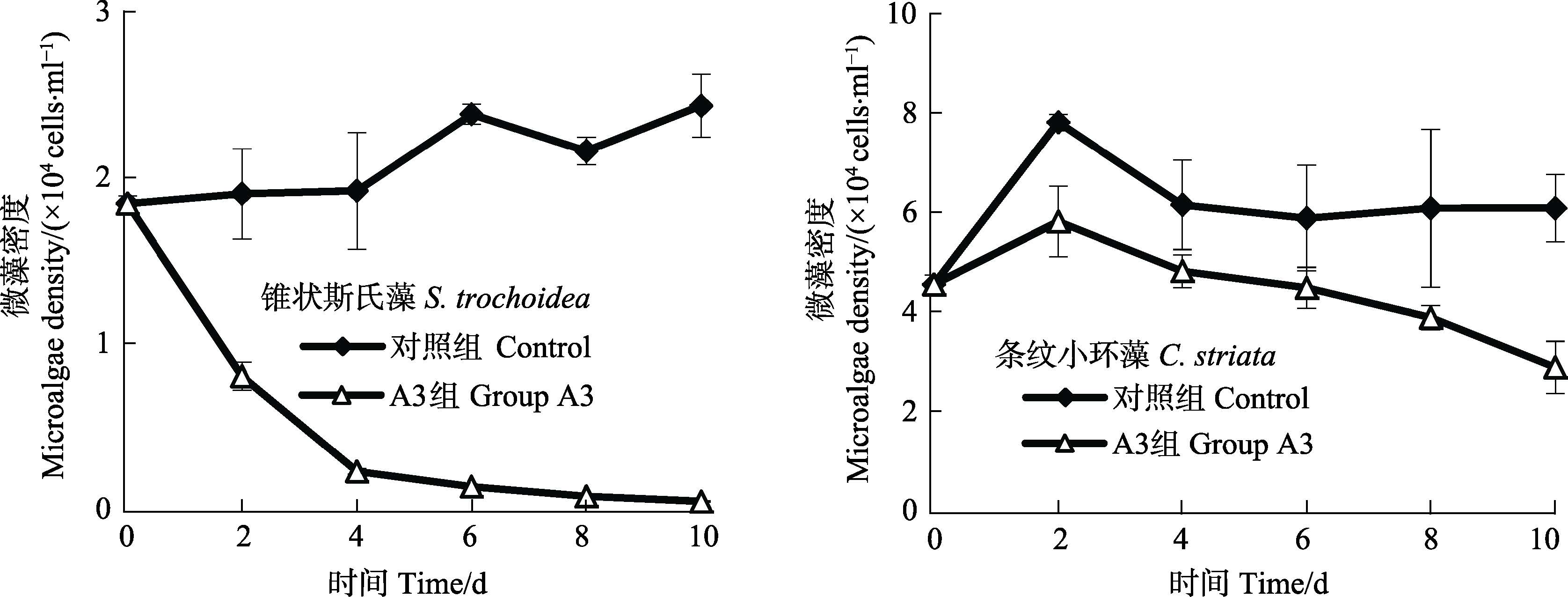
菌株A3对锥状斯氏藻与条纹小环藻混合培养生长的影响见图 4。从图 4可以看出,混合藻液中,对照组锥状斯氏藻细胞密度呈平缓的上升趋势,加菌组细胞密度呈显著的下降趋势,实验第10天时,对照组与加菌组藻细胞密度分别为2.43×104 cells/ml、3.93×102 cells/ml,加菌组藻细胞密度显著低于对照组(P<0.05),且加菌组混合藻液中锥状斯氏藻细胞密度很低,因此,菌株A3对锥状斯氏藻具有显著的溶藻作用;对照组与加菌组条纹小环藻细胞密度均呈先升高后下降的趋势,第10天时,对照组与加菌组条纹小环藻细胞密度分别为6.07×104 cells/ml、2.87×104 cells/ml,加菌组藻细胞密度显著低于对照组(P<0.05),此时,加菌组混合藻液中条纹小环藻细胞密度仍然较高,因此,菌株A3对条纹小环藻的溶藻作用较弱。结果表明,在锥状斯氏藻与条纹小环藻混合培养条件下,菌株A3对锥状斯氏藻生长具有显著的溶藻作用,对条纹小环藻生长的溶藻作用较弱。
|
图 4 菌株A3对混合培养条件下的锥状斯氏藻与条纹小环藻藻生长的影响 Figure 4 Effects of A3 on the growth of S. trochoidea and C. striata in the microalgal mix-culture system |
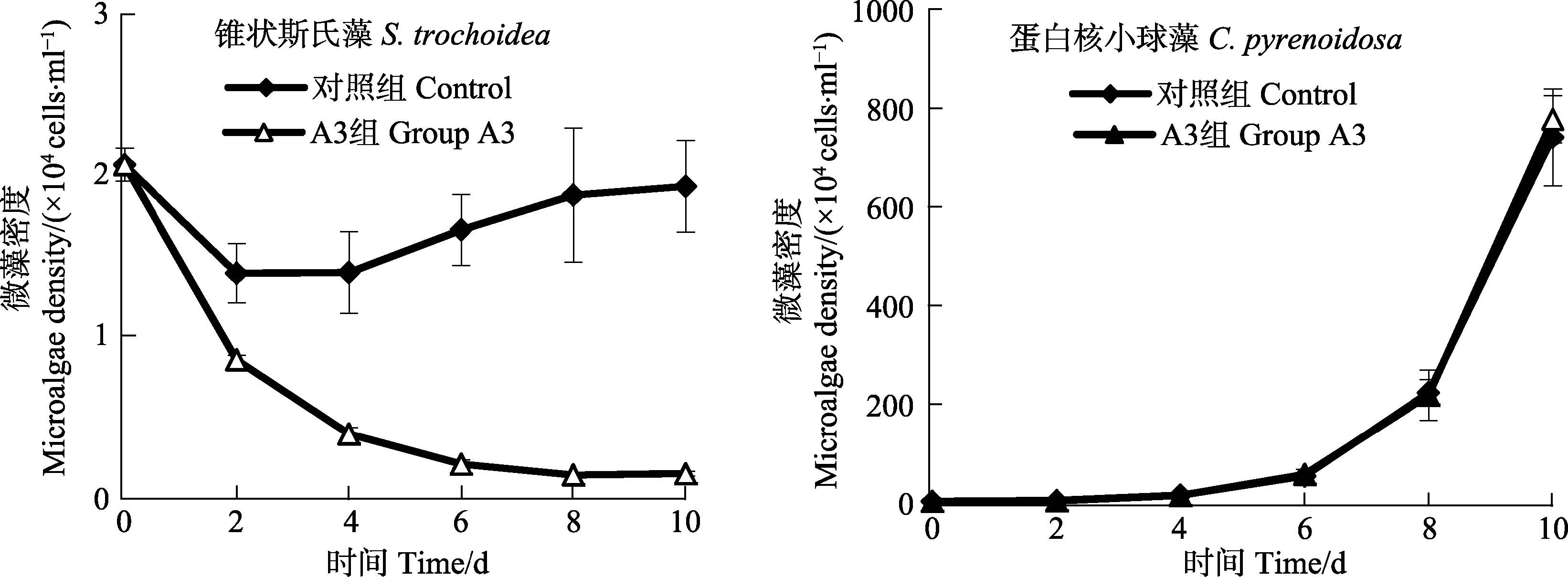
菌株A3对锥状斯氏藻与蛋白核小球藻混合培养条件下生长的影响见图 5。从图 5可以看出,对照组锥状斯氏藻细胞密度总体呈上升趋势,加菌组细胞密度呈显著的下降趋势,在实验第10天时,对照组与加菌组藻细胞密度分别为1.92×104 cells/ml、1.36×103 cells/ml,加菌组藻细胞密度显著低于对照组(P<0.05),且加菌组混合藻液中锥状斯氏藻细胞密度较低,因此,菌株A3对锥状斯氏藻具有显著的溶藻作用;实验期间,对照组与加菌组蛋白核小球藻细胞密度均呈显著的上升趋势,第10天加菌组与对照组蛋白核小球藻细胞密度分别7.40×106 cells/ml、7.77×106 cells/ml,因此,菌株A3对蛋白核小球藻生长无溶藻作用。结果显示,在锥状斯氏藻与蛋白核小球藻混合培养条件下,菌株A3可以有效溶解锥状斯氏藻,对蛋白核小球藻无溶藻作用。
|
图 5 菌株A3对混合培养条件下的锥状斯氏藻与蛋白核小球藻生长的影响 Figure 5 Effects of A3 on the growth of S.trochoidea and C. pyrenoidosa in the microalgal mix-culture system |
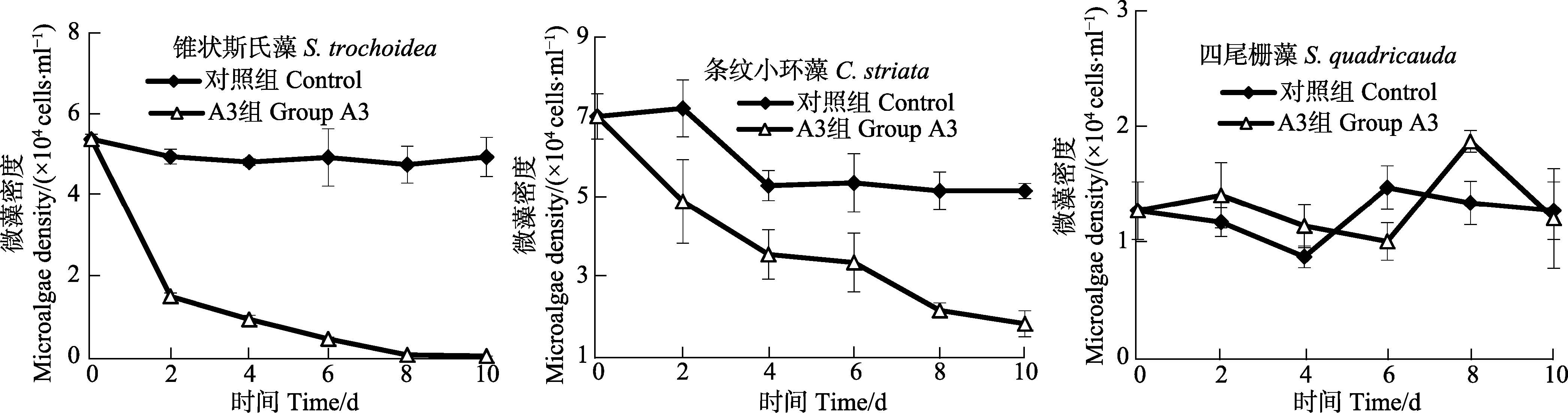
菌株A3对锥状斯氏藻、条纹小环藻、四尾栅藻混合培养生长的影响见图 6。从图 6可以看出,对照组锥状斯氏藻细胞密度呈平稳的波动趋势,加菌组锥状斯氏藻细胞密度呈明显的下降趋势,第10天时,对照组与加菌组藻细胞密度分别为4.92×104 cells/ml、31.00 cells/ml,加菌组锥状斯氏藻细胞密度显著低于对照组,表明菌株A3对锥状斯氏藻生长具有显著的溶藻 作用;对照组与加菌组条纹小环藻细胞密度均呈下降趋势,对照组实验4 d后呈平稳的波动趋势,第10天时,对照组与加菌组条纹小环藻细胞密度分别为5.13×104 cells/ml、1.80×104 cells/ml,虽然此时加菌组条纹小环藻细胞密度显著低于对照组(P<0.05),但加菌组条纹小环藻细胞密度仍然较高,因此,菌株A3对条纹小环藻溶藻作用较弱;实验期间,对照组与加菌组四尾栅藻细胞密度呈波动趋势,第10天对照组与加菌组藻细胞密度分别为1.27×104 cells/ml、1.20×104 cells/ml,对照组与加菌组藻细胞密度差异不显著(P>0.05),因此,菌株A3对四尾栅藻无溶藻作用。结果显示,菌株A3在锥状斯氏藻-条纹小环藻-四尾栅藻混合藻液中,可以有效溶解锥状斯氏藻,对条纹小环藻生长溶解作用较弱,对四尾栅藻无溶藻作用。
|
图 6 菌株A3对混合培养条件下的锥状斯氏藻、条纹小环藻、四尾栅藻的生长的影响 Figure 6 Effects of A3 on the growth of S. trochoidea,C. striata and S. quadricauda in microalgal mix-culture system |
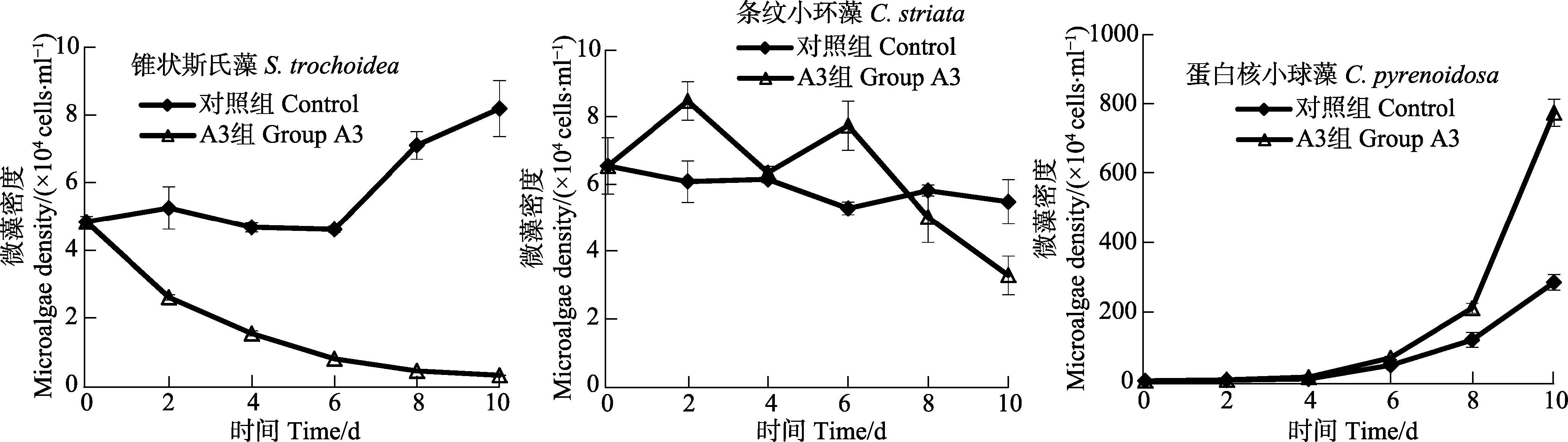
菌株A3对锥状斯氏藻、条纹小环藻、蛋白核小球藻混合培养生长的影响见图 7。从图 7可以看出,对照组锥状斯氏藻细胞密度实验前6 d呈平稳的波动趋势,之后呈明显的上升趋势,加菌组锥状斯氏藻细胞密度呈明显的下降趋势。第10天时,对照组与加菌组锥状斯氏藻细胞密度分别为8.17×104 cells/ml、2.83×103 cells/ml,加菌组藻细胞密度显著低于对照组(P<0.05),此时,加菌组混合藻液中锥状斯氏藻细胞密度较低,因此,菌株A3对锥状斯氏藻具有显著的溶藻作用;对照组条纹小环藻细胞密度呈平缓的波动趋势,加菌组条纹小环藻细胞密度实验前6 d呈波动趋势,6 d后呈显著的下降趋势,第10 天对照组与加菌组藻细胞密度分别为5.47×104 cells/ml、3.27×104 cells/ml,虽然加菌组藻细胞密度显著低于对照组(P<0.05),但加菌组混合藻液中条纹小环藻细胞密度仍然较高,因此,菌株A3对条纹小环藻的溶藻作用较弱;对照组与加菌组蛋白核小球藻细胞密度均呈显著的上升趋势,第10天对照组与加菌组藻细胞密度分别为2.85×106 cells/ml、7.74×106 cells/ml,因此,菌株A3对蛋白核小球藻无溶藻作用。结果显示,菌株A3在锥状斯氏藻、条纹小环藻、蛋白核小球藻混合藻液中,可以有效溶解锥状斯氏藻,对条纹小环藻生长具有较弱的溶藻作用,对蛋白核小球藻生长无溶藻作用。
|
图 7 菌株A3对混合培养条件下的锥状斯氏藻、条纹小环藻、蛋白核小球藻生长的影响 Figure 7 Effects of A3 on the growth of S. trochoidea,C. striata and C. pyrenoidosa in the microalgal mix-culture system |
锥状斯氏藻等有害甲藻在对虾养殖池塘中频繁出现,给对虾的养殖造成潜在威胁(张瑜斌等,2009; Alonso-Rodriguez et al,2003)。目前,利用溶藻菌防控甲藻的相关研究多有报道。如史荣君等(2013)从溶藻效果方面探究了菌株N3对锥状斯氏藻发挥溶藻作用的用菌浓度。Su等(2011)从溶藻机制方面探究发现9种溶藻菌:交替假单胞菌(Pseudoalteromonas sp.)(strain SP31与SP44)、交替单胞菌(Alteromonas sp.)(strain DH12与DH46)、海源菌(Idiomarina sp.)(strain SP96)、弧菌(Vibrio)(strain DH47与DH51)、盐单胞菌(Halomonas sp.)(strain DH74与DH77)都通过分泌溶藻物质间接溶解塔玛亚力山大藻(Alexa ndrium tamarense)。Park等(2015)探究了多环旋沟藻(Cochlodinium polykrikoides)水华暴发之前、暴发期间、暴发之后水体中菌群优势种与微藻优势种演替间的相互影响。由此可见,目前国内外利用溶藻菌防控甲藻的研究主要集中于溶藻效果、溶藻机制、藻菌间的相互关系等方面,而利用溶藻菌防控有害甲藻对优良微藻影响的研究则少见报道(Chen et al,2014; Jauzein et al,2015)。有研究表明,水体中的优良浮游微藻具有调控水质、促进养殖动物健康生长等作用(陆家昌,2010 1); 黄翔鹄,20132); 刘新宇,20143))。因此,在利用溶藻菌防控有害甲藻时,同时开展其对优良微藻影响的探究,对于水体有害甲藻调控及优良微藻的保护尤显重要。
溶藻菌具有溶藻专一性,大部分溶藻菌只能溶解1种或1类藻(Hare et al,2005)。Guan等(2014)开展了溶藻菌LP-10对铜绿微囊藻(Microcystis aeruginosa)、普通小球藻(Chlorella vulgaris)、三角褐指藻(Phaeodactylum tricornutum)、日本星杆藻(Asterionella japonica)、链状亚历山大藻(Alexandr ium minutum)、微小亚力山大藻(Alexandrium minutum)、海洋原甲藻(Prorocentrum micans)等24种蓝藻、绿藻、硅藻、甲藻溶藻特性研究,发现LP-10仅对链状亚历山大藻、塔玛亚力山大藻、海洋原甲藻、微小亚力山大藻、日本星杆藻5种藻产生有效的溶藻效果,且这5种藻中有4种藻属于甲藻种类。Pokrzywinski等(2012)研究发现,溶藻菌IRI-160分泌的溶藻物质IRI-160AA对甲藻门的卡尔藻(Karlodinium veneficum)、短凯伦藻(Karenia brevis)、条纹环沟藻(Gyrodinium instriatum)等具有明显的溶藻作用,而其对绿藻门的杜氏盐藻(Dunaliella tertiolecta)、隐藻门的红胞藻(Rhodomonas sp.)以及硅藻门的假微型海链藻(Thalassiosira pseudonana)无溶藻作用或者作用不显著。上述研究中的几种溶藻菌主要对甲藻类微藻具有溶藻作用,对其他种类微藻无影响或影响不显著,这种溶藻特性可能由不同藻类的结构组成不同所决定,目前缺乏相关方面的研究。本研究表明,无论在单种藻及混合藻实验中,菌株A3都能够将甲藻类锥状斯氏藻有效溶解,而对其他3种藻无溶藻效果或效果不甚显著。由于溶藻菌具有溶藻专一性,推测将菌株A3应用于养殖水体中,可以有效调控锥状斯氏藻等有害甲藻,而对绿藻等优良微藻无危害或者危害作用较弱。另外,在本研究的混合藻实验中,对照组中藻间的竞争作用不能抑制锥状斯氏藻生长,因此与藻间的竞争作用相比较,溶藻菌A3对锥状斯氏藻的防控更为有效。
本研究表明,向微藻群落中投放有益菌可以调控微藻群落结构。如Tilney等(2014)研究发现,在条纹环沟藻水华中投放溶藻细菌IRI-160的提取物IRI- 160AA,可以将群落中甲藻浓度降低为最初浓度的12%,而硅藻的浓度相对最初浓度升高110%。本研究将菌株A3加入几种藻的混合藻液中,结果显示,藻液向着以绿藻为主要优势种、硅藻为次要优势种的方向演替。米振琴等(1999)研究显示,在对虾养殖水体中,以绿藻为主的水体藻种类较多,而以硅藻为主的水体藻类单一,没有以绿藻为主的水体生态系统稳定,且以硅藻为主的水体对虾较易产生应激反应,因此,菌株A3对锥状斯氏藻的有效调控以及对条纹小环藻适当调控,有助于形成适宜对虾生长的水体环境。Cao等(2014)同样研究发现,向养殖虾池中投放芽孢杆菌(Bacillus sp.)与光合细菌复合菌能够调控虾池微藻,使得虾池中的绿藻(主要是蛋白核小球藻)数量可以达到95%,同时能够提高对虾产量。
综合以上研究,推测溶藻菌A3能够用于调控虾池水生生态系统中以甲藻为主要优势种的微藻群落结构。但是,由于不同的溶藻菌具有不同的特性,1株溶藻菌可能对某类有害微藻中绝大多数微藻具有溶藻作用,而对该类微藻中的某种微藻无溶藻作用。因此,针对虾池中暴发的不同种类甲藻水华,在使用株菌A3进行防控时仍然需要考虑该菌的溶藻特性。
| 史荣君, 黄洪辉, 齐占会, 等. 海洋细菌N3对几种赤潮藻的溶藻效应. 环境科学 , 2013, 34 (5) : 1922-1929 | |
| 李兰涛, 叶健欣, 叶宁, 等. 利玛原甲藻对湛江港多种鱼虾贝的毒性研究. 水产科学 , 2011, 30 (9) : 547-550 | |
| 刘孝竹, 曹煜成, 李卓佳, 等. 高位虾池养殖后期浮游微藻群落结构特征. 渔业科学进展 , 2011, 32 (3) : 84-91 | |
| 米振琴, 谢骏, 潘德博, 等. 精养虾池浮游植物、理化因子与虾病的关系. 上海水产大学学报 , 1999, 8 (4) : 304-308 | |
| 肖咏之, 齐雨藻, 王朝晖, 等. 大亚湾海域锥状斯氏藻赤潮及其与孢囊的关系. 海洋科学 , 2001, 25 (9) : 50-54 | |
| 张琪, 缪荣丽, 刘国祥, 等. 淡水甲藻水华研究综述. 水生生物学报 , 2012, 36 (2) : 352-360 | |
| 张瑜斌, 龚玉艳, 陈长平, 等. 高位虾池养殖过程浮游植物群落的演替. 生态学杂志 , 2009, 8 (12) : 2532-2540 | |
| 陈全震, 何德华. 甲藻赤潮对养鲍业的危害及其防治探讨. 水产学报 , 2000, 24 (2) : 151-155 | |
| 梁伟峰, 李卓佳, 陈素文, 等. 对虾养殖池塘微藻群落结构的调查与分析. 南方水产 , 2007, 3 (5) : 33-39 | |
| 彭聪聪, 李卓佳, 曹煜成, 等. 虾池浮游微藻与养殖水环境调控的研究概况. 南方水产 , 2010, 6 (5) : 74-80 | |
| Accoroni S, Percopo I, Cerino F, et al. Allelopathic interactions between the HAB dinoflagellate . Ostreopsis cf ovata and macroalgae. Harmful Algae , 2015, 49 : 147-155 | |
| Alonso-Rodriguez R, Páez-Osuna F. Nutrients, phytoplankton and harmful algal blooms in shrimp ponds: a review with special reference to the situation in the Gulf of California. Aquaculture , 2003, 219 (1-4) : 317-336 | |
| Bao VWW, Leung KMY, Lui GCS, et al. Acute and chronic toxicities of Irgarol alone and in combination with copper to the marine copepod Tigriopus japonicas. Chemosphere , 2013, 90 (3) : 1140-1148 | |
| Cao YC, Wen GL, Li ZJ, et al. Effects of dominant microalgae species and bacterial quantity on shrimp production in the final culture season. J Appl Phycol , 2014, 26 (4) : 1749-1757 | |
| Chen ZR, Zhang JY, Lei XQ, et al. Influence of plaque-forming bacterium, Rhodobacteraceae sp. on the growth of Chlorella vulgaris. Bioresource Technol , 2014, 169 (1) : 784-788 | |
| Guan CW, Guo XY, Cai GJ, et al. Novel algicidal evidence of a bacterium Bacillus sp. LP-10 killing Phaeocystis globosa, a harmful algal bloom causing species. Biol Control , 2014, 76 (3) : 79-86 | |
| Hare CE, Demir E, Coyne KJ, et al. A bacterium that inhibits the growth of Pfiesteria piscicida and other dinoflagellates. Harmful Algae , 2005, 4 (2) : 221-234 | |
| Jauzein C, Evans AN, Erdner DL. The impact of associated bacteria on morphology and physiology of the dinoflagellate Alexandrium tamarense. Erdner Harmful Algae , 2015, 50 : 65-75 | |
| Jing WW, Sui GD, Liu SX. Characteristics of a microcystin-LR biodegrading bacterial isolate: Ochrobactrum sp. FDT5. Bull Environ Contam Toxicol , 2014, 92 (1) : 119-122 | |
| Linares JP, Ochoa JL, Martínez AG. Retention and tissue damage of PSP and NSP toxins in shrimp: Is cultured shrimp a potential vector of toxins to human population. Toxicon , 2009, 539 (2) : 185-195 | |
| Park BS, Kim JH, Kim JH, et al. Dynamics of bacterial community structure during blooms of Cochlodinium polykrikoides (Gymnodiniales, Dinophyceae) in Korean coastal waters. Harmful Algae , 2015, 48 : 44-54 | |
| Pokrzywinski KL, Place AR, Warner ME, et al. Investigation of the algicidal exudate produced by Shewanella sp. IRI-160 and its effect on dinoflagellates. Harmful Algae , 2012, 19 : 23-29 | |
| Rolton A, Vignier J, Soudant P, et al. Effects of the red tide dinoflagellate, Karenia brevis, on early development of the eastern oyster Crassostrea virginica and northern quahog Mercenaria mercenaria. Aquatic Toxicol , 2014, 155 (4) : 199-206 | |
| Su JQ, Yang XR, Zhou YY, et al. Marine bacteria antagonistic to the harmful algal bloom species Alexandrium tamarense (Dinophyceae). Biol Control , 2011, 56 (2) : 132-138 | |
| Tilney CL, Pokrzywinski KL, Coyne KJ, et al. Effects of a bacterial algicide, IRI-160AA, on dinoflagellates and the microbial community in microcosm experiments. Harmful Algae , 2014, 39 : 210-222 | |
| Yang XR, Li XY, Zhou YY, et al. Novel insights into the algicidal bacterium DH77-1 killing the toxic dinoflagellate Alexandrium tamarense . Sci Total Environ , 2014, 482-483 : 116-124 |



