2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 山东省渔业技术推广站 济南 250013
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao, 266071;
3. Shandong Province Fisheries Technology Extension Station, Jinan 250013
孕激素脂联素受体(PAQRs)是具有7次跨膜结构的蛋白,广泛存在于古生菌、真细菌、线虫和哺乳动物(Lyons et al, 2004; Tang et al, 2005)。PAQRs家族成员在不同物种具有高度保守性,表明此基因家族在进化过程中具有重要作用(Tang et al, 2005)。关于PAQRs家族成员的膜拓扑结构、亚细胞定位、配基结合和信号传导机制一直存在争议。膜孕激素受体为PAQRs家族一个分支包含膜孕激素受体α (mPRα)、膜孕激素受体β (mPRβ)和膜孕激素受体γ (mPRγ)等,该受体家族在介导孕激素促进鱼类和两栖类卵母细胞成熟、哺乳动物分娩等过程发挥重要作用(Zhu et al, 2003; Karteris et al, 2006; Josefsberg Ben-Yehoshua et al, 2007)。在鲆鲽类中,首次发现了牙鲆(Paralichthys olivaceus)和半滑舌鳎(Cynoglossus semilaevis)新型膜孕激素受体基因(mPR-Like, mPRL),并分析该基因的分子特征(史宝, 20101); 柳学周等, 2015);根据半滑舌鳎基因组测序结果(Chen et al, 2014),其mPRL基因定位在18号染色体上。
1) Shi B. Study on the molecular mechanisms of reproductive endocrinology inParalichthys olivaceus and Paralichthys lethostigma. Doctoral Dissertation of Ocean University of China, 2010, 1-176 [史宝.牙鲆繁殖内分泌分子机理研究.中国海洋大学博士研究生学位论文, 2010, 1-176]
针对半滑舌鳎苗种生产中大量使用的人工培育亲鱼,时常出现产卵效果不佳、卵子质量差等现象(柳学周等, 2006),柳学周等(2015)研究了半滑舌鳎功能基因mPRL表达规律,发现在半滑舌鳎繁殖周期的脑和卵巢组织中,mPRL的表达水平从性腺发育Ⅱ期到Ⅴ期持续升高,并且在Ⅴ期达到最高值;从繁殖周期的垂体组织来看,在性腺发育Ⅴ期时,垂体中的mPRL表达量达到峰值;并且mPRL周期表达变化趋势与血清中孕酮激素含量变化规律一致。本研究分析了半滑舌鳎mPRL在卵子形成过程中母源的时序表达、繁殖相关组织mPRL的蛋白相对表达量和细胞学定位、促性腺激素调控mPRL基因和蛋白表达量的变化,旨在为进一步阐明mPRL在半滑舌鳎卵母细胞成熟过程中的生理功能提供参考资料,为提升人工亲鱼的培育技术和繁殖效率提供科学依据。
1 材料与方法 1.1 实验鱼和组织准备实验用的性成熟半滑舌鳎雌鱼取自山东青岛忠海水产有限公司,为野生亲鱼自然产卵后人工育苗得到的健康苗种经室内人工养成达到性成熟的F1亲鱼,雌鱼全长为53-66 cm,体重为1266.3-2271.0 g。其培育条件:全年开放流水培育,水温为8-25℃,盐度为27-31,pH为7.8-8.4,溶解氧 > 5 mg/L。按照半滑舌鳎卵巢发育的组织学特征,将其卵巢发育分为6期(柳学周等, 2009; 陈彩芳等, 2010)。在性腺发育不同阶段采集雌鱼卵巢用于后续实验。对不同性腺发育时期半滑舌鳎卵巢卵母细胞进行分离,从Ⅳ期卵巢分离到EV、LV和FG时相卵母细胞,从Ⅴ期卵巢分离到PV、EV、LV和FG时相卵母细胞,卵母细胞时相划分方法参考(李晓晓, 2013)2)。一部分卵母细胞样品用于促性腺激素调控实验,一部分不处理作为对照,实验结束后,卵母细胞使用液氮速冻并在-80℃保存,用于总RNA和总蛋白的提取。
2) Li XX. Study on the physiological function of membrane progestin receptor in the reproductive cycle of flatfish. Master’s Thesis of Shanghai Ocean University, 2013, 1-73 [李晓晓.膜孕激素受体在鲆鲽类繁殖周期中的生理功能研究.上海海洋大学硕士研究生学位论文, 2013, 1-73]
在半滑舌鳎繁殖季节,挑选性成熟雌鱼麻醉后取卵巢、脑、垂体组织样品,在4℃条件下使用4%多聚甲醛[溶于0.01 mol/L磷酸盐缓冲液(PBS)中]固定20 h,梯度甲醇(25%、50%、75%和100%甲醇溶于0.01 mol/L PBS)脱水,在-20℃保存于甲醇中的样品,一部分用于免疫组化,一部分用于原位杂交;部分性腺组织固定在Davidesons AFA中,用于检验性腺发育状况;另外,部分组织样品使用液氮速冻后保存在-80℃,用于总蛋白的提取。
1.2 实时定量PCR检测分别从半滑舌鳎PV时相、EV时相、LV时相、FG时相和GVBD时相卵母细胞提取总RNA进行反转录,并参照PrimerScriptTM RT reagent Kit with gDNA Eraser试剂盒(TaKaRa, 日本)合成cDNA第1链并用于基因表达分析。mPRL引物序列为:5′-TGTCC-TCGTCCAGCGTCACT-3′(mPRLF)和5′-CCCTGTCCCAAGAAATCACACT-3′(mPRLR);18S引物序列为:5′-GGTCTGTGATGCCCTTAGATGTC-3′(18SF)和5′-AGTGGGGTTCAGCGGGTTAC-3′(18SR)。荧光实时定量(qRT-PCR)的反应体系(20 μl):1 μl cDNA模板,1.5 μl引物(10 μmol/L),10 μl SYBR Premix Ex TaqTM Ⅱ和6 μl ddH2O。采用2步法PCR扩增程序,反应条件为95℃预变性30 s,95℃ 5 s,60℃18 s共40个循环。使用18S rRNA基因作为内参对照,用以校正所有样品中RNA的量。荧光实时定量PCR反应及信息的收集都在Mastercycler ep realplex实时定量PCR仪(Eppendorf, 德国)上进行。程序运行完成后进行熔解曲线(Melting curve)分析以确定引物及反应是否正常。每个样品设置3个平行孔,重复3次实验,同时实验设阴性对照,以保证实验结果的可靠性。
1.3 原位杂交使用正向引物(5′-AAGCTTTCACACCTGCATGGAAACG-3′)和反向引物(5′-GAATTCCCAAACATGATTATTTCCGCT-3′),扩增半滑舌鳎mPRL基因(Gen-Bank Accession No. KF277065),获得600 bp的cDNA片段。以此为模板,使用地高辛试剂盒(Roche, 德国)体外转录合成RNA正义和反义探针。脑、卵巢、垂体组织固定在4%多聚甲醛中,经酒精脱水、二甲苯透明、石蜡包埋,样品连续切片,厚度为5 μm。切片经二甲苯处理2次,每次5 min,酒精梯度处理,每次5 min。PBST冲洗3次,每次10 min。蛋白酶K (10 μg/ml) 37℃消化10 min。PBST冲洗2次,每次5 min。用预杂交液70℃处理3 h,然后加入含有地高辛标记的RNA探针杂交液,70℃杂交16 h。2×SSC洗涤,70℃,15 min,0.2×SSC,70℃,1 h。1×MAB室温洗涤5 min。血清室温封闭6 h。1︰500封闭液稀释的抗体4℃孵育过夜。PBST室温冲洗6次每次15 min;碱性磷酸缓冲液室温2次,每次10 min。加20 μl显色液BCIP/NBT室温避光显色。PBST洗涤5次,每次5 min终止反应,4% PFA-PBS固定10 min,PBST洗3次,每次5 min;酒精梯度脱水、二甲苯透明,封片,使用Nikon E80i显微镜(日本)观察并拍照。
1.4 Western blotting分析半滑舌鳎mPRL蛋白序列,选择抗原表位,并合成相应的免疫多肽;将合成的多肽常规免疫新西兰大白兔,制备抗体。冻存的脑、垂体、卵巢等组织(约100 mg),加入1 ml动物组织蛋白提取试剂,匀浆、提取组织蛋白。12% SDS-PAGE电泳检测提取蛋白的质量,并使用蛋白测定试剂盒测定组织总蛋白浓度。统一蛋白上样量为40 μg。蛋白提取液经12% SDS-PAGE胶分离,电转移到PVDF膜上,PBST洗涤2次,每次5min,5%脱脂奶粉封闭。一抗用制备的半滑舌鳎mPRL多克隆抗体,稀释度为1︰2000;二抗用辣根过氧化物酶标记山羊抗兔IgG,稀释度为1︰2000。DAB显色,凝胶成像系统拍照。同时采用空白对照检测多克隆抗体的特异性。使用软件对每个泳道的蛋白条带光密度值进行分析。
1.5 免疫组化组织切片脱蜡复水,3% H2O2室温孵育15 min,PBST洗涤2次,每次15 min;3% BSA室温孵育1 h,封闭非特异性反应。滴加半滑舌鳎mPRL抗体,稀释度为1︰1000,湿盒中室温孵育过夜,PBST洗涤5次,每次5 min。阴性对照组采用相同孵育方法,滴加未免疫的兔血清。实验组和对照组均用PBST洗涤5次,每次5 min;加入羊抗兔IgG (1︰1000)室温孵育1 h。DAB显色1-2 min。苏木精复染、脱水、透明、封片,使用Nikon E80i显微镜观察并拍照。
1.6 促性腺激素调控基因和蛋白表达从半滑舌鳎不同发育阶段的卵巢分离出不同发育时相、未受损的卵母细胞。24孔细胞培养板上每个孔放入2 ml pH为7.6的培养液(SIGMA, 美国),培养液添加促性腺激素(hCG)(SIGMA, 美国)并使其终浓度为10 IU/ml或20 IU/ml,同时每个激素添加实验组相应设置1个空白对照组。卵母细胞经过22℃ 6 h培养后,使用移液器将培养液移出,收集卵母细胞迅速放入液氮中冻存,用于mRNA和蛋白表达分析。
1.7 统计分析基因表达实验所得数据用相对定量的2-△△CT方法(Livak et al, 2001)计算后,使用SPSS 17.0软件的单因素方差分析(One-way ANOVA)和Duncan’s多重比较分析。P < 0.05为差异显著。相对表达量数据均表示为平均数±标准误(Mean±SE)。蛋白表达水平检测采用AIC.AlphaView成像分析系统(Cell Biosciences Inc)分析灰度值。
2 结果 2.1 mPRL蛋白表达量通过Western blotting方法检测半滑舌鳎mPRL蛋白在不同组织的表达水平。结果显示,在卵巢、脑、垂体、肝脏、头肾和肾脏组织检测到蛋白条带,分子量约为100 kDa,是理论值(40 kDa)的2倍多,可能形成了蛋白二聚体;对照组(PB)采用多肽抗原进行Western blotting,证实了抗体特异性(图 1-A)。半滑舌鳎mPRL蛋白表达量在卵巢、脑、垂体中相对较高,在肝脏、头肾、肾脏中也有表达,但表达量相对较少(图 1-B)。在卵巢、脑和垂体等较高水平表达,说明mPRL在半滑舌鳎多种组织中参与调节孕激素生理功能。

|
图 1 半滑舌鳎各组织mPRL蛋白的表达 Figure 1 Expression of mPRL protein in different tissues detected by Western blotting A:mPRL蛋白表达电泳图;B:mPRL蛋白表达量化O:卵巢;B:脑;P:垂体;L:肝;HK:头肾;K:肾;MK:蛋白分子量标准;PB:阴性对照;不同字母代表差异显著(P < 0.05),下同 A: Electrophoregram of protein expression for mPRL; B: Quantitative abundance of mPRL protein expression O: Ovary; B: Brain; P: Pituitary; L: Liver; HK: Head kidney; K: Kidney; MK: Protein molecular weight marker; PB: Peptide block; The values with different letters differ significantly from each other (P < 0.05), the same as below |
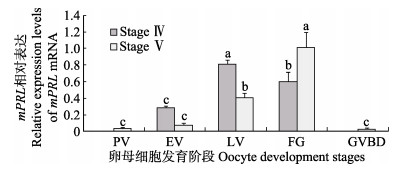
对半滑舌鳎卵巢各发育期中,不同发育时相的卵母细胞mPRLmRNA的相对表达量的分析结果显示,在发育Ⅳ期的卵巢中,处于卵黄生成后期卵母细胞(LV)的mPRLmRNA表达量最高(P < 0.05);在发育Ⅴ期的卵巢,即将进入成熟期卵母细胞(FG)的mPRLmRNA表达量最高(P < 0.05)(图 2)。总体来看,半滑舌鳎卵母细胞mPRLmRNA相对表达量的最高值出现在卵巢发育Ⅴ期进入成熟期的卵母细胞(P < 0.05),表明此阶段mPRL基因的生理学作用效果最明显,mPRL基因在卵母细胞成熟过程中起着重要的调控作用。
|
图 2 半滑舌鳎不同卵巢发育时期的不同时相卵母细胞mPRL基因的表达 Figure 2 The relative expression of mPRL mRNA at various stages of oogenesis at different ovary stages of C.semilaevis (n=3) PV:卵黄发生前卵母细胞;EV:卵黄发生早期卵母细胞;LV:卵黄生成后期卵母细胞;FG:即将进入成熟阶段卵母细胞;GVBD:生发泡破裂阶段卵母细胞。下同 PV: Previtellogenic stage; EV: Early vitellogenic stage; LV: Late vitellogenic stage; FG: Full grown stage; GVBD: Germinal vesicle breakdown stage. The same as below |
原位杂交分析mPRLmRNA在繁殖相关组织中的细胞学定位结果显示,在半滑舌鳎卵巢、脑和垂体组织中有明显的杂交信号(图 3)。在发育成熟的卵巢中,mPRLmRNA在卵母细胞膜上可观察到较强的阳性信号(图 3-A)。将成熟卵巢图像(图 3-A)放大1000倍,可清楚看到阳性信号定位在卵母细胞膜上(图 3-1)。在脑组织中,mPRLmRNA在脑组织神经元表达,在脑组织内mPRLmRNA阳性信号强度降低(图 3-B)。将脑组织图像(图 3-B)放大1000倍,可看到阳性信号明显定位在脑组织(图 3-2)。在垂体组织中,mPRLmRNA阳性信号在分散的细胞中表达较弱(图 3-C)。图 3-a、图 3-b和图 3-c分别为相应组织的阴性对照。

|
图 3 半滑舌鳎mPRL基因在不同组织中的细胞学定位 Figure 3 Localization of mPRL mRNA in different tissues of C.semilaevis detected by in situ hybridization A:卵巢;1:卵巢(x1000);a:卵巢对照组;B:脑;2:脑(x1000);b:脑对照组;C:垂体;c:垂体对照组;M:卵母细胞膜;PPD:垂体中外侧部;箭头指向为阳性信号位置 A: Ovary; 1: Ovary (x1000); a: Negative control of ovary; B: Brain; 2: Brain (x1000); b: Negative control of brain; C: Pituitary; c: Negative control of pituitary; M: Oocyte membrane; PPD: Proximalis pars distalis; The arrows indicated the positive reaction |
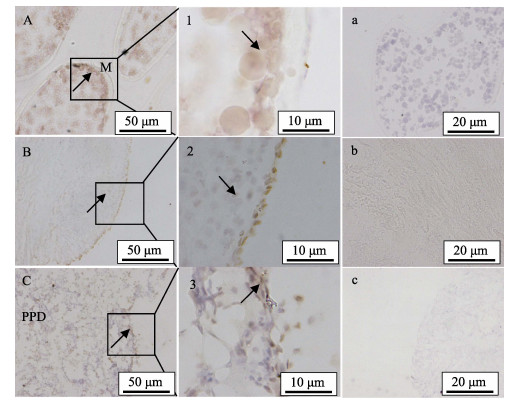
免疫组化结果显示,半滑舌鳎mPRL在卵巢、脑和垂体的细胞学定位与mPRL mRNA一致。在性成熟卵巢组织中,mPRL主要在卵母细胞膜上表达丰富(图 4-A);放大1000倍后(图 4-1),可以很明显看出其在膜附近的表达。在脑组织中,mPRL主要定位在脑组织的神经元(图 4-B);图 4-2为放大1000倍的表达结果。在垂体组织中,mPRL主要分布在垂体中分散的细胞(图 4-C);图 4-3为放大1000倍的表达结果。图 4-a、图 4-b和图 4-c分别为相应组织的阴性对照。
|
图 4 半滑舌鳎mPRL蛋白在各组织中的细胞定位 Figure 4 Localization of mPRL protein in the ovary, brain and pituitary of C.semilaevis demonstrated by immunohistochemistry A:卵巢;1:卵巢(×1000);a:卵巢对照组;B:脑;2:脑(×1000);b:脑对照组;C:垂体;3:垂体(×1000);c:垂体对照组;M:卵母细胞膜;PPD:垂体中外侧部;箭头指向为阳性信号位置 A: Ovary; 1: Ovary (x1000); a: Negative control of ovary; B: Brain; 2: Brain (x1000); b: Negative control of brain; C: Pituitary; 3: Pituitary (x1000); c: Negative control of pituitary; M: Oocyte membrane; PPD: Proximalis pars distalis; The arrows indicated the positive reaction |
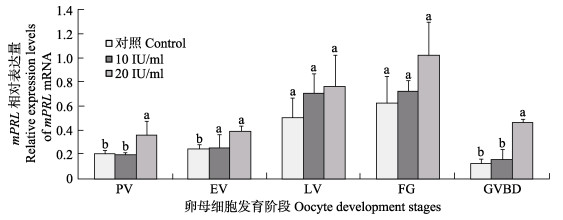
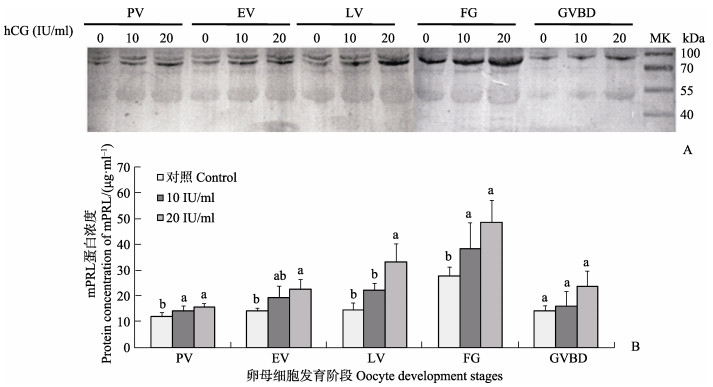
促性腺激素孵育不同时相的半滑舌鳎卵母细胞6 h后,采用实时荧光定量PCR和Western blotting方法检测半滑舌鳎mPRL基因和蛋白的表达变化。结果显示,10 IU/ml和20 IU/ml促性腺激素对半滑舌鳎卵母细胞中mPRL基因和蛋白表达都有一定的促进作用(图 5和图 6-A),特别是对即将进入成熟阶段(FG)的卵母细胞中mPRL基因和蛋白的表达量提升明显(P < 0.05)(图 5和图 6-B);促性腺激素通过mPRL提升了卵母细胞的减数分裂成熟能力。结果表明,mPRL和卵母细胞成熟存在密切关系。此外,20 IU/ml促性腺激素对mPRL基因和蛋白表达的调控作用比10 IU/ml促性腺激素作用更明显,表明mPRL基因和蛋白表达对促性腺激素调控作用存在剂量依存关系。
|
图 5 不同浓度促性腺激素调控半滑舌鳎不同时相卵母细胞mPRL表达 Figure 5 The relative expression of mPRL mRNA in isolated oocytes at various stages of oogenesis of C. semilaevis following different hCG treatment |
|
图 6 不同浓度促性腺激素调控不同时相卵母细胞mPRL蛋白表达 Figure 6 Changes of mPRL protein levels in isolated oocytes at various stages of oogenesis following hCG treatment detected by Western blotting analysis with a polyclonal mPRL antibody A:mPRL蛋白表达量电泳;B:mPRL蛋白表达量化;0:对照组;10:10 IU/ml hCG处理组;20:20 IU/ml hCG处理组 A: Electrophoregram of protein expression for mPRL; B: Quantitative abundance of mPRL protein expression; 0: Control group; 10: hCG (10 IU/ml) treatment group; 20: hCG (20 IU/ml) treatment group |
qRT-PCR检测发现,在半滑舌鳎不同组织中,mPRL mRNA在卵巢组织的表达丰富(柳学周等, 2015)。为进一步分析mPRL在半滑舌鳎卵巢的作用机制,本研究检测mPRL基因在半滑舌鳎不同时相卵母细胞表达规律,发现mPRL随着卵母细胞发育,表达水平逐步升高。在发育Ⅳ期的卵巢中,处于卵黄生成后期卵母细胞的mPRL基因表达量最高;在发育Ⅴ期的卵巢中,处于FG时相卵母细胞的mPRL基因表达量最高。总体来看,mPRLmRNA在卵黄生成早期的卵母细胞表达,可能参与卵黄生成过程;而在卵黄生成后期和即将进入成熟阶段的卵母细胞中mPRLmRNA迅速增加,表明mPRL基因和卵母细胞成熟存在密切关系。
3.2 mPRL的表达与定位分析Western blotting结果发现,mPRL蛋白表达量在半滑舌鳎的卵巢、脑、垂体中相对较高,明显的蛋白免疫反应条带出现在大约100 kDa位置,推测可能是形成了mPRL二聚体。膜孕激素受体家族成员蛋白二聚体形式比较常见,如在金鱼(Carassius auratus)不同组织和人类精子膜上,Western blotting分析发现类似情况,mPRα蛋白条带出现在大约80 kDa位置(Thomas et al, 2004; Tokumoto et al, 2006)。半滑舌鳎mPRL基因和蛋白在繁殖内分泌相关组织较丰富的表达并在卵巢组织表达量最大,该结果进一步说明mPRL主要调控卵巢的生理功能。
为探索mPRL的生理学作用,本研究分析了mPRL基因和蛋白的细胞学定位。原位杂交和免疫组化实验结果提供了清晰的组织细胞学证据,mPRL基因和蛋白阳性信号明显地分布在性成熟卵巢的卵母细胞膜上,并在脑的神经元和垂体内分散的细胞上分布。在半滑舌鳎卵母细胞发育过程中,mPRL基因表达增强,结合mPRL基因和蛋白在成熟卵母细胞膜上的定位,说明mPRL是受内分泌调控的介导卵母细胞成熟的膜受体。孕激素在神经系统具有重要的生理功能,如调节促性腺激素释放激素(GnRH)释放、繁殖行为、神经保护作用等(Baudry et al, 2013; Petersen et al, 2013)。赵明(2011)1)通过qRT-PCR方法分析GnRH基因在雌性半滑舌鳎各组织的分布时发现,GnRH mRNA在垂体和脑组织表达较丰富。因此,在本研究中发现的mPRL在半滑舌鳎神经内分泌相关组织垂体和脑的分布,表明mPRL可能介导孕激素调节GnRH释放,进而影响半滑舌鳎繁殖。
1) Zhao M. Studies on reproductive physiological characterstics and molecular cloning of cGnRH-Ⅱin tongue sole, Cynoglossus semilaevis Günther. Master’s Thesis of Ocean University of China, 2011, 1-79 [赵明.半滑舌鳎生殖生理特性及GnRH克隆初步研究.中国海洋大学硕士研究生学位论文, 2011, 1-79]
3.3 mPRL作用机制分析采用2种不同浓度促性腺激素孵育不同发育阶段的卵母细胞,发现mPRL基因和蛋白水平显著提高;本研究中,上调mPRL的表达可能与增强半滑舌鳎卵母细胞对孕激素应答能力以及完成卵母细胞减数分裂成熟有关。柳学周等(2014、2015)研究发现,雌性半滑舌鳎血清中促黄体激素(LH)和孕激素的浓度从Ⅱ到Ⅴ期卵巢逐渐上升,在Ⅴ期卵巢达到最高水平;这2种激素的变化趋势与本研究中mPRL基因和蛋白在卵母细胞表达的变化趋势相似,表明mPRL可能通过介导孕激素诱导卵母细胞成熟。在对金鱼和大西洋绒须石首鱼(Micropogonias undulatus)的研究中发现,促性腺激素孵育卵母细胞,mPRα蛋白水平升高;上调的卵母细胞mPRα蛋白水平与卵母细胞成熟相关(Zhu et al, 2003; Tokumoto et al, 2006)。半滑舌鳎mPRL与其他鱼类的mPRα类似的表达模式,预示着mPRL和mPRα基因可能在卵巢具有相似的生理功能。综合近年来的研究结果(柳学周等, 2014、2015; Shi et al, 2015; 王珊珊等, 2013; 李晓晓等, 2013; 赵明, 20111)),半滑舌鳎卵母细胞成熟机制表现为:下丘脑分泌GnRH,GnRH通过神经内分泌途径刺激垂体释放LH,LH卵巢滤泡细胞分泌孕激素,进而孕激素通过mPRL介导作用于卵母细胞,促使卵母细胞成熟。这为进一步研究半滑舌鳎mPRL作用机制和其生产应用提供了理论依据。
| Baudry M, Bi X, Aguirre C. Progesterone-estrogen interactions in synaptic plasticity and neuroprotection. Neuroscience , 2013, 239 : 280-294 DOI:10.1016/j.neuroscience.2012.10.051 | |
| Chen CF, Wen HS, Chen XY, et al. Studies on ovarian development and spawn type of cultured half-smooth tongue sole, Cynoglossus semilaevis. Marine Sciences , 2010, 34 (8) : 29-34 [陈彩芳, 温海深, 陈晓燕, 等. 人工养殖半滑舌鳎卵巢发育及其产卵类型研究. 海洋科学 , 2010, 34 (8) : 29-34] | |
| Chen SL, Zhang GJ, Shao CW, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle. Nature Genetics , 2014, 46 (3) : 253-260 DOI:10.1038/ng.2890 | |
| Josefsberg Ben-Yehoshua L, Lewellyn AL, Thomas P, et al. The role of Xenopus membrane progesterone receptor β in mediating the effect of progesterone on oocyte maturation. Molecular Endocrinology , 2007, 21 (3) : 664-673 DOI:10.1210/me.2006-0256 | |
| Karteris E, Zervou S, Pang Y, et al. Progesterone signaling in human myometrium through two novel membrane G protein coupled receptors: Potential role in functional progesterone withdrawal at term. Molecular Endocrinology , 2006, 20 (7) : 1519-1534 DOI:10.1210/me.2005-0243 | |
| Li XX, Liu XZ, Shi B, et al. Cloning and mRNA expression pattern of common glycoprotein α subunit of GTH in tongue sole Cynoglossus semilaevis Günther. Progress in Fishery Sciences , 2013, 34 (5) : 23-30 [李晓晓, 柳学周, 史宝, 等. 半滑舌鳎促性腺激素α亚基cDNA的克隆及组织表达特征. 渔业科学进展 , 2013, 34 (5) : 23-30] | |
| Liu XZ, Sun ZZ, Ma AJ, et al. Study on the technology of spawner culture and eggs collection of Cynoglossus semilaevis Günther. Marine Fisheries Research , 2006, 27 (2) : 25-32 [柳学周, 孙中之, 马爱军, 等. 半滑舌鳎亲鱼培育及采卵技术研究. 海洋水产研究 , 2006, 27 (2) : 25-32] | |
| Liu XZ, Shi B, Li XX, et al. Molecular characterization of the novel membrane progestin receptor gene and its role during ovarian development in the half smooth tongue sole Cynoglossus semilaevis Günther. Journal of Fishery Sciences of China , 2015, 22 (4) : 608-619 [柳学周, 史宝, 李晓晓, 等. 半滑舌鳎新型膜孕激素受体基因分子特征及其在卵巢发育过程的作用. 中国水产科学 , 2015, 22 (4) : 608-619] | |
| Liu XZ, Shi B, Wang SS, et al. Full length cDNA cloning and expression of luteinizing hormone (LH) and which serum concentration was measured in half smooth tongue sole Cynoglossus semilaevis Günther. Engineering Sciences , 2014, 16 (9) : 50-60 [柳学周, 史宝, 王珊珊, 等. 半滑舌鳎促黄体激素基因克隆和表达分析及其血清浓度测定. 中国工程科学 , 2014, 16 (9) : 50-60] | |
| Liu XZ, XU YJ, Liu NZ, et al. Study on histological and morphometric characters of gonad development of Cynoglossus semilaevis Günther. Progress in Fishery Sciences , 2009, 30 (6) : 25-35 [柳学周, 徐永江, 刘乃真, 等. 半滑舌鳎卵巢发育的组织学和形态数量特征研究. 渔业科学进展 , 2009, 30 (6) : 25-35] | |
| Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-DDCT method. Methods , 2001, 25 (4) : 402-408 DOI:10.1006/meth.2001.1262 | |
| Lyons TJ, Villa NY, Regalia LM, et al. Metalloregulation of yeast membrane steroid receptor homologs. Proceedings of the National Academy Sciences , 2004, 101 (15) : 5506-5511 DOI:10.1073/pnas.0306324101 | |
| Petersen SL, Intlekofer KA, Moura-Conlon PJ, et al. Novel progesterone receptors: Neural localization and possible functions. Frontiers in Neuroscience , 2013, 7 : 1-7 | |
| Shi B, Liu XZ, Xu YJ, et al. Molecular characterization of three gonadotropin subunits and their expression patterns during ovarian maturation in Cynoglossus semilaevis. International Journal of Molecular Sciences , 2015, 16 (2) : 2767-2793 DOI:10.3390/ijms16022767 | |
| Tang YT, Hu T, Arterburn M, et al. PAQR proteins: Novel membrane receptor family defined by an ancient 7-tran-smembrane pass motif. Journal of Molecular Evolution , 2005, 61 (3) : 372-380 DOI:10.1007/s00239-004-0375-2 | |
| Thomas P, Pang Y, Zhu Y, et al. Multiple rapid progestin actions and progestin membrane receptor subtypes in fish. Steroids , 2004, 69 (8-9) : 567-573 DOI:10.1016/j.steroids.2004.05.004 | |
| Tokumoto M, Nagahama Y, Thomas P, et al. Cloning and identification of a membrane progestin receptor in goldfish ovaries and evidence it is an intermediary in oocyte meiotic maturation. General and Comparative Endocrinology , 2006, 145 (1) : 101-108 DOI:10.1016/j.ygcen.2005.07.002 | |
| Wang SS, Liu XZ, Shi B, et al. Full length cDNA cloning and tissue expression analysis of follicle-stimulating hormone (FSH) from half-smooth tongue sole Cynoglossus semilaevis Günther. Progress in Fishery Sciences , 2013, 34 (6) : 15-23 [王珊珊, 柳学周, 史宝, 等. 半滑舌鳎促滤泡激素基因全长cDNA的克隆与组织表达分析. 渔业科学进展 , 2013, 34 (6) : 15-23] | |
| Zhu Y, Rice CD, Pang Y, et al. Cloning, expression, and characterization of a membrane progestin receptor and evidence it is an intermediary in meiotic maturation of fish oocyte. Proceedings of the National Academy Sciences , 2003, 100 (5) : 2231-2236 DOI:10.1073/pnas.0336132100 |



