2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306;
4. 青岛市渔业技术推广站 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
4. Qingdao Extension Station of Fisheries Technology, Qingdao 266071
黑色素聚集素(Melanin concentration hormone,MCH)是一种垂体神经肽,最早从大马哈鱼(Oncorhynchusketa)的垂体中被分离鉴定(Kawauchi et al, 1983),具有调节体色、色素沉着、摄食(Kang et al, 2013; Kawauchi, 2006)、能量平衡、压力、繁殖、行为、知觉和神经内分泌的作用(Kawauchi et al, 2004; Forray, 2003; Griffond et al, 2002; Pissios et al, 2003)。在硬骨鱼类中,MCH被认为是体色生理变化的一个关键调节因子(Kishida et al, 1989; Suzuki et al, 1995),其通过G蛋白偶联受体(MCHR)发挥生理作用,调节色素细胞内色素颗粒凝聚而使体色变浅。第1个MCH的受体MCHR1是在哺乳动物中发现的(Chambers et al, 1999; Lakaye et al, 1998; Lembo et al, 1999; Saito et al, 1999)。随后,在人类基因组数据中,第2个受体MCHR2被鉴定,并且从人脑cDNA文库中克隆获得(An et al, 2001; Hill et al, 2001; Mori et al, 2001; Rodriguez et al, 2001)。哺乳动物MCHR一般有2个亚型,而啮齿动物只有1个MCHR亚型(Tan et al, 2002)。硬骨鱼类,如金鱼(Carassius auratus)(Mizusawa et al, 2009)、条斑星鲽(Verasper moseri)(Takahashi et al, 2009)和美洲拟鲽(Pseudopleuronectes americanus)(Tuziak et al, 2012)等,一般有2种MCHR亚型,而在斑马鱼(Danio rerio)中发现了3种MCHR亚型:MCHR1a、MCHR1b及MCHR2。其中,MCHR1a只在胚胎期表达,MCHR1b和MCHR2在胚胎期和成体期都表达,且MCHR2在成体期表达水平明显升高(Berman et al, 2009; Logan et al, 2003),表明了其亚型基因功能的分化。MCHR1与啮齿类动物摄食行为和体内能量平衡调控有关(Wang et al, 2001)。在鱼类中,MCHR与摄食行为和体色调控有关,如饥饿条件下,美洲拟鲽MCHR2 mRNA表达量无变化,而MCHR1 mRNA表达量升高,说明MCHR1参与了其摄食调节(Tuziak et al, 2012)。Takahashi等(2004)对条斑星鲽的研究表明,MCH和MCHR相互作用调控黑色素颗粒的聚合。有眼侧皮肤在白色养殖环境下,MCHR2 mRNA表达量低于黑色养殖环境,而MCHR1 mRNA水平却没有变化,表明MCHR2可能主要参与体色对环境的适应调节(Takahashi et al, 2007)。目前,鱼类MCH与MCHR系统对体色的调控作用及其机制仍不明了,亟待开展深入的研究来阐释MCHR调节MCH作用的信号途径。
半滑舌鳎(Cynoglossus semilaevis)为我国鲆鲽类三大主导养殖品种之一,已形成规模化养殖产业(姜言伟等, 1993; 邓景耀等, 1988; 柳学周等, 2014)。近年来,在养殖生产中发现,养殖鱼存在较高比例的无眼侧黑化现象(60%以上),且无眼侧黑化鱼市场价格较无眼侧正常鱼低20%-30%,严重影响其养殖效益,成为制约产业持续发展的瓶颈之一。开展半滑舌鳎无眼侧黑化调控机制研究已极为迫切。MCH对硬骨鱼类特别是鲆鲽类无眼侧体色黑化具有明显的抑制作用,因此,有必要研究MCH/MCHR系统在养殖半滑舌鳎无眼侧黑化调控中的作用及其可能机制,以期为全面认识养殖半滑舌鳎无眼侧黑化的分子机制,建立实用的体色调控技术提供基础资料。
1 材料与方法 1.1 实验用鱼及样品处理实验用半滑舌鳎于2013年6-8月取自山东青岛某养殖场。取样实验鱼3尾,全长为25-35 cm,体重为250-350 g,用于MCHR基因克隆与组织表达特性分析。实验鱼以MS-222 (280 mg/L)麻醉后,快速取性腺、肝脏、心脏、胃、肠、脾、肾、头肾、垂体、脑、鳃、肌肉、有眼侧正常皮肤、无眼侧黑化皮肤、无眼侧正常皮肤组织投入液氮速冻后,转入-80℃保存,用于总RNA的提取。
选择同一批次受精卵孵化的鱼苗,按照发育进程,分别挑选无眼侧黑化面积为10%、50%和80%的半滑舌鳎各3尾,以无眼侧正常半滑舌鳎为对照。实验鱼体长为8-10 cm,体重为4-6 g,每个黑化组分别取脑垂体与皮肤组织,用于分析MCHR mRNA表达与无眼侧黑化程度的关系。因实验鱼个体较小,取样时将脑与垂体合并取样,皮肤组织(去除肌肉)整体取样。
1.2 总RNA提取和cDNA第1链合成利用RNAiso Plus (TaKaRa,日本)试剂盒并按照操作说明提取各组织样品的总RNA,通过1%琼脂糖凝胶电泳检测RNA的质量,Nanodrop 2000 (Thermo,美国)测定RNA浓度。取适量脑组织总RNA,以PrimeScriptTM Ⅱ 1st strand cDNA Synthesis Kit (TaKaRa)合成cDNA第1链,于-20℃保存用于中间片段的克隆。以SMARTerTM RACE cDNA Amplification Kit (Clontech, 美国)合成5'-RACE及3'-RACE cDNA第1链,用于MCHR基因RACE全长克隆。取适量各组织样品的总RNA,用PrimeScript RT Reagent Kit with gDNA Eraser反转录试剂盒(TaKaRa,日本)合成cDNA第1链,用于MCHR mRNA组织表达特性及其与无眼侧黑化程度分析。各操作步骤均严格按照使用说明书进行。
1.3 中间片段扩增根据GenBank登记的鲆鲽类MCHR2序列保守区设计特异引物MCHR2-F和MCHR2-R (表 1),以脑cDNA为模板,扩增半滑舌鳎MCHR2基因的核心序列,PCR反应体系(25 μl):0.3 μl Taq酶、2.5 μl 10× PCR Buffer、2 μl dNTP Mixture、1 μl模板、1 μl MCHR2-F、1 μl MCHR2-R、17.2 μl ddH2O。反应条件:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 50 s,34个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分离后,切胶回收目的条带并纯化。回收PCR产物与pEASY-T1载体(全式金,中国)连接,转化至Trans1-T1感受态细胞(全式金,中国),LB固体培养基37℃培养过夜,挑取阳性克隆送至生工生物工程(上海)股份有限公司测序;MCHR1的中间序列已在NCBI数据库登录(序列号:XM_008316788.1),直接下载其序列用于RACE引物设计。
|
|
表 1 半滑舌鳎MCHR基因克隆使用的PCR扩增引物序列 Table 1 Nucleotide sequences of primers used for PCR amplification of MCHR of C. semilaevis |
根据NCBI数据库登记的MCHR1和MCHR2中间片段设计RACE引物MCHR1-GSP1、MCHR1-GSP2、MCHR1-NGSP1、MCHR1-NGSP2、MCHR2-GSP1、MCHR2-GSP2、MCHR2-NGSP1、MCHR2-NGSP2(表 1),用Smart RACE Advantage 2 PCR试剂盒(Clontech,美国)进行梯度PCR扩增。第1次PCR使用引物MCHR1-GSP1、MCHR1-GSP2和MCHR2-GSP1、MCHR2-GSP2,反应体系:17.25 μl ddH2O、2.5 μl Buffer、0.5 μl 50×dNTP Mix、0.5 μl 50×Advantage 2 Polymerase Mix、1.25 μl cDNA、2.5 μl UPM和GSP引物0.5 μl,共计25 μl。PCR反应条件为94℃ 30 s;70℃ 30 s,16个循环,Tm每个循环降低0.5℃,72℃延伸1 min;然后,94℃ 30 s,63℃ 30 s,72℃ 60 s,28个循环,最后72℃延伸10 min。
以第1次PCR产物为模板,使用引物MCHR1-NGSP1、MCHR1-NGSP2和MCHR2-NGSP1、MCHR2-NGSP2进行巢式PCR,反应体系:1.25 μl第1次PCR产物的稀释液、19.25 μl ddH2O、2.5 μl Buffer、0.5 μl 50× dNTP Mix、0.5 μl 50×Advantage 2 Polymerase Mix、0.5 μl NUP、0.5μl NGSP引物,共计25 μl。PCR反应条件同第1次PCR。PCR产物于1%琼脂糖凝胶电泳检测后,对目的条带进行胶回收、载体连接、转化、筛选阳性克隆并测序。
1.5 MCHR mRNA定量表达分析根据获得的半滑舌鳎MCHR1和MCHR2的cDNA序列设计定量PCR引物MCHR1-DF、MCHR1-DR和MCHR2-DF、MCHR2-DR (表 1),以β-actin为内参,设计引物β-actin-F和β-actin-R (表 1) (Li et al, 2010)。利用Mastercycler ep realplex real-time PCR仪(Eppendorf,德国),使用SYBR Premix Ex TaqTMⅡ试剂盒(Takara)进行定量扩增,PCR体系(20 μl)为2 μl cDNA模板,0.8 μl上、下游引物(10 μmol/L),10 μl SYBR Premix Ex TaqTM Ⅱ和6.4 μl ddH2O。PCR反应条件为95℃预变性30 s,95℃ 5 s,58℃ (MCHR1)、60℃ (MCHR2) 20 s共40个循环。每个样品测试设置3个重复。MCHR mRNA的表达量以β-actin mRNA表达量为基础,利用2-ΔΔCt方法计算获得(Livak et al, 2001)。
1.6 序列分析及数据处理半滑舌鳎MCHR基因的序列拼接、氨基酸序列推导、分子量预测、等电点预测及氨基酸同源性分析均使用DNAstar 5.0.1,信号肽预测使用SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/)。氨基酸序列比对和系统进化分析使用ClustalX 2.0.12 (http://www.clustal.org/download/current/)和MEGA 5.1 (http://www.megasoftware.net/mega51.html)。蛋白结构预测使用SWISS-MODEL (http://www.swissmodel.expasy.org/)。
实验数据均以平均值±标准差(Mean±SD)表示,多组数据间比较采用SPSS 16.0统计软件进行单因素方差分析(One-way ANOVA)和Duncan’s多重比较分析,当P < 0.05时表示差异显著。
2 结果 2.1 MCHR cDNA序列结构半滑舌鳎MCHR1 cDNA序列全长为1685 bp,包括262 bp的5’非编码区(UTR)、1080 bp的开放阅读框(ORF)和343 bp的3'UTR,编码359个氨基酸。N端第1-30位氨基酸为信号肽序列,7个糖基化位点分别位于第5、8、15、72、94、222和324位氨基酸。存在7个跨膜结构域,分别位于29-51、68-90、105-127、147-169、195-217、246-268和283-302位氨基酸。3'端UTR含有1个加尾信号AATTAA (图 1)。编码蛋白预测分子量为39.9 kDa,等电点为9.00。

|
图 1 半滑舌鳎MCHR1基因cDNA全长序列及推导的氨基酸序列 Figure 1 The full-length cDNA sequence of C. semilaevis MCHR1 gene and deduced amino acid sequence 推导的氨基酸序列用单字母表示,从阴影显示的起始甲硫氨酸开始计数。信号肽用单下划线表示,糖基化位点以粗体表示,跨膜螺旋用斜体表示,AATTAA加尾信号用框表示,终止密码子(TGA)用*表示。下同 The deduced amino acid residues were represented as single letter abbreviations and numbered from the initiating methionine which was shadowed. The signal peptide was underlined. The potential glycosylation sites were bolded. The transmembrane helices were italicized. The AATTAA sequence that indicated the polyadenylation signal was boxed. The boxed stop codon was marked by an asterisk. The same as below |
半滑舌鳎MCHR2 cDNA序列全长为1626 bp,包括213 bp的5'UTR、1044 bp的ORF和369 bp的3'UTR,编码347个氨基酸。N端第1-47位氨基酸为信号肽序列,4个糖基化位点分别位于第2、11、15和23位氨基酸,存在7个跨膜结构域,位置分别为41-63、76-98、118-140、152-174、204-226、247-269和282-304位氨基酸。3'UTR区含有1个加尾信号AATAA (图 2)。编码蛋白预测的分子量为39.8 kDa,等电点为9.16。

|
图 2 半滑舌鳎MCHR2基因cDNA全长序列及推导的氨基酸序列 Figure 2 The full-length cDNA sequence of C. semilaevis MCHR2 gene and deduced amino acid sequence |
同源性分析显示,半滑舌鳎MCHR1的氨基酸序列与鲽形目、鲈形目的相似度达81.8%-83.3%,与牙鲆(Paralichthys olivaceus)的相似度为83.3%,与爬行类、鸟类和人的相似度分别为63.5%、62.2%和14.1%。半滑舌鳎MCHR2的氨基酸序列与鲽形目的相似度达到90%以上,与鲤形目鱼类相似度为33.0%-75.7%,而与爬行类、鸟类和人的相似度分别仅为33.6%、29.6%和34.2%。另外,半滑舌鳎MCHR1和MCHR2的氨基酸序列相似度仅为30.1%(表 2)。
|
|
表 2 半滑舌鳎MCHR氨基酸序列与其他脊椎动物的同源性比较 Table 2 Comparison of homology of the precursor peptide sequences of MCHR gene between C. semilaevis and other vertebrates |
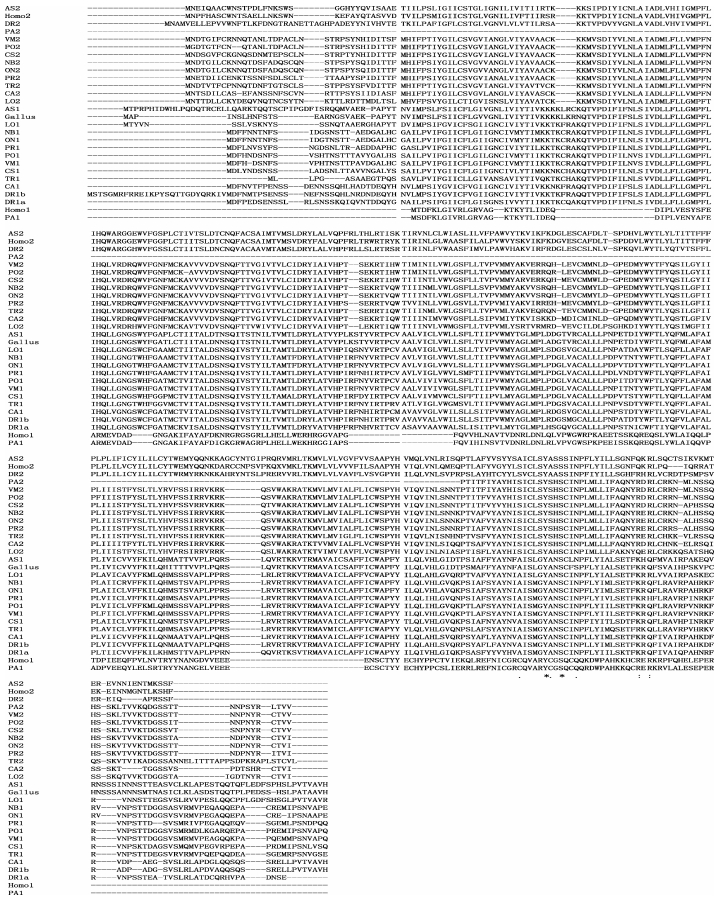
利用ClustalX 2.0.12对半滑舌鳎MCHR的氨基酸序列与其他物种的MCHR氨基酸序列进行了比较(图 3)。结果发现,半滑舌鳎与其他鱼类MCHR的氨基酸序列保守性较强,仅在C端和N端删除了一些氨基酸,中间部分较为保守。
|
图 3 半滑舌鳎与其他物种的MCHR氨基酸序列比较 Figure 3 Comparison of the amino acid sequences of C.semilaevis MCHR and other species “*”表示一致的氨基酸;“:”表示高度保守度的氨基酸;“.”表示低保守度的氨基酸;MCHR氨基酸序列号见表 2;AS1、AS2:扬子鳄;CA1、CA2:鲫鱼;CS1、CS2:半滑舌鳎;DR1a、DR1b、DR2:斑马鱼;Gallus:鸡;Homo1、Homo2:人;LO1、LO2:斑点雀鳝;NB1、NB2:布氏新亮丽鲷;ON1、ON2:尼罗罗非鱼;PA1、PA2:美洲拟鲽;PR1、PR2:网纹鳉;PO1、PO2:牙鲆;TR1、TR2:红鳍东方鲀;VM1、VM2:条斑星碟 Asterisks (*) indicated identical amino acid sequences; Dot (:) indicated highly conserved amino acid sequences; Dot (.) indicated amino acid sequences of low degree conserved; GenBank accession numbers were shown in Tab. 2; AS1, AS2: A. sinensis; CA1, CA2: C. auratus; CS1, CS2: C. semilaevis; DR1a, DR1b, DR2: D. rerio; Gallus: G. gallus; Homo1, Homo2: H. sapiens; LO1, LO2: L. oculatus; NB1, NB2: N. brichardi; ON1, ON2: O. niloticus; PA1, PA2: P. americanus; PR1, PR2: P. reticulate; PO1, PO2: P. olivaceus; TR1, TR2: T. rubripes; VM1, VM2: V. moseri |
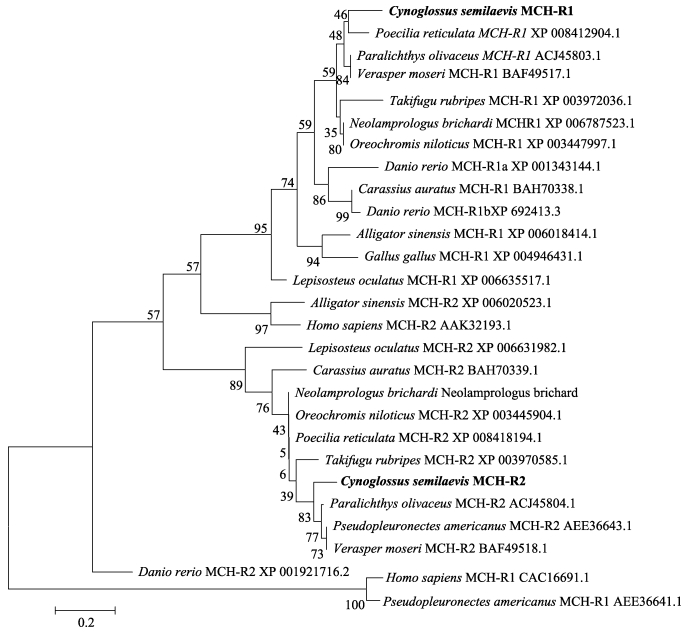
构建了半滑舌鳎MCHR和其他脊椎动物MCHR的系统进化树(图 4),半滑舌鳎MCHR1与鳉形目、鲽形目鱼类聚为1个小分支,与其他硬骨鱼类和鸟类、爬行类、人类聚为1个大分支;半滑舌鳎MCHR2与鲽形目聚为1个小分支,与其他硬骨鱼类聚为1个大分支,与MCHR1遗传距离较大,分别向2个方向进化。
|
图 4 基于MCHR氨基酸序列的NJ系统进化树 Figure 4 NJ phylogenetic tree based on MCHR amino acid sequences |
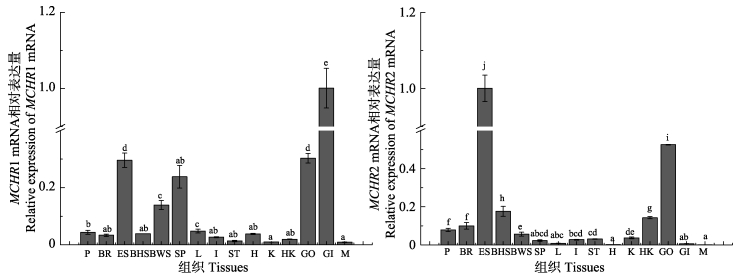
半滑舌鳎MCHR1 mRNA在鳃中表达量最高,有眼侧皮肤、性腺、脾脏和无眼侧正常皮肤中检测到较高的表达量,而垂体、脑、无眼侧黑化皮肤、肝、肠、心脏中表达量较低,胃、肾、头肾、肌肉中检测到微量表达;半滑舌鳎MCHR2 mRNA在有眼侧皮肤中表达量最高,性腺次之,而在垂体、脑、无眼侧黑化皮肤、无眼侧正常皮肤和头肾中有少量表达,在肝、肠、胃、肾、肌肉、心脏和脾脏中微量表达(图 5)。MCHR在性腺中的高表达表明其可能会参与生殖活动调控。另外,有眼侧皮肤中这2种MCHR亚基表达水平均显著高于无眼侧黑化和正常皮肤,而无眼侧黑化皮肤中,MCHR1表达显著低于无眼侧正常皮肤,无眼侧黑化皮肤中MCHR2则显著高于无眼侧正常皮肤,表现出差异表达特性。
|
图 5 半滑舌鳎MCHR mRNA在不同组织中的相对表达量 Figure 5 Relative expression of MCHR mRNA in different tissues of C.semilaevis P:垂体;BR:脑;ES:有眼侧皮肤;BHS:无眼侧黑化皮肤;BWS:无眼侧白皮肤;SP:脾;L:肝;I:肠;ST:胃;H:心;K:肾;HK:头肾;GO:性腺;GI:鳃;M:肌。不同字母代表差异显著(P < 0.05),下同 P: Pituitary; B: Brain; ES: Eye-side skin; BHS: Blind-side hypermelanosis skin; BWS: Blind-side white skin; SP: Spleen; L: Liver; I: Intestine; ST: Stomach; H: Heart; K: Kindey; HK: Head kidney; GO: Gonad; GI: Gill; M: Muscle. Different letters denoted significant differences (P < 0.05), the same as below |
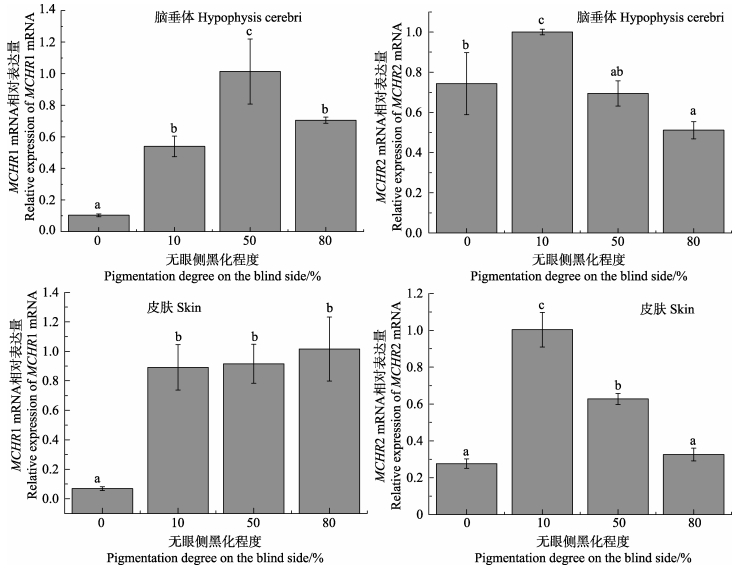
本研究分析了半滑舌鳎脑垂体和皮肤中MCHR mRNA表达与无眼侧黑化程度的关系(图 6)。无眼侧黑化发生早期,脑垂体中的MCHR1 mRNA显著升高,在无眼侧50%黑化组达峰值,其后又显著降低;皮肤中的MCHR1 mRNA在无眼侧10%黑化组显著高于对照组,其后保持较高表达水平。脑垂体和皮肤中的MCHR2 mRNA表达表现出一致的变化趋势,在无眼侧黑化发生早期(10%黑化组),垂体和皮肤中的MCHR2 mRNA都达到峰值,随后逐渐下降至相对较低水平。
|
图 6 半滑舌鳎脑垂体和皮肤中MCHR mRNA的表达与无眼侧黑化程度的关系 Figure 6 Correlation between expression of MCHR mRNAs in hypophysis cerebri and skin of C. semilaevis and its pigmentation degree on the blind-side |
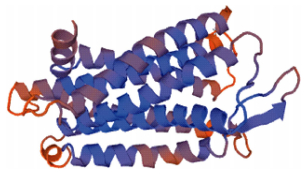
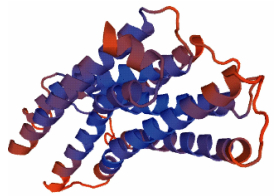
通过SWISS-MODEL网站预测了半滑舌鳎MCHR编码的蛋白质的三级结构,如图 7、图 8所示。
|
图 7 SWISS-MODEL预测的半滑舌鳎MCHR1蛋白三级结构 Figure 7 Tertiary structure of C. semilaevis MCHR1 protein predicted by SWISS-MODEL |
|
图 8 SWISS-MODEL预测的半滑舌鳎MCHR2蛋白三级结构 Figure 8 Tertiary structure of C. semilaevis MCHR2 protein predicted by SWISS-MODEL |
本研究获得了半滑舌鳎MCHR的2个亚型MCHR1和MCHR2 cDNA序列全长,并研究了其组织表达特性和不同黑化面积表达特性,为进一步研究MCH对体色调控的作用信号途径提供了基础。本研究获得了半滑舌鳎2个MCHR亚型的结构,这种单个或多个亚型的现象可能是由早期基因组的复制或者在进化分离过程中丢失造成的。在基因结构方面,半滑舌鳎MCHR1编码359个氨基酸,含有7个糖基化位点,其中,3个位于N端,1个位于C端。美洲拟鲽MCHR1序列中没有发现糖基化位点(Tuziak et al, 2012),条斑星鲽中含有5个糖基化位点,其中2个N端糖基化位点(Takahashi et al, 2007)。MCHR2编码347个氨基酸,含有4个N端糖基化位点和7个跨膜结构域,这与条斑星鲽的MCHR2序列中糖基化位点数量与位置相同(Takahashi et al, 2007),而在美洲拟鲽MCHR2只发现1个糖基化位点、3个跨膜结构域(Tuziak et al, 2012)。糖基化位点的存在可赋予蛋白质传导信号的功能,同时糖基化有助于某些蛋白的正确折叠,而跨膜结构对于受体蛋白发挥生物学功能起到决定性作用。不同鱼种间MCHR基因结构的差异可能与种的特异性和MCHR1功能的差异有关,具体机制还有待研究确认。同源性分析和系统进化分析表明,半滑舌鳎MCHR1和MCHR2的进化保守性较强,特别是MCHR1。但MCHR1和MCHR2的氨基酸同源性仅为30.1%,表明在进化过程中,其祖先基因发生了复制和功能的分化,且这种分化发生的时期可能较早。
组织表达分析显示,半滑舌鳎MCHR1 mRNA主要在鳃、有眼侧皮肤、性腺、脾脏和无眼侧白皮中表达,这种广泛的表达特性与美洲拟鲽MCHR1的研究结果相似(Tunisia et al, 2012),而对条斑星鲽的研究发现,MCHR1只在脑中表达(Takahashi et al, 2007),说明MCHR1的生理功能具有种属特异性。本研究还发现,MCHR2 mRNA主要在有眼侧皮肤、性腺中表达,这与美洲拟鲽和条斑星鲽的研究结果一致。说明半滑舌鳎MCHR2可能具有与美洲拟鲽和条斑星鲽类似的生理功能,参与皮肤黑化和摄食行为的调控(Takahashi et al, 2007; Tuziak et al, 2012)。除主要靶器官外,在半滑舌鳎其他组织中也检测到MCHR mRNA的表达,这种表达模式在美洲拟鲽(Tuziak et al, 2012)、条斑星鲽(Takahashi et al, 2007)、斑马鱼(Berman et al, 2009)、金鱼(Mizusawa et al, 2009)等鱼类中也同样存在,暗示MCHR可能与其他硬骨鱼类一样具有多样化的生理功能。
本研究发现,半滑舌鳎有眼侧皮肤中MCHR的表达水平显著高于无眼侧黑化皮肤和无眼侧正常皮肤,表明皮肤中的MCHR直接参与了黑色素细胞的代谢调控过程。在MCH的研究中,我们发现半滑舌鳎MCH1和MCH2的主要靶器官为垂体,而本研究发现,MCHR1和MCHR2的主要靶器官分别为鳃和有眼侧皮肤,提示MCHR介导MCH的生理功能可能是通过旁分泌和自分泌的信号途径。与无眼侧黑化皮肤和正常皮肤相比,有眼侧皮肤中MCH和MCHR的表达水平都显著升高。同时,在无眼侧黑化皮肤中的MCH1和MCHR1表达水平显著高于无眼侧正常皮肤,而无眼侧黑化皮肤中MCH2和MCHR2表达水平显著低于无眼侧正常皮肤。由此说明,MCH/MCHR信号系统在有眼侧体色调控和无眼侧黑化调控过程中可能存在协同作用,但具体的作用途径和机制尚需深入研究验证。
Takahashi等(2004)在条斑星鲽MCHR的研究中发现,MCH通过与MCHR结合控制着色素细胞中黑色素颗粒的聚合。条斑星鲽有眼侧皮肤中,MCH通过与MCHR2特异结合调控体色以适应不同环境背景的变化,如白色养殖环境下有眼侧皮肤MCHR2 mRNA表达量低于黑色养殖环境,表明MCHR2可能直接参与了对养殖环境的适应调控(Takahashi et al, 2007)。本研究初步揭示了MCHR与无眼侧黑化发生过程的关系,结合MCH的表达情况,发现在无眼侧黑化程度不同的半滑舌鳎垂体中,MCH1和MCHR1具有互补表达的变化趋势,即无眼侧10%黑化鱼垂体MCH1达峰值后显著下降,而MCHR1在10%黑化鱼中表达开始升高,而在50%黑化鱼中达峰值并在80%黑化鱼中保持较高水平,这种互补表达特性提示了MCH与MCHR之间可能存在协同调控作用。皮肤中MCH1与MCHR1也存在类似的协同表达调控关系,其具体的信号通路尚需进一步研究。作者还发现,垂体和皮肤中的MCH1与MCHR2都分别存在类似的表达变化趋势,MCH可能与MCHR1、MCHR2同时结合而发挥生理功能。有趣的是,我们发现半滑舌鳎垂体和皮肤中MCH2与MCHR1、MCHR2也具有类似的表达调控关系。综上所述,MCH/MCHR系统对半滑舌鳎无眼侧黑化性状发生和发展的过程具有重要的调控作用,但MCH/MCHR结合作用途径及机制尚不明了。目前研究尚无法确定哪种因子是参与无眼侧黑化调控的关键因子,通过构建基因敲除型模式鱼类可能为基因的功能解析提供支撑,探明MCH/MCHR信号系统对无眼侧黑化的调控作用机制将有利于建立实用的体色调控技术。
| An S, Cutler G, Zhao JJ, et al. Identification and characterization of a melanin-concentrating hormone receptor. Proceedings of the National Academy of Sciences of the United States of America , 2001, 98 (13) : 7576-7581 DOI:10.1073/pnas.131200698 | |
| Berman JR, Skariah G, Maro GS, et al. Characterization of two melanin-concentrating hormone genes in zebrafish reveals evolutionary and physiological links with the mammalian MCH system. Journal of Comparative Neurology , 2009, 517 (5) : 695-710 DOI:10.1002/cne.v517:5 | |
| Chambers J, Ames RS, Bergsma D, et al. Melanin-concentrating hormone is the cognate ligand for the orphan G-protein-coupled receptor SLC-1. Nature , 1999, 400 (6741) : 261-265 DOI:10.1038/22313 | |
| Deng JY, Meng TX, Ren SM, et al. Composition and quantity distribution of the Bohai Sea fish species. Marine Fisheries Research , 1988, 9 : 11-89 [邓景耀, 孟田湘, 任胜民, 等. 渤海鱼类种类组成及数量分布. 海洋水产研究 , 1988, 9 : 11-89] | |
| Forray C. The MCH receptor family: Feeding brain disorders?. Current Opinion in Pharmacology , 2003, 3 (1) : 85-89 DOI:10.1016/S1471-4892(02)00013-9 | |
| Griffond B, Baker BI. Cell and molecular cell biology of melanin concentrating hormone. International Review of Cytology , 2002, 213 (4) : 233-277 | |
| Hill J, Duckworth M, Murdock P, et al. Molecular cloning and functional characterization of MCH2, a novel human MCH receptor. Journal of Biological Chemistry , 2001, 276 (23) : 20125-20129 DOI:10.1074/jbc.M102068200 | |
| Jiang YW, Wang JR, Chen RS, et al. Artificial fry rearing of Cynoglossus semilaevis Günther in Bohai Sea. Marine Fisheries Research , 1993, 14 : 25-33 [姜言伟, 万瑞景, 陈瑞盛, 等. 渤海半滑舌鳎人工育苗工艺技术的研究. 海洋水产研究 , 1993, 14 : 25-33] | |
| Kang DY, Kim HC. Functional characterization of two melanin-concentrating hormone genes in the color camouflage, hypermelanosis, and appetite of starry flounder. General and Comparative Endocrinology , 2013, 189 : 74-83 DOI:10.1016/j.ygcen.2013.04.025 | |
| Kawauchi H, Baker BI. Melanin-concentrating hormone signaling systems in fish. Peptides , 2004, 25 (10) : 1577-1584 DOI:10.1016/j.peptides.2004.03.025 | |
| Kawauchi H, Kawazoe I, Tsubokawa M. Characterization of melanin concentrating hormone in chum salmon pituitaries. Nature , 1983, 305 (5932) : 321-323 DOI:10.1038/305321a0 | |
| Kawauchi H. Functions of melanin-concentrating hormone in fish. Journal of Experimental Zoology Part A Comparative Experimental Biology , 2006, 305 (9) : 751-760 | |
| Kishida M, Baker BI, Eberle AN. The measurement of melanin concentrating hormone in trout blood. General and Comparative Endocrinology , 1989, 74 (2) : 221-229 DOI:10.1016/0016-6480(89)90216-5 | |
| Lakaye B, Minet A, Zorzi W, et al. Cloning of the rat brain cDNA encoding for the SLC-1 G protein-coupled receptor reveals the presence of an intron in the gene. Biochimica et Biophysica Acta , 1998, 1401 (2) : 216-220 DOI:10.1016/S0167-4889(97)00135-3 | |
| Lembo PM, Grazzini E, Cao J, et al. The receptor for the orexigenic peptide melanin-concentrating hormone is a G-protein-coupled receptor. Nature Cell Biology , 1999, 1 (5) : 267-271 DOI:10.1038/12978 | |
| Li ZJ, Yang LJ, Wang J, et al. β-Actin is a useful internal control for tissue-specific gene expression studies using quantitative real-time PCR in the half-smooth tongue sole Cynoglossus semilaevis challenged with LPS or Vibrio anguillarum. Fish and Shellfish Immunology , 2010, 29 (1) : 89-93 DOI:10.1016/j.fsi.2010.02.021 | |
| Liu XZ, Zhuang ZM. Reproduction biology and culture technology of half-smooth tongue soleCynoglossus semilaevis. Beijing: China Agriculture Press, 2014 : 1 -10. [柳学周, 庄志猛. 半滑舌鳎繁育理论与养殖技术. 北京: 中国农业出版社, 2014 : 1 -10.] | |
| Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods , 2001, 25 (4) : 402-408 DOI:10.1006/meth.2001.1262 | |
| Logan DW, Bryson-Richardson RJ, Pagán KE, et al. The structure and evolution of the melanocortin and MCH receptors in fish and mammals. Genomics , 2003, 81 (2) : 184-191 DOI:10.1016/S0888-7543(02)00037-X | |
| Mizusawa KL, Saito Y, Wang Z, et al. Molecular cloning and expression of two melanin-concentrating hormone receptors in goldfish. Peptides , 2009, 30 (11) : 1990-1996 DOI:10.1016/j.peptides.2009.04.010 | |
| Mori M, Harada M, Terao Y, et al. Cloning of a novel G protein-coupled receptor, SLT, a subtype of the melanin-concentrating hormone receptor. Biochemical and Biophysical Research Communications , 2001, 283 (5) : 1013-1018 DOI:10.1006/bbrc.2001.4893 | |
| Pissios P, Maratos-Flier E. Melanin-concentrating hormone: From fish skin to skinny mammals. Trends in Endocrinology and Metabolism Tem , 2003, 14 (5) : 243-248 DOI:10.1016/S1043-2760(03)00079-1 | |
| Rodriguez M, Beauverger P, Naime I, et al. Cloning and molecular characterization of the novel human melanin-concentrating hormone receptor MCH2. Molecular Pharmacology , 2001, 60 (4) : 632-639 | |
| Saito Y, Nothacker HP, Wang Z, et al. Molecular characterization of the melanin-concentrating-hormone receptor. Nature , 1999, 400 (6741) : 265-269 DOI:10.1038/22321 | |
| Suzuki M, Narnaware YK, Baker BI, et al. Influence of environmental colour and diurnal phase on MCH gene expression in the trout. Journal of Neuroendocrinology , 1995, 7 (4) : 319-328 DOI:10.1111/jne.1995.7.issue-4 | |
| Takahashi A, Kobayashi Y, Amano M, et al. Structural and functional diversity of proopiomelanocortin in fish with special reference to barfin flounder. Peptides , 2009, 30 (7) : 1374-1382 DOI:10.1016/j.peptides.2009.04.014 | |
| Takahashi A, Kosugi T, Kobayashi Y, et al. The melanin-concentrating hormone receptor 2 (MCH-R2) mediates the effect of MCH to control body color for background adaptation in the barfin flounder. General and Comparative Endocrinology , 2007, 151 (2) : 210-219 DOI:10.1016/j.ygcen.2007.01.011 | |
| Takahashi A, Tsuchiya K, Yamanome T, et al. Possible involvement of melanin concentrating hormone in food intake in a teleost fish, barfin flounder. Peptides , 2004, 25 (10) : 1613-1622 DOI:10.1016/j.peptides.2004.02.022 | |
| Tan CP, Sano H, Iwaasa H, et al. Melanin-concentrating hormone receptor subtypes 1 and 2: Species-specific gene expression. Genomics , 2002, 79 (6) : 785-792 DOI:10.1006/geno.2002.6771 | |
| Tuziak SM, Volkoff H. A preliminary investigation of the role of melanin-concentrating hormone (MCH) and its receptors in appetite regulation of winter flounder (Pseudopleuronectes americanus). Molecular and Cellular Endocrinology , 2012, 348 (1) : 281-296 DOI:10.1016/j.mce.2011.09.015 | |
| Wang S, Behan J, O'Neill K, et al. Identification and pharmacological characterization of a novel human melanin-concentrating hormone receptor, mch-r2. Journal of Biological Chemistry , 2001, 276 (37) : 34664-34670 DOI:10.1074/jbc.M102601200 |



