2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306;
4. 日照市生态环境研究所 日照 276805
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
4. Ecological Environment Institute of Rizhao, Rizhao 276805
在鱼类集约化养殖条件下,高密度饲养容易在养殖池内蓄积较高浓度的氨氮和亚硝酸盐等有害物质,导致有害菌和条件致病菌大量滋生,从而降低鱼体抗病力,极易诱发疾病(Torrecillas et al, 2007)。微生态调控是从生态学角度对养殖水环境进行修复的一种安全、无污染、无残留的水质调控技术,其原理主要是通过益生菌改善养殖水环境及养殖鱼类肠道中的菌群结构,降低养殖水体中有害物质的浓度或者抑制病原菌的繁生(Crad et al, 2012; Avnimelech, 2007),可有效避免因大量使用抗生素带来的安全隐患。微生态制剂在水产养殖业的应用研究最早始于1986年,现在已被广泛用于制作有效调节水产动物肠道菌群平衡的饲料添加剂(杨艳等, 2013)。然而,微生态制剂的种类繁多,有单一菌种的微生态制剂,也有多种益生菌组成的复合型微生态制剂,其效果不一。很多微生态制剂存在作用时间短、效果不稳定等问题,其原因在于对菌种的分类保存、生理生化特性、功能及使用方式认识不足,限制了高效微生态制剂的研制和应用。
目前,微生态制剂已越来越广泛地应用于水产养殖环境调控和养殖物种的生长促进等方面,如芽孢杆菌(Bacillussp.)在水产养殖水质调控(刘卫东等, 2001; 王彦波等, 2003; 李健等, 2001)、养殖鱼类生长促进(华雪铭等, 2001)、养殖虾类肠道菌群调控(Dalmin et al, 2001)等方面都起到了较好的效果。植物乳杆菌(Lactobacillus plantarum)多在畜牧业中应用,可促进宿主对食物的消化吸收,提高宿主免疫力,降解氨等有害物质,减少环境污染等(温灿权等, 2014)。但是,微生态制剂在海水鱼类养殖方面的应用研究很少,其对养殖水质和养殖环境调控的相关机制尚不明了。本研究分离、纯化和鉴定出两株有益菌,并探讨了其适宜的培养条件及对水体中氨氮、亚硝酸盐、磷酸盐的降解效果,以期为开发绿色高效的海水养殖微生态制剂提供理论依据和技术支撑。
1 材料与方法 1.1 样品采集2014年春季,在山东省日照市傅疃河入海口附近采集底泥样品,置于经灭菌处理的容积为100 ml的安瓿瓶中,放入冰盒内,当天返回实验室,用于细菌分离培养。
1.2 菌株分离与培养将污泥用无菌水制成悬浮液,以300目筛绢网过滤,滤液6000 r/min离心,弃去上清液,再以无菌水制成混悬液。在超净操作台中,取1 ml混悬液样品,加入含9 ml TSB液体培养基的试管中,按1:10梯度制成6个梯度稀释液,分别取100 μl均匀涂布于TSB固体培养基上,置于28℃恒温培养箱中培养72 h。按照形态特征,挑取优势生长的单菌落置于TSB液体培养基中,28℃条件下培养24 h,再分别以接种环平板划线的方式接种于TSB固体培养基上,28℃恒温培养72 h。重复平板划线操作3次,直至培养基上存在单一菌落。
1.3 菌株鉴定 1.3.1 革兰氏染色与镜检取新鲜单菌体进行革兰氏染色,步骤参照试剂盒(青岛海博生物技术有限公司)说明书。光学观察进行形态鉴别,参照《伯杰细菌鉴定手册》、《常见细菌系统鉴定手册》(布坎南等, 1995; 东秀珠等, 2001)进行。
1.3.2 分子鉴定利用土壤基因组DNA提取试剂盒提取细菌总DNA (OMEGA,美国)。扩增16S rRNA基因的正向引物为27F: 5 -AGAGTTTGAT CCTGGCTCAG-3 ,反向引物为1492R: 5 -GGTTAC CTTGT TACGACTT-3 。PCR扩增采用50 μl反应体系:10×PCR Buffer 5 μl,dNTPs 4 μl,正反向引物各1 μl,Taq酶0.25 μl,细菌裂解液1.0 μl,ddH2O 37.25 μl。PCR反应条件:95℃变性5 min,30个循环(95℃ 30 s,56℃ 30 s,72℃ 50 s),最后72℃延伸10 min。电泳检测、切胶回收、连接、转化后,在LB平板涂布,37℃恒温培养。挑单菌落LB液体培养基扩培,以通用引物M13进行菌液PCR检测,将阳性克隆送至生工生物工程(上海)股份有限公司测序。将菌株测序结果进行BLAST检索,筛选同源性高的细菌16S rRNA基因序列,构建系统发育进化树。
1.3.3 生理生化特性分析参照《常见细菌系统鉴定手册》方法(东秀珠等, 2001),利用细菌微量生化鉴定管(青岛海博生物技术有限公司)进行生理生化鉴定。
1.4 适宜生长条件确立根据菌种鉴定结果,在温度为30℃、盐度为28的条件下,设置6.0、6.5、7.0共3个pH梯度,每个梯度设置3个平行。分别吸取20 μl分离纯化的菌液于1 ml TSB液体培养基中,150 r/min、30℃培养复苏2 h。将复苏的菌液各20 μl加入到不同pH的培养液中,150 r/min、30℃培养48 h。每2 h取50 μl培养液,比色皿中稀释至1 ml,根据OD值绘制生长曲线,以最先进入生长平台期为基准确定最佳生长pH。
在pH为6.0、盐度为28的条件下,设置30℃、33℃、36℃、39℃共4个温度,每个梯度设置3个平行。分别吸取20 μl分离纯化的菌液于1 ml TSB液体培养基中,150 r/min、30℃培养复苏2 h。将复苏的菌液各20 μl加入到不同温度的培养液中,150 r/min、30℃培养48 h。每2 h取50 μl培养液,在比色皿中稀释至1 ml,根据OD值绘制生长曲线,确定最佳生长温度。
1.5 水质调控效果测试水质调控实验分别在实验室条件和牙鲆(Paralichthys olivaceus)养殖池塘中进行,将两株益生菌(菌株A和菌株B)生产性扩大培养,至相同浓度时,按1:1的比例混合后添加到实验组中。水质检测指标包括氨氮、亚硝酸盐和磷酸盐。氨氮的测定采取水杨酸-次氯酸盐光度法(GB7481-87)进行,亚硝酸盐测定采用重氮化偶合光度法(GB 7493-87),磷酸盐的测定采用抗坏血酸钼氨酸分光光度法(GB 11893-89),使用哈希水质分析仪(DR/890, 美国)测定各参数值。
在实验室条件下,利用标准溶液制作标准曲线,以化学试剂配制不同浓度的氨氮、磷酸盐和亚硝酸盐溶液,设为实验组,起始浓度分别设置为0.22、0.25和0.05 mg/L,每组3个重复。将一定浓度的菌株A (OD600 nm=2.33)和菌株B (OD600 nm=2.23)培养液按照1:1混合,添加至实验组(添加密度为10×104cell/ml),对照组不添加,每24 h分别测定实验组氨氮、亚硝酸盐和磷酸盐含量变化,连续监测8 d。实验期间,各实验组实测水温为21-23℃。
选取2个泥沙底质、面积为0.33 hm2且放养同等数量牙鲆的池塘2口,池塘日换水率为50%。实验池塘按1:1的比例添加菌株A和菌株B的混合制剂,添加密度为5×104-10×104cell/ml。池塘日换水率为50%,换水后按照初始添加量的50%补充添加益生菌,维持池塘内有益菌浓度;不添加有益菌制剂的池塘作为对照组。实验进行10 d,实验期间,实验池塘和对照池塘内实测水温为20-23℃,每天检测、记录2组池塘中氨氮、磷酸盐和亚硝酸盐水平的变化。
1.6 数据分析对16S rRNA基因测序结果进行在线同源序列比对(http://blast.ncbi.nlm.nih.gov)。使用BioEdit进行同源性分析,采用MEGA 6.0软件Neighbor-Joining Method法构建系统发育进化树。利用SPSS 21.0统计软件对数据进行统计处理。设置差异显著性水平P为0.05,当P<0.05时认为差异显著,当P<0.01时认为差异极显著。
2 结果与分析 2.1 菌落特征TSB培养基初步筛选到2种不同形态特征的菌落。一种菌落呈圆形,边缘完整,中间凸起,乳白色,表面湿润光滑,数量多,标记为菌落A。经多次挑取单菌落、划线培养,最终得到优势明显的单一菌落A,半透明;另外一种菌落呈圆形,边缘不整齐,菌落整体扁平,暗黄色,表面干燥,菌落相对较大,标记为菌落B。
2.2 细菌形态特征革兰氏染色后,光镜(油镜)下观察菌株A和菌株B的形态特征(图 1)。菌株A菌体革兰氏染色阳性,短杆状、近球形,单个或者短链状排列(图 1-A);菌株B菌体革兰氏染色阳性,长直杆状,成对链状排列,可观察到卵圆形的芽孢(图 1-B)。
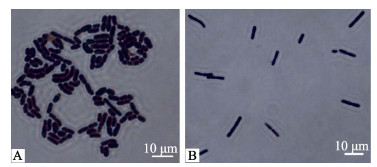
|
图 1 菌株A和菌株B的形态特征 Figure 1 Morphology of bacteria strain A and bacteria strain B |
菌株A和菌株B的16S rRNA基因扩增产物大小分别为1591 bp和1595 bp (图 2)。BLAST同源性比对分析结果表明,菌株A为植物乳杆菌,同时,筛选同源性高的细菌16S rRNA基因序列,构建了其系统发育进化树(图 3);菌株B的16S rRNA序列与枯草芽孢杆菌(Bacillus subtilis)的新种(Bacillussp. BSi20565,登录号EU330341.1)序列的相似度达到99%,鉴定其属于芽孢杆菌属与枯草芽孢杆菌相似种。
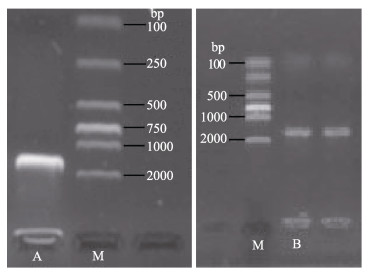
|
图 2 菌株A (左)和菌株B (右)的DNA琼脂糖凝胶电泳 Figure 2 Agarose gel electrophoresis of DNAs from strain A (left) and strain B (right) |

|
图 3 菌株A基于16S rRNA序列的系统发育进化树 Figure 3 Phylogenetic tree of strain A and other bacteria based on 16S rRNA sequences |
菌株A和B的生理生化特征分别见表 1和表 2。根据《常见细菌系统鉴定手册》(东秀珠等, 2001)和《伯杰氏细菌鉴定手册》(布坎南等, 1984)植物乳杆菌和芽孢杆菌属特征,比对测试结果显示,菌株A生理生化特性与植物乳杆菌一致,菌株B生理生化特性与芽孢杆菌属一致,但尚未对应到具体种。
|
|
表 1 菌株A生理生化特性 Table 1 Physiological and biochemical characteristics of strain A |
|
|
表 2 菌株B生理生化特性 Table 2 Physiological and biochemical characteristics of strain B |
在培养温度为30℃、盐度为28时,不同pH对植物乳杆菌生长影响差异不显著,但在pH=6.5时,植物乳杆菌生长曲线最先进入快速增长期,达到平台期的时间最短(图 4),表明此pH条件下其生长状态最好。
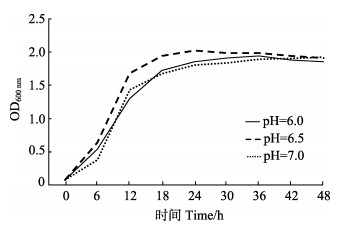
|
图 4 不同pH下菌株A (植物乳杆菌)的生长曲线 Figure 4 Growth curve of strain A (L. plantarum) in different pH |
在培养条件设定为pH=6.5、盐度为28时,不同温度对植物乳杆菌生长影响差异不显著,但在温度为30℃时,植物乳杆菌生长曲线最先进入快速增长期,达到平台期的时间最短(图 5),说明30℃是植物乳杆菌生长的最适宜温度。
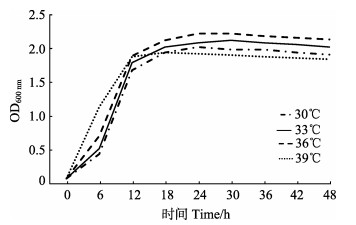
|
图 5 不同温度下菌株A (植物乳杆菌)的生长曲线 Figure 5 Growth curve of strain A (L. plantarum) under different temperatures |
当培养条件设定温度为30℃、盐度为28时,不同pH对枯草芽孢杆菌(菌株B)生长的影响见图 6。在pH=6.0的条件下,枯草芽孢杆菌生长曲线最先进入快速增长期,达平台期所用时间最短,说明pH=6.0时菌株B生长状态最好。
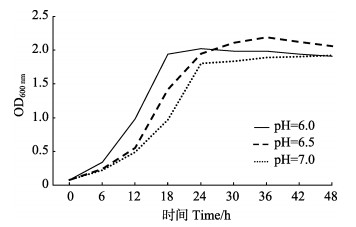
|
图 6 不同pH下菌株B (枯草芽孢杆菌)的生长曲线 Figure 6 Growth curve of bacteria strain B (B. subtilis) in different pH |
在pH=6.0、盐度为28的培养条件下,当温度设置为36℃时,枯草芽孢杆菌(菌株B)生长曲线最先进入快速增长期,达到平台期所用时间最短(图 7),说明36℃为菌株B的最适生长温度。
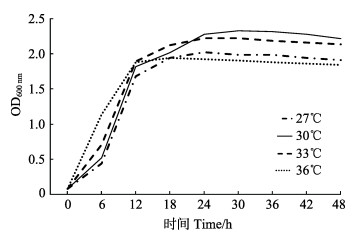
|
图 7 不同温度下菌株B (枯草芽孢杆菌)生长曲线 Figure 7 Growth curve of bacteria strain B (B. subtilis) under different temperatures |
在实验室条件下,添加益生菌后,实验组氨氮、亚硝酸盐和磷酸盐含量逐渐降低。其中,氨氮含量自第3天开始降低,至第4天氨氮含量显著下降(P < 0.05),其后维持较低水平,降解率达73.2%;实验组亚硝酸盐含量缓慢下降,第5天后基本达到稳定状态,降解率达到58.0%;实验组磷酸盐含量持续降低,至第4天后达到稳定状态,降解率达到52.4%(表 3)。对照组营养盐浓度未有明显变化,未在表 3中列示。
|
|
表 3 实验室条件下有益菌对水中营养盐的降解效果 Table 3 Degrading effects of the obtained probiotics on water nutritive salts under laboratory conditions |
添加2种益生菌混合液后,与对照池塘相比,添加益生菌的池塘水体中氨氮、亚硝酸盐和磷酸盐含量明显降低(表 4)。其中,实验池塘养殖水体中氨氮含量在6 d内没有明显变化,维持在0.41-0.51 mg/L之间,自第7天开始,氨氮含量明显下降,至实验结束时,氨氮降解率达86.3%;实验池塘养殖水体中磷酸盐含量自添加第4天开始显著下降,实验结束时,降解率达88.9%;实验池塘养殖水体中亚硝酸盐含量自添加后逐渐降低,最大降解率达到68.3%。
|
|
表 4 有益菌对池塘养殖水体中营养盐的降解效果 Table 4 Degrading effects of the obtained probiotics on nutritive salts in pond water |
本研究自河口污泥中利用培养基分离纯化,获得了两株细菌,经形态观察、分子鉴定、生理生化特性分析,鉴定其中一株为植物乳杆菌,另一株菌16S rRNA序列与枯草芽孢杆菌的新种序列相似度达99%。一般认为,16S rRNA序列同源性大于99%,可以认为属于同一种(Fry et al, 1991)。NCBI数据库已登录的枯草芽孢杆菌可能为新种,尚未命名,作者试图通过生理生态特性进一步确认,但仍未得到明确结果,具体种的鉴定和命名尚有待于今后进一步研究确认。
无论是淡水还是海水养殖条件下,养殖水体中氨氮、亚硝酸盐和磷酸盐等营养盐均会显著影响养殖鱼类的正常生长。芽孢杆菌在自然界中广泛存在,具有营养简单、繁殖迅速、适应能力强、抑制病原菌生长、产生物酶等特点。目前,芽孢杆菌已在水产养殖中应用,对养殖水体中氨氮等营养盐物质都具有较好的降解效果(白小丽, 20131); 邱燕, 20102); 李卫芬等, 2011; 张克强等, 2006; 郑虹等, 2005)。植物乳杆菌是乳酸菌的一种,是厌氧细菌(兼性好氧),可大量产酸控制水中pH值稳定,且在繁殖过程中能产出特有的乳酸杆菌素,在食品工业乳酸发酵等领域有着广泛的应用(王水泉等, 2010)。植物乳杆菌在水产养殖水质调控中的应用研究不多,且效果不一(齐欣等, 2007),对海水池塘水质调控效果研究未见报道。本研究建立了这两株有益菌适宜生长的pH和温度条件,为其生产性应用提供了支撑。本研究表明,将两株纯化培养的菌株按照1:1的比例混合后添加,无论是在实验室条件下,还是在池塘养殖条件下,都对水中氨氮、亚硝酸盐和磷酸盐具有显著的降解效果,实验室条件下各组分的降解率达52%以上,池塘水体中各组分的降解率达68%以上。但是,两种实验条件下,实验组水体中营养盐含量在第3天后才明显降低,表明有益菌起作用时间较晚,可能与有益菌未提前进行活化有关,今后生产应用过程中应提前利用糖等优质碳源对有益菌进行活化,以提高其作用效果。
1) Bai XL. The studies on ammonia excretions by grass carp (Ctenopharyngodon idellus) and mandarin fish (Siniperca chuatsi) and the effect of probiotics on the water quality of mandarin fish pond. Masterxs Thesis of Huazhong Agricultural University, 2013, 6 [白小丽.草鱼、鳜鱼氨氮排泄研究及微生态制剂对鳜鱼养殖池塘的影响.华中农业大学硕士研究生学位论文, 2013, 6]
2) Qiu Y. Effects of three micro-ecological agents on growth performance, physiological function and intestinal mucosa of grass carp (Ctenopharyngodon idellus). Masterxs Thesis of Soochow University, 2010, 5 [邱燕.三种微生态制剂对草鱼(Ctenopharyngodon idellus)生长性能、生理机能及肠道黏膜的影响.苏州大学硕士研究生学位论文, 2010, 5]
本研究发现,本次实验所使用的益生菌制剂对池塘水质调控的效果较实验室条件下的水质调控效果好,其原因可能在于池塘中所添加的益生菌与池塘养殖水体和底泥中的物质发生互作反应,同时,池塘养殖环境促进了菌株的生长和繁殖,增加了其密度,从而提高了其对污染物质的降解效果,具体的原因和机制尚有待于深入开展养殖环境微生物群落变化规律研究来确定。另外,本研究将两株菌1:1比例混合后应用,对于哪个菌株发挥关键调控作用尚未明确,今后应开展单菌株对水中营养盐的降解实验,明确两株有益菌各自的水质调控效果。
| Avnimelech Y. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds. Aquaculture , 2007, 264 (1) : 140-147 | |
| Buchanan RE, Gibbons NE. Berger's bacterial identification manual (Version 8). Beijing: Science Press, 1984 : 729 -758. [布坎南RE, 吉本斯NE. 伯杰氏细菌鉴定手册. 北京: 科学出版社, 1984 : 729 -758.] | |
| Crad R, Defoirdt T. Biofloc technology in aquaculture: Beneficial effects and future challenges. Aquaculture , 2012, 356-357 (4) : 351-356 | |
| Dalmin G, Kathiresan K, Purushothaman A. Effect of probiotics on bacterial population and health status of shrimp in culture pond ecosystem. Indian Journal of Experimental Biology , 2001, 39 (9) : 939-942 | |
| Dong XZ, Cai MY. Chang Jian Xi Jun Xi Tong Jian Ding Shou Ce. Beijing: Science Press, 2001 . [东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001 .] | |
| Fry NK, Warwick S, Saunders NA, et al. The use of 16S ribosomal RNA analyses to investigate the phylogeny of the family legionellaceae. Journal of General Microbiology , 1991, 137 (5) : 1215-1222 DOI:10.1099/00221287-137-5-1215 | |
| Hua XM, Zhou HQ, Qiu XZ, et al. Effects of dietary Bacillussp. and selenoyeast on the growth and disease resistance of allogynogenetic crucian carp. Journal of Fisheries of China , 2001, 25 (5) : 448-453 [华雪铭, 周洪琪, 邱小踪, 等. 饲料中添加芽杆菌和硒酵母对异育银卿的生长及抗病力的影响. 水产学报 , 2001, 25 (5) : 448-453] | |
| Li J, Sun XT, Wang Q, et al. Studies on the effects of probiotics in Crustacean s farming. Marine Fisheries Research , 2001, 22 (2) : 26-31 [李健, 孙修涛, 王群, 等. 微生态制剂在甲壳动物养殖中的应用研究. 海洋水产研究 , 2001, 22 (2) : 26-31] | |
| Li WF, Zhang XP, Song WH, et al. Application of Bacillus to water quality control in grass carp culture. Fisheries Modernization , 2011, 38 (4) : 22-26 [李卫芬, 张小平, 宋文辉, 等. 芽孢杆菌对草鱼养殖水质调控作用的研究. 渔业现代化 , 2011, 38 (4) : 22-26] | |
| Liu WD, Su H, Deng LK. Applications of microorganisms in aquaculture. Fisheries Science , 2001, 20 (2) : 28-31 [刘卫东, 苏浩, 邓立康. 微生物在水产养殖中的应用. 水产科学 , 2001, 20 (2) : 28-31] | |
| Qi X, Wei XS, Chen Y, et al. Effect of probiotics on growth performance of Carassius auratus var Pengze and water quality. Chinese Feed , 2007 (17) : 27-29 [齐欣, 魏雪生, 陈颖, 等. 益生菌对彭泽鲫生长性能及水体环境的影响. 中国饲料 , 2007 (17) : 27-29] | |
| Torrecillas S, Makol A, Cabaliero MJ, et al. Immunostimulations and improved infection resistance in European sea bass (Dicentrarchus labrax) fed mannan oligosaccharides. Fish and Shellfish Immunology , 2007, 23 (5) : 969-981 DOI:10.1016/j.fsi.2007.03.007 | |
| Wang SQ, Bao Y, Dong XM, et al. Physiological function and application of Lactobacillus planetarium. Journal of Agricultural Science and Technology , 2010, 12 (4) : 49-55 [王水泉, 包艳, 董喜梅, 等. 植物乳杆菌的生理功能及应用. 中国农业科技导报 , 2010, 12 (4) : 49-55] | |
| Wang YB, Deng YS. Study on the effect of probiotics on pond water quality. Water Conservancy and Fisheries , 2003, 23 (2) : 16-17 [王彦波, 邓岳松. 微生态制剂对虾池水质影响的研究. 水利渔业 , 2003, 23 (2) : 16-17] | |
| Wen CQ, Dai JJ, Huang MD, et al. Isolation, identification and growth characteristics of a strain of Lactobacillus planetarium. Fujian Journal of Animal Husbandry and Veterinary medicine , 2014, 36 (3) : 18-23 [温灿权, 戴佳佳, 黄梅丹, 等. 一株植物乳杆菌的分离鉴定及其生长特性研究. 福建畜牧兽医 , 2014, 36 (3) : 18-23] | |
| Yang Y, Pan BH, Sun XF. Function of Lactobacillus planetarium and its application in animal production. Feed Research , 2013 (2) : 36-37 [杨艳, 潘宝海, 孙笑非. 植物乳杆菌的功能及其在动物生产中的应用. 饲料研究 , 2013 (2) : 36-37] | |
| Zhang KQ, Li Y, Li JX. Application of the compound microbiological preparation in fish pond. Marine Sciences , 2006, 30 (9) : 88-91 [张克强, 李野, 李军幸. 芽孢杆菌菌剂在水产养殖中的应用初探. 海洋科学 , 2006, 30 (9) : 88-91] | |
| Zheng H, Shi QQ, Shi BH, et al. Comparison of Bacillussp. on depuration of aquaculture water-body. Journal of Microbiology , 2005, 25 (6) : 41-44 [郑虹, 施巧琴, 施碧红, 等. 芽孢杆菌对比养殖水体净化作用的比较研究. 微生物学杂志 , 2005, 25 (6) : 41-44] |



