2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 大连海洋大学 大连 110623
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. Dalian Ocean University, Dalian 110623
半滑舌鳎(Cynoglossus semilaevis)是我国重要的海水养殖经济鱼类(柳学周等, 2005),其养殖产业是我国北方海水养殖业的重要组成部分,在一定程度上代表了我国水产养殖业,尤其是海水养殖业的发展方向(杨正勇等, 2009)。近年来,半滑舌鳎生殖调控及规模化人工繁育技术的研究获得重大突破(柳学周等, 2006),但在生产实践中,时常出现亲鱼产卵质量差等现象,影响了苗种生产(史宝等, 2013)。因此,研究其生殖内分泌调控等方面的机理显得尤为重要。
膜孕激素受体(mPR)介导孕激素在细胞膜上发挥生理学功能,如参与鱼类卵母细胞的成熟(Hanna et al, 2009; Mourot et al, 2006; Tokumoto et al, 2006; Tubbs et al, 2010)。在鱼类生殖相关组织如卵巢和脑等检测到mPRs蛋白的表达,表明它们在卵巢和脑中介导孕激素行使不同的作用(Hanna et al, 2009)。mPRα作为mPRs家族的重要受体基因,在其中扮演着重要的角色,研究其表达对了解整个mPR家族的功能具有重要意义。目前,mPRα在人类(Homo sapiens)、小鼠(Mus musculus)等动物研究中有很多新进展(Frye et al, 2014; Thomas et al, 2014; Lu et al, 2015),近几年在斑马鱼(Danio rerio) (Thomas, 2012)、金鱼(Carassius auratus) (Kazeto et al, 2005a、b; Oshima et al, 2014)、漠斑牙鲆(Paralichthys lethostigma) (Tan et al, 2014a)和大西洋绒须石首鱼(Micropogonias undulatus) (Tan et al, 2014b)几种硬骨鱼类中有研究。但在重要海水经济鱼类半滑舌鳎中的研究鲜有报道,史宝等(2013)研究了mPRα基因在性成熟半滑舌鳎各组织中的表达分布,但有关mPRα的空间定位表达及生理功能研究仍相对较少,相关研究工作亟待开展。
本研究通过实时荧光定量PCR (qRT-PCR)、原位杂交、Western blotting和免疫组化等方法从基因和蛋白水平对mPRα在半滑舌鳎不同发育阶段卵母细胞和组织中的表达进行了定量和定位研究,为mPRα在半滑舌鳎卵母细胞成熟过程中的生理功能提供重要参考资料,并为鱼类繁殖内分泌调控研究提供科学依据,同时为多产优产的目标提供解决思路。
1 材料与方法 1.1 实验动物实验用半滑舌鳎取自山东青岛忠海水产有限公司。雌性半滑舌鳎亲鱼全长为53-66 cm,体重为1266.3-2271.0 g。实验所用的亲鱼为人工培育养殖达到性成熟的3龄全人工亲鱼。不同繁殖期在相同亲鱼培育池中随机选取4条半滑舌鳎雌鱼,分别对不同繁殖期鱼的卵巢取样,连续采集1年。解剖前先用MS-222(Sigma公司)麻醉亲鱼,部分卵巢组织取出后放于Davidson's AFA中固定,显微镜下按不同发育时相直径将卵巢组织的卵母细胞分类(柳学周等, 2015),使用液氮速冻后保存在-80℃,一部分样品用于提取RNA,另一部分样品用于提取蛋白。在半滑舌鳎繁殖季节,挑选腹部有明显膨大隆起且柔软的雌鱼,取各组织样,将其分为3部分,在4℃条件下使用4%多聚甲醛固定20 h,梯度甲醇脱水,在-20℃条件下保存于甲醇中,一部分用于免疫组化,一部分样品用于原位杂交;使用液氮速冻后保存在-80℃的样品,用于总RNA和总蛋白的提取。在显微镜下按不同发育时相将卵巢组织的卵母细胞分类,一部分样品用于促性腺激素(HCG)处理并培养,另一部分不处理作为对照,处理完的卵母细胞放于-80℃保存,用于之后的总RNA和总蛋白的提取。
1.2 总RNA提取、cDNA的合成和qRT-PCR半滑舌鳎不同发育阶段卵母细胞取自不同性腺发育期,卵巢分期参考柳学周等(2009)。每个卵母细胞发育时相设4个重复,从不同发育时期的半滑舌鳎中分别挑取Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ时相卵母细胞,提取总RNA进行反转录并参照TaKaRa生物公司的PrimerScriptTM RT Reagent Kit with gDNA Eraser试剂盒合成cDNA第一链,用于基因表达分析。ST-mPRαF引物序列:5′-CTCCATCTATCGGCTTCA AACAA-3′;ST-mPRαR:5′-ACCAATCTGCTCCATCA CCAC-3′,引物由TaKaRa生物公司合成。qRT-PCR反应体系为20 μl:1 μl cDNA模板,0.5 μl引物(10 μmol/L),10 μl SYBR Premix Ex TaqTM Ⅱ和8 μl ddH2O。采用两步法PCR扩增程序,反应条件为95℃预变性30 s,95℃ 5 s、60℃ 20 s,共40个循环。使用18S rRNA基因作为内参对照,用以校正所有样品中RNA的量。qRT-PCR反应及信息收集均在Mastercycler ep realplex实时荧光定量PCR仪(Eppendorf公司)上进行。程序运行完成后,进行熔解曲线分析,以确定引物及反应是否正常。每个样品设置3个平行,重复3次实验,同时设阴性对照,以确认实验结果的可靠性。
1.3 mPRα原位杂交质粒构建、探针合成与纯化根据半滑舌鳎mPRα cDNA序列设计和合成引物。上游:5′-AAGCTTCAGCCTTCACCTACCTCTCC T-3′;下游:5′-GAATTCGCAGGCAGTGAAGATGAA CAG-3′。PCR预期扩增产物为650 bp,1%琼脂糖凝胶电泳检测扩增产物。分别用限制性内切酶Hind Ⅲ和EcoR Ⅰ(均购自NEB公司)对回收的PCR产物和载体pBST-18进行双酶切,1%琼脂糖凝胶电泳检测后,试剂盒回收。然后通过T4快速连接酶(购自NEB公司)进行连接,将PCR产物克隆到pBST-18载体中。再将连接产物转化到大肠杆菌DH5α感受态细胞(全式金),挑取PCR检测阳性克隆,扩增培养,小量提取质粒,用Hind Ⅲ和EcoR Ⅰ进行双酶切鉴定,然后测序验证。将扩增后的阳性菌落提取的质粒分别用限制性内切酶Hind Ⅲ和EcoR Ⅰ酶切,使其完全线性化,1%琼脂糖电泳检测并回收。回收的酶切片段即为合成正、反义RNA探针的模板。按Roche公司的DIG RNA Labeling Kit (SP6/T7)试剂盒说明书,分别用SP6、T7转录酶进行体外转录,参照产品说明书合成地高辛标记的正、反义RNA探针。合成的RNA探针用1%琼脂糖电泳和紫外分光光度计鉴定检测。
1.4 mPRα mRNA在成熟雌鱼组织中的定位采用Roche公司的DIG Wash and Block Buffer Set、Blocking Reagent和NBT/BCIP Stock Solution试剂盒进行。详细操作参照产品说明书。
二甲苯脱蜡处理3次,每次5 min;无水乙醇处理2次,每次10 min;95%、70%和50%乙醇逐级脱水,各处理5 min。4% PFA-PBS固定10 min。PBS洗涤3次,每次10 min。0.2 mol/L的HCl处理10 min。PBST冲洗2次,每次10 min。10 μg/ml蛋白酶K (默克公司)消化10 min。PBST冲洗3次,每次5 min。加入含tRNA和肝素预杂交液,70℃预杂交8 h,再加入反义RNA探针200 ng的杂交液,70℃过夜。50%无tRNA和肝素的预杂交液和50% 2×SSC,70℃,15 min,0.2×SSC,70℃,1 h。1×MAB室温5 min。含10%山羊血清(博奥森公司)的封闭液室温封闭,6 h。1:500封闭液稀释的抗体,4℃过夜。PBST室温冲洗6次,每次15 min;碱性磷酸缓冲液室温冲洗2次,每次10 min。加200 μl BCIP/NBT底物溶液,置黑暗处显色,观察颜色变化。待显色达到理想着色后,PBST洗涤5次(每次5 min)终止反应,4% PFA-PBS固定10 min,PBST洗3次(每次5 min);酒精梯度脱水、二甲苯透明,封片,拍照。
1.5 成熟雌鱼组织中mPRα蛋白定量分析取冻存的各组织(约100 mg),加入1 ml动物组织蛋白提取试剂,使用Pro精密手持匀浆器充分匀浆,冰浴中静置30 min,于4℃、12000 r/min离心30 min,取上清液,即得到组织蛋白提取液。12% SDS-PAGE电泳检测提取蛋白的质量,并使用蛋白测定试剂盒(Thermo Scientific公司)测定组织总蛋白浓度。分析半滑舌鳎mPRα蛋白序列选择抗原表位,并合成相应的免疫多肽;将合成的多肽常规免疫新西兰大白兔,制备抗体。使用此多克隆抗体进行Western blotting,检测蛋白的表达水平。
12% SDS-PAGE蛋白电泳,每孔上样量约80 μg,220 V 25 min。转膜:缓冲液泡凝胶15 min,将滤纸在缓冲液中浸泡15 min;PVDF膜甲醇中浸泡1 min,缓冲液中浸泡15 min,活化PVDF膜;按阳极-滤纸-PVDF膜-凝胶-滤纸-阴极的顺序放入半干式转膜仪,400 mA 25 min。洗涤取出PVDF膜,1×PBST洗涤;5%脱脂奶粉溶液封闭(1×PBST稀释)室温3 h;洗涤;加溶解一抗与3% BSA (1:2000)摇床,室温2 h;洗涤;二抗(羊抗兔IgG抗体) (1×PBST 1:2000稀释) [生工生物工程(上海)股份有限公司]摇床,室温2 h;洗涤;DAB显色拍照,分析灰度。
1.6 mPRα蛋白在成熟雌鱼组织中的表达定位将保存在100%甲醇中的样品取出,使用无水乙醇处理2次(每次10 min);二甲苯透明,石蜡包埋,7 μm厚度石蜡切片,37℃烘干。具体免疫组化切片处理过程和条件如下(阴性对照:1×PBS代替一抗,其余步骤同下):二甲苯脱蜡2次,每次5 min;梯度乙醇复水各3 min;1×PBST洗涤;3% H2O2(溶于甲醇中)室温孵育15 min,封闭内源酶;洗涤;0.01 mol/L柠檬酸盐缓冲液微波炉加热沸腾后,中低档保持95℃ 20 min,自然冷却至室温修复抗原;洗涤;3% BSA封闭(溶于1×PBST),摇床上室温振摇2 h。抗mPRα抗体(1:1000)稀释,溶于3% BSA,滴加到载玻片上,使其完全覆盖组织切片,湿盒中室温过夜;洗涤。二抗,即羊抗兔IgG抗体(1:1000稀释在1×PBST中)滴加到载玻片上,湿盒中室温1 h;洗涤;DAB显色;洗涤;苏木精染液复染3-5 min;0.1% HCl分化复蓝后,立即自来水冲洗;梯度乙醇脱水;二甲苯透明2 min;封片;拍照。
1.7 HCG调控卵母细胞mPRα mRNA和蛋白的表达从半滑舌鳎不同发育阶段的卵巢分离出不同发育时相、未受损的卵母细胞。24孔细胞培养板上每个孔放入pH为7.6的2 ml培养液(SIGMA,美国),培养液添加HCG溶液(SIGMA,美国),使其终浓度为10 IU/ml或20 IU/ml,同时,每个激素添加实验组相应设置1个空白对照组。卵母细胞经22℃、6 h培养后,使用移液器将培养液移出,收集卵母细胞,迅速放入液氮中冻存,用于mRNA和蛋白表达分析;每个样品设置3个平行,重复3次实验。
1.8 统计分析基因表达实验所得数据用相对定量的2-△△Ct方法(Livak et al, 2001)计算后,使用SPSS 17.0软件的单因素方差分析(One-way ANOVA)(Tukey’s HSD检验)进行数据处理。P < 0.05为差异显著。相对表达量数据均表示为平均数±标准误(Mean±SE)。蛋白表达水平检测采用AIC.AlphaView成像分析系统(Cell Biosciences Inc)分析灰度值。
2 结果 2.1 半滑舌鳎不同发育期的卵母细胞不同时相mPRα mRNA相对表达量比较在性腺发育Ⅱ期,处于Ⅱ时相的卵母细胞中mPRα mRNA的表达量最高;在性腺发育Ⅲ、Ⅳ期,mPRα mRNA表达量最高值分别出现在Ⅲ、Ⅳ时相的卵母细胞中;性腺发育Ⅴ期鱼的卵母细胞中,mPRα mRNA表达量最高值出现在Ⅴ时相卵母细胞(P < 0.05)。卵母细胞mPRα mRNA表达的最高值出现在性腺发育Ⅴ期(P < 0.05)。mPRα mRNA在性成熟半滑舌鳎的Ⅴ时相卵母细胞的作用效果最强(图 1)。

|
图 1 不同发育时期半滑舌鳎卵母细胞不同时相mPRα mRNA的相对表达 Figure 1 The relative expression of mPRa mRNA at different oocyte phases in different development stage of C. semilaevis 不同字母间差异显著(P < 0.05),下同 Different letters represent significant difference (P < 0.05), the same as below |
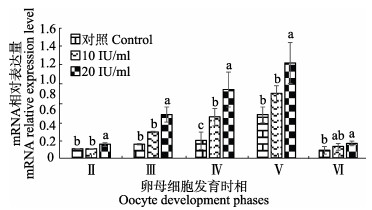
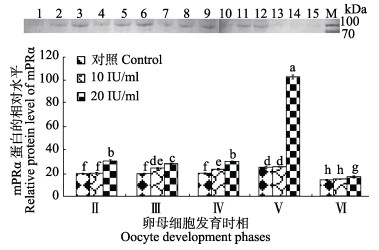
利用qRT-PCR、Western blotting技术,检测不同浓度HCG处理下半滑舌鳎卵母细胞mPRα mRNA和蛋白表达情况。结果显示,用20 IU/ml和10 IU/ml HCG处理的不同时相卵母细胞中mPRα mRNA (图 2)和蛋白(图 3)的表达量都有所提高。20 IU/ml HCG培养的细胞中mPRα mRNA和蛋白表达量远高于10 IU/ml HCG培养的卵母细胞中mPRα mRNA和蛋白的表达量。蛋白表达结果显示,20 IU/ml HCG对成熟时期半滑舌鳎Ⅴ时相卵母细胞调控作用最明显。
|
图 2 不同浓度HCG调控半滑舌鳎不同发育阶段卵母细胞mPRα mRNA的表达 Figure 2 Effects of HCG at different concentrations on mPRα mRNA expression in different oocyte phases of C. semilaevis |
|
图 3 不同浓度HCG对不同时期卵母细胞mPRα蛋白表达量的影响 Figure 3 Effects of HCG at different concentrations on mPRα protein expression in different oocyte phases of C. semilaevis 1:对照组, Ⅱ期卵母细胞; 2: 10 IU/ml HCG, Ⅱ期卵母细胞; 3: 20 IU/ml HCG, Ⅱ期卵母细胞; 4:对照组, Ⅲ期卵母细胞; 5: 10 IU/ml HCG, Ⅲ期卵母细胞; 6: 20 IU/ml HCG, Ⅲ期卵母细胞; 7:对照组, Ⅳ期卵母细胞; 8: 10 IU/ml HCG, Ⅳ期卵母细胞; 9: 20 IU/ml HCG, Ⅳ期卵母细胞; 10:对照组, Ⅴ期卵母细胞; 11: 10 IU/ml HCG, Ⅴ期卵母细胞; 12: 20 IU/ml HCG, Ⅴ期卵母细胞; 13:对照组, Ⅵ期; 14: 10 IU/ml HCG, Ⅵ期卵母细胞; 15: 20 IU/ml HCG, Ⅵ期卵母细胞; M:分子量标准 1: Control group, stage Ⅱ oocytes; 2: 10 IU/ml HCG, stageⅡ oocytes; 3: 20 IU/ml HCG, stage Ⅱ oocytes; 4: Control group, stage Ⅲ oocytes; 5: 10 IU/ml HCG, stage Ⅲ oocytes; 6: 20 IU/ml HCG, stage Ⅲ oocytes; 7: Control group, stage Ⅳ oocytes; 8: 10 IU/ml HCG, stage Ⅳ oocytes; 9: 20 IU/ml HCG, stage Ⅳ oocytes; 10: Control group, stage Ⅴ oocytes; 11: 10 IU/ml HCG, stage Ⅴ oocytes; 12: 20 IU/ml HCG, stage Ⅴ oocytes; 13: Control group, stage Ⅵ oocytes; 14: 10 IU/ml HCG, stage Ⅵ oocytes; 15: 20 IU/ml HCG, stage Ⅵ oocytes; M: Marker |
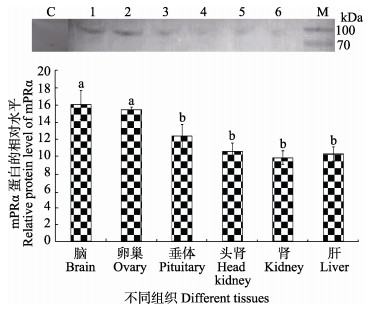
对不同组织中mPRα总蛋白表达量进行Western blotting检测,结果见图 4,mPRα蛋白表达量在脑、卵巢中相对较高,其他组织中也有表达,表达量相对较少(图 4)。
|
图 4 各组织mPRα蛋白表达量 Figure 4 Expression level of mPRα protein in different tissues 1:脑; 2:卵巢; 3:垂体; 4:头肾; 5:肾; 6:肝; M:分子量标准; C:对照 1: Brain; 2: Ovary; 3: Pituitary; 4: Head-kidney; 5: Kidney; 6: Liver; M: Marker; C: Control |
用所标记的正反义探针分别与半滑舌鳎卵巢、肝脏、头肾、肾脏、脑等组织中mRNA进行原位杂交反应,如图 5所示,作为阳性对照的A、B、C、D、E、F、G反义探针显示阳性结果,作为阴性对照的图a、b、c、d、e、f的正义探针没有杂交显色信号。用多克隆抗体分别与半滑舌鳎卵巢、肝脏、头肾、肾脏、脑、垂体组织蛋白进行免疫反应,如图 6所示,一抗孵育的A、B、C、D、E、F显示免疫显色结果,用1×PBS代替一抗孵育作为阴性对照的a、b、c、d、e、f没有免疫显色信号。

|
图 5 半滑舌鳎mPRα mRNA在不同组织中的表达(200倍) Figure 5 The expression of mPRα mRNA in different tissues of C. semilaevis (×200) A:卵巢; B:头肾; C:肝脏; D:脑; E:肾; F:垂体; G:垂体(100倍); 角图为相应组织放大1000倍,箭头指向为阳性信号位置: a、b、c、d、e和f:卵巢、头肾、肝脏、脑、肾和垂体的对照组IC:胆小管; K:肾脏细胞; Vt:卵黄; E:组织边缘; L:肝脏细胞; B:空白区; Br:脑细胞; HK:头肾细胞; M:卵母细胞膜; P:垂体细胞; PPD:外周部位; PI:中间部 A: Ovary; B: Head-kidney; C: Liver; D: Brain; E: Kidney; F: Pituitary; G: Pituitary (×100), the arrows indicated the positive reaction; the corner of pictures were ×1000; a, b, c, d, e, and f: Control group of ovary, head-kidney, liver, brain, kidney, and pituitary IC: Ile canaliculus; K: Kidney; Vt: Vitelo genic oocytes; E: Edge of tissues; L: Liver; B: Blank; Br: Brain cell; HK: Head-kidney cell; M: Oocyte membrane; PPD: Proximal part distalis; PI: Pars intermedia |
图 5-A和图 6-A显示,在成熟卵巢组织中,mPRα mRNA和蛋白在卵母细胞膜上显著性表达。图 5-B、图 6-B和图 6-D显示,相比内部头、肾、脑的表达部位,mPRα mRNA和蛋白在组织外周的显色表达更明显。图 5-C和图 6-C显示,mPRα mRNA和蛋白主要在肝脏的胆小管或肝静脉周围显色。图 5-E和图 6-E显示,mPRα mRNA和蛋白主要在肾脏的外周部位和肾小管表达,放大1000倍可以很明显地看出其在外周部位以及肾小管的管腔内外的表达。图 5-F、图 5-G和图 6-F显示,mPRα mRNA和蛋白主要在垂体外周组织表达。

|
图 6 半滑舌鳎mPRα蛋白在不同组织中的表达分布(200倍) Figure 6 The expression distribution of mPRα protein in different tissues of C. semilaevis (×200) A:卵巢; B:头肾; C:肝脏; D:脑; E:肾; F:垂体; 角图为相应组织放大1000倍; 箭头指向为阳性信号位置; a、b、c、d、e和f:卵巢、头肾、肝脏、脑、肾和垂体的对照组Tu:肾小管; K:肾脏细胞; Vt:卵黄; E:组织边缘; L:肝脏细胞; B:空白区; Br:脑细胞; HK:头肾细胞; M:卵母细胞膜; P:垂体细胞; PPD:外周部位; CV:肝静脉 A: Ovary; B: Head-kidney; C: Liver; D: Brain; E: Kidney; F: Pituitary; the corner pictures were ×1000; The arrows indicated the positive reaction; a, b, c, d, e, and f: Control group of ovary, head-kidney, liver, brain, kidney, and pituitary Tu: Tubules; K: Kidney; Vt: Vitelo genic oocytes; E: Edge of tissues; L: Liver; B: Blank; Br: Brain cell; HK: Head-kidney cell; M: Oocyte membrane; PPD: Proximal part distalis; CV: Central venous |
孕激素作为一种甾体激素,参与调控生物体内的多种生理过程,在动物生殖活动中起着非常重要的作用(Arck et al, 2007)。当孕激素与其受体结合后,激活成熟促进因子,卵母细胞完成减数分裂成熟(Masui et al, 1971; Nagahama, 1987)。Pace等(2005)研究表明,孕激素可通过mPRs诱导卵母细胞成熟。Tokumoto等(2006)检测到mPRα mRNA在成熟金鱼卵母细胞各个发育阶段均表达。本研究分析mPRα作用精确到半滑舌鳎卵巢不同发育时期的不同时相卵母细胞。通过实时荧光定量技术分析,显示在半滑舌鳎不同发育时期的性成熟卵巢的卵母细胞也都有mPRα mRNA的表达,表明mPRα在不同时相卵母细胞都发挥着一定的生理作用;并且卵母细胞mPRα mRNA表达的最高值出现在Ⅴ期卵巢的第Ⅴ时相卵母细胞中。李晓晓(2013)1)研究发现,在半滑舌鳎性成熟繁殖周期,卵巢mPRα mRNA表达量最大值出现在Ⅴ期卵巢,本研究从细胞水平进一步验证了Ⅴ期半滑舌鳎第Ⅴ时相mPRα mRNA表达量最高。RNA原位杂交、免疫组化结果显示,mPRα mRNA和蛋白都在卵巢成熟期的卵母细胞膜上显著表达,且Western blotting结果显示,其蛋白表达量丰富,此阶段mPRα mRNA高表达量进一步证明,mPRα在介导孕激素、促进卵母细胞成熟的生理功能上发挥重要的作用。相关报道发现与本研究相似的结果:斑马鱼、金鱼和斑点叉尾
1) Li XX. Study on the physiological function of membrane progestin receptor in the reproductive cycle of flatfish. Masterxs Thesis of Shanghai Ocean University, 2013 [李晓晓.膜孕激素受体在鲆鲽类繁殖周期中的生理功能研究.上海海洋大学硕士研究生学位论文, 2013]
鱼类的卵母细胞生长完成后,促黄体激素刺激卵巢滤泡产生成熟诱导类固醇激素,然后成熟诱导类固醇激素通过mPRα诱导卵母细胞成熟(Nagahama et al, 2008)。本研究采用促性腺激素诱导半滑舌鳎卵母细胞成熟后,发现不同时相卵母细胞中mPRα mRNA和蛋白的表达都明显上调。在HCG激素调控作用下,mPRα的正向应答效应进一步证明mPRα介导孕激素参与了卵母细胞成熟调控过程。20 IU/ml HCG对mPRα mRNA和蛋白表达的调控作用比10 IU/ml HCG作用更明显,表明mPRα mRNA和蛋白表达对HCG调控作用存在剂量依存关系。赵维信等(1986)也发现了类似结果,大西洋鲑(Salmo salar)的卵母细胞在促性腺激素刺激下,可连续地释放孕激素(17α, 20β-DHP),此时卵母细胞的胚泡破裂达到最后成熟,同时,该研究也说明孕激素是一种高效催熟剂。
3.2 mPRα组织表达与定位分析史宝等(2013)研究发现,mPRα mRNA较丰富地表达于半滑舌鳎卵巢、垂体、脑、头肾、肾组织,而在肝组织中表达较弱。本研究用Western blotting方法检测半滑舌鳎mPRα蛋白的表达,结果显示,mPRα蛋白在卵巢、脑、垂体中表达量较高,在肝、肾、头肾组织中也有表达,与mPRα mRNA结果基本一致。RNA原位杂交、免疫组化结果显示,mPRα mRNA和蛋白都在卵巢成熟期的卵母细胞膜上显著表达,在垂体、脑中,主要在外周部分表达。半滑舌鳎mPRα mRNA和蛋白在脑、垂体、性腺中的丰富表达,说明了mPRα参与介导孕激素调控半滑舌鳎繁殖内分泌系统。硬骨鱼类在生长、发育和繁殖过程中,体内的神经、免疫及内分泌三大系统起到重要的作用;性类固醇激素受体不仅存在于性腺中,在脑及免疫相关组织中也大量存在,通过3个系统之间的反馈作用,在神经-内分泌-免疫网络中起重要作用(Pakdel et al, 1997)。本研究用RNA原位杂交、免疫组化以及Western blotting方法在雌性半滑舌鳎的免疫相关组织肝、肾、头肾中检测到mPRα mRNA和蛋白表达,在头肾、肾主要显色在组织的外周部分。在肝脏主要显色在胆小管和肝静脉等与外界联系的管腔周围,在肾脏中也观察到其在肾小管附近表达丰富。因此,孕激素可能通过和其他系统交互连接部位和组织建立联系,从而行使其调控半滑舌鳎机体免疫系统的功能,但mPRα调控免疫系统的机理当前并不清楚。
综上所述,mPRα不仅在介导孕激素促进半滑舌鳎卵母细胞成熟的生理功能上发挥重要的作用,而且参与介导孕激素调控雌性半滑舌鳎机体的神经-内分泌-免疫网络系统,但其作用机制尚不明了,进一步的关联分析,将会为解析膜孕激素受体作用机制提供广阔的前景。另外,膜孕激素受体mPR (α、β、γ)和孕酮受体膜组分PGRMC (1、2)均为膜孕激素受体家族成员,在组织表达上存在重叠分布,因此,单独分析膜孕激素受体亚型的作用机制仍有一定技术挑战。尽管核孕激素受体(nPR)不像膜孕激素受体具有跨膜蛋白区域,但参与膜孕激素受体介导的信号通路,这也增加了膜孕激素受体研究的复杂性。本研究为进一步研究膜孕激素受体生理功能提供了组织学依据。
| Arck P, Hansen PJ, Biserka MJ, et al. Progesterone during pregnancy: Endocrine-immune cross talk in mammalian species and the role of stress. American Journal of Reproductive Immunology , 2007, 58 (3) : 268-279 DOI:10.1111/aji.2007.58.issue-3 | |
| Frye CA, Walf AA, Kohtz AS, et al. Progesterone-facilitated lordosis of estradiol-primed mice is attenuated by knocking down expression of membrane progestin receptors in the midbrain. Steroids , 2014, 81 (3) : 17-25 | |
| Hanna RN, Zhu Y. Expression of membrane progestin receptors in zebrafish (Danio rerio) oocytes, testis and pituitary. General and Comparative Endocrinology , 2009, 161 (1) : 153-157 DOI:10.1016/j.ygcen.2008.10.006 | |
| Kazeto Y, Goto-Kazeto R, Thomas P, et al. Molecular characterization of three forms of putative membrane-bound progestin receptors and their tissue-distribution in channel catfish, Ictalurus punctatus. Journal of Molecular Endocrinology , 2005a, 34 (3) : 781-791 DOI:10.1677/jme.1.01721 | |
| Kazeto Y, Goto-Kazeto R, Trant JM. Membrane-bound progestin receptors in channel catfish and zebrafish ovary: Changes in gene expression associated with the reproductive cycles and hormonal reagents. General and Comparative Endocrinology , 2005b, 142 (1-2) : 204-211 DOI:10.1016/j.ygcen.2005.01.017 | |
| Liu XZ, Xu YJ, Liu NZ, et al. Study on histological and morphometric characters of gonad development of Cynoglossus semilaevis Günther. Progress in Fishery Sciences , 2009, 30 (6) : 25-35 [柳学周, 徐永江, 刘乃真, 等. 半滑舌鳎卵巢发育的组织学和形态数量特征研究. 渔业科学进展 , 2009, 30 (6) : 25-35] | |
| Liu XZ, Shi B, Li XX, et al. Molecular characterization of the novel membrane progestin receptor gene and its role during ovarian development in the half smooth tongue sole Cynoglossus semilaevis Günther. Journal of Fishery Sciences of China , 2015, 22 (4) : 608-619 [柳学周, 史宝, 李晓晓, 等. 半滑舌鳎新型膜孕激素受体基因分子特征及其在卵巢发育过程的作用. 中国水产科学 , 2015, 22 (4) : 608-619] | |
| Liu XZ, Zhuang ZM, Ma AJ, et al. Operative technologies for seedling rearing of Cynoglossus semilaevis Günther. Marine Fisheries Research , 2006, 27 (2) : 17-24 [柳学周, 庄志猛, 马爱军, 等. 半滑舌鳎苗种生产技术的开发研究. 海洋水产研究 , 2006, 27 (2) : 17-24] | |
| Liu XZ, Zhuang ZM, Ma AJ, et al. Reproductive biology and breeding technology of Cynoglossus semilaevis Günther. Marine Fisheries Research , 2005, 26 (5) : 9-16 [柳学周, 庄志猛, 马爱军, 等. 半滑舌鳎繁殖生物学及繁育技术研究. 海洋水产研究 , 2005, 26 (5) : 9-16] | |
| Lu J, Reese J, Zhou Y, et al. Progesterone-induced activation of membrane-bound progesterone receptors in murine macrophage cells. Journal of Endocrinology , 2015, 224 (2) : 183-194 DOI:10.1530/JOE-14-0470 | |
| Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods , 2001, 25 (4) : 402-408 DOI:10.1006/meth.2001.1262 | |
| Masui Y, Markert CL. Cytoplasmic control of nuclear behavior during meiotic maturation of frog oocytes. Journal of Experimental Zoology , 1971, 177 (2) : 129-145 DOI:10.1002/(ISSN)1097-010X | |
| Mourot B, Nguyen T, Fostier A, et al. Two unrelated putative membrane-bound progestin receptors, progesterone membrane receptor component 1 (PGMRC1) and membrane progestin receptor (mPR) beta, are expressed in the rainbow trout oocyte and exhibit similar ovarian expression patterns. Reproductive Biology and Endocrinology , 2006, 4 (1) : 1-14 DOI:10.1186/1477-7827-4-1 | |
| Nagahama Y, Yoshikuni M, Yamashita M, et al. Regulation of oocyte maturation in fish. Development Growth and Regeneration , 2008, 50 (Suppl 1) : S174 | |
| Nagahama Y. Gonadotropin action on gametogenesis and steroidogenesis in teleost gonads. Zoological Science , 1987, 4 : 209-222 | |
| Oshima T, Nakayama R, Roy SR, et al. Purification of the goldfish membrane progestin receptor α (mPRα) expressed in yeast Pichia pastoris. Biomedical Research , 2014, 35 (1) : 47-59 DOI:10.2220/biomedres.35.47 | |
| Pace MC, Thomas P. Activation of a pertussis toxin-sensitive, inhibitory G-protein is necessary for steroid-mediated oocyte maturation in spotted seatrout. Developmental Biology , 2005, 285 (1) : 70-79 DOI:10.1016/j.ydbio.2005.06.003 | |
| Pakdel F, Delaunay F, Ducouret B, et al. Regulation of gene expression and biological activity of rainbow trout estrogen receptor. Kidney International Supplement , 1988, 25 (3) : S104-S109 | |
| Shi B, Li XX, Liu XZ, et al. Molecular cloning and tissue expression analysis of membrane progestin receptor alpha gene (mPR α) from half smooth tongue sole Cynoglossus semilaevis Günther. Progress in Fishery Sciences , 2013, 34 (3) : 61-67 [史宝, 李晓晓, 柳学周, 等. 半滑舌鳎膜孕激素受体基因克隆与组织表达分析. 渔业科学进展 , 2013, 34 (3) : 61-67] | |
| Tan W, Aizen J, Thoas P. Membrane progestin receptor alpha mediates progestin-induced sperm hypermotility and increased fertilization success in southern flounder (Paralichthys lethostigma). General and Comparative Endocrinology , 2014a, 200 : 18-26 DOI:10.1016/j.ygcen.2014.02.003 | |
| Tan W, Thomas P. Activation of the Pi3k/Akt pathway and modulation of phosphodiesterase activity via membrane progestin receptor-alpha (mPRalpha) regulate progestin-initiated sperm hypermotility in Atlantic croaker. Biology of Reproduction , 2014b, 90 (5) : 105 DOI:10.1095/biolreprod.113.112896 | |
| Thomas P, Pang Y, Dong J. Enhancement of cell surface expression and receptor functions of membrane progestin receptor α (mPRα) by progesterone receptor membrane component 1 (PGRMC1): Evidence for a role of PGRMC1 as an adaptor protein for steroid receptors. Endocrinology , 2014, 155 (3) : 1107-1119 DOI:10.1210/en.2013-1991 | |
| Thomas P. Rapid steroid hormone actions initiated at the cell surface and the receptors that mediate them with an emphasis on recent progress in fish models. General and Comparative Endocrinology , 2012, 175 (3) : 367-383 DOI:10.1016/j.ygcen.2011.11.032 | |
| Tokumoto M, Nagahama Y, Thomas P, et al. Cloning and identification of a membrane progestin receptor in goldfish ovaries and evidence it is an intermediary in oocyte meiotic maturation. General and Comparative Endocrinology , 2006, 145 (1) : 101-108 DOI:10.1016/j.ygcen.2005.07.002 | |
| Tokumoto T, Tokumoto M, Oshima T, et al. Characterization of multiple membrane progestin receptor (mPR) subtypes from the goldfish ovary and their roles in the induction of oocyte maturation. General and Comparative Endocrinology , 2012a, 177 (1) : 168-176 DOI:10.1016/j.ygcen.2012.03.005 | |
| Tokumoto T. Identification of membrane progestin receptors (mPR) in goldfish oocytes as a key mediator of steroid non-genomic action. Steroids , 2012b, 77 (10) : 1013-1016 DOI:10.1016/j.steroids.2012.04.006 | |
| Tubbs C, Psce M, Thomas P. Expression and gonadotropin regulation of membrane progestin receptor alpha in Atlantic croaker (Micropogonias undulatus) gonads: Role in gamete maturation. General and Comparative Endocrinology , 2010, 165 (1) : 144-154 DOI:10.1016/j.ygcen.2009.06.017 | |
| Yang ZY, Wang CX. On the development of flatfish aquaculture industry of China: A global perspective. Chinese Fisheries Economics , 2009 (6) : 115-121 [杨正勇, 王春晓. 全球视野下中国鲆鲽类养殖业的发展. 中国渔业经济 , 2009 (6) : 115-121] | |
| Zhao WX, Wright RS. Sex steroids production by vitellogenic ovarian follicles of Atlantic salmon (Salmo salar) in vitro. Journal of Fisheries of China , 1986 (4) : 389-394 [赵维信, WrightRS. 促性腺激素诱发大西洋鲑卵黄发生期卵巢滤泡释放性类固醇激素的离体研究. 水产学报 , 1986 (4) : 389-394] |



