2. 青岛海洋科学与技术国家实验室 海洋渔业科学与 食物产出过程功能实验室 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
硬骨鱼类的体色是由体表皮肤和鳞片中色素细胞的数量、类型以及分布区域决定的(Rawls et al, 2001; 马爱军等, 2003; 史学营等, 2015)。在内源性调节机制方面,黑色素聚集激素(MCH)、黑色素细胞刺激激素(MSH)和去甲肾上腺素(NE)等多种激素参与调控色素细胞的迅速收缩和舒张进而起到调控体色的作用(van der Salm et al, 2005; Fujii et al, 1991; Fujii, 2000)。Oshima等(2001)研究报道了不同剂量的MCH对鱼类色素细胞的影响,结果显示,低剂量的MCH ( < 1 μmol/L)会引起黑色素细胞内色素体颗粒聚集,且当MCH存在时色素体颗粒会一直保持聚集状态。黑色素聚集激素基因(MCH)和阿黑皮素原基因(POMC)是鲆鲽类体色调控的关键基因,MCH的主要功能是参与抑制皮肤黑化调控过程,而POMC的主要功能是参与无眼侧黑化的诱发过程调控(Kang et al, 2012、2013)。
牙鲆(Paralichthys olivaceus)是我国鲆鲽类三大主导养殖种类之一(欧俊新等, 2002; 木云雷等, 1999; 张美昭等, 1999)。养殖生产中发现,工厂化条件下养殖鱼出现高比例的无眼侧体色黑化现象,导致其市场价格较正常牙鲆低20%以上,影响了养殖效益。近年来,作者在山东省日照市开展牙鲆池塘养殖实验时发现,无眼侧发生黑化的牙鲆在池塘养殖一段时间后,其无眼侧黑化程度表现为逐步消褪直至正常。针对此现象,本研究从形态、血清和mRNA水平上对其生理机制进行了研究,旨在探讨池塘养殖牙鲆无眼侧体色黑化消褪的机制,为建立养殖牙鲆无眼侧黑化调控技术提供理论支撑。
1 材料与方法 1.1 实验材料及取样 1.1.1 养殖条件实验用牙鲆取自山东省日照市水利养殖场。2015年5月中旬前,在室内工厂化养殖车间进行实验鱼苗种中间培育。2015年5月中旬,实验鱼进入池塘进行养殖,养殖密度为4000尾/hm2,养殖期间水温为14-28℃,盐度为28-33,pH为7.8-8.2,溶解氧>5 mg/L。投喂鲜杂鱼,投喂量为养殖鱼体重的3%-5%,每日投喂2次。
1.1.2 无眼侧黑化及消褪检测入池塘养殖前,经检测,苗种的无眼侧黑化比例高达85%,未见无眼侧黑化消褪的个体。池塘养殖过程中采集样品,每次取30尾实验鱼,检测无眼侧黑化情况,并计算无眼侧黑化、正常和消褪个体的比例。无眼侧黑化消褪的判断依据为无眼侧黑化区域黑化程度降低,逐渐转为淡黄色。
1.1.3 取样2015年5月上旬,取样入塘前大规格苗种[体长为(18.0±3.3) cm、体重为(100.0±20.4) g] 10尾,分为无眼侧黑化、无眼侧正常两类样品。5月中旬,苗种进入池塘养殖,分别于2015年8月、11月再次取样。8月牙鲆体长为(30.0±5.1) cm、体重为(300.0±41.0) g、11月牙鲆体长为(40.0±5.5) cm、体重为(500.0±20.8) g,每次分别取无眼侧黑化、无眼侧正常和无眼侧黑化消褪的实验鱼各3尾,用于体色相关基因表达检测。所有实验鱼样品以MS-222 (300 mg/L)麻醉后,迅速取其垂体和脑组织,液氮速冻后-80℃保存,用于总RNA提取。11月取样时,对每种类型的牙鲆采取尾静脉取血方法抽取血液,置于灭菌的EP管中,3000 r/min离心10 min,取血清于-80℃保存,用于血清MCH和MSH表达水平测定。每次取样时,取实验鱼有眼侧、无眼侧正常、黑化区域和消褪区域的鳞片与皮肤,鳞片用于色素细胞及鳞片形态观察,皮肤用于电镜观察,具体操作方法参照商晓梅等(2016)。
1.2 RNA提取和cDNA第1链的合成利用RNAiso Plus (TaKaRa, 日本)提取垂体和脑组织总RNA,通过1%琼脂糖凝胶电泳检测质量,使用微量核酸测定仪(Nanodrop ND2000)检测浓度。利用PrimeScript 1st Strand cDNA Synthesis试剂盒(TaKaRa, 日本)反转录合成cDNA第1链,按试剂盒说明操作。
1.3 色素细胞形态与数量分布特征分析取有眼侧、无眼侧黑化、无眼侧正常和无眼侧消褪部位的鳞片,制作临时装片,将鳞片置于生理盐水(0.85%)中伸展3-5 min,吸水纸吸干后,用中性树胶将其固定。用正立显微镜(NIKON 80i)对色素细胞进行观察、测量和记录,并用CCD数码智能型成像系统进行拍照。
每个部位制作3-5张装片,记录每个视野下黑色素细胞的数量,每个样本观察30个视野进行统计分析,实验数据表示为平均值±标准差(Mean±SD)。同时,观察鳞片形态特征,记录鳞片类型、硬棘数量,分析其与无眼侧黑化的关系。
1.4 激素水平检测以鱼源MCH ELISA测定试剂盒、鱼源MSH ELISA测定试剂盒(北京绿源博德)检测血清中MCH、MSH肽浓度。试剂盒的最低检测浓度小于0.1 ng/ml;不与其他可溶性结构类似物交叉反应;板内、板间变异系数均小于15%。MCH和MSH标准品线性回归与预期浓度相关系数r2值分别为0.9985和0.9994。
1.5 荧光实时定量PCR分析根据NCBI登录的牙鲆POMC-1 (GenBank: AF 184066.1)和POMC-2 (GenBank: AF191593.1)、MCH (GenBank: EU232720.1)的cDNA序列分别设计定量引物,以18S为内参设计定量引物18S-DF和18S-DR,荧光实时定量PCR所用各引物序列见表 1。
|
|
表 1 牙鲆体色相关基因定量检测所用引物序列 Table 1 Primer sequences for qPCR detection of body color related genes of P. olivaceus |
使用SYBR Premix Ex TaqTMⅡ(TaKaRa, 日本)试剂盒配制反应体系,20 μl PCR体系:cDNA模板2 μl,10 μmol/L的上、下游引物各0.8 μl,SYBR Premix Ex TaqTMⅡ 10 μl和ddH2O 6.4 μl。采用两步法,PCR反应条件:95℃预变性30 s,95℃ 5 s,60℃ 20 s,共40个循环。在Mastercycler ep realplex real-time PCR仪(Eppendorf)上运行。
定量PCR扩增根据标准曲线的相关系数(r2)和扩增效率(E)确定反应条件。实时定量标准曲线以垂体cDNA进行5倍梯度稀释成6个标准品进行制作。所有基因的标准曲线0.99 < r2 < 0.999,0.85 < E < 1.1。
每次实验3个重复,每个组织样品进行3次平行实验,PCR反应完成后观察熔融曲线以确定扩增特异性,每次实验均设置空白对照。以18S为内参,利用2−ΔΔCt方法计算目的基因的相对表达量(Livak et al, 2001)。
1.6 数据统计分析实验数据采用SPSS 17.0统计,对色素细胞数量、硬棘数量、激素表达水平和基因的表达水平分别进行单因素方差分析(One-way ANOVA),P < 0.05为差异显著。
2 结果与分析 2.1 牙鲆无眼侧体色黑化消褪的表观特征本研究观察了无眼侧黑化牙鲆在池塘养殖过程中黑化消褪的情况,发现其无眼侧黑化部位皮肤颜色由黑色-淡黄色-白色-正常体色(图 1)。同时发现,养殖过程中无眼侧黑化消褪的牙鲆比例不断增加,待11月取样结束、商品鱼出池销售时,随机检测100尾养殖牙鲆,无眼侧全部正常的个体占67% (图 1-A),无眼侧黑化个体比例仅为4% (图 1-B-图 1-D),无眼侧有少许黑色斑点的个体占29% (图 1-E、图 1-F),表明池塘养殖牙鲆无眼侧黑化特征消褪明显。
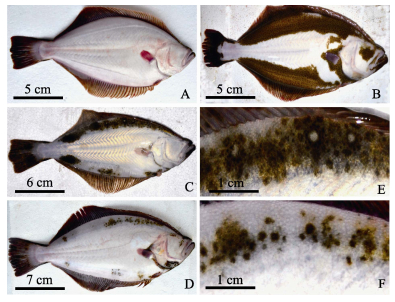
|
图 1 牙鲆无眼侧黑化消褪的表观特征 Figure 1 The morphology of degeneration of P. olivaceus blind-side hypermelanosis A:无眼侧正常;B:无眼侧黑化;C:无眼侧黑化部分消褪;D:无眼侧黑化消褪;E、F分别为C、D的局部放大 A: Normal blind-side; B: Blind-side hypermelanosis; C: Blind-side partial degeneration; D: Blind-side degeneration; E, F were partial magnification of figure C and D respectively |
无眼侧黑化消褪的牙鲆不同部位的鳞片黑色素细胞形态存在明显不同(图 2)。有眼侧鳞片上的黑色素细胞形态清晰、呈现明显的树枝状或鸟粪状(图 2-A),无眼侧黑化区域黑色素细胞形态同有眼侧区域(图 2-B)。无眼侧正常区域无黑色素细胞分布(图 2-C),而无眼侧黑化消褪区域黑色素细胞分布较为稀疏,细胞体积大而弥散,呈现出较为典型的凋亡特征(图 2-D)。

|
图 2 光镜下牙鲆鳞片黑色素细胞形态及分布 Figure 2 Morphology and distribution of melanophores of P. olivaceus scales under light microscope A:有眼侧;B:无眼侧黑化区域;C:无眼侧正常区域;D:无眼侧黑化消褪区域 A: Eye-side; B: Blind-side scale with hypermelanosis; C: Normal blind-side; D: Degenerated blind-side |
统计实验鱼有眼侧、无眼侧正常、无眼侧黑化区域和无眼侧黑化消褪区域的黑色素细胞分布数量(表 2)。不同部位鳞片上的黑色素细胞数量存在很大差异,有眼侧鳞片的黑色素细胞数量显著多于其他部位的黑色素细胞数量(P < 0.05),依次为有眼侧﹥无眼侧黑化区域﹥无眼侧黑化消褪区域﹥无眼侧正常区域。消褪区域的黑色素细胞数量显著少于有眼侧和黑化区域(P < 0.05)。
|
|
表 2 牙鲆不同部位黑色素细胞数量统计(n=30) Table 2 The number of melanophores at different parts of P. olivaceus (n=30) |
对无眼侧黑化区域和无眼侧黑化消褪区域的皮肤进行电镜观察(图 3)。无眼侧黑化区域皮肤中的黑色素细胞明显,细胞内的黑色素颗粒清晰且均匀分布(图 3-A、图 3-B)。在无眼侧黑化消褪区域皮肤中也存在少量黑色素细胞,其中黑色素颗粒模糊不清,表现出较为明显的凋亡迹象(图 3-C、图 3-D)。
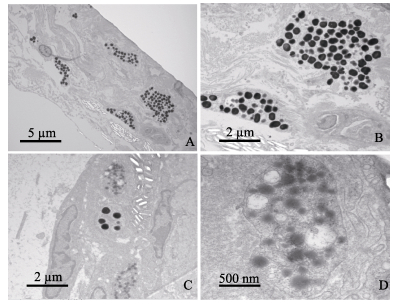
|
图 3 电镜下牙鲆皮肤黑色素细胞颗粒形态及分布 Figure 3 Morphology and distribution of melanophores of P. olivaceus under electron microscope A.无眼侧黑化区域(×5000);B.无眼侧黑化区域(×12000);C.无眼侧黑化消褪区域(×12000);D.无眼侧黑化消褪区域(×60000) A. Blind-side skin with hypermelanosis (×5000); B. Blind-side skin with hypermelanosis (×12000); C. Blind-side skin from degeneration regions (×12000); D. Blind-side skin from degeneration regions (×60000) |
本研究发现,牙鲆有眼侧、无眼侧黑化和正常区域的鳞片类型不同(图 4)。有眼侧鳞片为栉鳞(图 4-A);无眼侧黑化区域鳞片为弱栉鳞(图 4-B);无眼侧正常区域鳞片为圆鳞(图 4-C);无眼侧黑化消褪区域的鳞片类型介于弱栉鳞与圆鳞之间(图 4-D),其可能是黑化区域鳞片类型向圆鳞转化的过渡形态。
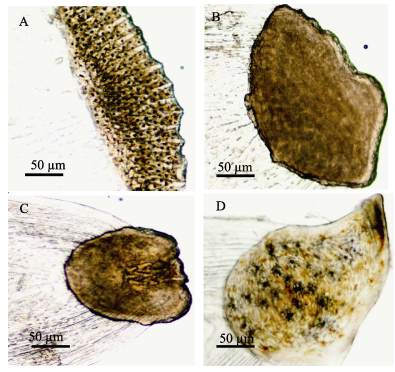
|
图 4 无眼侧黑化牙鲆不同类型的鳞片形态特征 Figure 4 Morphology of different types of scales of P. olivaceus with blind-side hypermelanosis A:有眼侧鳞片;B:无眼侧正常区域圆鳞;C:无眼侧黑化区域鳞片;D:无眼侧黑化消褪区域鳞片 A: Scale from eye side; B: Circular scale from normal part of blind side; C: Scale from blind-side part with hypermelanosis. D: Scale from blind-side part with degeneration |
对牙鲆有眼侧、无眼侧黑化和黑化消褪区域的栉鳞上硬棘数量进行了统计分析(表 3)。栉鳞上的硬棘多成2排或3排排列,有眼侧栉鳞上的硬棘数量明显多于无眼侧,无眼侧黑化区域栉鳞上的硬棘数量多于黑化消褪区域。
|
|
表 3 无眼侧黑化牙鲆不同部位栉鳞上硬棘数量 Table 3 The number of spines on the ctenoid scale at different parts of P. olivaceus with blind-side hypermelanosis |
无眼侧黑化消褪的牙鲆血清MCH的含量显著高于其他2种类型(P < 0.05),无眼侧黑化的牙鲆血清中MCH肽的含量最低(P < 0.05)(图 5-A)。同时,无眼侧黑化的牙鲆血清MSH的含量最高(P < 0.05),无眼侧正常和黑化消褪的牙鲆血清MSH肽的含量无显著差异(P < 0.05)(图 5-B)。
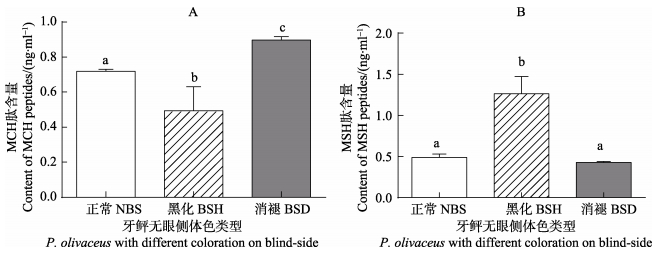
|
图 5 3种无眼侧体色不同的牙鲆血清MCH和MSH肽含量 Figure 5 The MCH and MSH peptide contents of three types of P. olivaceus with different color on blind-side NBS:无眼侧正常牙鲆;BSH:无眼侧黑化牙鲆;BSD:无眼侧黑化消褪牙鲆;数据标有相同字母表示差异不显著(P < 0.05),标有不同字母则表示差异显著(P < 0.05),下同 NBS: Normal blind-side fish; BSH: Blind-side hypermelanosis type; BSD: Blind-side degeneration type; Data with the same letter were not significantly different (P < 0.05), while with different letters were significantly different (P < 0.05), the same as below |
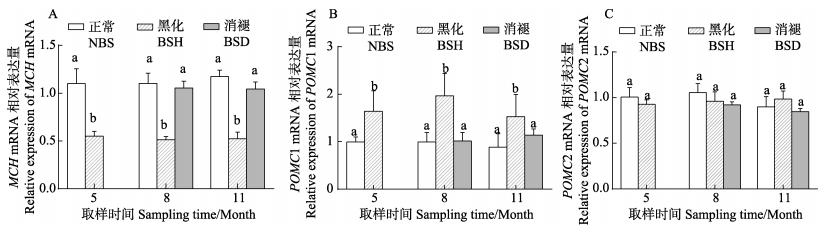
|
图 6 牙鲆垂体中体色相关基因MCH1 (A)、POMC1 (B)、POMC2 (C) mRNA表达水平 Figure 6 The MCH1 (A), POMC1 (B), POMC2 (C) mRNA levels in the pituitary of P. olivaceus |
比较了3个取样阶段牙鲆(无眼侧黑化程度不同)垂体中体色相关基因表达水平,结果显示:不同的取样阶段,无眼侧正常鱼和无眼侧黑化消褪鱼的垂体MCH mRNA表达水平明显高于无眼侧黑化鱼(P < 0.05),而无眼侧黑化鱼的垂体POMC1 mRNA表达水平明显高于其他2种。各个阶段牙鲆垂体POMC2 mRNA表达水平无显著差异(P > 0.05)。
3 讨论本研究观察了池塘养殖牙鲆无眼侧黑化特征消褪的现象,并从形态学、血清学和基因水平探讨了其可能的机制,为鲆鲽类无眼侧体色黑化调控机制研究提供了新的佐证和资料。
3.1 色素细胞和鳞片数量形态特征鱼类能够通过调节色素细胞数量分布以及胞内色素体的聚集和分散来改变调节体色(van der Salm et al, 2005)。叶元土等(2006)认为,出现分支不明显的黑色素细胞是细胞老化的表现,细胞衰老从而使黑色素细胞分支逐渐减少或消失,细胞进而萎缩、凋亡。本研究发现,牙鲆无眼侧黑化消褪区域的黑色素细胞数量较少,分支及形态模糊,发生了细胞凋亡,表明无眼侧黑化消褪过程伴随着黑色素细胞的形态及其内源性调控机制的变化。Isojima等(2013)对牙鲆无眼侧黑化机制的研究表明,无眼侧正常区域覆盖圆鳞,黑化区域的鳞片为栉鳞,而它们的交界区域多为弱栉鳞,黑色素细胞的转移与鳞片的类型存在着密切的关系。这与本研究结果一致,同时还发现,无眼侧黑化消褪区域的鳞片类型介于弱栉鳞与圆鳞之间,表明牙鲆无眼侧黑化区域消褪的过程中,鳞片类型也随之发生转变。此外,有眼侧、无眼侧黑化和消褪区域的栉鳞上硬棘数量存在较大差异,特别是无眼侧黑化消褪区域,随着黑化程度的减弱,栉鳞上硬棘数量减少。综上所述,无眼侧的黑化发生过程以及黑化消褪过程都与鳞片的发生和发育调控系统密切相关。阐明牙鲆鳞片发生和发育的调控机制,将有助于阐释池塘养殖牙鲆无眼侧黑化发生和消褪的具体机制。
3.2 MCH和MSH差异表达关系Fredriksson等(2003)和Kang等(2012)研究表明,垂体分泌的MCH和MSH肽,是一对具有拮抗生理功能的神经肽,前者能够引起黑色素细胞内色素体聚集,从而诱发体色变淡,后者则使黑色素细胞内色素体分散分布,从而诱发黑化。本研究发现,无眼侧黑化消褪的牙鲆血清中MCH肽的含量显著高于无眼侧黑化和正常个体,表明无眼侧黑化消褪过程中MCH可能起到了正向调控作用,其表达启动的外在和内源性因子及作用机制有待揭示。同时还发现,无眼侧皮肤黑化的牙鲆中MSH肽的含量显著高于其他2种牙鲆,而无眼侧体色正常和黑化消褪的牙鲆中MSH肽的含量基本一致,表明MSH肽高表达主要与无眼侧黑化过程相关,这与其他鲽形目鱼类的研究结果一致(Berman et al, 2009)。
3.3 体色相关表达基因表达对星斑川鲽(Platichthys stellatus)和条斑星鲽(Verasper moseri)的研究表明,MCH具有抑制无眼侧黑化发生的调控作用(Takahashi et al, 2007; Yamanome et al, 2007)。本研究发现,无眼侧黑化消褪的牙鲆垂体MCHmRNA表达水平显著高于无眼侧黑化个体,同时与无眼侧正常个体无显著差异,与血清MCH肽的表达作用相一致,表明MCH及其基因均参与了无眼侧黑化消褪的调控过程,其间存在密切的协同作用效应。MCH是通过结合并激活其受体(MCHR)从而对动物体色进行调控(Civelli et al, 2008; Wang et al, 2001),脊椎动物有2种不同等位形式的受体MCHR1和MCHR2,本研究中MCH与哪种受体特异性结合而行使生理功能还需深入探讨。POMC能够诱发养殖牙鲆无眼侧黑化发生,牙鲆POMC也存在2种不同等位形式的基因POMC1和POMC2 (Kobayashi et al, 2009)。本研究发现,无眼侧黑化消褪的牙鲆垂体POMC1 mRNA表达水平显著低于无眼侧黑化个体,同时与无眼侧正常个体无显著差异,表明POMC1参与了无眼侧黑化消褪过程的调控,但其可能扮演了反向调控因子的角色。本研究还发现,在3个养殖阶段中,牙鲆垂体POMC2 mRNA表达水平都无显著差异,表明了其可能不参与无眼侧黑化消褪过程的调控。有关牙鲆POMC两个等位基因在无眼侧黑化消褪调控过程中的信号通路有待深入研究。
与工厂化养殖相比,池塘养殖水环境、底泥以及养殖牙鲆肠道菌群结构多样性较高(李存玉等, 2015)。本研究发现,仅在泥沙底质的池塘养殖条件下,牙鲆会发生无眼侧黑化的消褪,工厂化养殖条件下养殖鱼不会发生此种现象。此外,在调研河北、天津等地池塘与工厂化养殖条件下牙鲆无眼侧黑化情况时也发现,即使同在池塘养殖条件下,水体透明度高的池塘养殖牙鲆无眼侧黑化的问题依然较为严重。由此,作者推测,池塘养殖牙鲆无眼侧黑化的消褪现象可能与水体透明度低、池塘环境菌群丰度和多样性高、肠道菌群调节有关。
| Berman JR, Skariah G, Maro GS, et al. Characterization of two melanin-concentrating hormone genes in zebrafish reveals evolutionary and physiological links with the mammalian MCH system. Journal of Comparative Neurology , 2009, 517 (5) : 695-710 DOI:10.1002/cne.v517:5 | |
| Civelli O, Zhou QY. Orphangprotein-coupled receptors and novel neuropeptide. Results and Problems in Cell Differentiation , 2008, 46 : 251-256 | |
| Fredriksson R, Lagerstrom MC, Lundin LG, et al. The G-protein coupled receptors in the human genome form five main families. Phylogenetic analysis, paralogon groups, and fingerprints. Molecular Pharmacology , 2003, 63 (6) : 1256-1272 DOI:10.1124/mol.63.6.1256 | |
| Fujii R, Hayashi H, Toyohara J, et al. Analysis of the reflection of light from the motile iridophores of the dark sleeper, Odontobutis obscura obscura. Zoological Science , 1991, 8 (3) : 461-470 | |
| Fujii R. The regulation of motile activity in fish chromatophores. Pigment Cell and Melanoma Research , 2000, 13 (5) : 300-319 DOI:10.1034/j.1600-0749.2000.130502.x | |
| Isojima T, Tsuji H, Masuda R, et al. Formation process of staining-type hypermelanosis in Japanese flounder juveniles revealed by examination of chromatophores and scales. Fisheries Science , 2013, 79 (2) : 231-242 DOI:10.1007/s12562-013-0600-2 | |
| Kang DY, Kim HC. Functional characterization of two melanin-concentrating hormone genes in the color camouflage, hypermelanosis, and appetite of starry flounder. General and Comparative Endocrinology , 2013, 189 : 74-83 DOI:10.1016/j.ygcen.2013.04.025 | |
| Kang DY, Kim HC. Relevance of environmental factors and physiological pigment hormones to blind-side hypermelanosis in the cultured flounder, Paralichthys olivaceus. Aquaculture , 2012, 356-357 : 14-21 DOI:10.1016/j.aquaculture.2012.05.041 | |
| Kobayashi Y, Mizusawa K, Yamanome T, et al. Possible paracrine function of α-melanocyte-stimulating hormone and inhibition of its melanin-dispersing activity by N-terminal acetylation in the skin of the barfin flounder (Verasper moseri). General and Comparative Endocrinology , 2009, 161 (3) : 419-424 DOI:10.1016/j.ygcen.2009.02.009 | |
| Li CY, Xu YJ, Liu XZ, et al. Comparative analysis of composition, diversity and origin of intestinal bacterial community in pond-and indoor tank-culture Japanese flounder (Paralichthys olivaceus). Journal of Fisheries of China , 2015, 39 (2) : 245-255 [李存玉, 徐永江, 柳学周, 等. 池塘和工厂化养殖牙鲆肠道菌群结构的比较分析. 水产学报 , 2015, 39 (2) : 245-255] | |
| Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCt method. Methods , 2001, 25 (4) : 402-408 DOI:10.1006/meth.2001.1262 | |
| Ma AJ, Lei JL, Chen SQ, et al. Progress of research on albinism mechanisms of flatfish. Marine Fisheries Research , 2003, 24 (3) : 80-85 [马爱军, 雷霁霖, 陈四清, 等. 鲆鲽类白化机理的研究进展. 海洋水产研究 , 2003, 24 (3) : 80-85] | |
| Mu YL, Liu Y, Wang J, et al. Study on indoor culture of flounder (Paralichthys olivaceus). Fisheries Science , 1999, 18 (3) : 3-8 [木云雷, 刘悦, 王鉴, 等. 牙鲆室内人工养殖试验. 水产科学 , 1999, 18 (3) : 3-8] | |
| Oshima N, Nakamaru N, Araki S, et al. Comparative analysis of the pigment-aggregating and -dispersing actions of MCH on fish chromatophores. Comparative Biochemistry and Physiology Part C Toxicology and Pharmacology , 2001, 129 (2) : 75-84 DOI:10.1016/S1532-0456(01)00187-9 | |
| Ou JX, Lin XZ. Flounder culture test in Fujian coastal pool. Marine Sciences , 2002, 26 (8) : 20-22 [欧俊新, 林祥志. 福建沿海牙鲆池塘养殖试验. 海洋科学 , 2002, 26 (8) : 20-22] | |
| Rawls JF, Mellgren EM, Johson SL. How the zebrafish gets its stripes. Developmental Biology , 2001, 240 (2) : 301-314 DOI:10.1006/dbio.2001.0418 | |
| Shang XM, Ma AJ, Wang XA, et al. Morphological characteristics and functional investigation of the abocular side skins on head of six pleuronectiformes fishes. Journal of Fisheries of China , 2016, 40 (2) : 189-197 [商晓梅, 马爱军, 王新安, 等. 六种鲽形目鱼类无眼侧头部皮肤形态特征与功能探讨. 水产学报 , 2016, 40 (2) : 189-197] | |
| Shi XY, Xu YJ, Wu NN, et al. Preliminary studies on blind-side hypermelanosis of Cynoglossus semilaevis: Chromatophores observation and expression of proopiomelanocortin. Progress in Fishery Sciences , 2015, 36 (2) : 46-53 [史学营, 徐永江, 武宁宁, 等. 半滑舌鳎(Cynoglossus semilaevis)体表色素细胞观察及POMC表达特性分析. 渔业科学进展 , 2015, 36 (2) : 46-53] | |
| Takahashi A, Kosugi T, Kobayashi Y, et al. The melanin-concentrating hormone receptor 2 (MCH-R2) mediates the effect of MCH to control body color for background adaptation in the barfin flounder. General and Comparative Endocrinology , 2007, 151 (2) : 210-219 DOI:10.1016/j.ygcen.2007.01.011 | |
| van der Salm A, Spanings T, Gresnigt R, et al. Background adaptation and water acidification affect pigmentation and stress physiology of tilapia, Oreochromis mossambicus. General and Comparative Endocrinology , 2005, 144 (1) : 51-59 DOI:10.1016/j.ygcen.2005.04.017 | |
| Wang S, Behan J, O'Neill K, et al. Identification and pharmacological characterization of a novel human melanin-concentrating hormone receptor (mch-r2). Journal of Biological Chemistry , 2001, 276 (37) : 34664-34670 DOI:10.1074/jbc.M102601200 | |
| Yamanome T, Amano M, Amiya N, et al. Hypermelanosis on the blind side of Japanese flounder Paralichthys olivaceus is diminished by rearing in a white tank. Fisheries Science , 2007, 73 (2) : 466-468 DOI:10.1111/fis.2007.73.issue-2 | |
| Ye YT, Guo JL, Xiao PZ, et al. Observation of the body color and scale melanophores of cultured Wuchang Fish. Feed Industry , 2006, 27 (22) : 25-27 [叶元土, 郭建林, 萧培珍, 等. 养殖武昌鱼体色与鳞片黑色素细胞的观察. 饲料工业 , 2006, 27 (22) : 25-27] | |
| Zhang MZ, Zhang ZQ, Zheng CB, et al. Energy emtabolism of juvenile Japanese flounder, Paralichthys olivaceus. Journal of Fishery Sciences of China , 1999, 6 (1) : 75-79 [张美昭, 张兆琪, 郑春波, 等. 牙鲆幼鱼能量代谢的初步研究. 中国水产科学 , 1999, 6 (1) : 75-79] |



