 (Seriola aureovittata)染色体核型分析
(Seriola aureovittata)染色体核型分析
2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能 实验室 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306;
4. 大连富谷水产有限公司 大连 116400
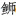 (Seriola aureovittata)为实验材料,经过体内注射植物血球凝聚素(PHA)和秋水仙素,取头肾细胞,经空气干燥法制片,Giemsa染液染色后,观察黄条
(Seriola aureovittata)为实验材料,经过体内注射植物血球凝聚素(PHA)和秋水仙素,取头肾细胞,经空气干燥法制片,Giemsa染液染色后,观察黄条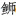 的染色体核型和特征。本研究分析了21条黄条
的染色体核型和特征。本研究分析了21条黄条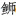 的80个中期染色体核型,结果显示,黄条
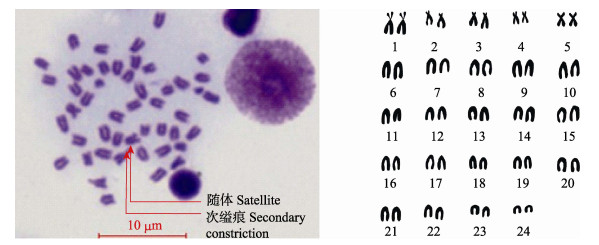
的80个中期染色体核型,结果显示,黄条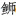 核型有48条染色体,2n=48占所观察分裂相的比例是81.25%;第1对染色体有次缢痕和随体。核型公式为2n=48=6sm+4st+38t,其染色体臂的数量为54,单倍体染色体总长度约为51.97 μm。黄条
核型有48条染色体,2n=48占所观察分裂相的比例是81.25%;第1对染色体有次缢痕和随体。核型公式为2n=48=6sm+4st+38t,其染色体臂的数量为54,单倍体染色体总长度约为51.97 μm。黄条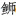 染色体核型比较独特,具有3对亚中部染色体和2对亚端部染色体;不同于以往报道的其他
染色体核型比较独特,具有3对亚中部染色体和2对亚端部染色体;不同于以往报道的其他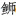 属鱼类的染色体核型特征。通过比较分析认为,黄条
属鱼类的染色体核型特征。通过比较分析认为,黄条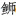 为进化上的高位类群中的特化类群。本研究为
为进化上的高位类群中的特化类群。本研究为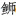 属鱼类的细胞遗传学研究提供了基础资料,并为黄条
属鱼类的细胞遗传学研究提供了基础资料,并为黄条 种质资源保护及未来人工养殖等奠定基础。
种质资源保护及未来人工养殖等奠定基础。
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
4. Dalian Fugu Fishery Co., Ltd., Dalian 116400
黄条









染色体是生物发育、进化、遗传和变异的物质基础,研究染色体的行为、数目、核型和带型等对于了解生物的遗传组成、遗传变异规律、发育机制、物种起源和亲缘关系、进化地位、分类及种族关系等都具有重要的参考价值(Amores et al, 2014; 王绿洲等, 2015; Braasch et al, 2016)。染色体核型图谱可为鱼类种质鉴定提供参考依据,也是多倍体诱导、雌核发育、雄核发育、种间杂交和种内杂交研究的重要参考(ínez et al, 2014; Molina-Luzón et al, 2015; Khan et al, 2000)。目前,国内关于黄条




实验用鱼为2015年8月在黄海北部的海洋岛附近海域捕获的体长为8-10 cm的野生黄条

实验鱼麻醉后胸鳍基部注射植物血球凝聚素(PHA) (Sigma)溶液(0.7%的生理盐水配制),剂量为20 μg/g (鱼体湿重)。注射后将实验鱼放回养殖池中,用小型网箱与其他鱼隔开,流水培育,4-6 h后在同一部位注射秋水仙素溶液(0.7%生理盐水配制),剂量为2.5 μg/g (鱼体湿重)。
注射秋水仙素1 h后用注射器抽取实验鱼血液,在鱼死前解剖,取头肾,去掉其他杂质,置于装有少许生理盐水的培养皿中,用解剖剪反复剪碎后,用纱布将细胞悬液过滤,1000 r/min离心8 min,收集细胞。用生理盐水洗涤后,用0.075 mol/L KCl溶液低渗处理30 min,1000 r/min离心8 min,弃去低渗液。加入新鲜配制的预冷的卡诺氏固定液(甲醇:冰醋酸=3:1)固定30 min,再重复固定2次,离心弃去固定液,加入400 μl新鲜预冷的固定液。
将处理干净的载玻片和一块大理石在烘箱中烘至65℃。滴片时先将大理石放在滴片的位置,滴片高度为120-130 cm,玻片在室温下自然干燥后,用10%吉姆萨染液(pH=6.8)染色20 min,蒸馏水冲洗后,在室温下自然干燥。
1.3 核型分析将染色体制片置于Nikon ECLIPSE 80i显微镜下观察,选用染色体着色较好、着丝粒明显、无重叠的中期分裂相片子,在油镜下选取20个染色体分散良好、长度适中的分裂相进行显微摄影。按Levan等(1964)提出的命名和分类标准,按臂比将染色体分为4组:(1)中部着丝点染色体为m组,臂比为1.00-1.70;(2)亚中部着丝点染色体为sm组,臂比为1.71-3.00;(3)亚端部着丝点染色体为st组,臂比为3.01-7.00;(4)端部着丝点染色体为t组,臂比≥7.0。
2 结果与分析 2.1 染色体数目在显微镜下选取80个分散良好的分裂相进行观察计数,确定2n值。通过核型分析得知,黄条



|
图 1 黄条 |
|
|
表 1 黄条 |
通过测量与数据统计分析,黄条


|
|
表 2 黄条 |
本研究采用PHA注射法制备黄条
本研究黄条



















迄今为止,所研究的大约60%的鲈形目鱼类具有48条端部着丝粒染色体,包括鲷科(Sparidae)、石首鱼科(Sciaenidae)、鳚科(Blennidae)、冰鱼科(Channichthyidae)、南极鱼科(Nototheniidae)、











小岛吉雄(1979)在研究染色体时对真骨鱼类进行了划分,提出了3个演化类群,分别为低位类、中位类和高位类;并且,高位类群鱼在进化上处于上位,其染色体数目越收敛,中部和亚中部着丝粒染色体少,端部和亚端部着丝粒染色体数目多(小岛吉雄, 1979; 李鹏飞等, 2007)。同时,在分类阶元中端部着丝粒染色体多的种类为基本类群;中部或者亚中部着丝粒较多为特化类群,即染色体臂数越多的类群更特化(李树深, 1981)。本研究中,黄海北部黄条







| Amores A, Catchen J, Nanda I, et al. A RAD-tag genetic map for the platyfish (Xiphophorus maculatus) reveals mechanisms of karyotype evolution among teleost fish. Genetics , 2014, 197 (2) : 625-641 DOI:10.1534/genetics.114.164293 | |
| Braasch I, Gehrke AR, Smith JJ, et al. The spotted gar genome illuminates vertebrate evolution and facilitates human-teleost comparisons. Nature Genetics , 2016, 48 (4) : 427-437 DOI:10.1038/ng.3526 | |
| Chai XL, Li XX, Lu RM, et al. Karyotype analysis of the yellowtail kingfish Seriola lalandi lalandi (Perciformes: Carangidae) from South Australia. Aquaculture Research , 2009, 40 (15) : 1735-1741 DOI:10.1111/are.2009.40.issue-15 | |
| Ida H, Murofushi S, Fujiwara S, et al. Preparation of fish chromosomes by in vitro colchicine treatment. Japanese Journal of Ichthyology , 1978, 24 (4) : 281-284 | |
| Galetti PM, Aguilar CT, Molina WF. An overview of marine fish cytogenetics. Hydrobiologia , 2000, 420 (1) : 55-62 DOI:10.1023/A:1003977418900 | |
|
Jiang DW, Lin LL, Chen Y, et al. Indoor wintering and growth of Seriola aureorvttata Temminck et Schegel.
Journal of Dalian Fisheries University , 2001, 16 (3) : 223-227 [姜大为, 林乐玲, 陈勇, 等. 黄条 |
|
| Khan TA, Bhise MP, Lakra WS. Chromosome manipulation in fish-a review. Indian Journal of Animal Science , 2000, 70 (2) : 213-221 | |
| Levan A, Fredga K, Sandberg A. Nomenclature for centromeric position on chromosomes. Hereditas , 1964, 52 (2) : 201-220 | |
| Li PF, Liu P, Liu XZ. Study on the karyotype of Paralichthys lethostigma. Marine Fisheries Research , 2007, 28 (4) : 26-30 [李鹏飞, 刘萍, 柳学周. 漠斑牙鲆染色体组型研究. 海洋水产研究 , 2007, 28 (4) : 26-30] | |
| Li SS. Taxonomy of fish cell. Science Trends of Biology , 1981 (2) : 8-15 [李树深. 鱼类细胞分类学. 生物科学动态 , 1981 (2) : 8-15] | |
| Martínez P, Viáas AM, Sánchez L, et al. Genetic architecture of sex determination in fish: applications to sex ratio control in aquaculture. Frontiers in Genetics , 2014, 5 : 1-13 | |
| Meng QW, Su JX, Miao XZ. Systematics of fishes. China Agriculture Press, 1995, 672 [孟庆闻, 苏锦祥, 缪学祖.鱼类分类学.北京:中国农业出版社, 1995, 672] | |
| Molina-Luzón MJ, López JR, Robles F. Chromosomal manipulation in Senegalese sole (Solea senegalensis Kaup, 1858): induction of triploidy and gynogenesis. Journal of Applied Genetics , 2015, 56 (1) : 77-84 DOI:10.1007/s13353-014-0233-x | |
| Nakada M. Capture-based aquaculture of yellowtail. in Capture-Based Aquaculture. Global Overview. FAO Fisheries Technical Paper. No. 508 (ed. by Lovatelli A & Holthus PF), 2008, 199-215 | |
| Ohara E, Nishimura T, Nagakura Y, et al. Genetic linkage maps of two yellowtails (Seriola quinqueradiata andSeriola lalandi). Aquaculture , 2005, 244 (1-4) : 41-48 DOI:10.1016/j.aquaculture.2004.10.022 | |
| Ojima. Aquatic biology and genetic breeding. Tokyo: Water delivery press, 1979 : 46 -62. [小岛吉雄. 水产生物及遗传育种. 东京: 水交出版社, 1979 : 46 -62.] | |
| Sola L, Cipelli O, Gornung E, et al. Cytogenetic characterization of the greater amberjack, Seriola dumerili (Pisces: Carangidae), by different staining techniques and fluorescence in situ hybridization. Marine Biology , 1997, 128 (4) : 573-577 DOI:10.1007/s002270050123 | |
| Tripathy NK, Das CC. Karyotypes of five Indian Perciform fishes. Copeia , 1988 (1) : 231-233 | |
| Vitturi R, Mazzola A, Macaluso M, et al. Chromosomal polymorphism associated with Robertsonian fusion in Seriola dumerili (Risso, 1810) (Pisces: Carangidae). Journal of Fish Biology , 1986, 29 (5) : 529-534 DOI:10.1111/jfb.1986.29.issue-5 | |
| Wang B, Sun PX, Dong ZF. Biological characteristics and breeding of yellowtail. Fishery Modernization , 2005 (3) : 18-20 [王波, 孙丕喜, 董振芳. 黄尾鰤的生物学特性与养殖. 渔业现代化 , 2005 (3) : 18-20] | |
| Wang LZ, Li L, Li T, et al. Karyotype ofSilurus lanzhouensis. Chinese Journal of Zoology , 2015, 50 (2) : 272-276 [王绿洲, 李蕾, 李涛, 等. 兰州鲇染色体组型. 动物学杂志 , 2015, 50 (2) : 272-276] | |
| Wang YY, Liu XZ, Xu YJ, et al. Study on the karyotype of Verasper moseri. Progress in Fisheries Science , 2009, 30 (2) : 8-13 [王妍妍, 柳学周, 徐永江, 等. 条斑星鲽染色体核型分析. 渔业科学进展 , 2009, 30 (2) : 8-13] | |
| Xue R, An H, Liu QH, et al. Karyotype and AG-NORS in male and female of Oplegnathus punctatus. Oceanologia Et Limnologia Sinica , 2016, 47 (3) : 626-632 [薛蕊, 安皓, 刘清华, 等. 斑石鲷(Oplegnathus punctatus)雌、雄鱼核型及Ag-NORs带型分析. 海洋与湖沼 , 2016, 47 (3) : 626-632] |



