2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071
氨氮是鱼类蛋白质代谢的最终产物,约占鱼类氮代谢的60%-80%(Salin et al, 1991)。鱼类已形成高密度工厂化养殖,鱼类的残饵和排泄物经氨化作用产生大量氨态氮,以非离子氨为主要毒性形式。王琨 (2007)1)研究证明,氨氮是诱发鱼病的主要环境因子。当水生动物机体在受到氨氮连续刺激且超过机体调节阈值时,其抗氧化系统会遭到破坏,鳃、肾和肝组织结构发生病变 (张武肖等, 2015),呼吸系统和排泄系统受到损害,进而影响机体的生长发育。目前,国内外已有较多关于氨氮胁迫对水生动物影响的报道,如黑鲷 (Acanthopagrus schlegeli) (龙章强, 2008)1)、牙鲆 (Paralichthys olivaceus) (叶继丹等, 2007)、黄颡鱼 (Pelteobagrus fulvidraco) (黎庆等, 2015)、克氏原螯虾 (Procambarus clarkia) (芦光宇等, 2014)、奥尼罗非鱼 (Oreochromis niloticus × O. areus) (韩春艳等, 2014) 等,不同种鱼对氨氮耐受能力不同。同种鱼不同规格及不同地理群体对氨氮的耐受能力也不尽相同 (周永欣, 1986)。本实验通过研究不同氨氮浓度、不同胁迫时间对圆斑星鲽 (Verasper variegatus) 鳃、肝组织结构及抗氧化、免疫指标的影响,探讨NH4-N对圆斑星鲽产生毒害的机制,进而实时监测养殖水体氨氮浓度的变化,预防病害,为圆斑星鲽的健康养殖提供依据。
1) Wang K. Effects of ammonia on some tissue and haematological parameters of juvenile carp (Cyprinus carpio Linnaeus). Master's Thesis of the Northeast Agricultural University, 2007, 12–23 [王琨. 氨氮对鲤(Cyprinus carpio Linnaeus)幼鱼部分组 织及血液指标的响. 东北农业大学硕士研究生学位论文, 2007, 12–23]
1) Long ZQ. The physiological responses to ammonia stress and vitamin C requirement of juvenile black seabream Acanthopagrus schlegeli. Master s Thesis of East China Normal University, 2008, 23-30 [龙章强.黑鲷 (Acanthopagrus schlegeli) 幼鱼对氨氮胁迫的生理响应及其维生素C的营养需求研究.华东师范大学硕士研究生学位论文, 2008, 23-30]
1 材料与方法 1.1 实验材料圆斑星鲽采自山东科合海洋高技术有限公司,挑选同一批次体质健康、规格接近[体重为 (70.0±5.5) g,体长为 (21.0±2.2) cm]的幼鱼。实验前驯养7 d,每天08:00和17:00定时换水20%,15:00投喂1次商品饲料,连续充气增氧。暂养水温为 (21.0±0.5)℃、pH为 (7.8±0.2)、溶氧>6 mg/L、总氨氮浓度为0.01 mg/L,氨氮测定仪由北京连华永兴科技发展有限公司提供。
1.2 急性毒性实验急性毒性实验在方形水泥池 (210 cm× 130 cm× 44 cm) 进行,以24 h内未见死亡的最小浓度 (75 mg/L) 和全部死亡的最大浓度 (150 mg/L) 为区间,作等对数划分。设置75.00、89.18、106.05、126.11和149.97 mg/L共5个浓度水平,每组2个重复,每个重复组20尾鱼,每天用氨氮测定仪检测并用对应氨氮质量浓度的养殖用水调整水体氨氮浓度,使其维持在初始浓度。分别记录24、48、72和96 h圆斑星鲽的死亡数量。每组浓度实测值分别为 (75.00±0.35)、(89.18±0.28)、(106.05±0.44)、(126.11±0.40) 和 (149.97±0.56) mg/L,水温为 (21.2±0.4)℃,pH为7.7±0.4,溶氧为 (6.20±0.25) mg/L。
1.3 氨氮胁迫实验 1.3.1 实验组设置通过预实验得出圆斑星鲽幼鱼96 h氨氮半致死浓度 (LC50),据此设置对照、低 (35 mg/L)、中 (50 mg/L) 和高氨氮组 (65 mg/L),实测每组氨氮值分别为对照 (0±0.01) mg/L、低 (35.00±1.87) mg/L、中 (50.00±1.22) mg/L、高氨氮组 (65.00±2.35) mg/L。随机挑选体色正常、健康的圆斑星鲽幼鱼,每组3个重复,每个重复20尾鱼,用对应氨氮质量浓度的养殖用水调整水体氨氮浓度,使其维持在初始浓度。实验期间停止投饵,每隔8 h测定氨氮浓度。水温为 (21.0±0.5)℃,pH为 (7.8±0.5),溶氧为 (6.68±0.15) mg/L。
1.3.2 样品采集与分析分别于氨氮胁迫后的0、6、12、24、48、96 h,每个池子随机挑选3尾实验鱼进行解剖取样。用1 ml无菌注射器尾静脉采血,置于无菌离心管中,4℃下3500 r/min离心15 min,取上层血清,置于-80℃超低温冰箱保存备用。冰浴条件下,在每条鱼的相同部位取出适量鳃丝、肝,并准确称量鳃、肝组织质量,按质量体积比制成10%的组织匀浆,4℃下3500 r/min离心10 min,取上清液,置于-80℃超低温冰箱保存备用。
鳃及肝组织显微观察:取鱼体右侧第二鳃弓及适量肝脏,用Bouin氏液固定,常规石蜡切片,HE染色,显微观察并拍照 (10×100)。
Na+/K+-ATP酶、谷胱甘肽过氧化物酶 (GSH-PX)、丙二醛 (MDA)、超氧化物歧化酶 (SOD)、谷丙转氨酶 (ALT)、谷草转氨酶 (AST) 和溶菌酶均采用南京建成生物工程研究所试剂盒测定。
1.4 数据统计分析急性毒性实验使用SPSS 17.0软件处理数据,采用直线内插法 (雷衍之, 2008) 求出LC50,安全浓度 (SC) 和非离子氨浓度 (国家环境保护局科技司, 1995) 的计算公式:
SC=0.1×96 h LC50
非离子氨浓度计算公式:
C1= 1.216×f×C2/100
f =100/(10pKa-pH+1)
pKa=0.09018+2729.92/T
T=273.15+t
式中,C1为非离子氨浓度 (mg/L),f为氨的水溶液中非离子氨的摩尔百分比 (%),C2为氨氮浓度 (mg/L),T为绝对温度 (K),t为摄氏温度 (℃)。
酶活实验结果以3个平行组数据平均值±标准差 (Mean±SD) 表示,用SPSS 17.0软件进行单因素方差分析 (One-way ANOVA) 和Duncan氏检验法统计分析,P < 0.05为差异显著。
2 结果与分析 2.1 氨氮半致死浓度的测定设置不同氨氮浓度梯度,记录圆斑星鲽幼鱼的死亡率 (表 1),通过直线内插法求出氨氮胁迫对圆斑星鲽幼鱼24、48、72和96 h的半致死浓度,并转换成非离子氨浓度,计算得出氨氮和非离子氨的安全浓度 (表 2)。
|
|
表 1 氨氮胁迫对圆斑星鲽幼鱼死亡率的影响 Table 1 Effects of ammonia-N stress on the mortality of V. variegatus |
|
|
表 2 氨氮对圆斑星鲽幼鱼的半致死浓度和安全浓度 Table 2 The median lethal concentration and safe concentration of ammonia nitrogen for V. variegatus |
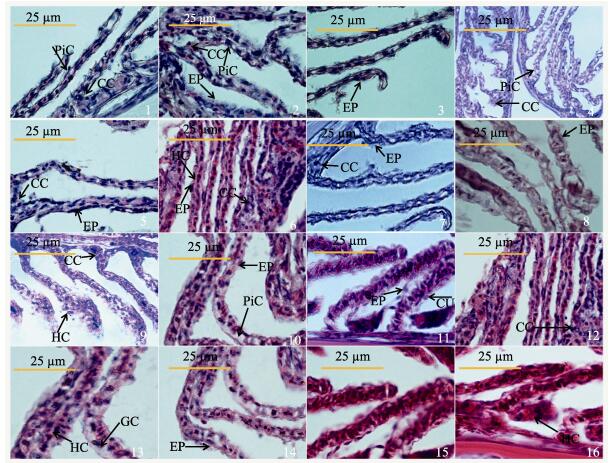
氨氮胁迫前,圆斑星鲽幼鱼的鳃丝和鳃小片泌氯细胞较少,柱状细胞和呼吸上皮细胞排列整齐规则 (图 1-1)。低氨氮胁迫6 h和12 h,泌氯细胞无明显变化 (图 1-2和图 1-3);24 h泌氯细胞增加 (图 1-4);48 h上皮组织增生 (图 1-5);96 h呼吸上皮细胞部分脱落,鳃腔有充血现象,柱状细胞排列不整齐 (图 1-6)。中氨氮胁迫12 h出现呼吸上皮细胞部分脱落 (图 1-8);24 h泌氯细胞增加,柱状细胞排列不整齐,部分毛细血管破裂,红细胞溢出 (图 1-9);48 h呼吸上皮细胞大面积脱落,鳃小片变粗、变短并卷曲 (图 1-10);96 h毛细血管破裂、鳃腔充血 (图 1-11)。高氨氮浓度胁迫6 h泌氯细胞数量增加 (图 1-12);12 h毛细血管扩张出现破裂,鳃腔充血,部分呼吸上皮细胞水肿变性、坏死和脱落,鳃小片部分融合 (图 1-13);24 h柱状细胞排列不规则,出现充血,鳃小片卷曲 (图 1-14);48 h呼吸上皮细胞水肿变性、大面积坏死和脱落,毛细血管破裂,血细胞溢出,鳃小片变粗变短 (图 1-15);96 h鳃腔内充血严重,上皮组织增生 (图 1-16)。
|
图 1 圆斑星鲽鳃组织切片
Figure 1 Microscopical observation of the gill structure of V. variegatus exposed to ammonia-N at different concentrations
1.氨氮胁迫0 h (对照组); 2-6:低氨氮浓度 (10 mg/L) 胁迫6、12、24、48和96 h; 7-11:中氨氮浓度胁迫6、12、24、48和96 h; 12-16:高氨氮浓度胁迫6、12、24、48和96 h GC:鳃腔; CU:角质膜; EP:上皮层细胞; HC:血细胞; CC:泌氯细胞; PiC:柱状细胞 1. Microscopical gill exposed to ammonia for 0 h; 2-6: Low ammonia for 6, 12, 24, 48, and 96 h; 7-11: Medium ammonia for 6, 12, 24, 48, and 96 h; 12-16: High ammonia for 6, 12, 24, 48, and 96 h GC: Gill cavity; CU: Cuticle; EP: Epith elium; HC: Haemolymph cell; CC: Secretory chloride cell; PiC: Columnar cell |
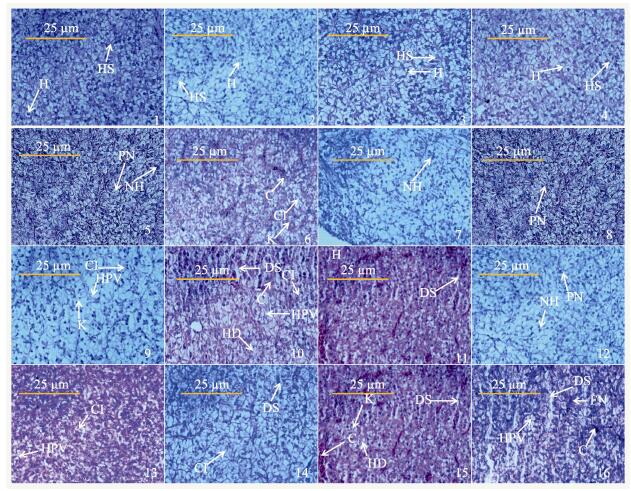
氨氮胁迫前,肝细胞排列整齐,细胞轮廓清晰 (图 2-1)。低氨氮胁迫6、12和24 h,肝细胞无明显变化 (图 2-2、3、4);48 h肝细胞核出现偏移、肿大现象 (图 2-5);96 h细胞核出现溶解,细胞轮廓模糊,血窦充血 (图 2-6)。中氨氮胁迫6 h部分细胞核肿大 (图 2-7);12 h出现细胞核溶解 (图 2-8);24 h细胞核溶解数量增多,细胞出现空泡化,细胞轮廓模糊 (图 2-9);48 h局部肝细胞水样变性,血窦扩张、充血 (图 2-10);96 h充血严重,细胞大量水样变性、空泡化 (图 2-11)。高氨氮胁迫6 h,细胞核颜色加深,细胞和细胞核均肿胀,细胞核出现偏移 (图 2-12);12 h细胞出现空泡化,胞浆疏松透明,水样变性 (图 2-13);24 h细胞轮廓模糊,个别细胞溶解 (图 2-14);48 h肝血窦出现扩张、充血,肝细胞溶解,形成局部病灶 (图 2-15);96 h大面积细胞核溶解,细胞空泡化、溶解严重,肝血窦严重扩张,大面积充血,形成点状病灶 (图 2-16)。
|
图 2 圆斑星鲽肝组织切片
Figure 2 Microscopical observation of the liver structure of V. variegatus
exposed to ammonia-N at different concentrations
1.氨氮胁迫0 h (对照组); 2-6:低氨氮浓度胁迫6、12、24、48和96 h; 7-11:中氨氮浓度胁迫6、12、24、48和96 h; 12-16:高氨氮浓度胁迫6、12、24、48和96 h H:肝细胞; HS:肝血窦; PN:细胞核偏移; NH:细胞核肿大; K:细胞核溶解; HPV:肝细胞空泡化; HD:肝细胞水样变性; C:充血; CI:细胞轮廓模糊; DS:血窦扩张; FN:点状病灶 1. Microscopical liver exposed to ammonia for 0 h; 2-6: Low ammonia for 6, 12, 24, 48, and 96 h; 7-11: Medium ammonia for 6, 12, 24, 48, and 96 h; 12-16: High ammonia for 6, 12, 24, 48, and 96 h H: Hepatocytes; HS: Sinusoids; PN: Cellular peripheral nucleus; NH: Nuclear hypertrophy; K: Karyolysis; HPV: Hepato cellular vacuolation; HD: Hydropic degeneration; C: Congestion; CI: Cellular outline indistinguishable; DS: Dilatation in sinusoids; FN: Focal necrosis |
与对照组相比,氨氮胁迫各组在24 h内,Na+/K+-ATP酶均呈负峰值变化,且高浓度组和中浓度组在6 h达到最低值,低浓度组在12 h达到最低值,均与对照组差异显著 (P < 0.05)。24 h后高浓度组呈正峰值增长,中浓度组到达对照组水平 (P < 0.05);低浓度组呈上升趋势但仍低于对照组 (P < 0.05)。氨氮胁迫组在24 h后均上升且在48 h达到最大值,均与对照组差异显著 (P < 0.05)。96 h各组降至对照组水平 (P > 0.05) (图 3)。
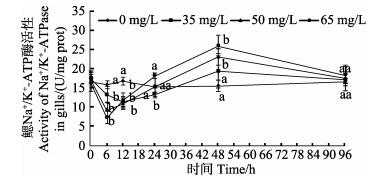
|
图 3 氨氮胁迫对圆斑星鲽鳃丝Na+/K+-ATP酶的影响 Figure 3 Effects of ammonia-N stress on the Na+/K+-ATPase in gills of V. variegatus 图中不同字母表示同一时间段不同处理组间差异显著 (P < 0.05);反之则差异不显著 (P > 0.05);下同 Different letters showed significant difference among treatments (P < 0.05) at the same sampling time; The same as below |
氨氮胁迫6 h,血清SOD活性高于对照组,且在6 h达到最大值,与对照组差异显著 (P < 0.05)(图 4)。6-96 h氨氮胁迫组均低于对照组,在12 h降到最低 (P < 0.05)。高浓度组48 h后显著低于对照组 (P < 0.05),低浓度组和中浓度组48 h后到达同一水平 (P < 0.05)。
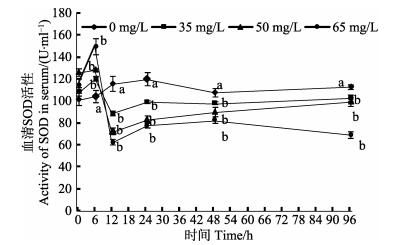
|
图 4 氨氮胁迫对圆斑星鲽幼鱼血清SOD的影响 Figure 4 Effects of ammonia-N stress on SOD in the serum of juvenile V. variegatus |
与对照组相比,氨氮胁迫下血清GSH-PX在96 h内先下降后上升,均低于对照组 (P < 0.05) (图 5)。低浓度组在24 h达到最低值,中浓度组在6 h达到最低值,高浓度组在12 h达到最低值,均与对照组差异显著 (P < 0.05)。

|
图 5 氨氮胁迫对圆斑星鲽幼鱼血清GSH-PX的影响 Figure 5 Effects of ammonia-N stress on GSH-PX in the serum of juvenile V. variegatus |
氨氮胁迫组在96 h内血清MDA均先升高后降低并显著高于对照组 (P < 0.05),且与氨氮浓度呈显著正相关 (P < 0.05) (图 6)。处理组均在24 h升高至最高值,高浓度组升至最高,并与对照组差异显著 (P < 0.05)。处理组96 h仍显著高于对照组 (P < 0.05)。

|
图 6 氨氮胁迫对圆斑星鲽幼鱼血清MDA的影响 Figure 6 Effects of ammonia-N stress on MDA in the serum of juvenile V. variegatus |
氨氮胁迫96 h,肝脏GSH-PX活性先下降后上升,均低于对照组 (P < 0.05) (图 7)。12 h时,高氨氮组GSH-PX活性降至最小,低、中氨氮组达到最小值,且均与对照组差异显著 (P < 0.05);24 h时,氨氮胁迫组GSH-PX活性均上升,高浓度组上升至最大,低浓度组和中浓度组也达到最大值,均与对照组有显著性差异 (P < 0.05)。12 h后高浓度组GSH-PX开始下降,48 h达到最低点,低浓度组12 h后上升,到48 h达到最高点。96 h三个处理组仍显著低于对照组 (P < 0.05)。
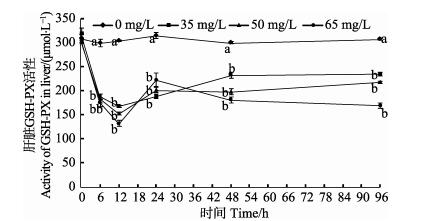
|
图 7 氨氮胁迫对圆斑星鲽幼鱼肝脏GSH-PX的影响 Figure 7 Effects of ammonia-N stress on GSH-PX in the liver of juvenile V. variegatus |
氨氮胁迫组肝脏SOD活性6 h升高至峰值,均高于对照组 (P < 0.05) (图 8)。6 h时,低浓度组呈下降趋势,在96 h仍显著高于对照组 (P < 0.05);中浓度组6 h后SOD下降,96 h低于对照组 (P > 0.05);高浓度组6 h后下降,96 h显著低于对照组 (P < 0.05)。
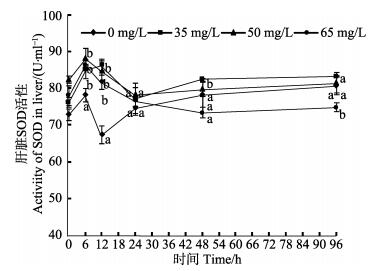
|
图 8 氨氮胁迫对圆斑星鲽幼鱼肝脏SOD的影响 Figure 8 Effects of ammonia-N stress on the SOD in the liver of V. variegatus |
与对照组相比,处理组MDA在胁迫6 h差异不显著 (P > 0.05);6-24 h处理组均先上升后下降,且都高于对照组 (P < 0.05);在24 h达到最大值,高浓度组显著高于中浓度组和低浓度组。高浓度组在24-96 h趋于平坦并显著高于对照组和其他2个处理组 (P < 0.05);中浓度组在24-96 h先上升后下降,在48 h有最大值并高于对照组 (P < 0.05);低浓度组96 h与对照组无显著性差异 (P > 0.05)(图 9)。
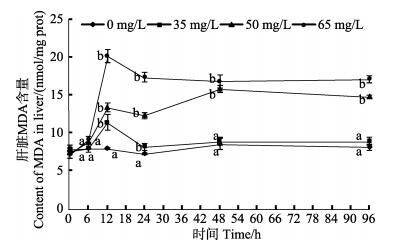
|
图 9 氨氮胁迫对圆斑星鲽幼鱼肝脏MDA的影响 Figure 9 Effects of ammonia-N stress on MDA in the liver of juvenile V. variegates |
氨氮胁迫对血清ALT、AST产生显著性影响 (P < 0.05),处理组均高于对照组 (P < 0.05)(图 10、图 11)。0-12 h,处理组ALT、AST活性随氨氮浓度增加均显著升高并在12 h达到峰值,高浓度组到达最大值。ALT在12-48 h呈下降趋势,AST在24-48 h呈下降趋势,2种酶48 h后均趋于平坦,96 h仍处于较高水平 (P < 0.05)。氨氮胁迫对血清LSZ影响显著 (P < 0.05)(图 12)。0-24 h,LSZ活性先升高后降低,在12 h达到峰值,表现为随氨氮浓度升高而升高,并高于对照组 (P < 0.05)。36 h后降至对照组以下,48 h降至最低,高浓度组达到最低值,48-96 h处理组趋于平坦,但显著低于对照组 (P < 0.05)。
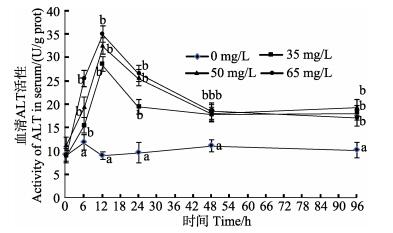
|
图 10 氨氮胁迫对圆斑星鲽幼鱼血清ALT的影响 Figure 10 Effects of ammonia-N stress on ALT in the serum of juvenile V. variegatus |

|
图 11 氨氮胁迫对圆斑星鲽幼鱼血清AST的影响 Figure 11 Effects of ammonia-N stress on AST in the serum of juvenile V. variegatus |
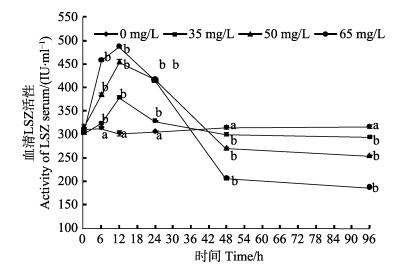
|
图 12 氨氮胁迫对圆斑星鲽幼鱼血清LSZ的影响 Figure 12 Effects of ammonia-N stress on LSZ in the serum of juvenile V. variegatus |
与对照组相比,氨氮胁迫0-6 h,肝脏ALT、AST活性显著升高 (P < 0.05),在6 h达到峰值,氨氮浓度越高峰值越高 (图 13、图 14)。ALT在6 h后呈下降趋势,24 h时,中浓度和高浓度组均低于对照组,低浓度组高于对照组,均有显著性差异 (P < 0.05)。48-96 h时,氨氮胁迫组均低于对照组 (P < 0.05)。AST在6 h后下降,12 h低浓度组仍显著高于对照组 (P < 0.05)。中浓度组和高浓度组降至对照组水平且无显著性差异 (P > 0.05)。24-96 h时,处理组均显著低于对照组 (P < 0.05),且氨氮浓度越高酶活性越低。

|
图 13 氨氮胁迫对圆斑星鲽幼鱼肝脏ALT的影响 Figure 13 Effects of ammonia-N stress on ALT in the liver of juvenile V. variegatus |

|
图 14 氨氮胁迫对圆斑星鲽幼鱼肝脏AST的影响 Figure 14 Effects of ammonia-N stress on AST in the liver of juvenile V. variegatus |
肝脏LSZ活性96 h均显著低于对照组水平 (P < 0.05)。0-48 h随氨氮浓度的增加,LSZ活性降低,48 h高浓度组达到最小值 (P < 0.05)。48-96 h低浓度组升高,高浓度组和中浓度组降低,均显著低于对照组 (P < 0.05)(图 15)。

|
图 15 氨氮胁迫对圆斑星鲽幼鱼肝脏LSZ的影响 Figure 15 Effects of ammonia-N stress on LSZ in the liver of juvenile V. variegatus |
鳃是鱼类的重要呼吸器官,具有呼吸、排泄、调节渗透平衡的功能。鱼类的鳃与其生活的水环境直接接触,易因水体污染受到损害,致其正常生理功能受损,危害鱼体健康 (吴玲玲等, 2007)。当受到有毒物质侵害后,鳃的组织细胞会出现损伤,可以分为以下两类:一是防御产生的损伤,包括鳃丝上皮细胞增生和肿大、鳃小片的呼吸上皮水肿等;二是直接造成损伤,包括鳃上皮细胞坏死和脱落等 (Sun et al, 2006; Fanta et al, 2003)。本研究结果显示,低浓度长时间或高浓度氨氮胁迫对鳃组织结构影响显著,泌氯细胞增加,呼吸上皮细胞严重水肿变性,上皮组织增生,上皮细胞脱落和坏死严重,毛细血管破裂,血细胞溢出,鳃腔内充血严重,鳃小片变粗变短并卷曲。与张武肖等 (2015)、Benli等 (2008)、周鑫 (2013)等研究结果相近。鳃丝上泌氯细胞数量增多,说明鳃的主动渗透调节机制被激活,且胁迫浓度越高,渗透调节机制启动越快。鳃丝上有数千个鳃小片,形成巨大的表面积供气体交换,鳃小片是气体交换的主要场所 (李加儿等, 2009)。鳃丝中毛细血管破裂,鳃腔狭窄,呼吸上皮细胞脱落等都严重影响鳃的呼吸功能。
鱼类的肝脏是主要的解毒和代谢器官,是鱼体中各种污染与毒素聚集处。高浓度的氨氮污染水体,氨氮通过肝门静脉运输参与肝的代谢活动。因此,肝脏是在氨氮胁迫下受到严重损害的器官之一。本研究结果显示,高浓度氨氮胁迫使肝细胞肿大,细胞核溶解,肝细胞空泡化、溶解,细胞轮廓模糊甚至消失,肝血窦扩张、充血形成点状病灶。这与在其他胁迫研究下肝脏的损伤相似,如氯氰菊酯对草鱼 (Ctenopharyngodon idellus) 的胁迫 (谢文平等, 2009)、对鲤 (Cyprinus carpio) 幼鱼 (Shiogiri et al, 2012) 的氨氮胁迫、草甘膦对细鳞肥脂鲤 (Mylopharyngodon piceus) 毒性实验 (Shiogiri et al, 2012) 等。当肝细胞肿大时,细胞活性增加,但当细胞空泡化时,说明肝功能已受损 (张武肖等, 2015)。本研究中,高浓度氨氮胁迫6 h,肝细胞及细胞核肿大,说明胁迫初期圆斑星鲽幼鱼的活性增加,可能是抗氧化酶的活性受到了影响 (徐力文等, 2007);胁迫12 h细胞出现空泡化,这时肝功能已受到了影响,细胞核空泡化表明细胞已开始坏死;48 h后,圆斑星鲽幼鱼肝细胞已大量坏死。结果表明,高浓度或者长时间的氨氮胁迫下,肝细胞坏死使肝功能受损。组织切片证明,高浓度氨氮胁迫12 h后可使鳃小片呼吸上皮细胞脱落坏死甚至鳃部毛细血管破裂组织充血,长时间胁迫下严重影响圆斑星鲽的呼吸功能,进而造成鱼体死亡。高浓度氨氮胁迫下,肝组织切片显示肝血窦扩张,细胞变性坏死,因此,氨氮胁迫会造成圆斑星鲽幼鱼鳃、肝等组织损伤使鱼体发生病变。
3.2 氨氮胁迫对鳃Na+/K+-ATP酶活力的影响Na+/K+-ATP酶是在鳃组织上泌氯细胞和细胞器膜上的蛋白酶,在鱼体起渗透调节作用,其原理是主动运输排出Na+、吸收K+,细胞内外形成电位差,通过细胞膜上的载体蛋白和离子通道运输,使体内渗透压稳定 (蒋玫等, 2014)。鲻鱼 (Mugil cephalus) (李波等, 2007)、黄颡鱼 (王雷等, 1994) 等在慢性氨氮胁迫下,Na+/K+-ATP酶都显著降低,但对急性氨氮胁迫的报道还较少。本研究结果显示,同一氨氮浓度下,鳃丝Na+/K+-ATP酶活性随时间出现降低升高交替的现象。胁迫6 h各处理组显著下降且低于对照组,浓度越高,下降越快,6 h后上升,48 h后下降。可能是胁迫初期水体中高浓度氨氮通过渗透作用进入机体,机体正常氨氮排泄受阻,高浓度的氨氮影响Na+/K+-ATP酶蛋白结构,使酶活力降低,后来机体激活体内渗透机制,通过主动渗透调节使酶活上升。鳃组织显微观察显示,高浓度组和中浓度组分别在胁迫6 h和12 h泌氯细胞开始增多,主动渗透调节被激活,且渗透调节机制胁迫浓度越高,启动越快。48 h后,Na+/K+-ATP酶下降,可能与鳃上皮细胞脱落、坏死,毛细血管破裂,鳃腔充血有关。
3.3 氨氮胁迫对抗氧化系统的影响机体内抗氧化系统主要由应激诱导的抗氧化酶如GSH-PX、SOD等组成。氨氮在水体中主要有非离子氨 (NH3) 和离子氨 (NH4+) 两种形式,由于NH3不带电荷又具有脂溶性,可透过细胞膜,使机体内产生大量活性氧自由基 (O2-和HO2-),进而启动机体抗氧化系统 (雷衍之, 2008)。本研究中,血清和肝脏GSH-PX在胁迫下先下降后降低,96 h仍显著低于对照组。GSH-PX是普遍存在于机体中的具有催化H2O2分解的酶,且特异催化GSH与H2O2的还原反应,从而保护细胞膜的结构和功能完整 (刘晓华等, 2007)。因氨氮胁迫初期机体有短暂应激反应,GSH-PX和GSH含量下降 (邱德全等, 2008)。血清和肝脏SOD先升高后降低,氨氮浓度越高,活性下降越快。肝脏MDA含量在抗氧化酶活性下降时明显升高。据洪美玲 (2007)1)报道,低氨氮浓度胁迫下,机体中抗氧化酶活性升高而抑制氧化自由基的产生,但机体抗氧化酶活力在高浓度氨氮胁迫下受到抑制,从而使机体抗氧化能力下降,机体不能及时有效的清除产生的氧自由基。氧自由基加快机体脂质过氧化,从而脂质化产物MDA增加 (陈昌生等, 2001)。这与叶继丹等 (2007)、李永等 (2012)、黎庆等 (2015)的报道一致。氨氮胁迫对机体的抗氧化系统产生不良影响,影响动物机体正常的生理活动甚至产生病害。
1) Hong ML. Toxicity of ambient nitrite and ammonia on Eriocheir sinensis juveniles and nutritional modulation of dietary VE. Doctoral Dissertation of East China Normal University, 2007, 82-89 [洪美玲.水中亚硝酸盐和氨氮对中华绒螯蟹幼体的毒性效应及维生素E的营养调节.华东师范大学博士研究生学位论文, 2007, 82-89]
3.4 氨氮胁迫对非特异性免疫系统的影响ALT和AST是动物体内广泛存在的重要的转氨酶,对机体氨基酸合成与分解代谢具有重要作用。通常用这2种酶活性检测动物体内氨基酸的代谢,同时反映肝脏功能。ALT绝大部分存在于细胞浆,AST位于线粒体,少量在细胞浆中。肝脏是动物机体营养物质消化的主要腺体,也是尿素合成的主要场所,有解毒功能。正常情况下,血清中只有微量ALT和AST,当肝细胞膜和线粒体膜受损时,膜通透性增加,ALT和AST被释放进入血液中 (赵杰等, 2002)。氨氮胁迫6 h,血清和肝脏中ALT和AST活性均升高,说明这2种酶受到胁迫诱导,活性提高以加强氨氮毒性的排出。6-96 h时,血清中ALT和AST活性仍处于显著高水平,但肝脏中这2种酶活性显著下降并低于对照组。其原因可能是随着氨氮胁迫时间的延长,肝细胞受到损害出现细胞溶解、充血、细胞轮廓模糊等症状,导致细胞膜和线粒体膜通透性增加,ALT和AST被释放进入血液所致。这与氯氰菊酯对鲫鱼的毒性实验 (王媛等, 2005),乙草胺对泥鳅 (张彬彬, 2005) 胁迫实验结果一致。氨氮胁迫对圆斑星鲽幼鱼的非特异免疫系统产生毒害作用,损害肝脏的正常功能,对鱼体生理生长产生阻碍。
溶菌酶 (LSZ) 是一种碱性蛋白酶,作为血淋巴免疫应答因子存在于动物体内,可以裂解微生物细胞壁,水解革兰氏阳性细菌,清除侵入机体体内的异物,起到免疫防御功能 (Zhao et al, 2003)。本研究中,胁迫0-12 h,血清LSZ上升,且氨氮浓度越高,酶活性越高。可能是因为在低浓度胁迫或短时间高浓度胁迫下,圆斑星鲽机体出现强烈应激反应,酶活性升高。12-96 h酶活性下降,48 h低于对照组,氨氮浓度越高酶活性下降越快,说明圆斑星鲽对氨氮有一定的耐受性,超过耐受浓度和时间后,LSZ活性降低。高浓度或长时间的氨氮胁迫会使圆斑星鲽幼鱼LSZ活性降低,进而使其非特异性免疫力下降。因此,LSZ活性可作为圆斑星鲽应激与污染物耐受性的信号。这与氨氮胁迫对马氏珠母贝 (Pinctada martensii) (栗志民, 2011)、菲律宾蛤仔 (Ruditapes philippinarum) (王文琪等, 2007)、建鲤 (陈家长等, 2000) 的研究结果一致。肝脏LSZ活性0-96 h呈下降趋势并显著低于对照组,本研究证明,氨氮胁迫对肝脏LSZ活性有抑制作用,表明肝脏作为鱼类的解毒器官对氨氮胁迫敏感。
本研究结果表明,高浓度或低浓度长时间氨氮胁迫下,圆斑星鲽幼鱼鳃、肝组织均出现充血现象,鳃组织呼吸上皮细胞水肿变性甚至脱落坏死,毛细血管破裂等,严重影响鱼的呼吸功能;肝细胞出现空泡化,水样变性,血窦扩张形成点状病灶,损害圆斑星鲽的新陈代谢与解毒功能。鳃Na+/K+-ATP酶活性降低,使鱼体内渗透调节紊乱,机体受损。圆斑星鲽抗氧化能力下降,使机体自由基增加,脂质化严重,非特异性免疫力下降,鱼体容易出现各种疾病,从而对养殖效益产生不利影响。本研究确定了圆斑星鲽幼鱼的氨氮半致死浓度及不同氨氮浓度下鱼体鳃、肝组织中Na+/K+-ATP酶、抗氧化指标、非特异性免疫指标的变化,为今后养殖中对水体氨氮的监测提供参考,以便及时对养殖水体氨氮进行调节,及时换水去污。
| Benli AC, Köksal G, Ozkul A. Sublethal ammonia exposure of Nile tilapia (Oreochromis niloticus L. ): Effects on gill, liver and kidney histology. Chemosphere, 2008, 72(9): 1355-1358 | |
| Chen CS, Wang SH, Ji DH, et al. Effects of ammonia-N on activities of CAT and SOD in Haliotis diversicolor supertexta. Journal of Shanghai Fisheries University, 2001, 10(3): 218-222 [陈昌生, 王淑红, 纪德华, 等. 氨氮对九孔鲍过氧化氢酶和超氧化物歧化酶活力的影响. 上海水产大学学报, 2001, 10(3): 218-222] | |
| Chen JZ, Jian JC, Hu GD, et al. Effects of NH3-N on non-specific immunity of Jian Carp. Journal of Zhanjiang Ocean University, 2000, 20(3): 13-16 [陈家长, 简纪常, 胡庚东, 等. 水体中NH3-N对建鲤非特异性免疫功能的影响. 湛江海洋大学学报, 2000, 20(3): 13-16] | |
| Fanta E, Rios FS, Rom S, et al. Histopathology of the fish Corydoras paleatus contaminated with sublethal levels of organ phosphorus in water and food. Ecotoxicology Environment Safety, 2003, 54(2): 119-130 DOI:10.1016/S0147-6513(02)00044-1 | |
| Han CY, Zheng QM, Chen GD, et al. Effect of ammonia-N stress on non-specific immunity of tilapia (Oreochromis niloticus × O. areus). South China Fisheries Science, 2014, 10(3): 49-52 [韩春艳, 郑清梅, 陈桂丹, 等. 氨氮胁迫对奥尼罗非鱼非特异性免疫的影响. 南方水产科学, 2014, 10(3): 49-52] | |
| Jiang M, Li L, Shen XQ, et al. Effect of ammonia stress immunity indicators of juvenile Mugil cephalus. Oceanologia et Limnologia Sinica, 2014, 45(3): 529-535 DOI:10.11693/hyhz20130300010 [蒋玫, 李磊, 沈新强, 等. 慢性氨氮胁迫对鲻鱼 (Mugil cephalus) 幼鱼组织细胞免疫指标的影响研究. 海洋与湖沼, 2014, 45(3): 529-535] | |
| Lei YZ. Chemical water environment for aquaculture. Beijing: China Agriculture Press, 2008: 191-202. [雷衍之. 养殖水环境化学. 北京: 中国农业出版社, 2008: 191-202.] | |
| Li B, Fan QX, Yang K, et al. Effects of chronic ammonia stress on foraging, growth, and haematological parameters of yellow catfish (Pelteobagrus fulvidraco) juveniles. Chinese Journal of Applied and Environmental Biology, 2007, 17(6): 824-829 [李波, 樊启学, 杨凯, 等. 慢性氨氮胁迫对黄颡鱼摄食、生长及血液指标的影响. 应用与环境生物学报, 2007, 17(6): 824-829] | |
| Li JE, Ou YQ, Liu C, et al. A scanning electron microscopic observation of the gill of yellow finporgy Sparus latus and Niletilapia Oreochrom isnilotica. South China Fisheries Science, 2009, 4(5): 26-29 [李加儿, 区又君, 刘匆, 等. 黄鳍鲷和尼罗罗非鱼鳃丝表面结构扫描电镜观察. 南方水产, 2009, 4(5): 26-29] | |
| Li Q, Gong SY, Li M. Chronic ammonia toxicity induces glutamine accumulation, oxidative damage and immunosuppression of juvenile yellow catfish Pelteobagrus fulvidraco. Journal of Fisheries of China, 2015, 39(5): 729-734 [黎庆, 龚诗雁, 黎明. 慢性氨氮暴露诱发黄颡鱼幼鱼谷氨酰胺积累、氧化损伤及免疫抑制的研究. 水产学报, 2015, 39(5): 729-734] | |
| Li Y, Yang QB, Su TF, et al. The toxicity of ammonia-N on Penaeus monodon and immune parameters. Journal of Shanghai Ocean University, 2012, 21(3): 358-362 [李永, 杨其彬, 苏天凤, 等. 氨氮对斑节对虾的毒性及免疫指标的影响. 上海海洋大学学报, 2012, 21(3): 358-362] | |
| Li ZM, Shen YC, Wang SM, et al. Effects of ammonia-N stress on immune activity of Pinctada martensii (Dunker). Journal of Guangdong Ocean University, 2011, 31(4): 52-57 [栗志民, 申玉春, 王淑敏, 等. 氨氮胁迫对马氏珠母贝免疫活性的影响. 广东海洋大学学报, 2011, 31(4): 52-57] | |
| Liu XH, Cao JM, Yang DW, et al. Ammonia nitrogen stress before and after, marina prawns in the organization of antioxidant enzyme and lipid peroxidation products distribution. Reservoir Fisheries, 2007, 27(6): 24-26 [刘晓华, 曹俊明, 杨大伟, 等. 氨氮胁迫前后凡纳滨对虾组织中抗氧化酶和脂质过氧化产物的分布. 水利渔业, 2007, 27(6): 24-26] | |
| Lu GY, Liu GX. Effect of ammonia nitrogen on function of antioxidant system in Procambarus clarkii. Acta Agriculturae Jiangxi, 2014, 26(2): 129-133 [芦光宇, 刘国兴. 氨氮对克氏原螯虾抗氧化功能的影响. 江西农业学报, 2014, 26(2): 129-133] | |
| Qiu DQ, Zhou XJ, Qiu MS. Study on anti-disease ability of Litopenaeus vannamei and the biological control of vibrio parahaemolyticus bacteriophage under stresses of ammonia nitrogen. Acta Hydrobiologica Sinica, 2008, 32(4): 455-461 [邱德全, 周鲜娇, 邱明生. 氨氮胁迫下凡纳滨对虾抗病力和副溶血弧菌噬菌体防病效果研究. 水生生物学报, 2008, 32(4): 455-461] | |
| Salin D, Williot P. Acute toxicity of ammonia to Siberian sturgeon Acipencer beari. Acipenser, Cemagre of Publication, 1991: 153-167 | |
| Shiogiri NS, Paulino MG, Carraschi SP, et al. Acute exposure of a glyphosate-based herbicide affects the gills and liver of the Neo tropical fish, Piaractus mesopotamicus. Environmental Toxicology and Pharmacology, 2012, 34(2): 388-396 DOI:10.1016/j.etap.2012.05.007 | |
| State environmental protection agency (EPA) slurry sampling. The standard of surface water environment non-ionic ammonia conversion method. Environmental Monitoring In China, 1995, 11(4): 9-21 [国家环境保护局科技司. 地面水环境标准非离子氨换算方法. 中国环境监测, 1995, 11(4): 9-21] | |
| Sun YY, Yu HX, Zhang JF, et al. Bioaccumulation, depuration and oxidative stress in fish Carassius auratus under phenanthrene exposure. Chemosphere, 2006, 63(8): 1319-1327 DOI:10.1016/j.chemosphere.2005.09.032 | |
| Wang L, Li GY, Mao YX. Measuring methods and variations of some haemolymph factors in Penaeus chinensis after their oral ingestion of immune drugs. Oceanologia et Limnologia Sinica, 1994, 26(5): 486-490 [王雷, 李光友, 毛远兴. 口服免疫药物后中国对虾某些血淋巴因子的测定及方法研究. 海洋与湖沼, 1994, 26(5): 486-490] | |
| Wang WQ, Jiang LX, Yang N. The effect of ammonia-N on immune activity of Ruditapes philippinarum. Marine Sciences, 2007, 31(1): 23-27 [王文琪, 姜令绪, 杨宁. 氨氮对菲律宾蛤仔免疫力的影响. 海洋科学, 2007, 31(1): 23-27] | |
| Wang Y, Yang KJ, Wu Z, et al. Effect of beta-cypermethrin on glutamic-pyruvic transaminase and glutamic-oxaloacetic transaminase activities in crucian carp. Fisheries Science, 2005, 24(9): 8-10 [王媛, 杨康健, 吴中, 等. 氯氰菊酯对鲫鱼血清中谷丙转氨酶及谷草转氨酶活力的影响. 水产科学, 2005, 24(9): 8-10] | |
| Wu LL, Chen L, Zhang YL. Effects of phenanthrene toxicity on histopathology of Brachydanio rerio gill and liver. Chinese Journal of Ecology, 2007, 26(5): 688-692 [吴玲玲, 陈玲, 张亚雷. 菲对斑马鱼鳃和肝组织结构的影响. 生态学志, 2007, 26(5): 688-692] | |
| Xie WP, Zhu XP, Chen KC, et al. Toxic effects of cypermethrin on Na+/K+-ATP activity and ultramicrostructure of gill and liver tissue in grass carp. Journal of Fishery Sciences of China, 2009, 16(1): 120-125 [谢文平, 朱新平, 陈昆慈, 等. 氯氰菊酯对草鱼组织Na+/K+-ATP酶活性及肝、鳃超显微结构的影响. 中国水产科学, 2009, 16(1): 120-125] | |
| Xu LW, Liu GF, Wang RX, et al. Effects of abrupt salinity stress on osmoregulation of juvenile Rachycentron canadum. Chinese Journal of Applied Ecology, 2007, 18(7): 1596-1600 [徐力文, 刘广锋, 王瑞旋, 等. 急性盐度胁迫对军曹鱼稚鱼渗透压调节的影响. 应用生态学报, 2007, 18(7): 1596-1600] | |
| Ye JD, Wang K, Chang JB. Effects of ammonia exposure on superoxide dismutase activities and malondialdehyde contents in liver of juvenile Paralichthys olivaceus. Chinese Journal of Fisheries, 2007, 20(1): 9-13 [叶继丹, 王琨, 常建波. 氨氮对牙鲆幼鱼肝中超氧化物歧化酶活性及脂质过氧化物含量的影响. 水产学杂志, 2007, 20(1): 9-13] | |
| Zhang BB. Effect of Acetochlor on loach liver cereal third transaminase and aspertate amino transferase. Jiangsu Agricultural Sciences, 2009(1): 289-290 [张彬彬. 乙草胺对泥鳅肝脏谷丙转氨酶和谷草转氨酶的影响. 江苏农业科学, 2009(1): 289-290] | |
| Zhang WX, Sun SM, Ge XP, et al. Acute effects of ammonia exposure on histopathology of gill, liver and kidney in juvenile Megalobrama amblycephala and the post-exposure recovery. Journal of Fisheries of China, 2015, 2(39): 233-240 [张武肖, 孙盛明, 戈贤平, 等. 急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃、肝和肾组织结构的影响. 水产学报, 2015, 2(39): 233-240] | |
| Zhao HX, Zhang YQ, Huang L, et al. Immune system and immunological protection of shrimp. Veterinary Medicine, 2003, 39(1): 41-44 | |
| Zhao J, Gu ZL, Cun QM, et al. Effect of "Kebaike" feed on the activities of succinate dehydrogenase, phosphoric acid triglycerides and aspertate aminotransferase of Penaees chinensis. China Feed, 2002(3): 31-32 [赵杰, 谷子林, 崔青曼, 等. "克白克"对中国对虾体内琥珀酸脱氢酶、磷酸甘油三酯和谷草转氨酶活性的影响. 中国饲料, 2002(3): 31-32] | |
| Zhou X, Dong X, Wang F, et al. The effect of high ammonia concentration on gill structure alternation and expression of SOD and Hsp90 genes in grass carp, Ctenopharyngodon idella. Acta Hydrobiologica Sinica, 2013, 37(2): 321-328 DOI:10.7541/2013.21 [周鑫, 董云伟, 王芳, 等. 急性氨氮胁迫对于草鱼SOD和Hsp90基因表达及鳃部结构的影响. 水生生物学报, 2013, 37(2): 321-328] | |
| Zhou YX. The acute and subacute toxicity of ammonia to grass carp (Ctenopharyngodon idellus). Acta Hydrobiologica Sinica, 1986, 10(1): 32-38 [周永欣. 氨对草鱼的急性和亚急性毒性. 水生生物学报, 1986, 10(1): 32-38] |



