2. 浙江省海水增养殖重点实验室 舟山 316021
2. Key Laboratory of Marine Culture and Enhancement of Zhejiang Province, Zhoushan 316021
条石鲷 (Oplegnathus fasciatus) 俗称日本鹦鹉鱼,主要分布在我国的黄海、东海、台湾沿海以及日本北海道以南等海域,系温热带近海岩礁鱼类 (朱元鼎等, 1963)。条石鲷体态优美,色泽鲜艳,肉质细致,营养丰富,具有较高的经济价值和观赏价值 (武云飞等, 1999)。我国于2004年首次完成条石鲷规模化人工育苗,目前,条石鲷已成为我国海水网箱养殖和人工增殖放流的优良品种之一 (牛化欣等, 2008)。近年来,国外关于条石鲷营养需求 (Shan et al, 2008; Lim et al, 2009)、免疫 (Kim et al, 2007; Kim et al, 2009; Zoysa et al, 2012) 及病害 (畑井喜司雄等, 2007; Jung et al, 2000) 等方面的研究取得了一些进展;国内也有一些条石鲷人工繁育 (倪梦麟等, 2007)、早期发育 (柳学周等, 2008)、生理 (柳敏海等, 2009; 孙鹏等, 2010) 及组织学 (王健鑫等, 2006; 何滔等, 2013) 等方面的报道,但有关条石鲷病害方面的研究还鲜见报道。
美人鱼发光杆菌杀鱼亚种 (Photobacterium damselae subsp. piscicida) 即原来的杀鱼巴斯德氏菌 (Pasteurella piscicida),最早从美国的野生美洲狼鲈 (Morone americana) 和条纹狼鲈 (Morone saxatilis) 分离得到 (张飞等, 2012),随后由该菌引起的鱼类感染相继在日本和美国发生,造成了鱼类大量死亡。美人鱼发光杆菌杀鱼亚种对宿主无专一性,可感染多种养殖鱼类,通常在18–20℃时发病 (Magarinos et al, 1992)。
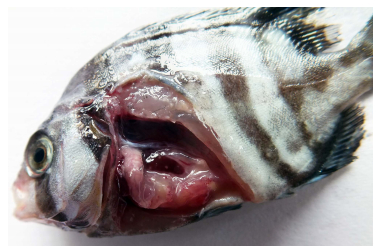
2013年8月,浙江省舟山市某网箱养殖条石鲷暴发了一种严重的疾病,死亡率达到20%以上。患病鱼主要症状为体色加深,离群独游,反应迟钝,食欲减退,体表无明显发病症状;解剖可见脾脏、肾脏表面出现许多1–2 mm左右白色类结节,严重者肝脏、肠道也会出现相同的白点 (图 1)。本研究从患病条石鲷的内脏分离得到优势菌,对细菌进行人工感染确定其致病性,并运用形态学观察、生理生化测定及16S rRNA基因序列分析对病原菌进行鉴定,最后进行了药物敏感实验,本研究结果将为条石鲷健康养殖和疾病防治提供理论依据。
|
图 1 患病条石鲷 Figure 1 Diseased O. fasciatus |
患病条石鲷取自浙江省舟山市某养殖网箱,体长为10–12 cm。人工感染实验所用条石鲷为浙江省海洋水产研究所西轩岛试验场放流的健康条石鲷,体长为8–10 cm,暂养7 d后用于感染实验。
细菌分离所用的TSA培养基购自北京陆桥技术有限责任公司;TCBS培养基购自杭州微生物试剂有限公司;法国API 20E细菌鉴定系统试剂条购自生物梅里埃中国有限公司;细菌生化鉴定管购自杭州微生物试剂有限公司;切胶回收试剂盒和引物由生工生物工程 (上海) 股份有限公司提供;Taq DNA聚合酶、10×PCR缓冲液、dNTP等购自宝生物工程 (大连) 公司。
1.2 病原菌的分离培养无菌条件下解剖病鱼,观察体表和各器官的病变情况。取体表黏液、鳃丝、肝脏、肾脏、脾脏等处组织,制作成水浸片,在显微镜下进行检查,以初步观察和确认可疑致病原。
取有典型症状的濒死条石鲷,用75%的酒精棉球反复擦拭病鱼体表,无菌解剖后,用接种环在脾脏、肾脏及肝脏处取样,平板划线接种于TSA和TCBS培养基,28℃恒温培养48 h,挑取形态一致的优势菌落进行纯化培养,获得纯培养菌株后,–80℃保存备用。
1.3 人工感染实验健康条石鲷暂养7 d后,选择规格均一、活力好的个体用于感染实验。实验在80 L水族箱中进行,每8尾条石鲷为1组,每个细菌浓度设3个平行,并设3个对照组。
将分离到的优势菌经TSA培养基培养48 h,用1.5%灭菌生理盐水洗下细菌,分光光度法结合平板计数法制成浓度为2×109、2×108、2×107、2×106、2×105、2×104 CFU/ml的菌悬液。采用腹腔注射法对条石鲷进行人工感染,每尾鱼注射0.2 ml菌悬液,对照组注射等量的1.5%灭菌生理盐水。连续观察14 d,随时记录发病症状和死亡情况。实验期间水温为26–28℃,盐度为30–32,充气,不投喂,每天换水量为50%。采用Reed-Muench法 (安德森, 1984) 计算半数致死量LD50。
1.4 病原菌的鉴定 1.4.1 形态学观察将纯化菌株接种于TSA培养基,28℃培养24 h,观察菌落形态并挑取纯培养物进行革兰氏染色和负染,观察细菌形态及大小。
1.4.2 生理生化鉴定按照产品说明所述方法以法国API 20E细菌鉴定系统的生化实验及细菌生化鉴定管测定细菌的生理生化指标。
1.4.3 16S rRNA基因序列分析及系统发育树的构建模板DNA的制备:挑取单菌落置于100 μl灭菌蒸馏水中,煮沸10 min,冰浴5 min,12000 g离心5 min,取上清液作为模板DNA。16S rRNA基因扩增采用通用引物27F (5'-AGAGTTTGATC (C/A) TGGCTCAG-3') 和1492R (5'-TACGG (C/T) TAC CTTGTTACGACTT-3')。25 μl PCR反应体系:10×PCR缓冲液2.5 μl、dNTP混合物2 μl、上下游引物各0.5 μl、Taq DNA聚合酶 (5 U/μl) 0.5 μl、模板DNA 5 μl,灭菌双蒸水补足反应体系。PCR扩增程序:95℃ 5 min;95℃ 30 s,52℃ 45 s,72℃ 45 s,进行30个循环;72℃ 7 min。PCR产物由生工生物工程 (上海) 股份有限公司进行测序,测序结果经Blast后用ClustalX软件进行多序列匹配排列,然后用MEGA软件构建系统发育树。
1.5 药物敏感实验用灭菌生理盐水从培养48 h的TSA培养基上洗下待测菌株,通过分光光度法结合平板计数法调整其菌液浓度为109 CFU/ml。取0.1 ml菌悬液涂布于TSA培养基,然后贴上药敏纸片 (购自杭州微生物试剂有限公司),28℃培养24 h后,测量抑菌圈的直径。
2 结果 2.1 病原菌的分离培养水浸片观察结果显示,肝脏、脾脏及肾脏等处有许多活动的杆状细菌。从多条患病条石鲷肝脏、脾脏及肾脏处分离得到同一种优势菌 (记为OF-1)。该菌在TSA培养基上28℃培养24 h后,菌落呈圆形、半透明、中央隆起、边缘规则、表面光滑湿润、乳黄色,直径为0.3–0.5 mm,48 h后直径为1.0–1.6 mm;在TCBS培养基上不生长。
2.2 人工感染实验实验鱼从第2天开始出现死亡 (表 1),第3天各实验组的死亡个体脾脏、肾脏开始出现白点,对照组在实验期间无症状、无死亡。人工感染实验发病鱼与自然发病鱼的症状相同,脾脏、肾脏处可见白色结节,从感染鱼分离得到的致病菌与OF-1的菌落形态、生理生化特征一致,证实菌株OF-1为此次条石鲷内脏白点病的致病菌。经计算,菌株OF-1的半数致死量LD50为5.93×104CFU/g。
|
|
表 1 条石鲷腹腔注射感染实验结果 Table 1 The mortality of O. fasciatus infected by intraperitoneal injection |
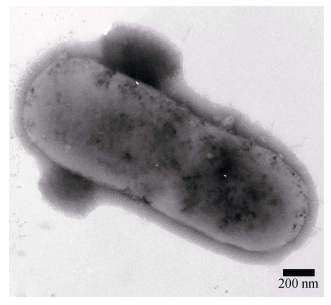
菌株OF-1为革兰氏阴性菌,短杆状,两端着色加深;细菌单个存在,或两个、多个连接成长杆状 (图 2)。生理生化结果显示 (表 2),氧化酶、V-P实验、精氨酸双水解酶、发酵葡萄糖及甘露糖等为阳性;β-半乳糖苷酶、赖氨酸脱羧酶、鸟氨酸脱羧酶、柠檬酸盐利用、H2S产生、脲酶、色氨酸脱氨酶、产生吲哚、明胶酶以及发酵甘露醇、肌醇、山梨醇、鼠李糖、蔗糖、蜜二糖、苦杏仁苷、阿拉伯糖等为阴性,在API 20E细菌鉴定系统编号为2005004,与美人鱼发光杆菌杀鱼亚种生理生化特征一致。
|
图 2 分离菌株的电镜照片 Figure 2 The electronic microphotograph of the isolated strain |
|
|
表 2 菌株OF-1生理生化指标 Table 2 Physiological and biochemical characteristics of the bacterial strain OF-1 |
测序得到的16S rRNA基因序列长度为1454 bp (GenBank登录号为:KF956381),在GenBank数据库中进行Blast比对,与美人鱼发光杆菌同源性最高,均达到99%以上。选取同源性较高的菌株16S rRNA序列,用MEGA 5.0软件构建系统发育树,结果显示,菌株OF-1与美人鱼发光杆菌2个亚种聚为一簇,说明菌株OF-1与美人鱼发光杆菌亲缘关系最近。
2.5 药物敏感实验菌株OF-1对25种抗菌药物的敏感性实验结果见表 3。结果显示,该菌对呋喃妥因、庆大霉素、青霉素、先锋必、氟哌酸、氧氟沙星、氨苄青霉素、先锋Ⅵ、氯霉素、环丙沙星、四环素敏感;对先锋噻肟、利福平、头孢肤肟中度敏感;对红霉素、万古霉素、菌必治、链霉素、卡那霉素、苯唑青霉素等药物具有抗性。
|
|
表 3 菌株OF-1药敏实验结果 Table 3 Sensitivity of strain OF-1 to antibiotics |
美人鱼发光杆菌杀鱼亚种感染不同鱼种所呈现的症状有明显差异,此次条石鲷感染死亡症状主要表现为脾脏、肾脏出现灰白色的结节,最终发生死亡,与其他多数受感染的鱼类,如军曹鱼 (Rachycentron canadum)、黄尾

O'Hara等 (2003)采用6种常用的细菌鉴定系统对美人鱼发光杆菌进行鉴定,结果发现,API 20E对美人鱼发光杆菌的鉴定准确率为100%。但是,Thyssen等 (2000)通过实验发现,只有76%的美人鱼发光杆菌杀鱼亚种在API 20E测定时系统编号为2005004,而且必须结合杀鱼亚种对温度和盐度的严格需求进行鉴定。本研究中,菌株OF-1的API 20E系统编号为2005004,在6%NaCl胨水以及在4℃、37℃不生长,与美人鱼发光杆菌杀鱼亚种生理生化特征一致。目前,16S rRNA是细菌鉴定和系统发育地位研究最常用的工具,普遍认为16S rRNA同源性大于97.5%的细菌可视为同种 (赛文婴等, 2000)。利用16S rRNA通用引物扩增了菌株OF-1的16S rRNA基因片段,测序并构建系统发育树,显示菌株OF-1与美人鱼发光杆菌聚为一簇,亲缘关系最近,综合细菌形态学特征、生理生化及分子鉴定结果,将菌株OF-1鉴定为美人鱼发光杆菌杀鱼亚种。
在对抗菌药物敏感性研究方面,Thyssen等 (2001)对采自不同地区的145株美人鱼发光杆菌杀鱼亚种进行了抗菌药物敏感性研究,结果显示,93%的菌株对红霉素具有抗性;几乎所有的欧洲菌株对卡那霉素敏感,而来自日本的菌株49%对卡那霉素具有抗性。本研究中,菌株OF-1对红霉素、卡那霉素均有抗性。王瑞旋等 (2010)报道,美人鱼发光杆菌杀鱼亚种对受试的20种抗菌药物有抗性,仅对诺氟沙星、环丙沙星、复方新诺明、红霉素、庆大霉素、氯霉素、四环素、新霉素、链霉素等药物中度敏感;在28种受试中草药中对番石榴和苍术高度敏感。而本研究中,菌株OF-1对环丙沙星、氯霉素、四环素、庆大霉素高度敏感,对复方新诺明、红霉素、链霉素具有抗性。由于氯霉素、红霉素、环丙沙星等为水产禁药,故本结果仅为其他同类药物使用提供参考。
| Anderson DP. Immunology of Fish. Beijing: China Agriculture press, 1984. [安德森DP. 鱼类免疫学. 北京: 中国农业出版社, 1984.] | |
| He T, Xiao ZH, Liu QH, et al. Ontogeny of the gill and Na+, K+-ATPase activity of rock bream (Oplegnathus fasciatus). Journal of Fisheries of China, 2013, 37(4): 520-525 [何滔, 肖志忠, 刘清华, 等. 条石鲷鳃的组织发育及鳃上钠钾三磷酸腺苷酶活性的早期变化. 水产学报, 2013, 37(4): 520-525] | |
| Jung SJ, Oh MJ. Iridovirus-like infection associated with high mortalities of striped beakperch, Oplegnathus fasciatus (Temminck et Schlegel), in southern coastal areas of the Korean peninsula. Journal of Fish Diseases, 2000, 23(3): 223-226 DOI:10.1046/j.1365-2761.2000.00212.x | |
| Kim MS, Hwang YJ, Yoon KJ, et al. Molecular cloning of rock bream (Oplegnathus fasciatus) tumor necrosis factor-α and its effect on the respiratory burst activity of phagocytes. Fish and Shellfish Immunology, 2009, 27(5): 618-624 DOI:10.1016/j.fsi.2009.07.007 | |
| Kim YI, Ha YM, Ahn SJ, et al. Production and characterization of polyclonal antibody against recombinant ORF 049L of rock bream (Oplegnathus fasciatus) iridovirus. Process Biochemistry, 2007, 42(2): 134-140 DOI:10.1016/j.procbio.2006.07.028 | |
| Kishio Hatai, Kazuo Ogawa. New atlas of fish diseases. Beijing: China Agricultural University press, 2007. [畑井喜司雄, 小川和夫. 新鱼病图谱. 北京: 中国农业大学出版社, 2007.] | |
| Liu MH, Peng ZL, Fu RB, et al. Annual variation of the female Oplegnathus fasciatus in gonadosomatic index, sex hormone and biochemical composition. Journal of Shanghai Ocean University, 2009, 18(5): 636-639 [柳敏海, 彭志兰, 傅荣兵, 等. 雌性条石鲷性体指标、性激素及生化组成的周年变化分析. 上海海洋大学报, 2009, 18(5): 636-639] | |
| Lim SJ, Lee KJ. Partial replacement of fish meal by cottonseed meal and soybean meal with iron and phytase supplementation for parrot fish Oplegnathus fasciatus. Aquaculture, 2009, 290(3-4): 283-289 DOI:10.1016/j.aquaculture.2009.02.018 | |
| Liu XZ, Xu YJ, Wang YY, et al. Characters of development and growth of early life stages of the rock bream Oplegnathus fasciatus. Acta Zoologica Sinica, 2008, 54(2): 332-341 [柳学周, 徐永江, 王妍妍, 等. 条石鲷的早期生长发育特征. 动物学报, 2008, 54(2): 332-341] | |
| Magarinos B, Romalde JL, Bandin I, et al. Phenotypic, antigenic, and molecular characterization of Pasteurella piscicida strains isolated from fish. Applied and Environmental Microbiology, 1992, 58(10): 3316-3322 | |
| Ni ML, Fan WM, Mao ZZ, et al. Research on whole artificial breeding technique of Oplegnathus fasciatus from the inshore water of Zhoushan. Journal of Zhejiang Ocean University (Natural Science), 2007, 26(2): 143-146 [倪梦麟, 范卫明, 毛志增, 等. 舟山沿海条石鲷人工育苗技术研究. 浙江海洋学院学报 (自然科学版), 2007, 26(2): 143-146] | |
| Niu HX, Chang J, Ma S. Research progress on biology and breeding ecology of Oplegnathus fasciatus. Fisheries Science and Technology Information, 2008, 35(1): 50-52 [牛化欣, 常杰, 马甡. 条石鲷的生物学及养殖生态学研究进展. 水产科技情报, 2008, 35(1): 50-52] | |
| O'Hara CM, Sowers EG, Bopp CA, et al. Accuracy of six commercially availablethe systems for identification of members of family Vibrionaceae. Journal of Clinical Microbiology, 2003, 41(12): 5654-5659 DOI:10.1128/JCM.41.12.5654-5659.2003 | |
|
Ren Y, Shi CB, Chang OQ, et al. Identification of Photobacterium damselae subsp.
piscicida from diseased yellowtail (Seriola quinqueradiata) and the sensitivity to antimicrobial agents. Guangdong Agricultural Sciences, 2012, 39(22): 148-152 DOI:10.3969/j.issn.1004-874X.2012.22.049 [任燕, 石存斌, 常藕琴, 等. 五条 |
|
| Sai WY, Dong XZ. Application of directed evolution of orthologous gene in the bacteria phylogenetic. Microbiology China, 2000, 27(5): 377-381 [塞文婴, 东秀珠. 定向进化同源基因在细菌系统发育研究中的应用. 微生物学通报, 2000, 27(5): 377-381] | |
| Shan XJ, Quan HF, Dou SZ. Effects of delayed first feeding on growth and survival of rock bream Oplegnathus fasciatus larvae. Aquaculture, 2008, 277(1-2): 14-23 DOI:10.1016/j.aquaculture.2008.01.044 | |
| Sun P, Peng SM, Yin F, et al. Effect of salinity on activity of Na+/K+-ATPase in juvenile of Oplegnathus fasciatus. Journal of Fisheries of China, 2010, 34(8): 1024-1029 [孙鹏, 彭士明, 尹飞, 等. 盐度对条石鲷幼鱼Na+/K+-ATP酶活力的影响. 水产学报, 2010, 34(8): 1024-1029] | |
| Thyssen A, Grisez L, van Houdt R, et al. Phenotypic characterization of the marine pathogen Photobacterium damselae subsp. piscicida. Microbial Pathogenesis, 2000, 28(2): 119-126 DOI:10.1006/mpat.1999.0330 | |
| Thyssen A, Ollevier F. In vitro antimicrobial susceptibility of Photobacterium damselae subsp. Piscicida to 15 different antimicrobial agents. Aquaculture, 2001, 200(3-4): 259-269 | |
| Wang JX, Shi G, Li P, et al. Morphology and histology of digestive in Oplegnathus fasciatus. Journal of Fisheries of China, 2006, 30(5): 618-626 [王健鑫, 石戈, 李鹏, 等. 条石鲷消化道的形态学和组织学. 水产学报, 2006, 30(5): 618-626] | |
| Wang RX, Feng J, Su YL, et al. Isolation of Photobacterium damselae subsp. piscicida from diseased golden pompano (Trachinotus ovatus Linnaeus) and its drug sensitivity. Journal of Fishery Sciences of China, 2010, 17(5): 1020-1027 [王瑞旋, 冯娟, 苏友禄, 等. 卵形鲳鲹美人鱼发光杆菌杀鱼亚种的分离鉴定. 中国水产科学, 2010, 17(5): 1020-1027] | |
| Wang Y, Han Y, Li Y, et al. Isolation of Photobacterium damselae subsp. piscicida from diseased tongue sole (Cynoglossus semilaevis Günther) in China. Acta Microbiologica Sinica, 2007, 47(5): 763-768 | |
| Wu YF, Men Q, Kang B. A supplementary study on the morphology and ecology of two species rare fish from Qingdao. Journal of Ocean University of Qingdao, 1999, 29(4): 581-585 [武云飞, 门强, 康斌. 两种珍稀鱼类的形态学和生态学的补充研究. 青岛海洋大学学报, 1999, 29(4): 581-585] | |
| Zhang F, Su YQ, Wang J, et al. Studies on the isolation, identification and virulence of Photobacterium damselae isolated from Pseudosciaena Crocea. Oceanologia et Limnologia Sinica, 2012, 43(6): 1202-1208 DOI:10.11693/hyhz201206025025 [张飞, 苏永全, 王军, 等. 大黄鱼 (Pseudosciaena crocea) 源美人鱼发光杆菌 (Photobacterium damselae) 的分离鉴定及致病性研究. 海洋与湖沼, 2012, 43(6): 1202-1208] | |
| Zhu YD, Zhang CL, Cheng QT, et al. Fishes of East China Sea. Beijing: Science press, 1963. [朱元鼎, 张春霖, 成庆泰, 等. 东海鱼类志. 北京: 科学出版社, 1963.] | |
| Zorrilla I, Balebona MC, Moriigo MA. Isolation and characterization of the causative agent of pasteurellosis, Photobacterium damsela subsp. piscicida, from sole, Solea senegalensis (Kaup). Journal of Fish Diseases, 1999, 22(3): 167-172 | |
| Zoysa MD, Ryu JH, Chung HC, et al. Molecular characterization, immune responses and DNA protection activity of rock bream (Oplegnathus fasciatus), peroxiredoxin 6 (Prx6). Fish and Shellfish Immunology, 2012, 33(1): 28-35 DOI:10.1016/j.fsi.2012.03.029 |



