2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
中国明对虾 (Fenneropenaeus chinensis) 又称东方对虾,旧称中国对虾 (Penaeus chinensis),主要分布在黄、渤海海域,是我国重要的土著海水养殖动物之一,其养殖产业近十几年来一直受病原困扰。在诸多病原中,白斑综合征病毒 (White spot syndrome virus,WSSV) 引起的白斑综合征发病快、破坏性强且防治困难。对虾感染WSSV后,一般3–10 d内累积死亡率可达到100% (Chou et al, 1995; Hossain et al, 2015),成为危害对虾养殖业最大的病原之一,对我国乃至全球范围内的对虾产业造成了重大经济损失,严重阻碍了对虾产业的持续健康发展 (衣启麟等, 2014)。经过育种学家不懈的努力,我国已有“黄海1号”(2003年)、“黄海2号”(2008年)、“黄海3号”(2013年)3个中国明对虾养殖新品种,一定程度上恢复了中国明对虾养殖业 (李健等, 2005、2015; 孔杰等, 2012)。
对虾等甲壳类作为重要的水产养殖经济对象,较脊椎动物缺少完善的免疫系统,更容易受到暴发性疾病的影响而大面积患病或死亡 (刘昂等, 2013; 曾祥兴等, 2009)。疾病的发生与对虾本身的免疫水平、感染方式和环境因素紧密相关 (吴信忠, 2005; 孙成波等, 2006),国内外学者用多种实验技术对WSSV展开研究,涉及对虾免疫学、WSSV感染机理及环境因素对疾病产生的影响等 (李一宁等, 2010)。
普遍认为,对虾等无脊椎动物缺少抗体这一类关键性的免疫分子,因此相关研究主要以天然的免疫反应为主。然而,随着研究的深入,发现对虾血清同样存在与脊椎动物免疫球蛋白 (Ig, Immunoglobulin) 功能非常类似、能识别“异己”成分的特异性免疫分子 (章跃陵等, 2001; 王雷等, 1995; 王伟庆等, 1998)。研究发现,对虾等能够产生特异性的免疫保护,Venegas等 (2000)对感染WSSV后存活的日本囊对虾 (Marsupenaesu japonicus) 进行二次感染,与对照相比,其死亡率降低了49%;李战军等 (2012)用γ射线照射含有WSSV的患病对虾肌肉,连续饲喂20 d后进行二次感染,存活率提高45%以上。朱斐 (2009)1)利用双乙烯亚胺 (BEI) 灭活WSSV病毒悬液,注射诱导7 d后二次感染,相对保护率达到60%。有学者将这种再次受到相同病原感染后,免疫保护作用显著增强、死亡率降低的现象,称之为特异性的免疫致敏 (Immune priming)(Tom et al, 2004; Schmid-Hempel et al, 2005),也有学者称之为类免疫反应 (Quasi-immune response)(Venegas et al, 2000)。
1) Zhu F. Protection of Procambarus clarkii against white spot syndrome virus with inactivated WSSV and polysaccharide. Doctoral Dissertation of Zhejiang University, 2009, 20–34 [朱斐.对虾白斑综合征病毒 (WSSV) 灭活制剂及多糖对克氏原螯虾抗WSSV作用的研究.浙江大学博士研究生学位论文, 2009, 20–34]
疾病的发生不仅与对虾的抗病力相关,还与环境因子密切相关,内外因共同作用,才会促使疾病暴发 (刘波等, 2003)。Hewitt等 (2001)研究发现,温度作为对虾生存环境的重要因子,影响对虾代谢、摄食、生长、存活和免疫力的强弱,且与疾病的感染密切联系。Vidal等 (2001)和Rahman等 (2007)研究发现,高温可延长感染WSSV后对虾的存活时间;宋晓玲等 (1996)发现,17–19℃是中国明对虾白斑综合征发生的最低温度,17℃是WSSV在其体内增殖的最低温度。
目前,针对对虾免疫致敏现象的研究还处在初步阶段,本研究通过热灭活 (60℃处理1 h) WSSV诱导对虾免疫致敏反应,并设置不同的实验温度,用实时荧光定量PCR方法 (qRT-PCR) 进行病毒载量的检测,探究热灭活WSSV诱导免疫致敏反应的有效性及温度与WSSV增殖之间的关系,以期为白斑综合征的预防提供理论支持。
1 材料与方法 1.1 实验材料实验所用健康中国明对虾取自中国水产科学研究院黄海水产研究所遗传育种中心,平均体重为 (0.21±0.08) g,平均体长为 (24.71±3.90) mm。实验用水为经砂滤的自然海水,盐度为29±1。实验前随机取3尾对虾提取DNA后进行WSSV荧光定量PCR检测,检测结果为阴性。
1.2 口饲感染毒饵的制备取感染WSSV且症状明显的中国明对虾腹节肌肉,剁碎成泥状后装入研钵中继续充分研磨,加入适量食用红色素并混合均匀,–80℃冰箱冷藏。
1.3 热灭活WSSV饵料的制备材料选择及破碎的方法同1.2所述,参考Balasubramanian等 (2006)的灭活方法,将粉碎后的对虾肌肉于60℃恒温培养箱中灭活处理1 h,充分研磨后加入适量可食用红色素并充分混合均匀,–80℃冰箱保存。
1.4 实验分组及管理根据实验温度 (低温15℃、常温23℃、高温28℃、高温32℃) 及投喂的饵料 (未经灭活的WSSV毒饵、热灭活饵料、商业配合饵料) 的不同,将实验用中国明对虾随机分成6组,分别为阳性对照组C23℃(投喂未经灭活的WSSV毒饵+商业配合饲料)、商业饵料对照组CF23℃(只投喂商业配合饲料)、实验组E15℃、E23℃、E28℃、E32℃(投喂热灭活饵料+商业配合饲料),每组设置3个重复 (30尾/重复),放入26.5 cm×20 cm×16.5 cm的整理箱。每个整理箱内安放一个气石,然后将每组3个小整理箱放入72 cm×52 cm×44 cm大整理箱中,E15℃组放入泡沫箱中。实验期间自然水温为 (23.0±1.8)℃,C23℃、CF23℃和E23℃组维持自然水温,E28℃和E32℃组放置加热棒控制温度,E15℃组通过调整常温海水与冰块配比来控制温度。分组后自然温度暂养3 d,随后开始升温或降温操作,E28℃和E32℃组在自然水温基础上每天升高1℃,E15℃组在自然水温的基础上每天降低1℃,升 (降) 至设定温度后保持此温度到实验结束。每天吸底换水1次,每3 h观察1次,捞出死虾并记录死亡时间。
1.5 热灭活饵料的饲喂及二次感染对照组CF23℃每天投喂4次配合饲料;C23℃组每天投喂1次未经灭活的WSSV毒饵 (约5 mg/尾),其余时间投喂商业配合饲料。实验组在实验第1–6天每天投喂3次配合饲料及1次热灭活的WSSV饵料 (约5 mg/尾),日投喂总量约为体重的5%。在实验第12天对存活个体进行二次WSSV人工感染,投喂含WSSV饵料时采用单尾定量口饲方法 (授权专利号:ZL201210 107377.8),5 mg毒饵含有WSSV约为8.24×108copies。
1.6 样品采集及处理在实验开始第2、4、6、10、12天及二次感染 (12 d) 后第6、12、24、48、72、120 h,共11个时间点取样,每重复、每取样点分别取1尾存活对虾 (即每组取3尾),置于–80℃保存;实验共进行19 d,然后收集所有存活个体置于–80℃冰箱冻存,取肌肉组织用于提取基因组DNA。
1.7 DNA提取及实时荧光定量PCRDNA提取参照王伟继 (2008)1)的方法。DNA经0.8%的琼脂糖凝胶电泳,利用EC3 Imaging system检测DNA完整性,使用超微量紫外分光光度计 (Biodropsis Bo-2000) 测定DNA质量及浓度,稀释至40 ng/μl备用。WSSV含量采用TaqMan qRT-PCR方法测定 (Durand et al, 2002),目标片段长度为69 bp,引物及探针由生工生物工程 (上海) 股份有限公司合成。qRT-PCR反应体系 (20 μl):1×Premix Ex TaqTM (Probe qPCR)、正反向引物各0.25 μmol/L、ROX Reference DyeⅡ0.25 μmol/L、探针0.125 μmol/L、病毒DNA模板2 μl,灭菌双蒸水补足体积。PCR反应程序:95℃预变性10 s;95℃变性5 s,60℃退火及延伸34 s,共40个循环。以本实验室自行制备含有目的片段的重组质粒PUCm-T/WSSV69为标准品,将WSSV标准品进行10倍系列梯度稀释,共7个梯度,分别为 (1.02×102–1.02×108) copies/μl,无菌双蒸水作为阴性对照,每个稀释度设3个平行,用作阳性对照及标准曲线的构建。每个DNA样品平行检测3次,取其平均值作为该样品WSSV载量。
1) Wang WJ. Genetic mapping of the Chinese shrimp Fenneropenaeus chinensis using AFLP markers and commercial traits QTL mapping. Doctoral Dissertation of Ocean University of China, 2008, 66–73 [王伟继.中国对虾 (Fenneropenaeus chinensis) AFLP分子标记遗传连锁图谱的构建以及相关性状的QTL定位.中国海洋大学博士研究生学位论文, 2008, 66–73]
1.8 数据处理及分析存活时间 (h) 从二次感染后 (13 d)0 h开始计算:
存活率=存活对虾数/初始对虾数×100%;
死亡率=对虾死亡数/初始对虾数×100%;
数据处理分析使用SPSS 19.0、Origin 9.0等软件进行差异显著性分析和多重比较,分别在差异显著水平P < 0.01和P < 0.05进行分析。。
2 结果 2.1 二次感染前死亡率及病毒载量变化实验第1–12天各实验组 (E15℃、E23℃、E28℃) 以及CF23℃组未出现死亡个体,阳性对照C23℃在投喂未经灭活的WSSV饵料后35 h开始出现死亡个体,至126 h累积死亡率达到100%。表明60℃处理1 h可以将WSSV完全灭活。
实验开始后,阳性对照组C23℃在实验第2天病毒载量达到1.55×106 copies/ng DNA,而CF23℃、E23℃、E15℃、E32℃组对虾体内病毒含量一直处于较低水平[(2.54±0.99)–(465.73±88.90) copies/ng DNA],与C23℃组病毒载量差异极显著 (P < 0.01) (表 1)。E32℃组在166 h出现1尾死亡个体,截至到二次感染前 (12 d),E32℃组共出现6尾死亡个体,对6尾死亡个体进行病毒含量检测,结果显示,其平均病毒载量为 (29.60±8.65) copies/ng DNA,表明E32℃组在二次感染前出现的死亡个体不是由WSSV导致。
|
|
表 1 1–12 d内 (二次感染前) 各组别中国明对虾病毒载量变化 (copies/ng DNA) Table 1 The change of F. chinensis viral load between 1–12d (before subsequent rechallenge) (copies/ng DNA) |
E23℃组连续6 d饲喂热灭活WSSV饵料诱导免疫致敏,CF23℃组在整个实验过程中只投喂商业配合饲料,作为对照组,在实验第13天对所有存活对虾进行二次感染。截止到实验第19天,E23℃和CF23℃组死亡个体的平均存活时间分别为 (106.19±26.83) h和 (92.05±25.38) h,2组进行独立样本T检验,结果显示,2组平均存活时间差异显著 (P < 0.05)。E15℃、E28℃、E32℃与E23℃组同样连续6 d饲喂经热灭活WSSV饵料,平均存活时间分别为 (136.00±9.80) h、(89.24± 27.19) h、(84.53±26.70) h和 (106.19±26.83) h,结果表明,随着实验温度升高,各温度组对虾感染WSSV后平均存活时间下降 (图 1)。经过单因素方差分析,E23℃、E28℃、E32℃与E15℃组对虾的平均存活时间差异极显著 (P < 0.01),E28℃、E32℃与E23℃组对虾的平均存活时间差异显著 (P < 0.05),而E28℃和E32℃组平均存活时间差异不显著 (P > 0.05)。
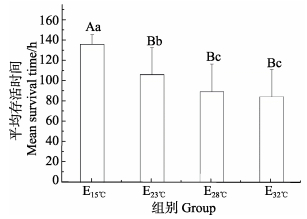
|
图 1 中国明对虾二次感染WSSV后不同温度组平均存活时间 Figure 1 The mean survival time of F. chinensis under different temperature after subsequent rechallenge 不同的大写字母表示极显著差异 (P < 0.01),不同小写字母表示显著差异 (P < 0.05) Different capital letters on the graph showed highly significant difference (P < 0.01), different small letters on the graph showed significant difference (P < 0.05) |
二次感染从第13天持续到第19天,CF23℃和E23℃组存活率分别为 (8.89±3.85)%和 (33.29±2.02)%(表 2)。经独立T检验,2组存活率存在显著差异 (P < 0.05)。热灭活WSSV诱导的各实验组存活率随着实验水温的提高而逐渐降低,其中,E28℃组的存活率最低,为 (8.47±9.50)%;E15℃组的存活率最高,达到 (80.41± 5.84)%;E15℃、E23℃组与其他各组之间的存活率具有显著差异 (P < 0.05),而E28℃和E32℃组无显著性差异 (P > 0.05)(表 2)。
|
|
表 2 中国明对虾二次感染WSSV后的存活率 Table 2 The survival rate of F. chinensis after subsequent rechallenge |
各实验组在二次感染后48 h前后出现死亡个体,CF23℃、E28℃和E32℃组在感染后4 d累积死亡率分别为57.78%、54.35%和61.11%,此时,E15℃组和E23℃组的累积死亡率仅为5.36%和25.00%(图 2)。到实验结束,CF23℃、E28℃和E32℃组累积死亡率达到91.11%、91.30%和83.33%,E15℃和E23℃组累积死亡率为19.64%和66.67%。经热灭活WSSV诱导的E23℃组比未经诱导的CF23℃组累积死亡率低24.44%。
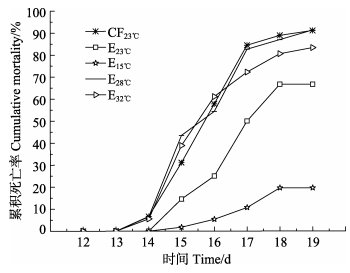
|
图 2 不同条件下中国明对虾的累积死亡率 Figure 2 The cumulative mortality of F. chinensis under different conditions |
二次感染后12 h,各实验组对虾体内病毒载量开始快速增加,其中,E28℃组增加速度最快,E23℃和CF23℃组次之,E15℃组增加速度最慢,而E32℃组呈现先增加后降低的趋势 (图 3)。二次感染后24 h,E28℃组病毒载量达到2.37×106 copies/ng DNA,E32℃组病毒载量为8.97×105 copies/ng DNA,E23℃和CF23℃组病毒载量分别为1.60×104和4.54×104 copies/ng DNA,但E15℃组病毒载量仅有52 copies/ng DNA (表 3)。
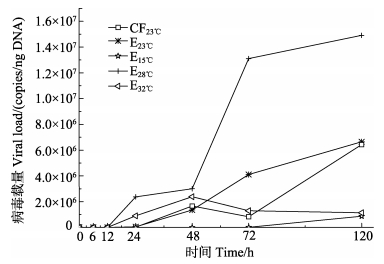
|
图 3 二次感染后不同组别的病毒载量变化 Figure 3 The change of viral load after subsequent rechallenge in different groups |
|
|
表 3 不同组别中国明对虾二次感染WSSV后的病毒载量变化 (copies/ng DNA) Table 3 The change of viral load of F. chinensis in different groups after subsequent rechallenge (copies/ng DNA) |
对各实验组和对照组的存活个体进行病毒载量检测,对照组CF23℃的平均病毒载量为1.59×107 copies/ng DNA,而相同温度条件下的实验组E23℃的平均病毒载量为6.54×106 copies/ng DNA,二者差异显著 (P < 0.05)。
3 讨论 3.1 免疫致敏对中国明对虾的保护在以往的认识中,无脊椎动物区别于脊椎动物的典型特征之一就是无特异性免疫,不能产生免疫记忆。但越来越多的研究发现,无脊椎动物的免疫系统没有普遍认为的那么简单,无脊椎动物在受到病原体的感染后也会启动复杂的免疫防御机制。在果蝇 (Drosophila melanogaster)(曹慧等, 2009)、长牡蛎 (Crassostrea gigas)(张涛, 2014)1)以及日本囊对虾 (Venegas et al, 2000) 等无脊椎动物中都曾发现,经过特定病原免疫刺激后,再次用同样病原二次感染,其感染率和致死率均呈下降趋势。这一发现对无脊椎动物的疾病防控指引了新的方向,也对饱受病害困扰的对虾等无脊椎动物的健康养殖带来了曙光。
1) Zhang T. A preliminary study on the mechanism of immune sensitization of Crassostrea gigas. Master's Thesis of Graduate University of Chinese Academy of Sciences, Institute of Oceanology, 2014, 17–33 [张涛.长牡蛎免疫致敏机制的初步研究.中国科学院研究生院 (海洋研究所) 硕士研究生学位论文, 2014, 17–33]
白斑综合征是一种严重危害对虾健康养殖的病毒性疾病,许多学者以WSSV为病原体感染对虾,围绕着白斑综合征的囊膜蛋白与对虾自身的免疫防御机制展开了大量细致的研究。Witteveldt等 (2004)用原核表达系统表达出WSSV主要囊膜蛋白VP28,将该蛋白作为抗原免疫对虾,取得了一定的效果。Jha等 (2006)用酵母细胞表达出了VP28和VP19蛋白,发现将这2种蛋白组合免疫对虾,免疫效果比单个免疫更为有效。但这些研究仅融合了一种或几种囊膜蛋白,导致病毒的免疫原性降低。有学者对完整WSSV进行灭活,朱斐 (2009)1)利用双乙烯亚胺 (BEI) 灭活WSSV悬液后注射克氏原螯虾 (Procambarus clarkia),免疫保护率高达60%。但上述研究诱导对虾产生免疫反应均是通过注射诱导的方式,而注射方式不适用于本研究中较小的对虾个体[平均体重为 (0.21±0.08) g,平均体长为 (24.71±3.90) mm]。
1) Zhu F. Protection of Procambarus clarkii against white spot syndrome virus with inactivated WSSV and polysaccharide. Doctoral Dissertation of Zhejiang University, 2009, 20–34 [朱斐.对虾白斑综合征病毒 (WSSV) 灭活制剂及多糖对克氏原螯虾抗WSSV作用的研究.浙江大学博士研究生学位论文, 2009, 20–34]
Balasubramanian等 (2006)用60℃灭活WSSV悬液,注射感染印度对虾 (Penaeus indicus),感染后20 d死亡率为0。本研究在1–6 d连续投喂60℃灭活的WSSV毒饵,未出现因感染WSSV而死亡的个体,证明了灭活的有效性。通过热灭活方式处理患病对虾的肌肉,人工饲喂热灭活WSSV诱导中国明对虾产生免疫致敏现象,连续6 d投喂热灭活WSSV饵料的实验组与只投喂配合饵料的对照组相比,平均存活时间和存活率有了显著性提高 (表 2),其死亡趋势也要比对照组CF23℃更为缓慢 (图 2)。对实验结束后存活个体的病毒载量检测发现,饲喂商业配合饲料的CF23℃组病毒载量要高于投喂灭活饵料的E23℃组 (表 3),这可能是由于灭活WSSV进入对虾体内后,使对虾血清中产生中和WSSV的物质,抑制了WSSV的复制,从而在一定程度上保护了感染WSSV的对虾 (Venegas et al, 2000)。Wu等 (2005)则认为,免疫致敏的作用机制是前期免疫诱导阶段进入对虾体内WSSV囊膜蛋白抢占了WSSV与靶细胞的结合位点,但不能否认还会有大量的WSSV可以进入宿主细胞。热灭活诱导免疫致敏的方法简单经济,适合大规模应用,尤其适合筛选在免疫致敏反应上有差异的群体或家系,对进一步加速中国明对虾抗性遗传选育、实施WSSV的有效防治具有重要实际应用价值,同时,为进一步揭示免疫致敏现象的分子机制提供可能性。但热灭活的局限性在于其导致蛋白构象发生部分改变,在一定程度上降低了免疫原性。实验也存在着诱导后二次感染存活率不高的问题,这可能与中国明对虾的WSSV易感性相关 (江世贵等, 2000; 盖春蕾等, 2013)。
3.2 不同温度对WSSV增殖的影响温度不仅直接影响对虾的新陈代谢、抗病能力、饲料转化率和生存发育,还对病毒及细菌在对虾体内的增殖有重要影响 (向赟等, 2014)。许多水产动物疾病的发生与季节有密切关系,对虾白斑综合征的发生也有明显的季节性,吴定虎等 (1995)2)研究发现,对虾流行病的高峰期是在4–5月和9–10月,水温较低和水温较高时疾病不容易暴发,许多病原体都需要较合适的增殖温度范围。本研究设置15℃、23℃、28℃和32℃共4个温度梯度,研究结果显示,中国明对虾经过热灭活WSSV诱导后,28℃条件下WSSV致病力最强,这表现28℃组在实验结束时累积死亡率最高 (图 2)。实验还通过qRT-PCR方法跟踪了各个温度条件下病毒的增殖情况,发现28℃条件下病毒复制速度最快 (表 2和图 3),这与李侃等 (2013)和张俊儒等 (2008)在未经诱导直接感染WSSV病毒所得出的结论一致。本研究中,E15℃组存活率最高 (80.41%)(表 2),病毒载量变化 (图 3) 也揭示了此温度下病毒增殖速度要比23℃、28℃和32℃组要缓慢。这与张俊儒等 (2008)和Jiravanichpaisal等 (2004)的研究结论一致:当水温低于16℃时,低温抑制了病毒的增殖从而使对虾体内的病毒载量处在一个比较低的水平,从而使WSSV的致病力降低。
2) Wu DH, Chen XF. Epidemiological study on virus disease of cultured shrimp. Proceedings of the second national symposium on disease control and environmental management of cultured shrimp. Qingdao: Qingdao Ocean University Press, 1995, 84–87 [吴定虎, 陈细法.养殖对虾病毒病的流行病学研究.第二届全国人工养殖对虾疾病防治和环境管理学术研讨会论文集.青岛:青岛海洋大学出版社, 1995, 84–87]
温度对WSSV影响研究更多集中在高温 (30℃以上) 对WSSV的抑制上,You等 (2010)设置27℃和31℃两个梯度对日本囊对虾幼虾和成虾分别感染,发现31℃条件下对虾死亡率大大降低。李侃等 (2013)通过激光共聚焦显微镜发现,WSSV进入宿主细胞的能力与温度密切相关,33℃条件下进入细胞的病毒数明显比27℃少。Wongmaneeprateep等 (2010)在研究水温对凡纳滨对虾 (Litopenaeus vannamei) 感染WSSV的影响时发现,对虾持续在 (32±1)℃下养殖或在此温度下养殖7 d后水温降至 (28±1)℃,感染了WSSV的对虾没有出现疾病症状和死亡,大大提高了对虾的存活率。本研究中,32℃组病毒载量的变化呈现先上升后下降的趋势 (图 3),说明高温抑制了WSSV的增殖。但本实验32℃组在二次感染之前出现部分死亡个体,二次感染后最终累积死亡率也高达83.33%(图 2),说明高温对中国明对虾并没有提供有效的保护。Rahman等 (2007)的研究证明,当以较高剂量感染对虾或者当对虾出现典型的白斑综合征症状后再将温度升到33℃左右时,不仅不能对已感染的对虾提供保护,反而加速了WSSV病毒的增殖过程,加速了对虾死亡进程。这可能是因为以较大剂量感染时,WSSV在较短的时间内就会侵入全身各组织,给对虾机体造成不可逆转的损伤;也可能是因为较高的水温造成了水体溶解氧含量减少、水质变坏、细菌滋生等,从而损伤对虾的身体机能 (Limsuwan et al, 2012),这说明高温对对虾的保护是条件性的、不确定性的。
综上所述,饲喂热灭活WSSV饵料可以诱导中国明对虾产生免疫致敏现象,但免疫保护强度较弱,仅在一定程度上增加了中国明对虾感染WSSV后存活的时间,需要对病毒的灭活方式以及如何高效诱导免疫致敏现象进一步探究。在实际生产中,温度作为一个重要的环境因子,应该引起足够的重视,适时地根据水体温度的变化采取有效措施,防止疾病的发生。
| Balasubramanian G, Sudhakaran R, Syed Musthaq S, et al. Studies on the inactivation of white spot syndrome virus of shrimp by physical and chemical treatments, and seaweed extracts tested in marine and freshwater animal models. Journal of Fish Diseases, 2006, 29(9): 569-572 DOI:10.1111/jfd.2006.29.issue-9 | |
| Cao H, Li ZY, Wang QX. The progress of research on Drosophila innate immunity. Chinese Bulletin of Entomology, 2009, 46(2): 196-202 DOI:10.7679/j.issn.2095-1353.2009.035 [曹慧, 李宗芸, 王秋香. 果蝇先天性免疫研究进展. 昆虫知识, 2009, 46(2): 196-202] | |
| Chou HY, Huang CY, Wang CH, et al. Pathogenicity of a baculovirus infection causing white spot syndrome in cultured penaeid shrimp in Taiwan. Diseases of Aquatic Organisms, 1995, 23(3): 165-173 | |
| Durand SV, Lightner DV. Quantitative real time PCR for the measurement of white spot syndrome virus in shrimp. Journal of Fish Diseases, 2002, 25(7): 381-389 DOI:10.1046/j.1365-2761.2002.00367.x | |
| Gai CL, Xu L, Ye HB, et al. Comparison of sensitivities of Fenneropenaeus chinensis and Marsupenaeus Japonicus to white spot syndrome virus (WSSV). Fisheries Science and Technology Information, 2013, 40(4): 207-209 [盖春蕾, 许拉, 叶海斌, 等. 中国对虾和日本对虾对白斑综合征病毒 (WSSV) 敏感性的比较. 水产科技情报, 2013, 40(4): 207-209] | |
| Hewitt DR, Duncan PF. Effect of high water temperature on the survival, moulting and food consumption of Penaeus (Marsupenaeus) japonicus (Bate, 1888). Aquaculture Research, 2001, 32(4): 305-313 DOI:10.1046/j.1365-2109.2001.00560.x | |
| Hossain A, Nandi SP, Siddique MA, et al. Prevalence and distribution of White Spot Syndrome Virus in cultured shrimp. Letters in Applied Microbiology, 2015, 60(2): 128-134 DOI:10.1111/lam.2015.60.issue-2 | |
| Jha RK, Xu ZR, Shen J, et al. The efficacy of recombinant vaccines against white spot syndrome virus in Procambarus clarkii. Immunology Letters, 2006, 105(1): 68-76 DOI:10.1016/j.imlet.2006.01.004 | |
| Jiang SG, He JG, Ma ZM, et al. The infectivity of white spot syndrome virus (WSSV) to larvae and postlarvae of Penaeus monodon. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2000, 39(S1): 172-176 [江世贵, 何建国, 马之明, 等. 白斑综合症病毒对斑节对虾幼体和仔虾的致病性. 中山大学学报 (自然科学版), 2000, 39(S1): 172-176] | |
| Jiravanichpaisal P, Söderhäll K, Söderhäll I. Effect of water temperature on the immune response and infectivity pattern of white spot syndrome virus (WSSV) in freshwater crayfish. Fish and Shellfish Immunology, 2004, 17(3): 265-275 DOI:10.1016/j.fsi.2004.03.010 | |
| Kong J, Luo K, Luan S, et al. The new variety of Fenneropenaeus chinensis "Huanghai No. 2". Journal of Fisheries of China, 2012, 36(12): 1854-1862 [孔杰, 罗坤, 栾生, 等. 中国对虾新品种"黄海2号"的培育. 水产学报, 2012, 36(12): 1854-1862] | |
| Li J, He YY, Wang QY, et al. Selective breeding of fast-growing and ammonia toxicity-resistant Chinese shrimp (Fenneropenaeus chinensis). Progress in Fishery Sciences, 2015, 36(1): 61-66 DOI:10.11758/yykxjz.20150109 [李健, 何玉英, 王清印, 等. 中国对虾 (Fenneropenaeus chinensis)"黄海3号"新品种的培育. 渔业科学进展, 2015, 36(1): 61-66] | |
| Li J, Liu P, He YY, et al. Artificial selection in the new breed of Fenneropenaeus chinensis named "Yellow Sea 1" based on fast growth trait. Journal of Fisheries of China, 2005, 29(1): 1-5 [李健, 刘萍, 何玉英, 等. 中国对虾快速生长新品种"黄海1号"的人工选育. 水产学报, 2005, 29(1): 1-5] | |
| Li K, Luo SY, Xu LM. A study on the mechanism of temperature impact on the proliferation of white spot syndrome virus (WSSV). Journal of Applied Oceanography, 2013, 32(1): 61-66 [李侃, 罗淑娅, 徐丽美. 温度影响对虾白斑综合症病毒增殖机制的研究. 应用海洋学学报, 2013, 32(1): 61-66] | |
| Li YN, Liang Y, Huang J, et al. Research progress on the molecular pathogenic mechanism of white spot syndrome virus. Journal of Anhui Agricultural Sciences, 2010, 38(7): 3533-3536 [李一宁, 梁艳, 黄倢, 等. 对虾白斑综合征病毒分子致病机制的研究进展. 安徽农业科学, 2010, 38(7): 3533-3536] | |
| Li ZJ, Meng XH, Kong J, et al. Quasi-immune response of Fenneropenaeus chinensis to WSSV and its verification. Journal of Fishery Sciences of China, 2012, 19(6): 989-993 [李战军, 孟宪红, 孔杰, 等. 中国对虾对白斑综合征病毒的类免疫反应与验证. 中国水产科学, 2012, 19(6): 989-993] | |
| Limsuwan C, Ching CA. Temperature affects shrimp survival, feed conversion. Global Aquaculture Advocate, 2012(4): 17-19 | |
| Liu A, Cha GC, Zhang ZX, et al. Research progress of immunity systems and regulatory mechanisms of penaeid shrimps. Journal of Hanshan Normal University, 2013, 34(3): 60-66 [刘昂, 查广才, 张振霞, 等. 对虾免疫系统及调控机制的研究进展. 韩山师范学院学报, 2013, 34(3): 60-66] | |
| Liu B, Yu ZM. A method research of establishing the latent infection of white spot syndrome virus (WSSV) in Penaeus japonicus. Marine Sciences, 2003, 27(8): 72-76 [刘波, 俞志明. 建立白斑综合症病毒在日本对虾体内潜伏性感染的方法研究. 海洋科学, 2003, 27(8): 72-76] | |
| Rahman MM, Corteel M, Dantas-Lima JJ, et al. Impact of daily fluctuations of optimum (27℃) and high water temperature (33℃) on Penaeus vannamei juveniles infected with white spot syndrome virus (WSSV). Aquaculture, 2007, 269(1): 107-113 | |
| Rahman MM, Corteel M, Wille M, et al. The effect of raising water temperature to 33℃ in Penaeus vannamei juveniles at different stages of infection with white spot syndrome virus (WSSV). Aquaculture, 2007, 272(1-4): 240-245 DOI:10.1016/j.aquaculture.2007.07.228 | |
| Schmid-Hempel P. Evolutionary ecology of insect immune defenses. Annual Review of Entomology, 2005, 50: 529-552 DOI:10.1146/annurev.ento.50.071803.130420 | |
| Song XL, Huang J, Wang CM, et al. Artificial infection of brood shrimp of Penaeus chinenis with hypodermal and hematopoietic necrosis baculovirus. Journal of Fisheries of China, 1996, 20(4): 374-379 [宋晓玲, 黄倢, 王崇明, 等. 皮下及造血组织坏死杆状病毒对中国对虾亲虾的人工感染. 水产学报, 1996, 20(4): 374-379] | |
| Sun CB, He JG, Li ZL, et al. Sensitivity difference to WSSV of Penaeus monodon and Litopenaeus vannamei. Journal of Zhanjiang Ocean University, 2006, 26(3): 17-20 [孙成波, 何建国, 黎子兰, 等. 凡纳滨对虾和斑节对虾对WSSV敏感性的比较. 湛江海洋大学学报, 2006, 26(3): 17-20] | |
| Tom JL, Alex RK. Ecological and evolutionary implications of immunological priming in invertebrates. Trends in Ecology and Evolution, 2004, 19(2): 58-60 DOI:10.1016/j.tree.2003.11.011 | |
| Venegas CA, Nonaka L, Mushiake K, et al. Quasi-immune response of Penaeus japonicus to penaeid rod-shaped DNA virus (PRDV). Diseases of Aquatic Organisms, 2000, 42(2): 83-89 | |
| Vidal OM, Granja CB, Aranguren F, et al. A profound effect of hyperthermia on survival of Litopenaeus vannamei juveniles infected with white spot syndrome virus. Journal of the World Aquaculture Society, 2001, 32(4): 364-372 DOI:10.1111/jwas.2001.32.issue-4 | |
| Wang L, Li GY, Mao YX. Measuring methods and variations of some haemolymph factors in Penaeus chinensis after their oral ingestion of immuno drugs. Oceanologia et Limnologia Sinica, 1995, 26(1): 34-41 [王雷, 李光友, 毛远兴. 口服免疫药物后中国对虾某些血淋巴因子的测定及方法研究. 海洋与湖沼, 1995, 26(1): 34-41] | |
| Wang WQ, Li AJ, Lan CX, et al. Measuring immune factors in the serum of Penaeus chinensis with the method of nephelometry. Journal of Fisheries of China, 1998, 22(2): 75-79 [王伟庆, 李爱杰, 兰翠霞, 等. 用免疫消浊比浊法测定中国对虾血清中的免疫因子. 水产学报, 1998, 22(2): 75-79] | |
| Witteveldt J, Cifuentes CC, Vlak JM, et al. Protection of Penaeus monodon against white spot syndrome virus by oral vaccination. Journal of Virology, 2004, 78(4): 2057-2061 DOI:10.1128/JVI.78.4.2057-2061.2004 | |
| Wongmaneeprateep S, Chuchird N, Baoprasertkul P, et al. Effects of high water temperature on the elimination of white spot syndrome virus in juveniles of Litopenaeus vannamei. Magic Publication Co Ltd, 2010, 34(2): 13-26 | |
| Wu DH, Chen XF. Epidemiological study on virus disease of cultured shrimp. Proceedings of the second national Symposium on disease control and environmental management of cultured shrimp. Qingdao: Qingdao Ocean University Press, 1995: 84-87. [吴定虎, 陈细法. 养殖对虾病毒病的流行病学研究.第二届全国人工养殖对虾疾病防治和环境管理学术研讨会论文集. 青岛: 青岛海洋大学出版社, 1995: 84-87.] | |
| Wu XZ. Mainstream research progress of Chinese marine disease. Pacific Journal, 2005(10): 49-59 DOI:10.3969/j.issn.1004-8049.2005.10.014 [吴信忠. 中国海洋病害学主流研究的进展. 太平洋学报, 2005(10): 49-59] | |
| Wu W, Wang L, Zhang X. Identification of white spot syndrome virus (WSSV) envelope proteins involved in shrimp infection. Virology, 2005, 332(2): 578-583 DOI:10.1016/j.virol.2004.12.011 | |
| Xiang Y, Wang G, Yang SW, et al. The pathogenicity of Micrococcus lysodeikticus and white spot syndrome virus to Litopenaeus vannamei under different temperature conditions. Journal of Zhejiang Ocean University (Natural Science), 2014, 33(4): 304-310 [向赟, 王刚, 杨绍文, 等. 不同温度条件下溶壁微球菌和白斑综合症病毒对凡纳滨对虾的致病性. 浙江海洋学院学报 (自然科学版), 2014, 33(4): 304-310] | |
| Yi QL, Wang LL, Song LS, et al. White spot syndrome in shrimp and its immunological prevention and control. Chinese Bulletin of Life Sciences, 2014, 26(9): 903-911 [衣启麟, 王玲玲, 宋林生. 对虾白斑综合征及其免疫防控. 生命科学, 2014, 26(9): 903-911] | |
| You X, Su Y, Mao Y, et al. Effect of high water temperature on mortality, immune response and viral replication of WSSV-infected Marsupenaeus japonicus juveniles and adults. Aquaculture, 2010, 305(1-4): 133-137 DOI:10.1016/j.aquaculture.2010.04.024 | |
| Zeng XX, Zhang C, Li KS. The study advance on cellular immunity of invertebrates. International Journal of Immunology, 2009, 32(5): 354-358 [曾祥兴, 张驰, 李康生. 无脊椎动物细胞免疫研究进展. 国际免疫学杂志, 2009, 32(5): 354-358] | |
| Zhang JR, Liu P, Wang QY, et al. Effect of water temperature on the infectivity of white spot syndrome virus to the brooders of Fenneropenaeus chinensis. Periodical of Ocean University of China (Natural Science), 2008, 38(3): 395-400 [张俊儒, 刘萍, 王清印, 等. 温度对WSSV感染中国对虾越冬亲虾的影响. 中国海洋大学学报 (自然科学版), 2008, 38(3): 395-400] | |
| Zhang YL, Peng XX, Wang SY. Study on three classes of immunoglobulin-like components in Penaeus japonicus. Marine Sciences, 2001, 25(5): 37-41 [章跃陵, 彭宣宪, 王三英. 日本对虾血清三类免疫球蛋白样物质的研究. 海洋科学, 2001, 25(5): 37-41] |



